Académique Documents
Professionnel Documents
Culture Documents
2008 11 AmSud Exo1 Correction PilesFace 6 5pts
Transféré par
MIMOUNI0 évaluation0% ont trouvé ce document utile (0 vote)
6 vues1 pageTitre original
2008-11-AmSud-Exo1-Correction-PilesFace-6-5pts
Copyright
© © All Rights Reserved
Formats disponibles
DOC, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOC, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
6 vues1 page2008 11 AmSud Exo1 Correction PilesFace 6 5pts
Transféré par
MIMOUNIDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOC, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 1
EXERCICE I.
LA PILE SOUS TOUTES SES FACES (6,5 points)
Amérique du sud 11/2008 CORRECTION © http://labolycee.org
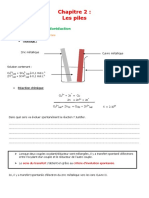
1. La pile Daniell.
1.1. Voir figure 1 ci-contre. e– I
énoncé :« L’électrode positive de cette pile est l’électrode de cuivre. » R
anode – +
cathode
1.2. oxydation anodique : Zn(s) = Zn2+(aq) + 2 e – Zn K (aq) NO 3 (aq) Cu
réduction cathodique : Cu2+(aq) + 2 e – = Cu(s)
1.3. Équation de la réaction de fonctionnement de la pile
Cu2+(aq) + Zn(s) = Cu(s) + Zn2+(aq)
1.4.1. Qr =
Figure 1
SO24 (aq) SO24 (aq)
1.4.2. Qr,i = =1
ions Zn2+(aq) ions Cu2+(aq)
1.4.3. Qr,i < K, le système chimique évolue spontanément dans le sens direct de l’équation.
Le zinc se transforme en ions zinc (II) et libère des électrons, la plaque de zinc est la borne négative de la pile.
1.5. Il y a consommation d’ions Cu2+, donc [Cu2+(aq)] diminue.
Il y a production d’ions Zn2+, alors [Zn2+(aq)] augmente.
1.6. Les ions du pont salin se déplacent afin de maintenir l’électroneutralité des solutions dans les bechers.
Les cations K+ se déplacent vers la cathode. Les anions NO3– se déplacent vers l’anode.
2. L’accumulateur au plomb.
réaction fonctionnement accumulateur en générateur : PbO2(s) + 4 H+(aq) + Pb(s) = Pb2+(aq) + Pb2+(aq) + 2 H2O(l)
2.1. couple Pb2+(aq)/Pb(s) oxydation du plomb Pb(s) = Pb2+(aq) + 2 e –
couple PbO2(s) / Pb2+(aq) réduction de l’oxyde de plomb PbO2(s) + 4 H+ + 2 e – = Pb2+(aq) + 2H2O(l)
Remarque : les demi-équations ne sont pas demandées, mais elles sont nécessaires pour vérifier la cohérence
des couples avec l’équation de la réaction. + – Générateur
On s’intéresse dans ce qui suit à la charge de l’accumulateur. (chargeur)
2.2. e –
libération d’e–, i consommation
il se produit des e–
une oxydation. apportés, il se
C’est l’anode. produit une
Accumulateur réduction.
Figure 2 au plomb C’est la
cathode.
2.3. Il s’agit d’une transformation forcée, le générateur impose le sens du courant.
2.4. Le chargeur par son apport d’énergie, permet de réaliser la réaction dans le sens inverse au sens d’évolution
spontanée. L’équation est : Pb2+(aq) + Pb2+(aq) + 2 H2O(l) = PbO2(s) + 4 H+(aq) + Pb(s)
2.5. Spontanément, le système chimique évoluerait dans le sens inverse de la réaction ci-dessus. Qr > K.
Qr diminuerait pour tendre vers K.
La transformation étant forcée, le quotient de réaction augmente et sa valeur s’éloigne de celle de K.
3. La pile à combustible à hydrogène
3.1. n(H2) = avec m en g.
n(H2) = = 1,25103 mol = 1,3103 mol
3.2. D’après la demi-équation d’oxydation de H2 : n(H2) = , ou n(e –) = 2.n(H2).
n(e –) = 21,25103 = 2,5103 mol
3.3. Q = n(e –).F
Q = 2,5103 9,65104 = 2,4108 C
Q = I.t
I=
I= = 1,0104 A on utilise la valeur non arrondie de Q, on convertit t en s
Vous aimerez peut-être aussi
- Protection Cathodique PDFDocument80 pagesProtection Cathodique PDFMohamed Rjeb85% (13)
- C9Chim Transformations Forcees PDFDocument2 pagesC9Chim Transformations Forcees PDFAzizElheni100% (1)
- Site TS C 09 L'ElectrolyseDocument4 pagesSite TS C 09 L'ElectrolysePecorellaPas encore d'évaluation
- Techniques Ingé PDFDocument34 pagesTechniques Ingé PDFDavid SikhPas encore d'évaluation
- TD Électrochimie de Chimie Analytique 2eme Année Pharmacie DR DJAOUDocument5 pagesTD Électrochimie de Chimie Analytique 2eme Année Pharmacie DR DJAOUmoh moh100% (1)
- C8Chim - Les - Piles - Exos - Alessandro Volta PDFDocument4 pagesC8Chim - Les - Piles - Exos - Alessandro Volta PDFAzizElheniPas encore d'évaluation
- Webinaire - Batteries - Lithium - 23 06 22Document60 pagesWebinaire - Batteries - Lithium - 23 06 22VERONIQUE SALESPas encore d'évaluation
- 1 - Transformation Spontanées Dans Le Piles Et Production D'énergieDocument7 pages1 - Transformation Spontanées Dans Le Piles Et Production D'énergieTaha BoulmanePas encore d'évaluation
- Solution de La Série N°1-1Document4 pagesSolution de La Série N°1-1Fleuretta FleurePas encore d'évaluation
- ElectroDocument30 pagesElectrofatimazahragramziPas encore d'évaluation
- 1s Ch20 TP Piles Et Oxydoreduction Corrige PDFDocument2 pages1s Ch20 TP Piles Et Oxydoreduction Corrige PDFL'aigle ImposantPas encore d'évaluation
- 2011 Reunion Exo1 Correction Volta 6 5ptsDocument2 pages2011 Reunion Exo1 Correction Volta 6 5ptsgrajzgrPas encore d'évaluation
- Partie Ii Reaction Oxydo-ReductionDocument31 pagesPartie Ii Reaction Oxydo-ReductionAmr BahriPas encore d'évaluation
- 26 Electrolyse Td-CorrigeDocument10 pages26 Electrolyse Td-CorrigeChiboubPas encore d'évaluation
- Cours - Chimie Electrolyse - Bac Technique (2011-2012) MR Ouerghemmi PDFDocument5 pagesCours - Chimie Electrolyse - Bac Technique (2011-2012) MR Ouerghemmi PDFLotfi Bouchareb100% (3)
- Cours OxydoreductionDocument4 pagesCours Oxydoreductionblackcat.fantomasPas encore d'évaluation
- Chapitre 11 Piles CORRIGEDocument7 pagesChapitre 11 Piles CORRIGECharles GoPas encore d'évaluation
- Les Reactions D Oxydo Reduction Cours 4Document3 pagesLes Reactions D Oxydo Reduction Cours 4mohmedPas encore d'évaluation
- Piles Corriges D ExercicesDocument3 pagesPiles Corriges D ExercicesAmine AlaoUii AlaouiPas encore d'évaluation
- Site TS C 08 Les PilesDocument9 pagesSite TS C 08 Les PilesPecorellaPas encore d'évaluation
- RedoxDocument4 pagesRedoxCidss CssPas encore d'évaluation
- Chap7 BtsDocument16 pagesChap7 BtsImen HammoudaPas encore d'évaluation
- Electro Chimie 01Document7 pagesElectro Chimie 01t123medPas encore d'évaluation
- I. Définition:: Réactions D'Oxydo-Réduction en Solution AqueuseDocument6 pagesI. Définition:: Réactions D'Oxydo-Réduction en Solution AqueuseyahouzazineidouPas encore d'évaluation
- 0809 CpilesDocument4 pages0809 CpilesHarilaza Ny aina RZFPas encore d'évaluation
- 2007 Afrique Spe Correction Piles 4ptsDocument2 pages2007 Afrique Spe Correction Piles 4ptsMartin SALEHPas encore d'évaluation
- Oxyred 2Document97 pagesOxyred 2Mohamed AIT KASSIPas encore d'évaluation
- 5351 Entrainement TSDocument6 pages5351 Entrainement TSmohammed laadili100% (1)
- PilesDocument6 pagesPilesmohamed laghribPas encore d'évaluation
- Diapo CorrosionDocument26 pagesDiapo CorrosionYousra BenzeguirPas encore d'évaluation
- 14chi3e E1Document4 pages14chi3e E1Harilaza Ny aina RZFPas encore d'évaluation
- Cours Electrolyse ElouardeDocument6 pagesCours Electrolyse Elouarderihab100% (1)
- COURS 2015 PILES Complété Rendu PDFDocument11 pagesCOURS 2015 PILES Complété Rendu PDFOhayoベンジャミンPas encore d'évaluation
- Cours Oxydoreduction COVDocument4 pagesCours Oxydoreduction COVzinebPas encore d'évaluation
- CCC 10Document7 pagesCCC 10Haykel AlarbiPas encore d'évaluation
- Reactions OxydoreductionDocument4 pagesReactions Oxydoreductionfouda fouda aloys baudouinPas encore d'évaluation
- Série Transformation Forcée CorrectionDocument8 pagesSérie Transformation Forcée CorrectionAmine AlaoUii AlaouiPas encore d'évaluation
- Chimie Des Solutions Mpsi-1Document9 pagesChimie Des Solutions Mpsi-1mounirPas encore d'évaluation
- 2003 Liban Correction Exo2 PileCuAg 3ptsDocument1 page2003 Liban Correction Exo2 PileCuAg 3ptskjnokinikoPas encore d'évaluation
- Chapitre 5 Réactions D'oxydoréductionDocument4 pagesChapitre 5 Réactions D'oxydoréductionjean06Pas encore d'évaluation
- Tpcours 2024chap 4 PilesDocument10 pagesTpcours 2024chap 4 PilesfirminfraniaPas encore d'évaluation
- Chimie C Chap11 ElectrolyseDocument5 pagesChimie C Chap11 Electrolysemghaete100% (1)
- Cours 2015 Piles PDFDocument18 pagesCours 2015 Piles PDFOhayoベンジャミン100% (1)
- Lecon1 Competence 2 REACTION DOXYDOREDUCTIONDocument4 pagesLecon1 Competence 2 REACTION DOXYDOREDUCTIONFrançois-jo YaoPas encore d'évaluation
- Chap 3 TD Diagrammes EpHDocument4 pagesChap 3 TD Diagrammes EpHdimaPas encore d'évaluation
- 2011 CtresEtrangers Exo2 Correction PileCitron Electrolyse 6 5ptsDocument2 pages2011 CtresEtrangers Exo2 Correction PileCitron Electrolyse 6 5ptsgrajzgrPas encore d'évaluation
- 1 - Transformation Forcées - L'électrolyseDocument5 pages1 - Transformation Forcées - L'électrolyseTaha BoulmanePas encore d'évaluation
- Activité Redox - CorrectionDocument2 pagesActivité Redox - CorrectionEl Mehdi (203) EL AZHARIPas encore d'évaluation
- D Equilibres Oxyred PowerDocument45 pagesD Equilibres Oxyred Powermenin noorPas encore d'évaluation
- LC05 OxydantsEtReducteursDocument9 pagesLC05 OxydantsEtReducteursgü zelPas encore d'évaluation
- Correction Exercices Chapitre N°8 - Oxydo-Réduction Dans Les Piles Et AccumulateursDocument3 pagesCorrection Exercices Chapitre N°8 - Oxydo-Réduction Dans Les Piles Et Accumulateursunsheatedsword55Pas encore d'évaluation
- CH18 ExercicesDocument2 pagesCH18 ExercicesHAMADA1972100% (1)
- Oxydo Reduction-Professeur 7Document14 pagesOxydo Reduction-Professeur 7neo.noisettePas encore d'évaluation
- Chap Piles CouleurDocument4 pagesChap Piles CouleurIsmail ait talebPas encore d'évaluation
- Electrolyse NaClDocument9 pagesElectrolyse NaClkissmedjerryPas encore d'évaluation
- Cours 3 Transformation Forcées - L'électrolyse PDFDocument4 pagesCours 3 Transformation Forcées - L'électrolyse PDFGlenn wilfranPas encore d'évaluation
- Electrolyse NaClDocument9 pagesElectrolyse NaClImane ARPas encore d'évaluation
- Les Piles 1Document4 pagesLes Piles 1lamia lamiaPas encore d'évaluation
- Cours Chimie Minérale 1ere D&C OXYDOREDUCTIONDocument3 pagesCours Chimie Minérale 1ere D&C OXYDOREDUCTIONSada Diop100% (1)
- Electrolyse CoursDocument6 pagesElectrolyse CoursMehdi BnmssdPas encore d'évaluation
- Corrige TPC8 PDFDocument4 pagesCorrige TPC8 PDFSaraa Papillon100% (1)
- Cours Oxydoréduction en Solution AqueuseDocument4 pagesCours Oxydoréduction en Solution AqueuseFleuretta FleurePas encore d'évaluation
- Correction Ex6 - 7 - 8 TP WhileDocument1 pageCorrection Ex6 - 7 - 8 TP WhileMIMOUNIPas encore d'évaluation
- Exercice: Les Nombres AmisDocument12 pagesExercice: Les Nombres AmisMIMOUNIPas encore d'évaluation
- Exercice: Les Nombres AmisDocument12 pagesExercice: Les Nombres AmisMIMOUNIPas encore d'évaluation
- (PFS) (TD) Eolienne 4Document4 pages(PFS) (TD) Eolienne 4El Maimouni kenzaPas encore d'évaluation
- Liste Des Equipements Et Materiels ElectriqueDocument4 pagesListe Des Equipements Et Materiels Electriqueahmed chakrounPas encore d'évaluation
- 22 MateriauxDocument32 pages22 MateriauxJBPas encore d'évaluation
- 6piles PDFDocument20 pages6piles PDFBen Mamia MahmoudPas encore d'évaluation
- Chimie CombustionDocument114 pagesChimie CombustiongploegaertsPas encore d'évaluation
- 1 - Transformation Forcées - L'électrolyseDocument5 pages1 - Transformation Forcées - L'électrolyseTaha BoulmanePas encore d'évaluation
- Corrosion Chapitre 1Document25 pagesCorrosion Chapitre 1Mariam ZouhairPas encore d'évaluation
- TD N 2 CHIMIE 1ère CDTIDocument2 pagesTD N 2 CHIMIE 1ère CDTIANDRE ELOCKPas encore d'évaluation
- GP M1 Corrosion Chap 1Document11 pagesGP M1 Corrosion Chap 1nadia be2lkhirPas encore d'évaluation
- TP3 PDFDocument3 pagesTP3 PDFYasmina BenPas encore d'évaluation
- I. Principes de Piles Galvaniques: Demi-PileDocument15 pagesI. Principes de Piles Galvaniques: Demi-PileMOHAMMED ZOUINIPas encore d'évaluation
- Cours D ElectrochimieDocument35 pagesCours D ElectrochimieAdel LaimechePas encore d'évaluation
- Plan Conversion ElectrochimiqueDocument3 pagesPlan Conversion Electrochimiqueyassmine guergourPas encore d'évaluation
- N3 3Document31 pagesN3 3Hamza BouhaouchinePas encore d'évaluation
- Ue CHM 441 ElectrochimieDocument46 pagesUe CHM 441 ElectrochimieAxel AzanguimPas encore d'évaluation
- Pil3 Pile de Daniell Force ElectromotriceDocument5 pagesPil3 Pile de Daniell Force ElectromotriceBenjamain HakdaPas encore d'évaluation
- Ph-Mètre - Wikipédia PDFDocument1 pagePh-Mètre - Wikipédia PDFmeriem ouaPas encore d'évaluation
- Corrige Eni Geipi Sujet 1Document7 pagesCorrige Eni Geipi Sujet 1la physique selon le programme FrançaisPas encore d'évaluation
- FicheReponse L3GP TPCinétiqueElectrochimie Revjan2020Document3 pagesFicheReponse L3GP TPCinétiqueElectrochimie Revjan2020Daoud TellaiPas encore d'évaluation
- CR Electro 9Document22 pagesCR Electro 9Mer IemPas encore d'évaluation
- TP 3 Chémi PhisiqueDocument3 pagesTP 3 Chémi PhisiqueBøũdįāf Khäwlå100% (1)
- Nombre D'oxydation Cours N°2Document4 pagesNombre D'oxydation Cours N°2Amine NouarPas encore d'évaluation
- Devoir Commun de Fevrier 2023 Tsti2dDocument4 pagesDevoir Commun de Fevrier 2023 Tsti2dJFCDhydhy YTPas encore d'évaluation
- La Corrosion Des Équipements Métalliques A Des Impacts Majeurs Sur Les Coûts DDocument12 pagesLa Corrosion Des Équipements Métalliques A Des Impacts Majeurs Sur Les Coûts Dsidi mohamed el amine nekkal100% (1)
- Compt Rendu TP ElectrochimieDocument4 pagesCompt Rendu TP ElectrochimieAziza El hamzaouiPas encore d'évaluation
- Compte Rendu Du TP OxydoréductionDocument3 pagesCompte Rendu Du TP OxydoréductionAngela LourençoPas encore d'évaluation
- Cinetique PDFDocument16 pagesCinetique PDFSamah SoltanePas encore d'évaluation
- LPro ElectroDocument23 pagesLPro ElectroYoussef Akr100% (1)