Académique Documents
Professionnel Documents
Culture Documents
Explication Et Interprétation Au Niveau Microscopique:: La Concentration Des Réactifs
Transféré par
ALPHA designTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Explication Et Interprétation Au Niveau Microscopique:: La Concentration Des Réactifs
Transféré par
ALPHA designDroits d'auteur :
Formats disponibles
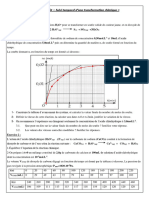
3.
1 L’évolution de la vitesse volumique en fonction de temps
Au fur et à mesure que la transformation se déroule, le coefficient directeur des différentes
tangentes aux différentes dates, diminue. Alors la vitesse diminue au cours du temps.
la vitesse de la réaction chimique est maximale au début de la transformation puis diminue avec
le temps et tend vers zéro lorsque la réaction atteint son terme .
Explication et interprétation au niveau microscopique :
la diminution de la vitesse de la réaction chimique est due à la diminution de la concentration des
réactifs au cours de la transformation, puisque la concentration des réactifs est un facteur cinétique :
Au cours de la transformation chimique la concentration des réactifs diminue, donc le nombre des
réactifs par unité de volume diminue, alors le nombre de chocs efficaces par seconde décroit , et
par conséquent la vitesse de réaction chimique diminue
3. 3 Expression de v en fonction de [ ]
On sait que v= (1) . D’après le tableau d’avancement, on a [ ] = , alors x (t ) = V. [ ]
On remplace x par son expression dans la relation (1) , On obtient v= (V . [ ] ) ce qui donne
[ ]
v(t)= ( [ ] ) , puisque V = Cte , d’où v =
Expression de v en fonction de [ ]
D’après le tableau d’avancement on a : [ ]= , ce qui donne V. [ ] = n0 - x (t)
Alors x (t) = n0 -V. [ ] , donc v(t) = (n0 -V . [ ] ), soit v(t)= - (V.[ ] )
D’où v(t) = - ( [ ] )
3. 4 Déterminons graphiquement le temps de demi-réaction t1 /2 pour cette transformation :
D’après la courbe on a t1 /2 = 5 min
2. Méthodes physiques :Pressiométrie , Conductimétrie
2. 1 Suivi temporel d’une transformation chimique par Pressiométrie ( la mesure de pression )
Activité 2 : suivi de l’évolution d’une transformation chimique par la mesure de pression d’un gaz
Etape (1) Etape (2) Etape (3)
Dans une fiole branchée à un On relie un ruban de Zinc( Zn A l’instant t = 0 , on fait tomber
manomètre, on introduit un ) de masse m = 0.5 g avec le le ruban dans la solution d’acide
volume VA = 75 mL d’acide bouchon de la fiole de tel chlorhydrique et on note la
chlorhydrique ( H3O (aq)+Cl ( aq) ) sorte qu’on peut le faire
+ - valeur de la pression indiquée par
de concentration CA = 0.4 mol.L-1. tomber par un petit secousse le nanomètre tous les 30 secondes.
Site : www.chtoukaphysique.com E-mail : prof.jenkalrachid@gmail.com Page 7
La courbe ci-dessous représente la variation de la pression de gaz H2(g) en fonction du temps
Données :
- On considère que tous les gaz sont parfaits
- Constante des gaz parfaits : R = 8, 314 ( SI )
- La masse molaire atomique du zinc : M ( Zn ) = 65,4 g .mol-1
- Les couples interviennent sont: H3O+(aq)/H2(g) et Zn2+ (aq)/ Zn(s)
- La température dans à l’intérieure de la fiole est 25C°
Exploitation
1. Écrire l’équation bilan de la réaction étudiée
2. Citer d’autres techniques qui peuvent être utilisé pour suivre
l’évolution de cette réaction chimique
3. Calculer la quantité de matière initiale des
réactifs
4. Dresser le tableau d’avancement
5. Déterminer l’avancement maximal xmax et en
déduire le réactif limitant
6. En appliquant l’équation d’état des gaz parfaits
et en se basant sur le tableau d’avancement
précédent, trouver l’expression de l’avancement
x (t) de la réaction à l’instant t en fonction de
P( H2 )t , T, V et R
7. Montrer que l’avancement de la réaction
chimique s’écrit : x ( t ) = . P( H2 )t
8. Trouver qu’à l’instant t1 /2, on a P(H2 )t1 /2 = , et en déduire la valeur de t1 /2
9. Exprimer la vitesse de la réaction en fonction de P( H2 )t
10. Vérifier que la vitesse volumique de la réaction à l’instant t0 = 0 s : v0 = 1,6 .10-3 mol.L-1 .min-1
Interprétation
1. l’équation bilan de la réaction étudiée
Les demi-équations électroniques relatives aux couples : H3O+(aq)/H2(g) e t Zn2+ (aq)/ Zn(s)
- Pour le premier couple : H3O+(aq)/H2(g) : 2 H3O+(aq) + 2e- H2(g) + 2 H2O(l)
- Pour le deuxième couple : Zn2+ (aq)/ Zn(s): Zn(s) Zn2+ (aq) + 2 e-
L’équation bilan de la réaction chimique : Zn(s) + 2 H3O+(aq) → Zn2+ (aq) + H2(g)
2. On peut suivre l’évolution temporelle de cette réaction chimique par :
- pH-métrie : puisque le milieu réactionnel contient des ions oxonium H3O+ .
- Conductimétrie : car le milieu réactionnels contient des ions ( H3O+(aq) , Zn2+ (aq) ) .
3. Calculons la quantité de matière initiale des réactifs
On a ni ( H3O+ ) = CA .VA , AN ni ( H3O+ ) = 0.4 . 75 .10-3 , alors ni ( H3O+ ) = 3 .10-2 mol
On a ni ( Zn ) = , AN ni ( Zn ) = , alors ni ( Zn ) = 7,65.10-3 mol
4. Tableau d’avancement :
Équation de la réaction chimique Zn(s) + 2 H3O+(aq) → Zn2+ (aq) + H2(g)
État du système Avancement Quantité de matière ( mol )
État initial 0 ni ( Zn ) ni ( H3O+ ) 0 0
au cours de la
x(t) ni ( Zn ) - x(t) ni ( H3O+ ) – 2 x(t) x(t) x(t)
transformation
État final Xmax ni ( Zn ) – xmax ni (H3O+ ) – 2 xmax xmax xmax
5. Si H3O+ est le réactif limitant , alors ni ( H3O+ ) – 2 x1max = 0 , donc = ,
AN = 1,5 .10-2 mol .
Site : www.chtoukaphysique.com E-mail : prof.jenkalrachid@gmail.com Page 8
Si Zn est le réactif limitant , alors ni ( Zn ) – x2max = 0 , donc = ni ( Zn ) ,
AN = 7,65 .10 mol
-3
Or , alors l’avancement maximal est xmax = 7,65 .10-3 mol et les réactif limitant est Zn
6. D’après l’équation d’état des gaz parfaits on a P( H2 )t . V = n( H2 )t .R .T et d’après le tableau
d’avancement on a n( H2 )t = x (t) , alors P( H2 )t . V = x (t) .R .T d’où x (t ) =
À l’instant t, on a x (t ) = (1) . à l’instant tf ( état final ) on a xmax = (2)
donne = alors = . . donc =
D’où x( t ) = . P( H2 )t .
7. À l’instant t = t1/2 , on a x(t1/2 ) = . P(H2 )(t1/2) , alors = . P(H2)(t1/2 )
Alors P(H2)(t1 /2 ) = .
D’après la courbe on a : Pmax = 737,5 hPa , alors = 368,75 hPa , par la projection on obtient
t1/2 = 42 min
8. Déterminons la vitesse volumique de la réaction chimique en fonction de P( H2 )t
On sait que : v = , comme x( t ) = . P( H2 )t , alors v = ( . P( H2 )t )
D’où v =
9. La vitesse de la réaction chimique à l’instant t = 0 en mol .L-1.min-1 :
On a v( t =0 ) = / t= 0 , A N v0 = .( ),
donc : v0 = 1,6 .10-3 mol.L-1 .min-1
2. 2 Suivi temporel d’une transformation chimique par la conductimétrie
Activité 3 : suivi de l’évolution d’une transformation chimique par la conductimétrie
On se propose d’étudier, par conductimétrie, la cinétique de l’hydrolyse du 2 –chloro-2-
méthylpropane qu’on notera simplement RCl .
On verse, dans un bécher, 50 ml d’eau distillée et 25 ml d’alcool
(éthanol) et on met le bécher dans un bain marie à température
de 40° C .
A l’instant t =0 on verse un volume V = 1 mL de 2-chloro-2-
méthylpropane dans le mélange eau-éthanol et on plonge dans le
bécher une cellule conductimétrique préalablement étalonnée
puis on mesure la conductivité σ(t) à différentes dates .
L’éthanol est un solvant dans lequel RCl se dissout très
facilement et sans réagir avec l’éthanol .RCl réagit avec l’eau
selon l’équation suivante : RCl(l) + 2 H2O(l) ROH(l) + H3O+ (aq) + Cl-(aq)
La courbe ci-contre , représente la variation de la conductivité de la solution en fonction du temps
Données :
- la masse molaire de RCl est : M (RCl ) = 92,6 g .mol-1
- La masse volumique de RCl est : ρ = 0.85 g.cm-3
- La conductivité d’une solution est : σ(t) = ∑ [ ]
Exploitation
1. Pourquoi peut-on effectuer un suivi conductimétrique
pour cette transformation ?
2. Dresser le tableau d’avancement de la réaction
chimique étudiée.
3. Calculer n0 la quantité de matière initiale de composé
organique, et déduire l’avancement maximal xmax
Site : www.chtoukaphysique.com E-mail : prof.jenkalrachid@gmail.com Page 9
4. Donner l’expression de la conductivité σ(t) du mélange à la date t en fonction de l’ avancement
de la réaction x (t) , du volume V du mélange et des conductivités molaires ioniques des ions
et
5. Montrer que l’avancement de la réaction s’écrit : x (t ) = .
6. Calculer la composition du système chimique à l’instant t = 7 min
7. Définir le temps de demi-réaction t1 /2
8. Trouver qu’à l’instant t1/2 , on a ( t1 /2 ) = et en déduire la valeur du temps de demi-
réaction t1 /2
9. Exprimer la vitesse de la réaction en fonction de
10. Vérifier que la vitesse volumique de la réaction chimique à l’instant t = 10 min est :
v = 3,0 .10-3 mol.L-1 .min-1
11. En gardant, les concentrations initiales des réactifs et en diminueant la température à 20 °C ,
tracer sur la figure précédente la nouvelle évolution de = f(t)
Interprétation
1. On peut effectuer un suivi conductimétrique de cette transformation car elle est lente et il se
forme des ions au cours de la transformation . autrement dit la formation des ions H3O+ (aq) et
Cl-(aq) entraine l’augmentation de la conductivité du milieu réactionnel
2. Tableau d’avancement de la réaction chimique
Équation de la réaction chimique RCl(l) + 2 H2O(l) ROH(l) + H3O+ (aq) + Cl-(aq)
État du système Avancement Quantité de matière ( mol )
État initial 0 n0 (RCl ) En excès 0 0 0
au cours de la
x(t) n0 (RCl ) - x(t) En excès x(t) x(t) x(t)
transformation
État final xmax n0(RCl) – xmax En excès xmax xmax xmax
3. Calculons n0 (RCl ) :
On sait que n0 (RCl ) = , comme ( RCl ) = , alors n0 (RCl ) = ,
AN n0 (RCl ) = , D’où n0 (RCl ) = 9,2 .10-3 mol = 9,2 mmol
Puisque l’eau est en excès , alors RCl est un réactif limitant , alors n0(RCl) – xmax = 0
Donc xmax = n0(RCl) = 9,2 mmol
4. Déterminons l’expression de la conductivité σ(t) :
On sait que : σ(t) = ∑ [ ] alors σ (t) = [ ]+ [ ] et d’après le tableau
d’avancement , on a [ ]= [ ] = , d’où σ (t) = ( + )
5. À l’instant t , on a : σ (t) = ( + ) (1)
et à l’instant tf ( l’état final ) on a σ (tf) = =( + ) (2)
donne = , alors = donc x (t ) = .
6. La composition du système chimique l’instant t = 7 min
D’après le tableau d’avancement on a :
n(RCl)t=7min = n0(RCl) – x = 9,2 - x , n (ROH )t=7min = n (H3O+)t=7min = n ( Cl- )t=7min = x
Calculons x ( à t = 7 min ) :
on a x (t = 7 min ) = . et d’après la courbe on a = 6 mS . cm-1
et = 8 mS . cm-1 , AN x (t = 7 min ) = . 6 , donc x (t = 7 min ) = 6,9 mmol
d’où n(RCl)t=7min = 9,2 - 6,9 = 2,3 mmol ,
n (ROH )t=7min = n (H3O+)t=7min = n ( Cl- )t=7min = 6,9 mmol
Site : www.chtoukaphysique.com E-mail : prof.jenkalrachid@gmail.com Page 10
Vous aimerez peut-être aussi
- Série N°9-9Document3 pagesSérie N°9-9Jihad ELPas encore d'évaluation
- Suivi Temporel D Une Transformation Chimique Vitesse de Reaction Exercices Corriges 3Document2 pagesSuivi Temporel D Une Transformation Chimique Vitesse de Reaction Exercices Corriges 3Jou mohammedPas encore d'évaluation
- Capture D'écran . 2023-11-16 À 19.24.58Document14 pagesCapture D'écran . 2023-11-16 À 19.24.58azeddineelghazoui637Pas encore d'évaluation
- Série D'exercices de Révision Corrigées de Chimie Suivi Temporel d'1 Transformation Vitesse de La Réaction p.SBIRO Abdelkrim (WWW - Pc1.ma)Document19 pagesSérie D'exercices de Révision Corrigées de Chimie Suivi Temporel d'1 Transformation Vitesse de La Réaction p.SBIRO Abdelkrim (WWW - Pc1.ma)Yacine Ait El Houss100% (15)
- Serir SuiviDocument7 pagesSerir Suivikhaoula elhansaliPas encore d'évaluation
- Serie Suivi 2 Bac Biof SM PC FrancaisDocument5 pagesSerie Suivi 2 Bac Biof SM PC FrancaisMoussa Traoré100% (1)
- Cours de Cinétique ChimiqueDocument6 pagesCours de Cinétique Chimiqueilyes fellagPas encore d'évaluation
- Suivi Temporel N2-À Distance-Prof OthmaneDocument12 pagesSuivi Temporel N2-À Distance-Prof Othmaneanass100% (1)
- 2 - Suivi Temporel D'une Transformation - Vitesse de RéactionDocument31 pages2 - Suivi Temporel D'une Transformation - Vitesse de Réactionlahcen essPas encore d'évaluation
- SuiviDocument3 pagesSuivihahaPas encore d'évaluation
- Série de Préparation Suivi D'une Transformation Chimique PDFDocument4 pagesSérie de Préparation Suivi D'une Transformation Chimique PDFSaid Ha70% (10)
- Suivi Temporel D Une Transformation Chimique Vitesse de Reaction Cours 2Document5 pagesSuivi Temporel D Une Transformation Chimique Vitesse de Reaction Cours 2MOSTAFA HABIRKOUPas encore d'évaluation
- Cours Vitesse de ReactionDocument3 pagesCours Vitesse de ReactioncristyenPas encore d'évaluation
- serie-2-suivi-temporelle-d-une-transformation-chimiqueDocument7 pagesserie-2-suivi-temporelle-d-une-transformation-chimiquee.maskarPas encore d'évaluation
- Ahim NoureddineDocument4 pagesAhim NoureddineAlaoui Amine100% (1)
- 2-Cinetique ChimiqueDocument5 pages2-Cinetique ChimiqueAnis Dahnen0% (1)
- Réaction Suivie Par Conductimétrie: Qté de Matière Initiale de R-CL: N (Mol) Masse (G) / Masse Molaire (G/mol)Document5 pagesRéaction Suivie Par Conductimétrie: Qté de Matière Initiale de R-CL: N (Mol) Masse (G) / Masse Molaire (G/mol)khalid el yacoubiPas encore d'évaluation
- 2 Suivi Temporel Dune Transformation Vitesse de Reaction RepareDocument4 pages2 Suivi Temporel Dune Transformation Vitesse de Reaction RepareMouna ElPas encore d'évaluation
- Série Sur Suivi 2 Bac PC - 2022Document4 pagesSérie Sur Suivi 2 Bac PC - 2022Alaoui AminePas encore d'évaluation
- Cours - Suivi TemporelDocument7 pagesCours - Suivi TemporelRedouane Reda100% (2)
- Ex-1Document2 pagesEx-1soulaimaneelaouni220Pas encore d'évaluation
- Exercice Corrigé Suivi Temporel D'une Transformation Chimique PDFDocument2 pagesExercice Corrigé Suivi Temporel D'une Transformation Chimique PDFMohammed Elhlou75% (8)
- Série D'exercices Vitesse de RéactionDocument4 pagesSérie D'exercices Vitesse de Réactionothmane GbPas encore d'évaluation
- Chapitre-2 - Suivi Temporel D'une Transformation Chimique - Vitesse de RéactionDocument5 pagesChapitre-2 - Suivi Temporel D'une Transformation Chimique - Vitesse de Réactiona houssPas encore d'évaluation
- Simili 2Document3 pagesSimili 2Noureddine ElmabroukiPas encore d'évaluation
- Série D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument8 pagesSérie D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDMoulayMouly100% (6)
- Série D'exercices N°2 - Sciences Physiques Cinétique Chimique - Bac Sciences Exp (2013-2014) MR Alibi AnouarDocument6 pagesSérie D'exercices N°2 - Sciences Physiques Cinétique Chimique - Bac Sciences Exp (2013-2014) MR Alibi AnouarKais GuesmiPas encore d'évaluation
- Correction Td3Document7 pagesCorrection Td3Harakat ElhoucinePas encore d'évaluation
- Exercices de Soutien Sur La Cinetique 2023-2024Document3 pagesExercices de Soutien Sur La Cinetique 2023-2024JHGPas encore d'évaluation
- Technique de Suivi Temporel D'une TransformationDocument8 pagesTechnique de Suivi Temporel D'une TransformationJosé Ahanda NguiniPas encore d'évaluation
- 02-Vitesse SerieDocument5 pages02-Vitesse SerieboustakatbPas encore d'évaluation
- 2009 Afrique Exo1 Correction Pomme 6 5ptsDocument2 pages2009 Afrique Exo1 Correction Pomme 6 5ptsla physique selon le programme FrançaisPas encore d'évaluation
- FDS - TD Cinétique Chimique - 2013Document6 pagesFDS - TD Cinétique Chimique - 2013Lenz Daniel Jean Paul100% (1)
- TD2 Correction PDFDocument8 pagesTD2 Correction PDFKhadija LakhdiriPas encore d'évaluation
- Suivi Temporel D - Une TransformationDocument6 pagesSuivi Temporel D - Une TransformationerrairachidPas encore d'évaluation
- 6-TDPCSIcinetique-2015Document8 pages6-TDPCSIcinetique-2015Nguissaly SonkoPas encore d'évaluation
- Exos CH 04Document3 pagesExos CH 04lol testPas encore d'évaluation
- TP N° 02 ThermodynamiqueDocument6 pagesTP N° 02 ThermodynamiquemutracePas encore d'évaluation
- Travaux Dirigés de Chimie N° C2: Exercice 1: Méthode Des Vitesses InitialesDocument3 pagesTravaux Dirigés de Chimie N° C2: Exercice 1: Méthode Des Vitesses InitialesAbderrahman IGHNIHPas encore d'évaluation
- sujet 2PCDocument6 pagessujet 2PCotakunotfound9Pas encore d'évaluation
- 1 - Suivi Temporel D'une Transformation - Vitesse de RéactionDocument12 pages1 - Suivi Temporel D'une Transformation - Vitesse de RéactionTaha BoulmanePas encore d'évaluation
- 0607 C Exo S VitesseDocument3 pages0607 C Exo S VitesseSeverin LouaPas encore d'évaluation
- Exercice 30 Suivi Temporel D'une Transformation ChimiqueDocument5 pagesExercice 30 Suivi Temporel D'une Transformation ChimiqueMoulayMoulyPas encore d'évaluation
- Série Cinétique Chimique 2bac: P T P T RDocument9 pagesSérie Cinétique Chimique 2bac: P T P T Rrkibi.khadija2006Pas encore d'évaluation
- 0607DM2 PDFDocument3 pages0607DM2 PDFFoudil Laouici100% (1)
- Chapitre 1Document5 pagesChapitre 1Manel AbrichePas encore d'évaluation
- Exercice 3 SuiviDocument6 pagesExercice 3 Suiviyasserofficiel2006Pas encore d'évaluation
- Suivi TemporelDocument8 pagesSuivi TemporelphytanjaPas encore d'évaluation
- Cinétique Chimique PDFDocument6 pagesCinétique Chimique PDFAzizElheniPas encore d'évaluation
- Solution Exercices de Suivi Temporeldune Transformation Vitesse DereactionDocument13 pagesSolution Exercices de Suivi Temporeldune Transformation Vitesse DereactionTsu BakiPas encore d'évaluation
- TSP2SP2Ch9T4-exos Resolus p245n11 246n15 250n25Document5 pagesTSP2SP2Ch9T4-exos Resolus p245n11 246n15 250n25mohPas encore d'évaluation
- Série N°1Document1 pageSérie N°1alae el jarmouniPas encore d'évaluation
- SerieDocument7 pagesSeriemehdi benmassoudPas encore d'évaluation
- Devoir Surveillé N°1 Semestre 1 2ème Bac SP Biof Prof JaouadDocument2 pagesDevoir Surveillé N°1 Semestre 1 2ème Bac SP Biof Prof Jaouadnahli aya100% (1)
- Cinn Chim1Document4 pagesCinn Chim1Sarra HmPas encore d'évaluation
- Série D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriDocument5 pagesSérie D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriTawfiq Weld EL Arbi0% (1)
- Les 72 Génies de KabbaleDocument133 pagesLes 72 Génies de KabbaleFernando Rodrigues Lopes100% (3)
- Comment Un Accident Peut ArriverDocument14 pagesComment Un Accident Peut Arriverمحمد الأمين سنوساوي100% (1)
- Mecanique Tp3usmba09Document8 pagesMecanique Tp3usmba09AymanPas encore d'évaluation
- Francais Fin Ce2 Marseille 2014 EleveDocument9 pagesFrancais Fin Ce2 Marseille 2014 Eleveajy montessouriPas encore d'évaluation
- Chapitre 12 StatistiquesDocument25 pagesChapitre 12 StatistiquesLyse NdifoPas encore d'évaluation
- TopoDocument3 pagesTopoSta ToxPas encore d'évaluation
- Gazoline Juin 2017Document148 pagesGazoline Juin 2017Mou Mou100% (2)
- H50D H60D H70D H80D de 01.2004 LINDEDocument104 pagesH50D H60D H70D H80D de 01.2004 LINDEAmmar ZouhairPas encore d'évaluation
- 0130 BONUS Cours+PDF Switch+et+IOSDocument62 pages0130 BONUS Cours+PDF Switch+et+IOSJulienne FatumaPas encore d'évaluation
- 1741 DGD 4Document2 pages1741 DGD 4SerignePas encore d'évaluation
- Cours Système NerveuxDocument9 pagesCours Système NerveuxMohammed errifaiyPas encore d'évaluation
- CNTRL 2 Bac SC X S 1 - 22-23Document2 pagesCNTRL 2 Bac SC X S 1 - 22-23Outouli MohamedPas encore d'évaluation
- V2-3-12 Steering SystemDocument47 pagesV2-3-12 Steering Systemredwane ouberriPas encore d'évaluation
- Item 242 - Adenome HypophysaireDocument4 pagesItem 242 - Adenome HypophysaireTekwa MelsPas encore d'évaluation
- La Santé Mentale PrésentationDocument12 pagesLa Santé Mentale PrésentationFerdaous MalamanePas encore d'évaluation
- Chapitre IDocument15 pagesChapitre Ihassane ayiPas encore d'évaluation
- Chapitre 1-Domaine D'étude de La MicrobiologieDocument100 pagesChapitre 1-Domaine D'étude de La MicrobiologieBernard SoumaPas encore d'évaluation
- AC042Qui Êtes-Vous ..Document266 pagesAC042Qui Êtes-Vous ..Attar NoureddinePas encore d'évaluation
- Efm Stat 16 17 PDFDocument3 pagesEfm Stat 16 17 PDFSoufiane TouilPas encore d'évaluation
- PR ésentation 2Document17 pagesPR ésentation 2oumqsdfPas encore d'évaluation
- Supplement CarieDocument24 pagesSupplement Carielamia temmouchePas encore d'évaluation
- La Ministre de La Justice Est Responsable de L'application de La Présente Loi. Décret 919-2019 Du 4 Septembre 2019, (2019) 151 G.O. 2, 3975Document10 pagesLa Ministre de La Justice Est Responsable de L'application de La Présente Loi. Décret 919-2019 Du 4 Septembre 2019, (2019) 151 G.O. 2, 3975David MessierPas encore d'évaluation
- ISO 11133 (1) (Mode de Compatibilité)Document9 pagesISO 11133 (1) (Mode de Compatibilité)agrojus778790Pas encore d'évaluation
- M Ethodes Num Eriques Pour Les Ecoulements IncompressiblesDocument80 pagesM Ethodes Num Eriques Pour Les Ecoulements IncompressiblesMohamed LatifiPas encore d'évaluation
- Book - Présentation de La Société MGT Apporteur de Solution MécaniqueDocument44 pagesBook - Présentation de La Société MGT Apporteur de Solution MécaniqueASMGTPas encore d'évaluation
- Seance Du 05-06-2020Document2 pagesSeance Du 05-06-2020Chimie PhysiquePas encore d'évaluation
- RehabiilitationDocument30 pagesRehabiilitationAHMEDOU LIMAMPas encore d'évaluation
- P3270analyse Organique Technique de L IngenieurDocument12 pagesP3270analyse Organique Technique de L IngenieursalimPas encore d'évaluation
- ForaDocument9 pagesForaanthonybrandon1302Pas encore d'évaluation
- SLUMP TEST+ COMPRESSION - NidhiDocument6 pagesSLUMP TEST+ COMPRESSION - NidhiHrithik IGPas encore d'évaluation