Académique Documents
Professionnel Documents
Culture Documents
TD-nomenclature Correction
Transféré par
mm72c48gbgTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
TD-nomenclature Correction
Transféré par
mm72c48gbgDroits d'auteur :
Formats disponibles
Introduction à la chimie organique : Rappels de nomenclature
TD – Introduction à la chimie organique : Rappels de nomenclature
CORRECTION
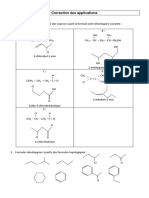
1. Représentation topologique
a) b) c)
2.Nomenclature et écriture topologique
Commencer par écrire la chaîne principale puis le groupe caractéristique principal, puis les éventuelles insaturations,
et enfin les substituants.
a. b. c. d.
e. f. g. h.
4 étapes majeures : Choix de la chaîne principale (règles à suivre dans l’ordre) : elle contient le groupe fonctionnel
principal, le nombre maximal d'autres groupes fonctionnels, le nombre maximal d’insaturations, et est la plus longue
possible - Numéroter pour avoir les indices les plus petits possibles (somme minimale et, en cas d’égalité, premier
indice qui diffère le plus petit) - En suffixe : les insaturations puis le groupe fonctionnel principal- En préfixe : les
ramifications et les groupes fonctionnels non principaux
i) 3-éthyl-5-méthyl-4-propylheptane j) 3,4-diméthylhex-2-ène k) 4-éthyl-6-méthylheptan-2-ol
l) chlorure de 2-éthylbutanoyle m) butanoate de méthyléthyle n) 4-chloro-1,1,2-triméthylcyclopentane
o) 4-amino-3-méthylpentan-2-one p) 4-chloro-6-méthylhept-3,6-dién-2-ol q) 5-éthy-4,7-dioxooctanal
3. Détermination d'une formule brute
a) Lors de la combustion, les atomes de C et de H ne proviennent uniquement de la molécule A.
On a donc nC = nCO2 = mCO2 /MCO2 et nH = 2nH2O = 2mH2O / MH2O
De même, l'oxydation permet de dire que nN = 2nN2= 2 VN2 / Vmol
D'où % C = mC / mA combustion = nC x MC / mA combustion = (mCO2 xMc) /(MCO2 x mA combustion ) = 51,7 %
% H = mH / mA combustion = nHx MH / mA combustion = (2 mH2O xMH) /(MH2O x mA combustion ) = 10,3 %
% N = mN / mA oxydation = nN x MN / mA oxydation = (2 VN2 xMN) /(Vmol x mA oxydation ) = 24,1%
Et donc %O = 13,9 % pour arriver à 100%.
b) On cherche à exprimer les nombres d'atome de A comme multiples ou sous-multiples du nombre d'atomes
d'oxygène. Soit A : CxHyOzNw
On sait, par définition, que %O = z MO / MA donc MA = z MO / %O
Comme %C = xMc / MA alors x = (%C MO z) / (MC %O) = 5z
PCSI – 2
Introduction à la chimie organique : Rappels de nomenclature
%H = yMH / MA alors y = (%H MO z) / (MH %O) = 11,9z
%N = wMN / MA alors w = (%N MO z) / (MN %O) = 2z
c) La masse molaire de A est de 232 g.mol-1.
MA = z MO / %O donc z = MA %O / MO = 2
La formule brute de A est C10H24O2N4.
PCSI – 3
Vous aimerez peut-être aussi
- Exos Chimie Cours PRIAMSDocument60 pagesExos Chimie Cours PRIAMSLevier Poids86% (7)
- Nomenclature OrganiqueDocument10 pagesNomenclature Organiqueshadowkyllers89% (9)
- Chimie OrganiqueDocument29 pagesChimie OrganiqueRubyPas encore d'évaluation
- td1 Chimie Organiquer PDFDocument15 pagestd1 Chimie Organiquer PDFLimoune AliPas encore d'évaluation
- Exercices Avec Solution SV2-STU2Document18 pagesExercices Avec Solution SV2-STU2SaoudPas encore d'évaluation
- Corrige CF 2015-2016 PDFDocument6 pagesCorrige CF 2015-2016 PDFAsmahane FaslaPas encore d'évaluation
- CP Mareme Baba: 1 L2 2023/2024 M Thiam Devoir de Sciences Physiques N°1: 1h 45' Exercice1Document1 pageCP Mareme Baba: 1 L2 2023/2024 M Thiam Devoir de Sciences Physiques N°1: 1h 45' Exercice1nabou190494Pas encore d'évaluation
- Examen Correction L2 Chimie Organique 2007 4Document6 pagesExamen Correction L2 Chimie Organique 2007 4R-win100% (1)
- Corrige 20EVAL2 202014-2015.TextMarkDocument5 pagesCorrige 20EVAL2 202014-2015.TextMarkRoumaissa LbPas encore d'évaluation
- Corrigés Leçon 6 - Composés Oreganiques OxygénésDocument5 pagesCorrigés Leçon 6 - Composés Oreganiques Oxygénésholyeric50Pas encore d'évaluation
- CAHIER D'Exercices ChimieDocument67 pagesCAHIER D'Exercices ChimieAdama MaigaPas encore d'évaluation
- Ch4 Analyse SpectraleDocument9 pagesCh4 Analyse Spectraleالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- ExtraitDocument8 pagesExtraitLewis HamiltonPas encore d'évaluation
- TD AminesDocument1 pageTD AminesKenfack BryndaPas encore d'évaluation
- Composes Fonctionnels PDFDocument17 pagesComposes Fonctionnels PDFNabil holmesPas encore d'évaluation
- T Science DevoirdDocument2 pagesT Science DevoirdOumar TraoréPas encore d'évaluation
- CHAP 1 Chimie OrganiqueDocument4 pagesCHAP 1 Chimie Organiquetoto TOTOROTOPas encore d'évaluation
- TD 1 GMP 2023-2024Document4 pagesTD 1 GMP 2023-2024mennanesalaheddinePas encore d'évaluation
- Exercices Supplémentaires Feuille 2Document4 pagesExercices Supplémentaires Feuille 2hajisaid3007Pas encore d'évaluation
- Al CoolsDocument13 pagesAl Coolsbmm2Pas encore d'évaluation
- Corrige EVAL2 2014-2015Document5 pagesCorrige EVAL2 2014-2015jamjamalPas encore d'évaluation
- Correction TD de Masse Version 2021Document24 pagesCorrection TD de Masse Version 2021Amine Omari100% (1)
- Série D'exercices N°16 - Chimie Les Amides - Bac Sciences Exp (2013-2014) MR BARHOUMI EzedineDocument4 pagesSérie D'exercices N°16 - Chimie Les Amides - Bac Sciences Exp (2013-2014) MR BARHOUMI EzedineAfef Afef100% (4)
- Ch4 Analyse SpectraleDocument7 pagesCh4 Analyse SpectraleLahoucine GhourchanePas encore d'évaluation
- 01 Chimie OrganiqueDocument9 pages01 Chimie OrganiqueHocine MichelPas encore d'évaluation
- Chimie Organique Licence 1 Année 2004-2005: Effet Inductif, Effet MésomèreDocument2 pagesChimie Organique Licence 1 Année 2004-2005: Effet Inductif, Effet MésomèreGomez Bakoua PegaPas encore d'évaluation
- Nomenclature 1Document14 pagesNomenclature 1Stachis MadiambaPas encore d'évaluation
- Pays: Togo Année: 2016 Session: Sciences Physiques Série: BAC, Série D Durée: 3 H Coefficient: 3Document3 pagesPays: Togo Année: 2016 Session: Sciences Physiques Série: BAC, Série D Durée: 3 H Coefficient: 3MAGNANGOUPas encore d'évaluation
- Chorg Fmpos 1Document8 pagesChorg Fmpos 1André Kassogue100% (1)
- CHM 100 Atomes Et MoleculesDocument32 pagesCHM 100 Atomes Et MoleculesOzias100% (1)
- T Science DevoirdDocument2 pagesT Science DevoirdOumar TraoréPas encore d'évaluation
- Exam Et Corrigé TP SMC3 17-18Document10 pagesExam Et Corrigé TP SMC3 17-18Hamza FaFouriPas encore d'évaluation
- Serie4 3 20Document1 pageSerie4 3 20Math PilotePas encore d'évaluation
- MP Chimie CCP 1 2011.extraitDocument4 pagesMP Chimie CCP 1 2011.extraitkmeriemPas encore d'évaluation
- SEQ 2 CHIMIE THEORIQUE Tle CDDocument3 pagesSEQ 2 CHIMIE THEORIQUE Tle CDUlriche Enama EbandaPas encore d'évaluation
- Base Version EtudiantDocument8 pagesBase Version EtudiantLyes Rainier De MonacoPas encore d'évaluation
- Chimie Organique 2021 2022 DR Atmani Merabet. G 1ère AnnéeDocument20 pagesChimie Organique 2021 2022 DR Atmani Merabet. G 1ère AnnéeaimemartinbanusengePas encore d'évaluation
- Corrige PC s2 2013 2Document6 pagesCorrige PC s2 2013 2Essohanam AwatePas encore d'évaluation
- Chimie OrganiqueS3Document70 pagesChimie OrganiqueS3Akram OmariPas encore d'évaluation
- PC 1ère CD-C3 Hydrocarbures InsaturésDocument12 pagesPC 1ère CD-C3 Hydrocarbures InsaturésJoconias Mongnonhoda100% (1)
- td1 CorrDocument6 pagestd1 Correlmaliky.ibtissamPas encore d'évaluation
- 1er Devoir Du 1er Semestre PCT 1ère D 2022-2023 Ceg GoukaDocument4 pages1er Devoir Du 1er Semestre PCT 1ère D 2022-2023 Ceg GoukaAdeline KwadzoPas encore d'évaluation
- Alcénes - Alcynes 1S1-1S2 AT 22 Renf FinDocument6 pagesAlcénes - Alcynes 1S1-1S2 AT 22 Renf Finpapaaliouba3Pas encore d'évaluation
- Corrige EVAL2 2014-2015Document5 pagesCorrige EVAL2 2014-2015sou50% (2)
- Concours 2021Document20 pagesConcours 2021chartiercapucinePas encore d'évaluation
- Id-3031 PDFDocument29 pagesId-3031 PDFMicrocosmos MystiquePas encore d'évaluation
- TP Nylon 2018 CorrectionDocument8 pagesTP Nylon 2018 CorrectionHassanPas encore d'évaluation
- ds5 CorrigeDocument16 pagesds5 Corrigeakissiyapi555Pas encore d'évaluation
- AlcaneDocument4 pagesAlcaneMamadou Thioye100% (1)
- TD 1Document4 pagesTD 1Abdou HajjajiPas encore d'évaluation
- 2001 Preselection Partie1Document7 pages2001 Preselection Partie1Majed GharibPas encore d'évaluation
- Transformation en Chimie Organique Terminale ScientifiqueDocument4 pagesTransformation en Chimie Organique Terminale ScientifiqueThomas D.Pas encore d'évaluation
- PC 1ère CD-C6 Quelques Composés Oxygénés PDFDocument11 pagesPC 1ère CD-C6 Quelques Composés Oxygénés PDFZanaple CoulibalyPas encore d'évaluation
- TD CH - Org.Serie N°1 - 2021 - 22Document2 pagesTD CH - Org.Serie N°1 - 2021 - 22mohamedaminedarrajPas encore d'évaluation
- TP2 Spectro IR-CorrectionDocument10 pagesTP2 Spectro IR-CorrectionlahcenPas encore d'évaluation
- Introduction à la physique de la matièreD'EverandIntroduction à la physique de la matièreÉvaluation : 3 sur 5 étoiles3/5 (1)
- DS N°2 - ÉnoncéDocument8 pagesDS N°2 - Énoncémm72c48gbgPas encore d'évaluation
- DS N°1 - Énoncé CopieDocument6 pagesDS N°1 - Énoncé Copiemm72c48gbgPas encore d'évaluation
- TD2 CorrectionDocument3 pagesTD2 Correctionmm72c48gbg0% (1)
- TD1 - CorrectionDocument8 pagesTD1 - Correctionmm72c48gbgPas encore d'évaluation
- TD CH14 CorrectionDocument6 pagesTD CH14 Correctionmm72c48gbgPas encore d'évaluation
- 2007 03 NelleCaledonie Exo2 Correction Fusion 5 5ptsDocument3 pages2007 03 NelleCaledonie Exo2 Correction Fusion 5 5ptspilounPas encore d'évaluation
- Mèmoire Sur La SoudureDocument115 pagesMèmoire Sur La Soudureصلاح الدينPas encore d'évaluation
- Cours Theme 2 MutationsDocument18 pagesCours Theme 2 MutationsAlice CAILLAUDPas encore d'évaluation
- Note de CalculsDocument20 pagesNote de Calculsnouna201367% (3)
- TD2 TransformationschimiquescorrigesDocument10 pagesTD2 TransformationschimiquescorrigesNacir DaikhPas encore d'évaluation
- CV - MR SALAH - STAGIAIRE INGENIEUR D'ETUDESDocument1 pageCV - MR SALAH - STAGIAIRE INGENIEUR D'ETUDESOssama NachatPas encore d'évaluation
- Aciers SpeciauxDocument8 pagesAciers SpeciauxYassine SayehPas encore d'évaluation
- Chapitre 2Document6 pagesChapitre 2MiraPas encore d'évaluation
- Application de la photocatalyse pour la dégradation des polluants chimiques et bactériologiques dans l’eau en utilisant des catalyseurs irradiés par des photons de lumière naturelle ou artificielle(UVA/UVB)Document27 pagesApplication de la photocatalyse pour la dégradation des polluants chimiques et bactériologiques dans l’eau en utilisant des catalyseurs irradiés par des photons de lumière naturelle ou artificielle(UVA/UVB)Saliha Aidoun100% (1)
- Cours Initiation TechniqueDocument78 pagesCours Initiation TechniqueAsmaa KasmiPas encore d'évaluation
- 1 - Introduction Générale Au SoudageDocument28 pages1 - Introduction Générale Au SoudageomatrPas encore d'évaluation
- SOLTANI Abd El KaderDocument62 pagesSOLTANI Abd El KaderYahiyaoui SofyanePas encore d'évaluation
- Automate Analyse Des Gaz Du SangDocument4 pagesAutomate Analyse Des Gaz Du SanghalimabiomedicalPas encore d'évaluation
- 842 PDFDocument98 pages842 PDFGhizlene CHPas encore d'évaluation
- Xypex Admix c1000Document4 pagesXypex Admix c1000Mohamed Seifeddine NaijaPas encore d'évaluation
- Sujet de Physique Chimie Bac C Et E 2021Document3 pagesSujet de Physique Chimie Bac C Et E 2021Ahmadou MohamadouPas encore d'évaluation
- 3e PCTDocument11 pages3e PCTeucludePas encore d'évaluation
- Correction D ExercicesDocument2 pagesCorrection D Exerciceslesdeux tchatcheusePas encore d'évaluation
- 032a-Circuit D - Huile MoteurDocument9 pages032a-Circuit D - Huile MoteurBoukhlifi Kouder KamelPas encore d'évaluation
- Cal-Examen Aut 2021-2022 SNDocument3 pagesCal-Examen Aut 2021-2022 SNHafsa NourPas encore d'évaluation
- Knowledge Basic Testo 340 350 Boiler FRDocument4 pagesKnowledge Basic Testo 340 350 Boiler FRAbdelaziz JamalPas encore d'évaluation
- Chap 6-Cours-Structure de La Matière BOUDJEMAADocument18 pagesChap 6-Cours-Structure de La Matière BOUDJEMAAعماد الدين بن عبودPas encore d'évaluation
- Cours de Geologie Petroliere OriDocument13 pagesCours de Geologie Petroliere OriSamba Koukouare ProsperPas encore d'évaluation
- NUT Ra AGtransDocument221 pagesNUT Ra AGtransIlyas VoiceoverPas encore d'évaluation
- Tubes Carre Et RectangulairesDocument28 pagesTubes Carre Et RectangulairesGuillaumeHNOPas encore d'évaluation
- Bulletin 032 03 PDFDocument2 pagesBulletin 032 03 PDFAnonymous 1au3l9ivwPas encore d'évaluation
- ALT TGP (IFCC) MonoréactifDocument2 pagesALT TGP (IFCC) MonoréactifDavid kyPas encore d'évaluation
- Thèse Séchage Milieu Poreux Par Un Modèle BidimentionnelDocument127 pagesThèse Séchage Milieu Poreux Par Un Modèle BidimentionnelimenrdsPas encore d'évaluation
- 9 23Document15 pages9 23SamiAmeurPas encore d'évaluation
- AS v2n2 NaceriDocument11 pagesAS v2n2 Nacerikoukou bayPas encore d'évaluation