Académique Documents
Professionnel Documents
Culture Documents
2014 Polynesie Exo1 Correction AcideCitrique 5 5pts
Transféré par
Haman Bello OumarouCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
2014 Polynesie Exo1 Correction AcideCitrique 5 5pts
Transféré par
Haman Bello OumarouDroits d'auteur :
Formats disponibles
BAC S – Polynésie 2014 Correction © http://labolycee.
org
EXERCICE I : À PROPOS DE L’ACIDE CITRIQUE (5,5 POINTS)
1. La molécule d’acide citrique
1.1. Le groupe hydroxyle (entouré) est caractéristique de la fonction alcool.
OH
HOOC CH2 C CH2 COOH
COOH
1.2. Les trois groupes caractéristiques carboxyle COOH sont responsables de l’acidité de l’acide
citrique. En effet chaque groupe COOH peut céder un proton H+, et il y a trois groupes carboxyle,
donc la possibilité de libérer trois protons : l’acide citrique est un triacide.
2. L’acide tartrique, un détartrant
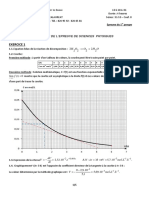
2.1.1. On effectue un titrage pH-métrique de l’acide citrique par une solution d’hydroxyde de
sodium cb = 1,00×10-1 mol.L-1.
Le volume à l’équivalence est déterminé grâce à la courbe : il correspond à l’abscisse du point
d’ordonnée maximale de la dérivée dpH/dv = f(v) (on peut utiliser la méthode des tangentes).
On lit Véq = 31,0 mL.
À l’équivalence les réactifs ont été mélangés dans les proportions stœchiométriques, d’après
n + - n
l’équation de la réaction support du titrage, on a : (Na +HO ) = acide
3 1
CB .Véq CA .VA
Soit = où CB est la concentration molaire de la solution d’hydroxyde de sodium et
3 1
CA est la concentration recherchée en acide citrique.
C .V
CA = B éq
3VA
1,00 × 10−1 × 31,0
CA = = 0,103 mol.L-1 d’acide citrique (valeur non arrondie stockée en mémoire)
3 × 10,0
mA
2.1.2. Pourcentage en masse : p = où mA est la masse d’acide dans le sachet qui a été
msachet
dissoute dans V = 2,00 L d’eau.
n m
C A = A = A donc mA = CA.V.M
V M.V
C .V.M
p= A
msachet
0,103 × 2,00 × 192
p= = 0,992 = 99,2% avec CA non arrondie
40,0
2.1.3. Notons l’incertitude ∆p = U(p) U pour uncertainty
2 2 2
U(CB ) U(Véq ) U(VA ) U(V)
2
U(p)
L’incertitude relative a pour expression : =
+
+ +
p CB Véq VA V
2
U(p) 0,02 × 10−1
= −1
+ (0,01)2 + (0,005)2 + (0,005)2
p 1,00 × 10
U(p)
= 0,02 donc U(p) = p ×0,02 = 99,2 × 0,02 = 2 %
p
Le sachet indique 100% d’acide citrique ce qui est cohérent avec p = 99,2 ± 2 %
2.2.1. La température est un facteur cinétique, le fait de chauffer la solution va permettre
diminuer la durée de réaction. Le détartrage sera plus rapide.
2.2.2.
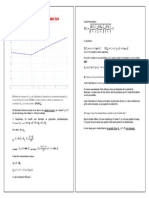
Énergie Énergie
électrique W él thermique Q1
BOUILLOIRE
Secteur « EDF » Eau
Énergie
thermique Q2
Milieu
extérieur
Eutile
Le rendement est défini par η =
Edépensée
Q1 m.c.∆θ ρ.V.c.∆θ
Ici η = = =
Wél P.∆t P.∆t
1,0 × 0,40 × 4,2 × 103 × (85 − 18)
η= = 0,94 = 94 %
1500 × (60 + 20)
Les bouilloires électriques ont de très bons rendements.
Vous aimerez peut-être aussi
- 2016 AmSud Exo2 Correction Benzaldehyde 9ptsDocument5 pages2016 AmSud Exo2 Correction Benzaldehyde 9ptsShanthini JekumarPas encore d'évaluation
- La Pile DaniellDocument4 pagesLa Pile Daniellarmelo simbePas encore d'évaluation
- Correction de DSN2 Bac 2020..Document3 pagesCorrection de DSN2 Bac 2020..dahnenanisPas encore d'évaluation
- QCM - Medecine ChimieMr SABOUR 2023Document9 pagesQCM - Medecine ChimieMr SABOUR 2023SABOUR MOHAMMEDPas encore d'évaluation
- Bac Blanc N1 Corr Ex1Document2 pagesBac Blanc N1 Corr Ex1la physique selon le programme FrançaisPas encore d'évaluation
- Examen National Physique Chimie 2 Bac SVT 2020 Rattrapage CorrigeDocument9 pagesExamen National Physique Chimie 2 Bac SVT 2020 Rattrapage CorrigeMohamed SaidiPas encore d'évaluation
- Corige SCPH S1Document9 pagesCorige SCPH S1Anafan DiemePas encore d'évaluation
- 2004 Maroc Correction Pile Electrolyse CuivreDocument2 pages2004 Maroc Correction Pile Electrolyse Cuivredjoudi mouradPas encore d'évaluation
- U Universitec A D D Séries: S2-S2A - S4-S5: Ttéléfax (221) 33 824 65 81 - Tél.: 33 824 95 92 - 33 824 65 81Document5 pagesU Universitec A D D Séries: S2-S2A - S4-S5: Ttéléfax (221) 33 824 65 81 - Tél.: 33 824 95 92 - 33 824 65 81Joséphine NancassePas encore d'évaluation
- Exercices de Révision C132Document18 pagesExercices de Révision C132abraham LincolnPas encore d'évaluation
- Corrige Bac PC Serie s1 2013 PDFDocument6 pagesCorrige Bac PC Serie s1 2013 PDFngariPas encore d'évaluation
- Corrige Bac Normale Physique Chimie PC FrancaisDocument4 pagesCorrige Bac Normale Physique Chimie PC FrancaiselmehdiPas encore d'évaluation
- 4-Corrige Bac Blanc SP s2Document6 pages4-Corrige Bac Blanc SP s2el hadji thierno dioumPas encore d'évaluation
- Bb2018 Corrige SiteDocument7 pagesBb2018 Corrige SitedimaPas encore d'évaluation
- 2008 Polynesie Exo1 Correction Acides 7ptsDocument3 pages2008 Polynesie Exo1 Correction Acides 7ptsla physique selon le programme FrançaisPas encore d'évaluation
- Spe Physique Chimie 2021 Zero 1 CorrigeDocument8 pagesSpe Physique Chimie 2021 Zero 1 CorrigeChahid OUAAZIZIPas encore d'évaluation
- TP 5 - Dosage Conductimétrique - CorrectionDocument1 pageTP 5 - Dosage Conductimétrique - Correctionthierryleprofesseurdephysique bristolPas encore d'évaluation
- Corrigé Serie D 2021Document7 pagesCorrigé Serie D 2021ChristellePas encore d'évaluation
- Série TD N°2 Chimie Des Surfaces Plus CorrectionDocument10 pagesSérie TD N°2 Chimie Des Surfaces Plus CorrectionKawthar100% (5)
- TD: Exercices Avec Solution: Méthodes Instrumentales D'analyse/ ElectrochimieDocument24 pagesTD: Exercices Avec Solution: Méthodes Instrumentales D'analyse/ ElectrochimieHamza YahyaouiPas encore d'évaluation
- Chimie D Chap14 Correction ExosDocument4 pagesChimie D Chap14 Correction ExosSOULA CHAHINAZPas encore d'évaluation
- 2008PC1Document6 pages2008PC1Khaouda DrissPas encore d'évaluation
- Spécialité Physique-Chimie - Sujet Zéro - Corrigé EXERCICE 1 - Dépolluer Une Eau Avec Des Carapaces de Crevettes (10 Points)Document7 pagesSpécialité Physique-Chimie - Sujet Zéro - Corrigé EXERCICE 1 - Dépolluer Une Eau Avec Des Carapaces de Crevettes (10 Points)Mamadou Lamine NianePas encore d'évaluation
- Correction TD1Document2 pagesCorrection TD1fbdbhdPas encore d'évaluation
- Correction DS-satllites-ammoniacDocument4 pagesCorrection DS-satllites-ammoniaccqfd242Pas encore d'évaluation
- Devoir de Synthese N°2: Epreuve: Sciences PhysiquesDocument5 pagesDevoir de Synthese N°2: Epreuve: Sciences PhysiquesNour NessahPas encore d'évaluation
- 2007 09 National Exo1 Correction Iode 6 5ptsDocument4 pages2007 09 National Exo1 Correction Iode 6 5ptsYoussef Ismaili alaouiPas encore d'évaluation
- 28examen National Physique Chimie SPC 2018 Rattrapage Corrige 2Document8 pages28examen National Physique Chimie SPC 2018 Rattrapage Corrige 2yaasir ouukesoPas encore d'évaluation
- TD PVTDocument5 pagesTD PVTDja LilPas encore d'évaluation
- DS n6 CorrectionDocument2 pagesDS n6 CorrectionŤăhã ÊìîPas encore d'évaluation
- PC C 1999 CorDocument8 pagesPC C 1999 Corrktm.avotraPas encore d'évaluation
- Examen PC - PC InternationalDocument5 pagesExamen PC - PC InternationalMalak KabbajPas encore d'évaluation
- 1D1S - TleC - CEG 1 ALLADA - 23-24Document4 pages1D1S - TleC - CEG 1 ALLADA - 23-24Vadius COCOUPas encore d'évaluation
- Physique C PDFDocument4 pagesPhysique C PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- 2011 Metropole Exo1 Correction Detartrant 6 5ptsDocument3 pages2011 Metropole Exo1 Correction Detartrant 6 5ptsScarleth Mejia ManzanaresPas encore d'évaluation
- TP Dosage ConducDocument1 pageTP Dosage Conducsarra bekriPas encore d'évaluation
- U C A D D: Exercice 1Document5 pagesU C A D D: Exercice 1Lindeltaylor DioufPas encore d'évaluation
- TP CCDocument7 pagesTP CCabdouaoaoaoPas encore d'évaluation
- Lycée Pilote Sfax DC 3 2010 CorrigéDocument3 pagesLycée Pilote Sfax DC 3 2010 CorrigéMaram BouaskerPas encore d'évaluation
- Corrigé Série 1électrochimie 23-24Document10 pagesCorrigé Série 1électrochimie 23-24Soumia BakhtaPas encore d'évaluation
- Correction TP4 de CinétiqueDocument5 pagesCorrection TP4 de CinétiqueDjaafeurMenouar80% (5)
- Examen National Physique Chimie SPC 2009 Rattrapage SujetDocument6 pagesExamen National Physique Chimie SPC 2009 Rattrapage SujetŤăhã ÊìîPas encore d'évaluation
- 628bcf3af06f4 - Sujet1 - Bac2022-Sujet N°1-EnoncéDocument9 pages628bcf3af06f4 - Sujet1 - Bac2022-Sujet N°1-EnoncéWael Hajji0% (1)
- Oxydoreduction Exercices Corrigés 05Document3 pagesOxydoreduction Exercices Corrigés 05Ferdannie BemsPas encore d'évaluation
- TP - SI N°1Document10 pagesTP - SI N°1Roi AroufPas encore d'évaluation
- Corrige td1 ElectrochimieDocument7 pagesCorrige td1 Electrochimieayoub dahbi100% (1)
- Fiche 2Document3 pagesFiche 2Wadih MansourPas encore d'évaluation
- 2010 Polynesie Spe Exo3 Correction AnanasDocument2 pages2010 Polynesie Spe Exo3 Correction Ananasla physique selon le programme FrançaisPas encore d'évaluation
- Sujet SciencesDocument6 pagesSujet SciencesLina LamouchiPas encore d'évaluation
- ExercicesDocument5 pagesExercicesAhmed BellakhalPas encore d'évaluation
- TS - BAC Blanc N°1 Corrigé - Spécialité PDFDocument4 pagesTS - BAC Blanc N°1 Corrigé - Spécialité PDFphytanjaPas encore d'évaluation
- Rabat Ratt 2017 PDFDocument4 pagesRabat Ratt 2017 PDFAya El kotbiPas encore d'évaluation
- MR Amara: Devoir de Contrôle N°1 ChimieDocument10 pagesMR Amara: Devoir de Contrôle N°1 ChimieFadhel Fourat BoughanmiPas encore d'évaluation
- Corr 4Document2 pagesCorr 4Moetez FellahPas encore d'évaluation
- 2023 Asie J2 Exo1 Correction VitamineC 9ptsDocument4 pages2023 Asie J2 Exo1 Correction VitamineC 9ptsMahdi GoddiPas encore d'évaluation
- 2023 Asie J2 Exo1 Correction VitamineC 9ptsDocument4 pages2023 Asie J2 Exo1 Correction VitamineC 9ptsgrajzgrPas encore d'évaluation
- Politique EconomiqueDocument12 pagesPolitique EconomiqueHaman Bello OumarouPas encore d'évaluation
- EX SN 2022 2023 Economie Internationale FrancaisDocument3 pagesEX SN 2022 2023 Economie Internationale FrancaisHaman Bello OumarouPas encore d'évaluation
- Politique EconomiqueDocument12 pagesPolitique EconomiqueHaman Bello OumarouPas encore d'évaluation
- Politique EconomiqueDocument12 pagesPolitique EconomiqueHaman Bello OumarouPas encore d'évaluation
- Tchatat Nya RaoulDocument47 pagesTchatat Nya RaoulHaman Bello OumarouPas encore d'évaluation
- Politique EconomiqueDocument12 pagesPolitique EconomiqueHaman Bello OumarouPas encore d'évaluation
- bacCD Chimie 2006Document2 pagesbacCD Chimie 2006Haman Bello OumarouPas encore d'évaluation
- bacCD Chimie 2005Document3 pagesbacCD Chimie 2005Haman Bello OumarouPas encore d'évaluation
- 2013 CtresEtrangers Exo3 Correction Pendule Ammoniac 5ptsDocument3 pages2013 CtresEtrangers Exo3 Correction Pendule Ammoniac 5ptsHaman Bello OumarouPas encore d'évaluation
- bacCD Chimie 2006Document2 pagesbacCD Chimie 2006Haman Bello OumarouPas encore d'évaluation
- Bac CH 2006Document3 pagesBac CH 2006Haman Bello OumarouPas encore d'évaluation
- 2015-Pondichery-Exo1-Correction-Vitamine C-9 PtsDocument3 pages2015-Pondichery-Exo1-Correction-Vitamine C-9 PtsHaman Bello OumarouPas encore d'évaluation
- Bac F1Document2 pagesBac F1Haman Bello OumarouPas encore d'évaluation
- Bac CH 1999Document3 pagesBac CH 1999Haman Bello OumarouPas encore d'évaluation
- TD de Chimie Tle C&DDocument21 pagesTD de Chimie Tle C&DHaman Bello OumarouPas encore d'évaluation
- Bac CH 2000Document2 pagesBac CH 2000Haman Bello OumarouPas encore d'évaluation
- Information Metier Hotellerie Restauration Personnel Du Hall WWW - Hotellerie-Restauration - CoDocument4 pagesInformation Metier Hotellerie Restauration Personnel Du Hall WWW - Hotellerie-Restauration - CoEmploi Hotellerie RestaurationPas encore d'évaluation
- Developpement Dun Systeme de Production Du Biodiesel A Partir Dhuile UtiliseDocument59 pagesDeveloppement Dun Systeme de Production Du Biodiesel A Partir Dhuile UtiliseyveseonePas encore d'évaluation
- Département de Génie Mécanique Option - Génie Des Matériaux Mémoire de Fin D Étude en Vue de L Obtention Du Diplôme de Master en Génie Des MatériauxDocument120 pagesDépartement de Génie Mécanique Option - Génie Des Matériaux Mémoire de Fin D Étude en Vue de L Obtention Du Diplôme de Master en Génie Des MatériauxmoummouPas encore d'évaluation
- StatiqueDocument4 pagesStatiqueMounire BenmoussaPas encore d'évaluation
- Rapport Revue Processus Production Septembre 2023 (2) ADocument16 pagesRapport Revue Processus Production Septembre 2023 (2) AKOUAMEPas encore d'évaluation
- Ondes Sonores Fluides 1Document7 pagesOndes Sonores Fluides 1SaraIdrissiPas encore d'évaluation
- Corrigé DS01 2014 PDFDocument6 pagesCorrigé DS01 2014 PDFEssaidi AliPas encore d'évaluation
- Texte 3 - "Les Colchiques" (Apollinaire, Alcools Extrait N°1)Document2 pagesTexte 3 - "Les Colchiques" (Apollinaire, Alcools Extrait N°1)Florence MauriesPas encore d'évaluation
- Accessoire Pour Distributeurs A Commande Electrique Connecteurs BobinesDocument5 pagesAccessoire Pour Distributeurs A Commande Electrique Connecteurs Bobinesfcbarca2020ifyPas encore d'évaluation
- Engin BTP Et Terrassement-1Document37 pagesEngin BTP Et Terrassement-1SamuelPas encore d'évaluation
- 1 Cours Catenaire Date Inconnue FraDocument130 pages1 Cours Catenaire Date Inconnue Frasnoofsnoof100% (5)
- Environnement Et Changement Climatique Au MarocDocument90 pagesEnvironnement Et Changement Climatique Au MarocHichamLahbil100% (1)
- Chap 1Document14 pagesChap 1NoussaPas encore d'évaluation
- Croquis Quartier Batignolles ParisDocument23 pagesCroquis Quartier Batignolles ParisBruno BROCHARDPas encore d'évaluation
- 2013 - Audit EnergetiqueDocument58 pages2013 - Audit EnergetiqueMouhcine HajjoujePas encore d'évaluation
- Tpe Seminaire Et ConferenceDocument19 pagesTpe Seminaire Et ConferenceErickPas encore d'évaluation
- TDM3 Sans RéponsesDocument2 pagesTDM3 Sans RéponsesOumaima LemouyiPas encore d'évaluation
- Devoir de Contrôle N°2 1er Semestre - Math - Bac Technique (2018-2019) MR Dkhili AhmedDocument2 pagesDevoir de Contrôle N°2 1er Semestre - Math - Bac Technique (2018-2019) MR Dkhili Ahmedkougfst ldhdPas encore d'évaluation
- 30ème FOIRE DE LA PRODUCTION ALGÉRIENNE - SAFEXDocument5 pages30ème FOIRE DE LA PRODUCTION ALGÉRIENNE - SAFEXnabil heddadPas encore d'évaluation
- Le Renouveau Rural (Algérie - 2006)Document435 pagesLe Renouveau Rural (Algérie - 2006)cissmaroc100% (3)
- Guide Des Protocoles Gynecologie-ObstetriqueDocument159 pagesGuide Des Protocoles Gynecologie-Obstetriquejeannette bonivhe100% (1)
- InvestissementsDocument2 pagesInvestissementsMOUSSA DIABATEPas encore d'évaluation
- Al Simiya La Magie Des LettresDocument10 pagesAl Simiya La Magie Des LettresMoussa Bana100% (1)
- Epreuve Pratique CGM Chaudronnerie 2021Document34 pagesEpreuve Pratique CGM Chaudronnerie 2021ben ayed bouraouiPas encore d'évaluation
- VELLARD, Jehan - Une Civilisation Du Miel PREVIEWDocument22 pagesVELLARD, Jehan - Une Civilisation Du Miel PREVIEWResearcherPas encore d'évaluation
- 2020 01 15 Liste OFDocument4 pages2020 01 15 Liste OFREHAZPas encore d'évaluation
- Sites Potentiels en Substances Utiles (Tunis°Document112 pagesSites Potentiels en Substances Utiles (Tunis°Ons Ben Abdallah Kalai100% (1)
- ZAP05 Pages SimplesDocument68 pagesZAP05 Pages SimplesFourier MakambioPas encore d'évaluation
- 6180Document827 pages6180Justyna Podlecka67% (3)
- ImpressionDocument17 pagesImpressionAbdelaziz AbdelazizPas encore d'évaluation