Académique Documents
Professionnel Documents
Culture Documents
2020 Metropole Exo3 Correction ConductiNH3 5pts
Transféré par
hessasTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
2020 Metropole Exo3 Correction ConductiNH3 5pts
Transféré par
hessasDroits d'auteur :
Formats disponibles
Bac S Métropole 2020 Correction © http://labolycee.
org
Exercice 3 : Dosage de l’ammoniac dans un produit ménager (5 points)
1. Extraction de l’ammoniac du liquide d’entretien de canalisation
1.1. D’après les données, la solubilité de l’ammoniac dans l’eau diminue lorsque la température
augmente. Donc le chauffage permet d’extraire l’ammoniac qui devient gazeux progressivement.
1.2. L’ammoniac NH3 est une base et le bleu de thymol deviendrait bleu en sa présence ; or il
reste jaune.
2. Détermination de la masse volumique du liquide d’entretien
m
=
V
220, 4
= = 1,102 g.mL-1 de liquide d’entretien de canalisation.
200, 0
3. Titrage de l’ammoniac
3.1. Burette contenant (H3O+ + Cl–) à
CA = 0,10 mol.L-1
Sonde
conductimétrique
100 mL de solution S
contenant NH3
conductimètre
Agitateur
magnétique
3.2. L’équation de la réaction montre que la base NH3 capte un proton H+ pour former NH4+ et
que H3O+ cède un proton pour se transformer en H2O.
Cette réaction acido-basique faisant intervenir les deux couples H3O+ / H2O et NH4+ / NH3.
3.3. Avant l’équivalence, on apporte dans le milieu réactionnel des ions chlorure Cl– et il se forme
des ions NH4+. Ainsi la concentration en ions croît régulièrement ce qui justifie l’augmentation de
la conductivité σ.
Après l’équivalence, on continue d’apporter des anions chlorure Cl–.
Il ne se forme plus d’ions ammonium NH4+.
Les ions H3O+ sont en excès, ils ne sont plus consommés et contribuent à l’augmentation de la
conductivité de la solution.
La conductivité augmente plus fortement car la conductivité molaire ionique λ des ions oxonium
H3O+ est bien plus grande que celle des ions NH4+.
mNH3
3.4. Le pourcentage massique est défini par w = où mliquide représente la masse de
mliquide
Vliquide = 10,0 mL.
La masse volumique déterminée en 2., permet de calculer mliquide.
m
= liquide donc mliquide = ρ.Vliquide.
Vliquide
(Calcul non demandé mliquide = 1,102×10,0 = 11,0 g)
Pour déterminer mNH3 , on utilise le titrage.
D’après l’équation de la réaction support du titrage, à l’équivalence on a nNH3ini = nH O+versée .
3
Ainsi nNH3ini = CA .Véq
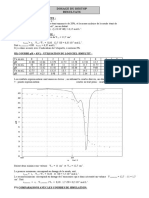
On détermine le volume équivalent en trouvant l’abscisse du point d’intersection des deux demi-
droites modélisant l’évolution de la conductivité σ en fonction du volume d’acide.
Conductivité
(en mS/cm)
? ?
6 6
5 5
4 4
3 3
2 2
1 1
Véq
0 5 10 15 20 25 30
V/mL
0 5 10 15 20 25 30
Volume versé V
On mesure Véq = 19,0 mL. (en mL)
mNH3ini = nNH3ini .MNH3
mNH3ini = CA .Véq .MNH3
(Calcul non demandé mNH3 = 0,10 19, 0 10−3 (14, 0 + 3 1, 0) = 3,23×10–2 g)
mNH3 CA .Véq .MNH3
w= =
mliquide .Vliquide
0,10 19, 0 10−3 (14, 0 + 3 1, 0)
w= = 2,9×10–3 = 0,29 %.
1,102 10
L’introduction indique un pourcentage massique compris entre 0,1% et 0,5%.
Comme on trouve un pourcentage inférieur à 0,5%, on peut penser que la bouteille a été ouverte
avant cette expérience.
Vous aimerez peut-être aussi
- Electrochimie - Compte Rendu TP - Titrages Conductimétrique 6565Document7 pagesElectrochimie - Compte Rendu TP - Titrages Conductimétrique 6565Khezazna Seif89% (9)
- Technologies de L'énergie Propre, Moins Connues, Faible Coût, Et Liées À L'évolution Des ApplicationsDocument388 pagesTechnologies de L'énergie Propre, Moins Connues, Faible Coût, Et Liées À L'évolution Des ApplicationsBen RusuisiakPas encore d'évaluation
- Rapport BroyageDocument59 pagesRapport BroyageIhsan Afriad75% (4)
- 2014 11 AmSud Exo2 Correction Nettoyage 7ptsDocument3 pages2014 11 AmSud Exo2 Correction Nettoyage 7ptsHaman Bello OumarouPas encore d'évaluation
- BB2 Corr (14-15)Document13 pagesBB2 Corr (14-15)LeKaizo vampirePas encore d'évaluation
- 01 - 01 - Preparation Solutions TitreesDocument3 pages01 - 01 - Preparation Solutions TitreesEchafaiPas encore d'évaluation
- Killian - 2022 - Tp1Document9 pagesKillian - 2022 - Tp1amandine gaianiPas encore d'évaluation
- DS 1 CorrigéDocument3 pagesDS 1 CorrigéFethi BorsaliPas encore d'évaluation
- FTSCdevoirCinetique5 CorrigeDocument2 pagesFTSCdevoirCinetique5 CorrigeTay SsirPas encore d'évaluation
- ch02 61 Exos SupDocument6 pagesch02 61 Exos SupskanderPas encore d'évaluation
- TP PSC Final1Document12 pagesTP PSC Final1Malek SaidaouiPas encore d'évaluation
- 2011 11 Amsud Exo3 Correction DosageEtalonnageAlu 4ptsDocument2 pages2011 11 Amsud Exo3 Correction DosageEtalonnageAlu 4ptsAmina EnnPas encore d'évaluation
- Chimie TP4 Conductimetrie - Serum ProfDocument1 pageChimie TP4 Conductimetrie - Serum ProfLéa NuyttensPas encore d'évaluation
- CR Electro 9Document22 pagesCR Electro 9Mer IemPas encore d'évaluation
- Correction Conductivite Des SolutionsDocument4 pagesCorrection Conductivite Des SolutionsClash of Clans Bilal DzPas encore d'évaluation
- Contrôle 4Document2 pagesContrôle 4operarep35Pas encore d'évaluation
- TP Chimie 9 Acides Conductimetrie Version RevisionsDocument3 pagesTP Chimie 9 Acides Conductimetrie Version RevisionsRachaPas encore d'évaluation
- TP Thermodynamique: Le Volume MolaireDocument7 pagesTP Thermodynamique: Le Volume MolaireAya DOGHMANEPas encore d'évaluation
- CoursDocument146 pagesCoursKenza HatrounePas encore d'évaluation
- Rapport Final de L Electrochimie - CopieDocument34 pagesRapport Final de L Electrochimie - CopieMgouni Ismail100% (1)
- Conductimetrie - TPDocument18 pagesConductimetrie - TPChafi Mohammed100% (1)
- 1059 TP Doser Par ConductimetrieDocument3 pages1059 TP Doser Par ConductimetrieAli TrikiPas encore d'évaluation
- 2 T Cos T: 4 + (Aq) 3 (Aq) 2 (L) - (Aq) e - 14 - 1 + (Aq) 3 - (Aq)Document2 pages2 T Cos T: 4 + (Aq) 3 (Aq) 2 (L) - (Aq) e - 14 - 1 + (Aq) 3 - (Aq)Souhail El AsferPas encore d'évaluation
- Titrage Conductim TriquegDocument4 pagesTitrage Conductim Triquegsidi mohamed el amine nekkalPas encore d'évaluation
- Ach13 Corrige ExercicesDocument3 pagesAch13 Corrige ExercicesmohamedPas encore d'évaluation
- TP Dosage ConducDocument1 pageTP Dosage Conducsarra bekriPas encore d'évaluation
- Compte Rendu TP Chimie Des Solutions 2019-2020Document9 pagesCompte Rendu TP Chimie Des Solutions 2019-2020Ikram KhedimPas encore d'évaluation
- Exercices de Révision C132Document18 pagesExercices de Révision C132abraham LincolnPas encore d'évaluation
- Compte Rendu TP CoagulationDocument10 pagesCompte Rendu TP CoagulationMeriem BouPas encore d'évaluation
- TP 02. ConductimétrieDocument4 pagesTP 02. Conductimétriefafoulol100% (1)
- Devoir 1 pc2 PDFDocument6 pagesDevoir 1 pc2 PDFالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Exam - 2014-SN - PC - BIOF (WWW - Pc1.ma) PDFDocument7 pagesExam - 2014-SN - PC - BIOF (WWW - Pc1.ma) PDFRabiaa BabiPas encore d'évaluation
- Correction DS Titrage LaitDocument2 pagesCorrection DS Titrage Laitcqfd242Pas encore d'évaluation
- AcidimétrieDocument15 pagesAcidimétriezineb elmaslouhyPas encore d'évaluation
- Destop ResultatsDocument2 pagesDestop ResultatspiminkPas encore d'évaluation
- Travaux DirigesDocument3 pagesTravaux DirigesLina alikhPas encore d'évaluation
- Copie de Hicham Isotherme D'adsorptionDocument13 pagesCopie de Hicham Isotherme D'adsorptioncélia ferPas encore d'évaluation
- TP L - AdsorptionDocument10 pagesTP L - AdsorptionKahina BghPas encore d'évaluation
- TP-Dosage Par Étalonnage Conductimétrique Fayel Et LuaneDocument3 pagesTP-Dosage Par Étalonnage Conductimétrique Fayel Et LuaneFayel MISTOIHIPas encore d'évaluation
- Cours ConductimetrieDocument8 pagesCours Conductimetrienico21du13Pas encore d'évaluation
- TP2 (1) - ConvertiDocument2 pagesTP2 (1) - ConvertimohaPas encore d'évaluation
- tp2 Chimie de CoordinationDocument6 pagestp2 Chimie de CoordinationNour DriaPas encore d'évaluation
- Exercices PDFDocument4 pagesExercices PDFالغزيزال الحسن EL GHZIZAL Hassane100% (3)
- Technique de Suivi Temporel D'une TransformationDocument8 pagesTechnique de Suivi Temporel D'une TransformationJosé Ahanda NguiniPas encore d'évaluation
- Correction Du TP - Suivi Temporel D'une Transformation Chimique Par ...Document3 pagesCorrection Du TP - Suivi Temporel D'une Transformation Chimique Par ...WaliD MerabeT0% (1)
- TP CCDocument7 pagesTP CCabdouaoaoaoPas encore d'évaluation
- Spécialité Physique-Chimie - Sujet Zéro - Corrigé EXERCICE 1 - Dépolluer Une Eau Avec Des Carapaces de Crevettes (10 Points)Document7 pagesSpécialité Physique-Chimie - Sujet Zéro - Corrigé EXERCICE 1 - Dépolluer Une Eau Avec Des Carapaces de Crevettes (10 Points)Mamadou Lamine NianePas encore d'évaluation
- TP GR 1 Trinome N°7Document14 pagesTP GR 1 Trinome N°7Mohamed TaanePas encore d'évaluation
- Contrôle de Qualité Par DosageDocument6 pagesContrôle de Qualité Par DosageHamza El RHARIRPas encore d'évaluation
- 2019 11 NelleCaledo Exo3 Correction NH4NO3 Conducti 5ptsDocument3 pages2019 11 NelleCaledo Exo3 Correction NH4NO3 Conducti 5ptsgrajzgrPas encore d'évaluation
- Site 164 2083473816Document9 pagesSite 164 2083473816chérifa boulechfarPas encore d'évaluation
- Les Dosages Ou Titrages Directs Exercices Non Corriges 1Document5 pagesLes Dosages Ou Titrages Directs Exercices Non Corriges 1Zeineb BiadPas encore d'évaluation
- DecapageConducti 5pts CorrectionDocument2 pagesDecapageConducti 5pts CorrectionRATIARIVELO Mamy FrédéricPas encore d'évaluation
- Deca Page Conduct IDocument2 pagesDeca Page Conduct IRATIARIVELO Mamy FrédéricPas encore d'évaluation
- Dosage Conduct DestopDocument8 pagesDosage Conduct DestopAmelie PinchonPas encore d'évaluation
- Travaux Diriges GPC 402Document6 pagesTravaux Diriges GPC 402Benito BenitoPas encore d'évaluation
- CONDUCTIMETRIE TPDocument11 pagesCONDUCTIMETRIE TPOUMAIMA SAKHIPas encore d'évaluation
- DS 3 B - CorrigéDocument11 pagesDS 3 B - Corrigéhedidbz38Pas encore d'évaluation
- C9 Exos Supplementaires 50p138 Cor InternetDocument1 pageC9 Exos Supplementaires 50p138 Cor InternethessasPas encore d'évaluation
- Devoir 3 Modele 1 Corrige 1Document4 pagesDevoir 3 Modele 1 Corrige 1hessasPas encore d'évaluation
- 2021 Centres Etrangers ExoC Sujet AmmoniaquepH 5ptsDocument3 pages2021 Centres Etrangers ExoC Sujet AmmoniaquepH 5ptsMartin SALEHPas encore d'évaluation
- Résumé, Lois de Newton, PR FilaliDocument2 pagesRésumé, Lois de Newton, PR FilalihessasPas encore d'évaluation
- Transferts Energetiques Cours 1Document4 pagesTransferts Energetiques Cours 1hessasPas encore d'évaluation
- Devoir 3 Modele 1 Enonce 1Document11 pagesDevoir 3 Modele 1 Enonce 1hessasPas encore d'évaluation
- DC 2015 DecembreDocument15 pagesDC 2015 DecembreAli TalebPas encore d'évaluation
- Tournoi Des 6 Nations SujetDocument1 pageTournoi Des 6 Nations SujethessasPas encore d'évaluation
- Devoir 2 Modele 2 Enonce 1Document3 pagesDevoir 2 Modele 2 Enonce 1hessasPas encore d'évaluation
- Devoir 2 Modele 2 Corrige 1Document4 pagesDevoir 2 Modele 2 Corrige 1hessasPas encore d'évaluation
- Devoir 1 Modele 4 Corrige 1Document3 pagesDevoir 1 Modele 4 Corrige 1hessasPas encore d'évaluation
- Devoir 2 Modele 1 Corrige 1Document3 pagesDevoir 2 Modele 1 Corrige 1hessasPas encore d'évaluation
- Devoir 1 Modele 1 Enonce 1Document3 pagesDevoir 1 Modele 1 Enonce 1hessasPas encore d'évaluation
- Devoir 1 Modele 3 Enonce 1Document4 pagesDevoir 1 Modele 3 Enonce 1hessasPas encore d'évaluation
- TS EXERCICES KeplerDocument4 pagesTS EXERCICES KeplerNajimou Alade TidjaniPas encore d'évaluation
- Correction Les Minerais Dargent Et Leur ExploitationDocument3 pagesCorrection Les Minerais Dargent Et Leur ExploitationhessasPas encore d'évaluation
- Devoir de Vacances 5e Module 4Document2 pagesDevoir de Vacances 5e Module 4hessasPas encore d'évaluation
- Ec11 Te Wo 05 19Document25 pagesEc11 Te Wo 05 19hessasPas encore d'évaluation
- Ec11 Te Wo 05 19Document25 pagesEc11 Te Wo 05 19hessasPas encore d'évaluation
- Chapitre 9 La Mole Et La Concentration Molaire 2016Document5 pagesChapitre 9 La Mole Et La Concentration Molaire 2016hessasPas encore d'évaluation
- Annale Maths Bac S Antilles Guyane Septembre 2020 SujetDocument6 pagesAnnale Maths Bac S Antilles Guyane Septembre 2020 SujethessasPas encore d'évaluation
- CHEWINGUM1Document4 pagesCHEWINGUM1hessasPas encore d'évaluation
- Annale Maths Bac S Antilles Guyane Septembre 2020 CorrigeDocument7 pagesAnnale Maths Bac S Antilles Guyane Septembre 2020 CorrigehessasPas encore d'évaluation
- La Grammaire Du Français Points de Vigilance VFDocument6 pagesLa Grammaire Du Français Points de Vigilance VFhessasPas encore d'évaluation
- Chapitre 9 La Mole Et La Concentration Molaire 2016Document5 pagesChapitre 9 La Mole Et La Concentration Molaire 2016hessasPas encore d'évaluation
- Ria 1 PDFDocument28 pagesRia 1 PDFamal118Pas encore d'évaluation
- Norme Européenne: NF EN 10028-5Document13 pagesNorme Européenne: NF EN 10028-5Noureddine SemaraPas encore d'évaluation
- MANSOURI Fatima-Converti - 3Document97 pagesMANSOURI Fatima-Converti - 3Ouail guePas encore d'évaluation
- Leçon N6 Reactions Les Solutions Avec Les MetauxDocument3 pagesLeçon N6 Reactions Les Solutions Avec Les MetauxAgnaou MohamedPas encore d'évaluation
- Aniosyme Pla IiDocument8 pagesAniosyme Pla IiAbdelPas encore d'évaluation
- Mémo Thermochimie Chap 1 MP 22Document3 pagesMémo Thermochimie Chap 1 MP 22emilian ghaniPas encore d'évaluation
- T1 C1A2 COURS Evolution AtmosphèreDocument1 pageT1 C1A2 COURS Evolution AtmosphèresimousseePas encore d'évaluation
- Application Des Méthodes Expérimentales Dans Des Structures en B.ADocument25 pagesApplication Des Méthodes Expérimentales Dans Des Structures en B.ANazim KASSABPas encore d'évaluation
- Chapitre 2-0-Pliage Des TolesDocument32 pagesChapitre 2-0-Pliage Des TolesHamza Liberados80% (5)
- Biology Paper 1 TZ1 HLDocument16 pagesBiology Paper 1 TZ1 HLyara hazemPas encore d'évaluation
- Extraction Solide Liquide Sur Pilote de GraineDocument78 pagesExtraction Solide Liquide Sur Pilote de GraineMaryem Ben SalemPas encore d'évaluation
- Devoir de Synthèse N°1 - Sciences Physiques - 3ème Mathématiques (2015-2016) Mme Grissa HafidhaDocument3 pagesDevoir de Synthèse N°1 - Sciences Physiques - 3ème Mathématiques (2015-2016) Mme Grissa HafidhaaliPas encore d'évaluation
- La Gaine de Câble À Fibre Optique ++++Document1 pageLa Gaine de Câble À Fibre Optique ++++Abdelhamid SammoudiPas encore d'évaluation
- TDPermDocument4 pagesTDPermAmine HeddoubPas encore d'évaluation
- Adet 0251 Fraisage Usinage Matériaux MétalliquesDocument22 pagesAdet 0251 Fraisage Usinage Matériaux MétalliquesOkbaPas encore d'évaluation
- 32examen National Physique Chimie Sciences Maths 2018 Rattrapage CorrigeDocument4 pages32examen National Physique Chimie Sciences Maths 2018 Rattrapage CorrigeAssia OunkhirPas encore d'évaluation
- 10 SD FRDocument4 pages10 SD FRabbes ben hemanaPas encore d'évaluation
- Mod4 Corrige ch8 Partie2Document8 pagesMod4 Corrige ch8 Partie2api-278378684100% (1)
- Ads TPDocument6 pagesAds TPcélia ferPas encore d'évaluation
- Freitapox SR 215 NFDocument2 pagesFreitapox SR 215 NFmarine MPas encore d'évaluation
- Chap 1Document15 pagesChap 1Anonymous f5yW3N0jSPas encore d'évaluation
- Analyse TGADocument20 pagesAnalyse TGAzhor El hallaoui100% (1)
- Criteres D'acceptation API 1104Document1 pageCriteres D'acceptation API 1104Had Rayane100% (2)
- Amelioration de La Disponibili - Safae JTITE - 4630Document151 pagesAmelioration de La Disponibili - Safae JTITE - 4630Zineddine El Mehdi MustaphaPas encore d'évaluation
- Exp RaffinageDocument15 pagesExp RaffinageNøü ĐaPas encore d'évaluation
- TD 3 Et CorrectionDocument10 pagesTD 3 Et CorrectionCǿêûr Ðê PîirâtêPas encore d'évaluation
- Les Structures PoreusesDocument9 pagesLes Structures PoreusesSeddik hPas encore d'évaluation
- PDR Pour Analyseur Chimiques Et SondesDocument19 pagesPDR Pour Analyseur Chimiques Et SondesSODEX FRANCEPas encore d'évaluation