Académique Documents
Professionnel Documents
Culture Documents
Réactions D'oxydation Ménagée - Correction
Transféré par
physikcollegeTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Réactions D'oxydation Ménagée - Correction
Transféré par
physikcollegeDroits d'auteur :
Formats disponibles
Réactions d’oxydation ménagée - Correction
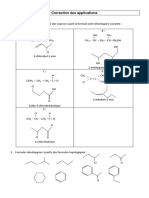
Exercice 01 : Classe et noms des alcools
1. Indiquer la classe et le nom de chacun des alcools suivants :
Le nom de l’alcool dérive du nom de l’alcane possédant la même chaîne carbonée. Le –e final est
remplacé par le suffixe –ol.
a. 3-méthylbutan-2-ol : le carbone fonctionnel est lié à deux atomes de carbone, il s’agit d’un alcool
secondaire.
b. pentan-3-ol : le carbone fonctionnel est lié à deux atomes de carbone, il s’agit d’un alcool secondaire.
c. pentan-1-ol : il s’agit d’un alcool secondaire.
d. 2,2-diméthylpropan-1-ol ; il s’agit d’un alcool primaire.
e. 2-méthylbutan-2-ol ; il s’agit d’un alcool tertiaire.
2. Quel est le point commun entre tous ces alcools ?
Ces alcools ont la même formule brute C3 H12 O : ce sont des isomères.
Exercice 02 : Identification d’un alcool
On dispose d’un alcool à chaîne carbonée linéaire de formule brute C4 H10 O. Afin de l’identifier, on
réalise deux expériences.
Expérience 1 : on introduit dans un tube à essai 1 mL de cet alcool et on ajoute quelques gouttes d’une
solution acidifiée de permanganate de potassium. La coloration violette du permanganate disparait. La
phase organique obtenue est traitée à la 2,4-DNPH : un précipité jaune se forme.
Expérience 2 : on introduit dans un tube à essai contenant 1 mL de cet alcool un excès de solution de
permanganate de potassium jusqu’à ce que la coloration violette persiste. La phase organique obtenue ne
donne cette fois aucun précipité avec la 2,4-DNPH.
Quelle est la classe de cet alcool ? L’identifier et donner sa formule topologique.
Dans l’expérience 1, la solution se décolore, ce qui signifie que l’ion permanganate a été réduit par
l’alcool : l’alcool est primaire ou secondaire et son oxydation a produit un composé carbonylé qui donne
un test positif à la 2,4-DNPH.
Dans la deuxième expérience, lorsque l’ion permanganate est en excès, le test à la 2,4-DNPH est négatif :
le composé carbonylé a été oxydé ; c’est donc un aldéhyde. L’alcool de départ est donc un alcool
primaire.
Il s’agit du butanal-1-ol : OH
Exercice 03 : La menthone
La menthone est un constituant de certaines espèces de menthe. Son odeur et sa saveur en font un arôme
très utilise dans les produits alimentaires. La menthone est préparée par oxydation ménagée du menthol
par l’ion permanganate en milieu acide.
On introduit une masse m = 4.7 g de menthol dans un ballon de 100 ml, on ajoute un volume V = 30 mL
d’une solution aqueuse de permanganate de potassium de concentration c = 0.5 mol.L-1, quelques gouttes
d’acide sulfurique concentré, quelques grains de pierre ponce. On chauffe à
reflux pendant une vingtaine de minutes. On laisse refroidir le mélange CH3
réactionnel.
CH
Données : formule semi-développée du menthol : CH2 CH2
Masses molaires : CH2 CH
M (menthol) = 156.2 g.mol-1 CH OH
M (menthone) = 154.2 g.mol-1 CH
CH3 CH3
a. Dessiner un montage à reflux en précisant le rôle de chacun des éléments du
montage.
Le menthol, la solution de potassium et l’acide sulfurique sont placés dans le ballon et chauffés grâce au
chauffe-ballon. Le ballon est surmonté d’un réfrigérant qui condense les vapeurs s’échappant du ballon. Il
évite les pertes par évaporation que l’on rencontrerait dans un chauffage simple. Le support élévateur
permet d’ajuster le niveau du chauffe-ballon à celui du montage et de pouvoir le baisser rapidement en
cas de surchauffe.
b. A quelle famille appartient le menthol ?
Le menthol possède un groupe hydroxyle OH, c’est un alcool (secondaire).
c. Quelle est la formule semi-développée de la menthone ? A quelle famille appartient-elle ?
La menthone est obtenue par oxydation d’un alcool secondaire, c’est une cétone de formule semi-
développée :
CH3
CH
CH2 CH2
CH2 C
CH O
CH
CH3 CH3
d. Ecrire les deux demi-équations d’oxydoréduction des couples MnO−4 (𝑎𝑞) / Mn2+ et menthone /
menthol.
La demi-équation d’oxydoréduction du couple MnO−4 2+
(𝑎𝑞) / Mn :
MnO−4 (aq) + 8 H +(aq) + 5 e− = Mn2+(aq) + 4 H2 O (l)
En utilisant une formule simplifiée pour la menthone et le menthol, la demi-équation d’oxydoréduction
du couple menthone / menthol est :
C9 H18 CO + 2 H +(aq) + 2 e− = C9 H18 CHOH
e. En déduire l’équation de la réaction d’oxydation du menthol par les ions permanganate.
L’équation de la réaction d’oxydation du menthol par les ions permanganate est donc :
2 MnO−4 (aq) + 5C9 H18 CHOH + 6 H +(aq) → 2 Mn2+(aq) + 5 C9 H18 CO + 8 H2 O (l)
f. Y-a-t-il un réactif en excès ? Si oui, lequel ?
𝑛𝑖 (MnO−4 ) = c X V = 0.5 𝑋 30 𝑋 10−3 = 1.5 𝑋 10−2 𝑚𝑜𝑙
𝑚 4.7
𝑛𝑖 (C9 H18 CHOH) = = = 3 𝑋 10−2 𝑚𝑜𝑙
𝑀𝑚𝑒𝑛𝑡ℎ𝑜𝑙 156.2
Le tableau d’avancement de la réaction :
2 MnO−4 (aq) + 5C9 H18 CHOH + 6 H +(aq) → 2 Mn2+(aq) + 5 C9 H18 CO + 8 H2 O (l)
Avancement
Quantités de matière (mol)
(mol)
Etat
0 1.5 𝑋 10−2 3 𝑋 10−2 Excès 0 0 Solvant
initial
En
cours
de 𝑥 1.5 𝑋 10−2 − 2𝑥 3 𝑋 10−2 − 5𝑥 Excès 2𝑥 5𝑥 Solvant
transfor
mation
Etat
𝑥𝑚𝑎𝑥 1.5 𝑋 10−2 − 2𝑥𝑚𝑎𝑥 3 𝑋 10−2 − 5𝑥𝑚𝑎𝑥 Excès 2𝑥𝑚𝑎𝑥 5𝑥𝑚𝑎𝑥 Solvant
final
Si MnO−4 est le réactif limitant : 1.5 𝑋 10−2 − 2𝑥𝑚𝑎𝑥 = 0, 𝑠𝑜𝑖𝑡 ∶ 𝑥𝑚𝑎𝑥 = 7,5 𝑋 10−3 𝑚𝑜𝑙.
Si C9 H18 CHOH est le réactif limitant : 3 𝑋 10−2 − 5𝑥𝑚𝑎𝑥 = 0, 𝑠𝑜𝑖𝑡 ∶ 𝑥𝑚𝑎𝑥 = 6 𝑋 10−3 𝑚𝑜𝑙.
Ce qui correspond à une masse de zinc qui a été oxydée :
𝑥𝑚𝑎𝑥 = 6 𝑋 10−3 𝑚𝑜𝑙, donc l’ion MnO−4 est en excès.
g. Déterminer la masse théorique de menthone 𝑚𝑡ℎ que l’on peut obtenir.
La quantité de matière théorique de menthone que l’on peut obtenir est 5𝑥𝑚𝑎𝑥 , ce qui correspond à une
masse de menthone : 𝑚𝑡ℎ = 5𝑥𝑚𝑎𝑥 𝑋 𝑀𝑚𝑒𝑛𝑡ℎ𝑜𝑛𝑒
𝑚𝑡ℎ = 5 𝑋 6 𝑋 10−3 𝑋 154.2 = 4.6 𝑔
h. Proposer un test qui permettrait de mettre en évidence la menthone obtenue.
Le test caractéristique permettant de mettre en évidence la présence d’un composé carbonylé est le test à
2,4-DNPH. En introduisant quelques gouttes de menthone dans un tube à essai contenant de la 2,4-
DNPH, on obtient un précipité jaune orange.
i. Après purification et séchage, on obtient 𝑚𝑒𝑥𝑝 = 3.4 𝑔 de menthone. Calculer le rendement de la
synthèse. Pour quelles raisons ce rendement est-il inférieur à 1 ?
𝑚𝑒𝑥𝑝 3.4
Soit η le rendement de cette synthèse : η = = 4.6 = 0.74 ; η = 74 % .
𝑚𝑡ℎ
Le rendement d’une synthèse est toujours inférieur à 1. En effet, une partie du produit est perdue au
cours des différentes étapes. De plus, des réactions parasites peuvent avoir lieu qui consomment les
réactifs sans que l’on obtienne le produit désiré.
Vous aimerez peut-être aussi
- C11Chim - Controle - Evolution - Exos - SavondeMarseille PDFDocument8 pagesC11Chim - Controle - Evolution - Exos - SavondeMarseille PDFAzizElheniPas encore d'évaluation
- 492 PC GENE 123 SUJET Chi Exo1 Menthone AvecCalc CorDocument2 pages492 PC GENE 123 SUJET Chi Exo1 Menthone AvecCalc CorYoman Arthur verdier AssuiPas encore d'évaluation
- Comp6 Evalc1Document4 pagesComp6 Evalc1Kheria ZitouniPas encore d'évaluation
- Devoir Surveillé 2 TS1Document2 pagesDevoir Surveillé 2 TS1Serigne Abdou NiassePas encore d'évaluation
- Exam Et Corrigé TP SMC3 17-18Document10 pagesExam Et Corrigé TP SMC3 17-18Hamza FaFouriPas encore d'évaluation
- Chap 2 Les AlcanesDocument7 pagesChap 2 Les Alcanestoto TOTOROTO100% (1)
- Chimie Probatoire Blanc 1 PDFDocument2 pagesChimie Probatoire Blanc 1 PDFWilliam YemeliPas encore d'évaluation
- ds5 CorrigeDocument16 pagesds5 Corrigeakissiyapi555Pas encore d'évaluation
- Chimie Chapitre11 Groupes - CaracteristiquesDocument3 pagesChimie Chapitre11 Groupes - CaracteristiquesStevy AtaliPas encore d'évaluation
- TD6 RMGXDocument4 pagesTD6 RMGXamalPas encore d'évaluation
- No1 30 Jan 2022 Sujetexa - ComDocument2 pagesNo1 30 Jan 2022 Sujetexa - ComJuste Landry OngoloPas encore d'évaluation
- Jijel - Cours de Chimie OrganiqueDocument8 pagesJijel - Cours de Chimie OrganiqueImene Aoun SeghirPas encore d'évaluation
- Sem 1 S10405Document4 pagesSem 1 S10405jamjamalPas encore d'évaluation
- Benzène 0607Document2 pagesBenzène 0607PFE86% (7)
- Corrige PC s2 2013 2Document6 pagesCorrige PC s2 2013 2Essohanam AwatePas encore d'évaluation
- Exam-Corrige Chimie PDFDocument4 pagesExam-Corrige Chimie PDFNassimaPas encore d'évaluation
- 01 Chimie OrganiqueDocument9 pages01 Chimie OrganiqueHocine MichelPas encore d'évaluation
- Chimie Bac - Transformations Chimiques - SpectrophotométrieDocument1 pageChimie Bac - Transformations Chimiques - SpectrophotométrieMohammed NiaguiPas encore d'évaluation
- Corrigés Leçon 6 - Composés Oreganiques OxygénésDocument5 pagesCorrigés Leçon 6 - Composés Oreganiques Oxygénésholyeric50Pas encore d'évaluation
- Chapitre VII Les Réactions D'estérificationDocument11 pagesChapitre VII Les Réactions D'estérificationRenolga MountekelaPas encore d'évaluation
- 14 Corrigé Série 1Document8 pages14 Corrigé Série 1Snaptube 2022Pas encore d'évaluation
- Co5 ReactivitealcoolsDocument2 pagesCo5 ReactivitealcoolsAhmed Ben RomdhanePas encore d'évaluation
- Sirop MentheDocument3 pagesSirop MentheRATIARIVELO Mamy FrédéricPas encore d'évaluation
- Chimie Organique TD1Document7 pagesChimie Organique TD1Mira MaroPas encore d'évaluation
- Solvants en Chimie OrganiqueDocument3 pagesSolvants en Chimie OrganiqueMvone100% (2)
- Tres Bon Doc Cours Chimie Tle DDocument60 pagesTres Bon Doc Cours Chimie Tle DChristophe Nemlin100% (1)
- ResineDocument16 pagesResineHenadi GhomrianePas encore d'évaluation
- 2009 Polynesie Spe Exo3 Correction AcideBenzoique 4ptsDocument2 pages2009 Polynesie Spe Exo3 Correction AcideBenzoique 4ptsla physique selon le programme FrançaisPas encore d'évaluation
- IChO1-Structure de La MatièreDocument2 pagesIChO1-Structure de La MatièreDominique LoeuilletPas encore d'évaluation
- LyBilTougang II Tles C - CH THEORIQUE - N°1 22-23Document2 pagesLyBilTougang II Tles C - CH THEORIQUE - N°1 22-23rodriguekamara4Pas encore d'évaluation
- Solvants en Chimie OrganiqueDocument3 pagesSolvants en Chimie OrganiqueNozha HammamiPas encore d'évaluation
- c1 Les AlcoolsDocument6 pagesc1 Les AlcoolsComan SakoPas encore d'évaluation
- Mangani M Ét RieDocument5 pagesMangani M Ét RieVictoria BuciuceanuPas encore d'évaluation
- Chimie Organique Et Chimie Des Solutions AqueusesDocument10 pagesChimie Organique Et Chimie Des Solutions AqueusesbangnhatquangquangPas encore d'évaluation
- Toute La Chimie en Tle S de c1 A c9 PDFDocument65 pagesToute La Chimie en Tle S de c1 A c9 PDFPatrice NyaPas encore d'évaluation
- TD ALCANE Et TEC 1ère DDocument4 pagesTD ALCANE Et TEC 1ère DNguettia Yao jean Daniel Adou100% (1)
- TD AlcoolsDocument3 pagesTD AlcoolsnutsugadjifaPas encore d'évaluation
- Cours Chimie Organique BEP ProfDocument10 pagesCours Chimie Organique BEP ProfOtaku 4 LifePas encore d'évaluation
- Composés Organiques SNV 2018-19Document18 pagesComposés Organiques SNV 2018-19meriembatoul lachehebPas encore d'évaluation
- Yyy Suppexos cm4 cm5 Chimie Acides Bases PDFDocument16 pagesYyy Suppexos cm4 cm5 Chimie Acides Bases PDFKurosaki AimarPas encore d'évaluation
- TD CH 2 EspoirDocument6 pagesTD CH 2 EspoirRodrigue TchoffoPas encore d'évaluation
- Reactions D Esterification Et D Hydrolyse Cours LatexDocument5 pagesReactions D Esterification Et D Hydrolyse Cours LatexIsmail EloualiPas encore d'évaluation
- ExtraitDocument8 pagesExtraitLewis HamiltonPas encore d'évaluation
- DS05Document11 pagesDS05baatoutmbPas encore d'évaluation
- Correction TD Chimie Générale Fiche2 - CópiaDocument10 pagesCorrection TD Chimie Générale Fiche2 - CópiacomboudriPas encore d'évaluation
- Chimie Tle DBLANCDocument2 pagesChimie Tle DBLANCFabien KenmognePas encore d'évaluation
- Bac S 2019 Polynesie Ex 2Document2 pagesBac S 2019 Polynesie Ex 2Nina HanPas encore d'évaluation
- AminesDocument2 pagesAminesHaykelGaouaPas encore d'évaluation
- Molecules Organiques Et Squelettes Carbones Modification Du Squelette Carbone Cours 2 4Document5 pagesMolecules Organiques Et Squelettes Carbones Modification Du Squelette Carbone Cours 2 4Ossama SariaPas encore d'évaluation
- c9 - Correction DexercicesDocument7 pagesc9 - Correction Dexercicesedford013Pas encore d'évaluation
- Examen Correction L2 Chimie Organique 2007 4Document6 pagesExamen Correction L2 Chimie Organique 2007 4R-win100% (1)
- Chimie TleCD Eval2 Lycee Bilingue Zenmeh Dschang 2021 2022Document2 pagesChimie TleCD Eval2 Lycee Bilingue Zenmeh Dschang 2021 2022alhadjiamadouPas encore d'évaluation
- Mines CH MP - Psi 2018Document6 pagesMines CH MP - Psi 2018Zaineb AbbadPas encore d'évaluation
- TP00 H2O2corr PDFDocument2 pagesTP00 H2O2corr PDFEl Ouahabi SoufyanePas encore d'évaluation
- ch11 AP Alcools Alcanes Avec Correction DMDocument3 pagesch11 AP Alcools Alcanes Avec Correction DMMarc JonasPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Polymères 1ère S Exercices CorrigésDocument3 pagesPolymères 1ère S Exercices CorrigésAbdallah AmmarPas encore d'évaluation
- Réactions D'oxydation Ménagée - ExercicesDocument4 pagesRéactions D'oxydation Ménagée - ExercicesphysikcollegePas encore d'évaluation
- Cours, La QualitéDocument46 pagesCours, La QualitéphysikcollegePas encore d'évaluation
- Management de La Qualité, TQMDocument39 pagesManagement de La Qualité, TQMphysikcollege100% (1)
- Outils de QualiteDocument50 pagesOutils de QualiteAdama Fangafossé Coulibaly100% (3)
- CO1 1S1 2024 LSLL - WahabdiopDocument3 pagesCO1 1S1 2024 LSLL - Wahabdioppapa samba sarrPas encore d'évaluation
- Orbitales Et Réactivité ChimiqueDocument17 pagesOrbitales Et Réactivité ChimiqueCharles CostesPas encore d'évaluation
- Chimie Biologie Appliquees A LEnvironnementDocument3 pagesChimie Biologie Appliquees A LEnvironnementHafida ZiouaniPas encore d'évaluation
- Exo Sur La Nomenclature GINNA DOGONDocument2 pagesExo Sur La Nomenclature GINNA DOGONIssouf BerthePas encore d'évaluation
- Valorisation DéchetsDocument18 pagesValorisation DéchetsRania ImakorPas encore d'évaluation
- 17-Techniques de Biologie MoléculaireDocument76 pages17-Techniques de Biologie MoléculaireInsafPas encore d'évaluation
- These Zemmouri HaneneDocument211 pagesThese Zemmouri HaneneLilium Cattleya50% (2)
- Transcription Et Maturation Des ARNDocument26 pagesTranscription Et Maturation Des ARNMariama Ali houmadiPas encore d'évaluation
- Les Biocapteurs Enzymatiques: République Algérienne Démocratique Et PopulaireDocument15 pagesLes Biocapteurs Enzymatiques: République Algérienne Démocratique Et PopulaireLezghed Amira meriamPas encore d'évaluation
- AldostéroneDocument8 pagesAldostéronezlimitounePas encore d'évaluation
- Cours Génie Microbiologique ETDocument223 pagesCours Génie Microbiologique ETFatima Ezzahra LaftouhiPas encore d'évaluation
- Memoire Tebbi Houda FinalDocument91 pagesMemoire Tebbi Houda FinalFouad MihoubPas encore d'évaluation
- Le Soin Par Les PlantesDocument35 pagesLe Soin Par Les PlantesCécile BerlanPas encore d'évaluation
- Chap 2 UV 2020 2021Document19 pagesChap 2 UV 2020 2021Hk EhPas encore d'évaluation
- 11201224t.pdfm, Nqno Qteriqux Hybrides Bqndou SQ IrqDocument122 pages11201224t.pdfm, Nqno Qteriqux Hybrides Bqndou SQ Irqbandou samiraPas encore d'évaluation
- 3-Synthèse Des Polymères Etudiant 2020Document100 pages3-Synthèse Des Polymères Etudiant 2020max hebertPas encore d'évaluation
- TD Chimie Org Corrigé SuiteDocument20 pagesTD Chimie Org Corrigé SuiteBöris LetökössPas encore d'évaluation
- General ENSAIADocument28 pagesGeneral ENSAIASalsabil MhamdiPas encore d'évaluation
- Theme: Memoire de Fin D'EtudeDocument99 pagesTheme: Memoire de Fin D'Etudekhalida zehriPas encore d'évaluation
- Genèse de PétroleDocument8 pagesGenèse de PétroleAbderrazak BerrahalPas encore d'évaluation
- 18chi3e E1Document4 pages18chi3e E1Oumarou KontaPas encore d'évaluation
- 1.CH13 TD Familles Molecules OrganiquesDocument11 pages1.CH13 TD Familles Molecules OrganiquesmahadPas encore d'évaluation
- Cours de MetabolismeDocument69 pagesCours de Metabolismeleonce kadjiPas encore d'évaluation
- 112618GBS3Document46 pages112618GBS3ines bouzianePas encore d'évaluation
- T JacquesDocument205 pagesT Jacquessouiguioussama17Pas encore d'évaluation
- Présentation Des Differents PolluantsDocument6 pagesPrésentation Des Differents Polluantsraouf raoufPas encore d'évaluation
- Chap 13Document5 pagesChap 13hepived840Pas encore d'évaluation
- ADEME - Guide de Bonnes Pratiques Agricoles Pour La Qualité de L'airDocument43 pagesADEME - Guide de Bonnes Pratiques Agricoles Pour La Qualité de L'airMichel WalkowiakPas encore d'évaluation
- Biochimie Structurale Des GlucidesDocument147 pagesBiochimie Structurale Des GlucidesLuciano HajaharisonPas encore d'évaluation
- Micro-Mémoire TP ORGANIQUE L3-2024Document5 pagesMicro-Mémoire TP ORGANIQUE L3-2024lizamrzkPas encore d'évaluation