Académique Documents
Professionnel Documents
Culture Documents
Exercices Résolus
Transféré par
Pascal DalatTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Exercices Résolus
Transféré par
Pascal DalatDroits d'auteur :
Formats disponibles
C H I M I E
ORGA NI QUE
Notions fondamentales
Exercices rsolus
5
e
di t i on
r i c ha r d h u ot
g r a r d - y von r oy
revue et corrige
h
u
o
t
r
o
y
C
H
I
M
I
E
O
R
G
A
N
I
Q
U
E
N
o
t
i
o
n
s
f
o
n
d
a
m
e
n
t
a
l
e
s
E
x
e
r
c
i
c
e
s
r
s
o
l
u
s
Couverture : Gianni Caccia
Photos : Serg64 / Le Do / Shutterstock
isbn 978-2-923989-07-5
CHI MI E ORGA NI QUE
Notions fondamentales
Exercices rsolus
Ce livre sadresse aux tudiants des cgeps qui participent au programme Sciences
de la nature. Le volume couvre intgralement le contenu et les lments de la
comptence des deux cours de chimie organique (202-fya-04 et 202-fyb-04).
Comprenant quinze chapitres et deux textes complmentaires, louvrage aborde
systmatiquement toutes les fonctions organiques de base, en plus des fonctions
particulires aux sciences biologiques. Les auteurs y privilgient ltude de la
chimie organique sous les angles de la rigueur, de la logique et de la prcision des
termes, principalement lors des exercices danalyse des ractions. Laccent est
galement mis sur une solide comprhension des mcanismes de raction base
sur un constant rappel des relations entre les diverses fonctions. Plutt quun
savoir encyclopdique ou clectique, lissue de ce cours, ltudiant aura acquis
une relle conance en sa formation de base, essentielle pour aborder nimporte
quel programme universitaire.
Outre sa nouvelle prsentation, cette cinquime dition de Chimie organique, notions
fondamentales, une ralisation entirement qubcoise, publie la premire fois en 1992,
a t revue et corrige en tenant compte des exigences et des suggestions de nombreux
enseignants du niveau collgial. Laccent a t mis sur les mthodes systmatiques de
rsolution dexercices dans les chapitres 5, 6, 7 et 8. Ces chapitres fournissent quantit
doccasions de mettre en relation les diverses fonctions de chimie organique dans les
ractions tudies.
Richard Huot, dtenteur dun doctorat en chimie organique (synthse de quinones) de
lUniversit Laval, a enseign pendant 35 ans au niveau collgial et a t charg de cours
lUniversit Laval (cours compensateurs) pendant 10 ans.
Grard-Yvon Roy, dtenteur dun baccalaurat s arts et dun baccalaurat en sciences
(chimie) de lUniversit Laval, a enseign pendant 32 ans au Cgep de Sainte-Foy. Il est lauteur
de Chimie organique, apprentissage individualis, paru aux ditions Le Grion dargile.
Chimie organique-couv final.indd 2 4/28/11 9:47:09 PM
CHIMIE ORGANIQUE
CHIMIE ORGANIQUE
Notions fondamentales
5
e
dition
EXERCICES RSOLUS
Richard Huot
D.Sc. (chimie organique)
Grard-Yvon Roy
B.A., B.Sc. (chimie)
CONSULTATION
Judith Bouchard
Cgep du Vieux-Montral
Sonia Bourgeois
Collge Ahuntsic
ISBN 978-2-923989-07-5
ditions Saint-Martin, 2011
Mise en page : Grald Prudhomme
Montage de la couverture : Gianni Caccia
Image en couverture : Serge64/Le Do/Shutterstock
La maison ddition reconnat laide nancire du Gouvernement du
Canada par lentremise du Fonds du livre du Canada pour ses activits
ddition.
La maison ddition bncie du Programme de crdit dimpt pour
ldition de livres du Gouvernement du Qubec, gr par la SODEC.
Tous droits rservs
Il est illgal de reproduire la totalit ou une partie quelconque de ce
livre sans lautorisation crite de la maison ddition. La reproduction
illgale de cette publication, par nimporte quel procd, sera
considre comme une violation des droits dauteurs.
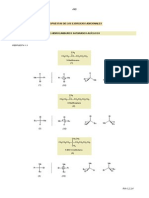
Chapitre 1
RAPPELS
Latome
1.1 et 1.2 Composition de latome et reprsentation lectronique
1.
2. 1839 lectrons. La masse dun lectron est donc 1839 fois plus petite que celle dun proton.
3.
4.
Atome :
Nombre
H C N O Cl Br Mg S
de protons 1 6 7 8 17 35 12 16
dlectrons internes 0 2 2 2 10 28 10 10
dlectrons priphriques 1 4 5 6 7 7 2 6
dlectrons priphriques
clibataires
1 2 3 2 1 1 0 2
Atome Configuration lectronique Structure de Lewis
Na 1*
Mg 2
C
4
N 5
O
6
Cl
7
CH
4
HCl NH
3
H
2
O HF
* nombre d'lectrons priphriques
6 Chapitre 1 Section 1.3
1.3 Proprits
1. F > N > H > O > Na
2. Seule la raction (c) implique lnergie de premire ionisation dun atome.
3. F < O < N < H < C < Br < I
4 a) lion chlorure ClW
b) latome Cl
c) le carbanion H
3
C
W
d) latome C
e) lion N
3
W
5. Li < H < C < S < Br < N < Cl < O < F
6. a) La liaison CUC. Les deux atomes de carbone possdent la mme lectrongativit.
b) La liaison CUF. La distance moyenne o peut se situer le doublet dlectrons par rapport
au centre de latome C dpend du rayon atomique de latome auquel il est li. Latome F
tant le plus petit atome de la srie et le plus lectrongatif, on peut dire que le doublet
de la liaison qui le relie au C est plus rapproch du centre de latome F, donc le plus
droite. On peut galement se baser sur la diffrence dlectrongativit: CUF (n* =
1,45), CUI (n = 0,11). Donc plus la diffrence dlectrongativit est grande, plus le
doublet est dplac vers latome le plus lectrongatif.
*n = diffrence dlectrongativit
La molcule
1.4 Proprits
1. La plus polaire: CUF. La moins polaire: CUC.
2.
Espce(s) chimique en solution Type de liaison dans la substance
KCl(s) ions K
Q
et Cl
W
ionique
H
2
(g) molcules H
2
(g) covalente non polaire
CH
3
OH(l) molcules CH
3
OH(aq) covalente polaire
C
6
H
12
O
6
(s) molcules C
6
H
12
O
6
(aq) covalente polaire (CUO et OUH)
N
2
(g) molcules N
2
(g) covalente non polaire
HCl (g) ions H3O
Q
et Cl
W
covalente trs polaire
7 Chapitre 1 Section 1.5
3. a) Liaisons hydrogne dans: H
2
O(l) et CH
3
OH(l).
b) Liaison ionique dans: NaCl(s).
4. Dans les molcules O
2
(g) et N
2
(g) o la diffrence dlectrongativit est nulle.
5. Lair non pollu contient:
a) des molcules non polaires: N
2
(78%), O
2
(21%) et CO
2
(en faible %) ;
b) des molcules polaires : vapeur deau, H
2
O (% variable).
Lair pollu peut videmment contenir diverses autres espces polaires ou non polaires:
radon, Ra ; oxydes dazote, NOx ; monoxyde de carbone, CO ; anhydrides sulfureux et sulfu-
riques, SO
2
et SO
3
, etc.
6. a) Liaison la moins polaire
b) Liaison la plus polaire
c) CUO est plus polaire que CUH parce que n est plus grande que dans CUH.
1.5 Liaisons intramolculaires
1. En se rfrant au tableau 1.1, la valeur de lcart entre llectrongativit de chaque lment,
n, permet de tirer les conclusions suivantes:
2. nergie de dissociation de Br
2
< CO < KBr
Br
2
est non polaire, donc liaison covalente faible. De plus, les bromes sont gros et la liaison
est longue.
CO est polaire, donc liaison covalente assez forte.
KBr est ionique. Les ions constituent un rseau cristallin o la liaison est trs forte.
3. Sa capacit extraordinaire se lier lui-mme un grand nombre de fois et de multiples
faons: la catnation.
lments n Nature de la liaison
a) C et H 0,35 covalente polaire (quoique faiblement polaire)
b) C et Li 1,57 covalente fortement polaire
c) C et O 0,89 covalente polaire
d) Cl et Li 2,18 ionique
e) H et O 1,24 covalente polaire (fortement polaire)
f) C et C 0,00 covalente non polaire
g) S et C 0,03 covalente polaire (quoique faiblement polaire)
h) N et C 0,49 covalente polaire (quoique faiblement polaire)
8 Chapitre 1 Section 1.5
4.
5. Ils se repousseraient et tous
trois occuperaient un mme
plan leur distance dqui-
libre. Cest le mme principe
pour les trois (3) nuages
lectroniques de lhybridation
sp
2
.
6. a) Elles se repousseraient de faon occuper les positions les plus loignes possibles les
unes des autres.
b) 120
c) Le systme des 3 balles se comporterait de la mme manire et les 3 balles noccu-
peraient quun seul plan de lespace. (Il est toujours possible de passer un plan par 3
points). Constater, ici, lanalogie avec les orbitales atomiques hybrides sp
2
.
7. Langle serait de 180 (donc linaire). Analogie avec les orbitales atomiques hybrides sp.
8. Il nen est rien. La longueur darc correspondant langle de 90 nest pas la plus grande
possible. Il existe un arrangement plus naturel pour que les balles soient le plus loignes
possible. Au lieu de se placer aux extrmits de deux diamtres se coupant 90, elles oc-
cupent, deux deux, deux plans qui se coupent 90, en passant par le centre de la sphre,
ce qui permet aux balles de sloigner davantage. Langle correspondant ce nouvel arc de
cercle est de 10928. Pour sen convaincre dfnitivement: construire un modle.
OA pures
impliques
OA hybrides Gomtrie Angles
Type et nombre
de liaisons
s ou p
Nombre de
voisins
1 orbitale s
3 orbitales p
sp
3
ttradrique 109 28' 4 s 4
1 orbitale s
2 orbitales p
sp
2
plane 120
3 s
1 p
3
1 orbitale s
1 orbitale p
sp linaire 180
2 s
2 p
2
1 orbitale s
2 orbitales p
sp
2
plane 120
3s
1 p
3
9 Chapitre 1 Section 1.5
9.
10. Toutes les liaisons de lhexane sont de type s. Elles tournent librement autour de laxe des
carbones.
11.
12.
Ce sont tous les isomres dune mme molcule: C
2
FClBrl
13.
Molcules
Type
dhybridation
sur les
atomes C
Nombre de
liaisons
Angles
de liaison
Forme :
ttradrique
plane
linaire s p
Mthane CH
4
sp
3
4 0 109 28' ttradrique
thylne CH
2
uCH
2
sp
2
3 1 120 plane
Actylne HCICH sp 2 2 180 linaire
but-2-ne
but-2-ne
C
1
sp
3
4 0 ttradrique
C
2
sp
2
3 1
3
plane
C
3
sp
2
3 1 plane
C
4
sp
3
4 0
3
4
ttradrique
(a) (b) (c)
ttradrique plane ttradrique
109 28'
109 28'
120
120
10 Chapitre 1 Section 1.5
14.
15.
16.
17. Structures de Lewis des molcules:
a)
d)
parties ttradriques
partie plane
plane
tous les C sont
b)
c)
e)
ttradrique
plane
plane
tous les C sont
tous les C sont
tous les C sont
En traits: simples, liaisons
doubles, liaisons +
triples, liaisons + 2 .
sp
120
180
109
120
120
109
109
109
109
HCOOH
11 Chapitre 1 Section 1.6
18. a)
b)
c)
19. Liaisons de plus en plus polaires (diffrence dlectrongativit, n, entre parenthses):
1.6 Attractions intramolculaires
1. Lactone et leau sont miscibles en toutes proportions grce aux liaisons hydrogne qui
stablissent entre les deux molcules. La molcule dactone peut former une liaison hydro-
gne cause de la prsence de la liaison covalente polaire CuO et la prsence de deux
doublets dlectrons libres sur latome doxygne.
2. Bien que la molcule dthoxythane (lther) puisse tablir une liaison hydrogne entre son
atome doxygne et un atome dhydrogne dune molcule deau, un autre facteur intervient:
limportance plus grande de la partie non polaire de cette molcule, i.e. les deux groupes
CH
2
CH
3
. En ce qui concerne le mthanol et leau, la petite taille de la molcule de mthanol
jointe la double possibilit de liaison hydrogne font quil y a miscibilit en toutes propor-
tions.
3. Les molcules de benzne tant non polaires, elles ne peuvent pas entourer effcacement
(solvater) chacun des ions ammonium et chlorure pour les tenir distance lun de lautre.
1 2 3 4 5
sp
1 2
sp
(0,40)
(0,96)
(0,41)
(0,49)
(0,89)
(0,35)
(1,24) (0,89)
(0,00) (0,00) (0,00) (0,00)
12 Chapitre 1 Section 1.7
4.
1.7 Exercices complmentaires
1. Vrai. Rduction = gain dlectrons. Oxydation = perte dlectrons.
2. Faux. Ce sont des orbitales atomiques. Les orbitales s et p sont des orbitales molculaires.
3. Vrai. Lbullition est un phnomne physique qui ne modife pas la nature des molcules.
Seules les liaisons intermolculaires qui retiennent les molcules ou les atomes (dans le cas
dune substance atomique) dans la phase liquide sont rompues.
4. Faux. Ce sont les liaisons intermolculaires qui sont rompues, phnomne analogue lbul-
lition.
5. Faux. Les coeffcients stchiomtriques indiquent les nombres relatifs de moles des subs-
tances impliques dans une raction chimique.
6. Faux. Intermolculaire. Cest une liaison faible mais plus forte que les liaisons habituelles de
type Keesom.
7. Vrai.
8. Vrai.
9. Faux. Les lectrons internes ne participent jamais aux ractions chimiques. Ce sont les lec-
trons priphriques qui participent aux bris et la formation des liaisons chimiques.
10. Vrai.
11. Vrai. Les protons et les neutrons constituent la quasi totalit de la masse dun atome. En
effet, les lectrons sont environ 1839 fois plus lgers quun proton ou quun neutron.
12. Vrai. La raction vers la droite se produisant la mme vitesse que celle vers la gauche, do
le symbole .
13. Vrai. Ce sont les lectrons priphriques qui sont les plus accessibles et les moins retenus
par le noyau positif de latome. Lionisation est larrachement dun ou de plusieurs lectrons.
14. Faux. Il faut fournir de lnergie un atome ou une molcule pour lui arracher un ou des
lectrons.
15. Vrai. Lacidit (forte ou faible) est dfnie par rapport leau prise comme substance basique
de rfrence (ou de comparaison). Cest leau qui accepte alors lion hydrogne:
H
2
O + H
Q
H
3
O
Q
(ion oxonium ou hydronium)
a) mthane
b) acide actique
c) thanol
d) propane
e) butane
f) mthanol
g) mthanol
h) mlange d'alcanes
o n = 6 12 environ.
13 Chapitre 1 Section 1.7
16. Faux. La mise en commun de deux lectrons caractrise une liaison covalente. Dans une
liaison ionique, lun des atomes cde un lectron lautre atome.
17. Faux. Ce sont des orbitales molculaires. On dit aussi liaison s et liaison p.
18. Vrai. Ces orbitales lient les atomes dans les molcules.
19. Vrai.
20. Vrai.
21. Vrai.
22. Vrai.
23. Vrai.
24. Vrai. Les molcules diatomiques et triatomiques sont ncessairement planes. Les autres
peuvent tre ttradriques ou de forme plus complexe.
25. Vrai.
26. Vrai.
27. Vrai. Latome le plus lectrongatif a tendance attirer vers lui les lectrons qui sont sa
porte.
28. Vrai.
Chapitre 2
LCRITURE ORGANIQUE
Reprsentation des
molcules organiques
Formules chimiques planes
2.1 Formule empiriques et formules molculaires
1. CH
2
O n= 1 (ex.: HCHuO)
C
2
H
4
O
2
n= 2 (ex.: CH
3
UCO
2
H)
C
3
H
6
O3 n= 3 (ex.: HOUCH
2
UCH
2
UCO
2
H)
2. C:
40
12,011
= 3,33
3,33
3,33
= 1
H:
6,6
1,008
= 6,55
6,55
3,33
= 2 donc la formule empirique sera:
(CH
2
O)
n
O:
53,4
16,00
= 3,33
3,33
3,33
= 1
3.
173,5
43,046
= 4,03 donc n = 4 et la formule molculaire est: C
8
H
12
O
4
4. a) possible d) impossible (la somme de H et Cl est impaire)
b) possible e) possible
c) impossible (H est impair) f) possible
2.2 Formules stucturales
1. La spectroscopie infrarouge (IR) et la rsonance magntique nuclaire (RMN).
2. La formule C
2
H
6
O est une formule molculaire. Elle correspond deux molcules diffrentes:
CH
3
UCH
2
UOH et CH
3
UOUCH
3
Ces deux formules sont dites semi-dveloppes par comparaison aux formules dveloppes
suivantes:
La formule dveloppe est plus prcise que la formule
molculaire. Elle indique lorganisation de tous les
atomes et de toutes les liaisons. Toutefois, la gom-
trie prcise de la molcule nest pas reprsente.
16 Chapitre 2 Section 2.2
3. Formules dveloppes de C
4
H
10
O:
4.
5.
quatre alcools
trois thers
a)
b)
g)
a)
b)
c)
d)
e)
f)
17 Chapitre 2 Section 2.3
6.
Strrochimie
2.3 Reprsentation prcise des molcules
1.
C
1 2 3 4 5 6 7 8 9 10 11 12 13 14
Nombre
de liaisons
s
3 3 4
Nombre
deliaisons
p
1 1 0
Type
dhybridation
de chaque C
sp
2
sp
2
sp
3
Gomtrie
autour de
chaque C
ttr.
Angles de liaisons
autour de
chaque C
109
cortisone
histamine acide nicotinique
10928'
ttradrique
sp
3
0
4
120
plan
18 Chapitre 2 Section 2.4
2.
2.4 Reprsentations des molcules avec carbones sp
3
1. Ce sont les diffrentes formes des molcules obtenues par des rotations libres autour des
liaisons simples. Elles sont illustres en utilisant une convention appele projections de New-
man.
2. La rotation libre autour de laxe de la liaison.
3. a) Lhybridation sp
3
b) Deux C la fois: lun en premier plan, lautre en second plan.
c) Ils doivent tre voisins, i.e. conscutifs.
4. La ressemblance avec les projections de Newman est vidente. Le rayon lumineux doit ce-
pendant tre parfaitement align avec laxe de la liaison CC pour que les deux C se super-
posent exactement.
5.
a. b. c.
d. e.
f.
1 2
A
2
1
une conformation dcale
1 2
1
2
19 Chapitre 2 Section 2.5
6. a) Non, tous les atomes et groupes datomes sont en rotation rapide perptuelle.
b) Elles se font encore plus rapidement ; la limite la molcule peut se briser si on chauffe
trop ; sajoutent alors les chocs de plus en plus violents et frquents entre les molcules.
c) Ces rotations ralentissent beaucoup ; on peut imaginer les arrter compltement en
abaissant davantage la temprature et isoler ainsi un conformre particulier ; cest pos-
sible dans certains cas.
7. 15,1 kJ/mol
8. Non. La valeur de 15,1 kJ/mol est du mme ordre de grandeur que les liaisons de London
(9 17 kJ/mol) ; elle est trs faible compare lnergie de la liaison CUC (344 kJ/mol) ; elle
est environ deux fois plus faible que les liaisons hydrogne de leau (28,9 kJ/mol).
9. Lencombrement strique correspond lespace occup par un atome ou un groupe
datomes: plus cet atome ou ce groupe datomes est volumineux, plus son encombrement
strique est important, cest--dire que les chances de se toucher augmentent.
10. Justement parce que les atomes ou les groupes datomes ports par la liaison CUC consi-
dre sont leur loignement maximal.
11. Cela tient au fait que dans la position en zigzag, tous les atomes et les groupes datomes les
uns par rapport aux autres se retrouvent dans une conformation dcale correspondant
une nergie minimum de rpulsion.
12. Aux conformations dcales naturellement adoptes par les molcules.
2.5 Les cycles avec carbones sp
3
1. a) 60 (cycle 3 carbones)
b) 88 (cycle 4 carbones)
c) Environ 109 (cycle 5 carbones)
d) 10928 (et non 120 comme le laisse croire sa reprsentation par un hexagone plat).
2. cause de la tension interne dans ces cycles dont les angles, respectivement de 60 et 88,
tendent toujours souvrir la moindre occasion pour atteindre la valeur dangle maximale
plus confortable de 10928.
3. Il est plus stable. Ses angles intrieurs sont voisins de la valeur de 10928, angle exig par
lhybridation sp
3
du carbone.
4. 120
5. Le cycle nest pas plan. Chaque C est ttradrique et chacune des liaisons CUC est place
de manire obtenir la conformation la plus stable, i.e. dcale.
Cette distance est la plus grande possible entre
les atomes ou les groupes datomes.
20 Chapitre 2 Section 2.6
6.
7.
8. La rotation libre qui permet le passage facile dun conformre lautre.
9.
Regroupement datomes
2.6 Groupes et fonctions
1. La diffrence de ractivit entre les diffrents regroupements datomes appels groupes et
fonctions dpend, entre autres, de la polarit des liaisons qui les composent, laquelle son
tour dpend de llectrongativit des lments impliqus.
2. Parce quils sont exclusivement constitus des atomes C et H dlectrongativit voisine.
Ces lments ne peuvent donc former que des liaisons peu polaires.
H = quatorial
Encombrement strique.
4 1
a)
b) la plus stable:
1
3
5
On ny retrouve pas
les rpulsions 1,3 et
1,5 comme dans la
conformation axiale du
brome:
axial
21 Chapitre 2 Section 2.6
3.
4. Alkyle: R exemple: CH
3
U
(mthyle)
Aryle: Ar exemple: (phnyle)
Carbonyle: Alkyle:
Groupe Nom Symbole
CH
3
U mthyle Me
CH
3
CH
2
U thyle Et
cyclopropyle UUUUUU
cyclohexyle UUUUUU
CH
3
CH
2
CHCH
3
butyle secondaire s -Bu
benzyle UUUUUU
CH
2
uCHU vinyle UUUUUU
CH
3
CH
2
CH
2
U propyle Pr
isopropyle iPr
(CH
3
)
3
CU butyle tertiaire t -Bu
CH
2
uCHUCH
2
U allyle UUUUUU
CH
3
U[CH
2
]
4
UCH
2
U hexyle UUUUUU
22 Chapitre 2 Section 2.6
5.
6. videmment! Il sufft que la chane carbone compte au moins deux atomes de carbone.
Exemple:
7.
Fonction Nom
acide carboxylique
aldhyde
alcool
amine
ctone
ester
chlorure dacide
nitrile
ther
halognure
anhydride
amide
alcne
alcyne
alcool alcne
amine
acide carboxylique
a
b
1
2
2
Tous les C sont 2
3
3
3
3
2
2
2
1
1
1
1 1
23 Chapitre 2 Section 2.7
2.7 Sries homologues
1. Deux ou plusieurs substances constituent une srie homologue si elles ne diffrent que par
un ou plusieurs groupement(s) UCH
2
U tout en conservant le mme squelette carbon de
base et la mme fonction.
2.
3. Sont homologues:
2.8 Classication gnrale des substances organiques
1. Voici deux exemples de chaque catgorie et il y en a bien dautres:
a)
b)
a)
b) e)
f) et
et
c) g) et
cyclohexane
benzne
2-mthylpentane
cyclopentane
naphtalne
propane
a) cyclique:
b) aromatique:
c) acyclique:
24 Chapitre 2 Section 2.9
2.
Il y en a bien dautres...
Nomenclature
2.9 Principes gnraux
1. Non. Cette molcule devrait sappeler: acide thanoque.
2. Le nom dun compos organique doit contenir les lments suivants:
a) la classe de compos, indique par la fonction ;
b) le nom de base, reli la chane carbone la plus longue et dont la terminaison dpend
de la fonction implique dans cette chane ;
c) les ramifcations ou les substituants fxs la chane la plus longue, placs devant le nom
de base et prcds dun indice de position numrique prcisant le point dattache
cette chane.
3. partir de la fonction: alcool, acide, aldhyde, etc. (voir tableau 2.2).
4. Une ramifcation est une chane carbone relativement courte, fxe sur une chane fonda-
mentale plus longue. Ce peut tre un groupe alkyle bien connu ou quelque chose de plus
complexe.
Un substituant est un terme plus gnral et reprsente aussi bien une ramifcation quune
fonction secondaire.
5. Devant le nom de base, en ordre alphabtique, prcds des indices de position les plus
petits suivis dun tiret. Sil ny en a quun, il doit tre li au nom de base, sans tiret. Sil y en a
plusieurs, le dernier doit tre li au nom de base, sans tiret. Exemples:
a) 2-mthylpentane,
b) 2-chloro-3-thylhexane.
6. Par un indice de position numrique plac devant la terminaison relative la fonction ;
comme dans le butan-2-ol.
a) b)
cyclique insatur substitu
1-mthylcyclohex-1-ne
aromatique disubstitu
1,2-dimthylbenzne
(o -xylne)
25 Chapitre 2 Section 2.10
2.10 Composs acycliques
1.
2. alcool
alcne
alcyne
alcane, halognure, ther, nitro
Classe fonctionnelle Terminaison Exemple
alcne ne CH
2
uCH
2
ester UUUUUU
anhydride UUUUUU
amide UUUUUU
alcyne yne CH
3
UCICUH
alcne ne CH
3
UCHuCHUCH
3
alcane ane CH
3
UCH
2
UCH
2
UCH
3
alcne ne CH
3
UCHuCHUCH
2
UCH
3
alcool ol CH
3
UCH
2
uOH
alcyne yne CH
3
UCICUCH
3
acide carboxilique UUUUUU CH
3
UCO
2
H
amine amine CH
3
UCH
2
UCH
2
UNH
2
chlorure dacide ________
aldhyde al
ctone one
Ordre de priorit.
26 Chapitre 2 Section 2.10
3.
4. Certaines fonctions sont nommes surtout comme prfxes. En voici quelques exemples.
5. a) CH
2
Cl
2
dichloromthane
b CH
3
F fuoronthane
c) CHBr
3
tribromomthane
d) CHClBrF
bromochlorofuoromthane
e) HOCH
2
UCH
2
NH
2
2-aminothanol
f) HOCH
2
UCH
2
OH
thane-1,2-diol
g) Cl
3
CUCCl
3
hexachlorothane
h) CH
3
UCHUCHUCH
3
2-chloro-3-mthylbutane
CH
3
Cl
i) Cl
2
CuCCl
2
ttrachlorothylne
6.
Nom Structure Prfixe
halognure UX
selon lhalogne
(bromo, choloro, etc.)
nitro UNO
2
nitro
alcool UOH
hydroxy
(occasionnelement)
ther UOR
(R)....oxy
exemple: mthoxy
amine UNH
2
amino
(occasionnellement)
UU
a) b) c)
2-mthylhexane 1-cyclohexyl-5-mthylhexane 5-mthylnonane
d) e) f)
4-thyl-4-mthyloctane 6-thyl-2-mthylnonane 1-cyclopropyl-3,5-dimthylhexane
Ordre de priorit.
27 Chapitre 2 Section 2.10
6. (suite)
7. a) thane
b) propane
c) butane
d) pentane
e) hexane
f) 2-mthylpentane
g) 3-chloro-4-mthylhexane
h) 5-thyl-3,3-dimthylheptane
i) 2,2,3-trimthylbutane
2-bromo-5-chlorohexane
1-mthoxypropane
3-mthylpent-2-ne
g) h) i)
3-thyl-5-mthylhex-1-yne 7-chloro-5-thyl-2-mthyloct-3-yne 4-aminopentan-1-ol
(priorit la fonction alcool)
k) l) j)
2-thyl-3-mthylbuta-1,3-dine 3-bromo-3-mthylpentan-1-ol
n) m)
28 Chapitre 2 Section 2.11
7. (suite)
j) 3-mthylhexane
k) 4-isopropyl-2,6-dimthyloctane
l) 4-thyl-4-mthylheptane
m) 4-tert -butyl-4-mthylheptane
n) hexa-1,3-din-5-yne.
2.11 Composs cycliques
1. a) b)
3-cyclohexyl-5,5-dimthylhexan-1-ol
1-mthyl-4-pentylcyclohexane
c) d)
isopropylcyclopropane
ou 2-cyclopropylpropane
isopropylcyclohexane
e)
f)
1,2-dimthylcyclobutane tert -butylcyclohexane
29 Chapitre 2 Section 2.11
1. (suite)
2. a) 1,3-dimthylcyclohexane
b) cyclobutne
c) 2,3-dibromocyclopenta-1,3-dine
d) 3-cyclohexylpentane
e) 1,2,3,4,5,6-hexachlorocyclohexane
f) 1-cyclohexyl-2-mthylbutane
g) 3-mthylcyclohex-1-ne
h) cyclohexanol
i) bromocyclopentane
g) h)
4-cyclohexylpentan-1-ol
thylcyclopentane
30 Chapitre 2 Section 2.12
2.12 Composs benzniques
1. Le benzne.
2.
3. a) Phnyle.
b) Lorsquil est reli une chane carbone complexe contenant au moins six carbones ou
lorsque la priorit dune fonction lexige.
4. Ortho, mta et para.
5.
e) benzaldhyde
a) phnol
b) tolune
c) styrne
d) alcool benzylique
f) acide benzoque
g) aniline
i) p -xylne
h) actophnone
o -bromochlorobenzne p -bromochlorobenzne m -bromochlorobenzne
tolune acide benzoque 3-thyltolune
ou m -thyltolune
2-mthylaniline
ou o -mthylaniline
a) b) c)
d) e) f)
thylbenzne 4-chlorotolune
ou p -chlorotolune
vinylbenzne
ou styrne
2-thyltolune
ou o -thyltolune
g)
h) i)
3-thyl-1-mthylnaphtalne
31 Chapitre 2 Section 2.12
5. (suite)
6.
tolune acide benzoque 3-thyltolune
ou m -thyltolune
2-mthylaniline
ou o -mthylaniline
a) b) c)
d) e) f)
thylbenzne 4-chlorotolune
ou p -chlorotolune
vinylbenzne
ou styrne
2-thyltolune
ou o -thyltolune
g)
h) i)
3-thyl-1-mthylnaphtalne
o -dichlorobenzne
1,2,4-trimthylbenzne
a) b)
d) e)
p -chlorostyrne
m -chlorophnol
c)
biphnyle
f)
isopropylbenzne
g) h) i)
o -bromochlorobenzne acide benzoque
2-chloro-4-thyl-3,5-dinitrotolune
2-phnylpentane acide benznesulfonique
p -xylne
j) k) l)
m) n)
1,2-diphnylbenzne acide p -bromobenzoque
o)
m -nitrotolune
p)
1,2,5-trinitronaphtalne
32 Chapitre 2 Exercices complmentaires
6. (suite)
2-phnylpentane acide benznesulfonique
p -xylne
j) k) l)
m) n)
1,2-diphnylbenzne acide p -bromobenzoque
o)
m -nitrotolune
p)
1,2,5-trinitronaphtalne
Exercices complmentaires
1. a)
3
(il contient de loxygne [fonction], alors que les autres ne contiennent que du
carbone et de lhydrogne [groupes] ) ;
b)
1
(le seul non ramif) ;
c)
3
(le seul aldhyde, les autres tant des ctones).
2. Dans b), sont homologues:
2 3 4
Dans c), sont homologues:
1 2 4
3. a) La conformation dcale est la plus
stable et les atomes de brome se
positionnent le plus loin possible pour
rduire lencombrement strique au
minimum.
b) La conformation chaise est la plus
stable. Le gros groupe tert-butyle subit
moins dencombrement strique en
position quatoriale.
33 Chapitre 2 Exercices complmentaires
4. Le compos inconnu C
7
H
7
Cl est le
2-chlorotolune.
5. Le cyclopropne ne peut exister. Les tensions dangles lintrieur de cette molcule
cyclique seraient trop leves.
6. Non. Il sagit en fait du pentane. Une remarque: lorsque vous nommez un compos en srie
acyclique, le mthyle nest jamais en position 1.
7. a) Hydrocarbure acyclique ramif insatur:
b) Substance contenant un carbone tertiaire:
3
c) Homologue suprieur de
est
d) Cycloalcane dont tous les carbones sont dans le mme plan: ou
e) Hydrocarbure dont la liaison CUC serait plus courte que dans CH
2
uCH
2
la liaison triple de: CH
3
UCICH
f) Voici les composs correspondants aux formules molculaires donnes:
1) CH
3
UCHuCH
2
et
2) CH
3
UCH
2
UCH
2
UCH
2
UCH
2
UOH et CH
3
UCH
2
UCH
2
UCH
2
UOUCH
3
3) CH
3
UCH
2
UCHuCHUNH
2
et NH
2
4) et
8.
2-mthylpentane
1,2-dimthylcyclohexane
cyclohexane
a) b)
c)
isohexane
2-mthylpentane
d)
2,2-dimthylbutane 2,2,3- trimthylpentane
3,4-dithyl-5-isopropyl-2,3,5,6-ttramthyloctane
e) f)
h) g)
actylne
34 Chapitre 2 Exercices complmentaires
8. (suite)
2-mthylpentane
1,2-dimthylcyclohexane
cyclohexane
a) b)
c)
isohexane 2-
mthylpentane
d)
2,2-dimthylbutane 2,2,3- trimthylpentane
3,4-dithyl-5-isopropyl-2,3,5,6-ttramthyloctane
e) f)
h) g)
actylne
9.
3-mthylhexane
3,4-dimthylpent-1-ne
2,2,3,3-ttramthylbutane
4-thyl-4-mthyloctane
2,2,5-trimthylhexane
2-mthyloctane
a)
b)
c)
d)
e)
f)
h)
i)
j)
k)
l)
m)
2-bromo-3-nitro-butane
3-chloropropane-1,2-diol
nopentylcyclohexane
1-chloro-2-isopropylcyclohexane
1-bromopropan-2-ol
1,1,1-trichlorothane
g)
n)
o)
3,4,4-trimthyloctane
4-thylpent-4n-2-ol
cyclohexane-1,4-diol
35 Chapitre 2 Exercices complmentaires
10.
11.
12. Pour les formules suivantes, le type de liaison est directement li lhybridation du carbone,
ainsi:
sp
3
implique 4 liaisons s
sp
2
implique 3 liaisons s et 1 liaison p
sp implique 2 liaisons s et 2 liaisons p.
alcool
halognure
acide carboxylique
ctone
alcne
amine
aldhyde
cycloalcane
hydrocarbure benznique
amide
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
a) ester
b) alcool
c) amide
d) bromure d'alkyle
e) alcne
f) hydrocarbure benznique
g) chlorure d'acide
a) b) c)
sp sp
d) e) pour chacun
des C
f) pour chacun
des C
g) h)
pour chacun
des C
36 Chapitre 2 Exercices complmentaires
13.
14. a) Les composs e et j ont toutes leurs liaisons dans le mme plan.
b) Tous les composs mentionns peuvent avoir tous leurs carbones dans le mme plan
lexception de d et h.
15.
a) mthanol
d) actone
b) propne c) propyne
f) pent-2-ne e) buta-1,3-dine
Nom du groupe Formule du groupe
mthyle UCH
3
benzyle
phnyle
butyle secondaire
butyle tertiaire
isopropyle
cyclohexyle
cyclopropyle
thyle CH
3
UCH
2
U
37 Chapitre 2 Exercices complmentaires
16
17. a) C
12
H
21
OCl
b) C
19
H
30
O
18. a) cyclohexa-1,4-dine
b) 2-mthylcyclopent-2-n-1-ol
c) 2,2-dimthoxypentane
d) hexa-1,3,5-trine
e) 2-thylpent-1-n-4-yne
f) 2-bromo-4-mthylphnol
g) 1,4,4-trimthylcyclohex-1-ne
h) 2,5-dichloro-1-naphtol
i) 4-thylpent-4-n-2-ol
j) hex-3-n-1-yne
k) 2-bromo-5-chlorohexane
l) 2-bromopentan-3-ol.
Nom de la fonction Formule dune fonction
chlorure d'acide
ctone
ther CH
3
OCH
3
halognure (chlorure) CH
3
UCl
amine CH
3
UCH
2
UNH
2
alcool CH
3
UOH
amide
nitrile CH
3
UCH
2
UCIN
anhydride
acide carboxylique
aldhyde
alcyne CH
3
UCICH
alcne CH
3
UCHuCHUCH
3
ester
38 Chapitre 2 Exercices complmentaires
19. a) 3-chloro-2,4-dimthylhexane
b) acide 3-mthylbenzoque
c) hept-5-n-3-ol
d) 4-chlorocyclohexan-1-ol
e) 3-nitrobenzaldhyde
f) oct-5-yne-2,3-diol.
Chapitre 3
LISOMRIE
3.1 et 3.2 Prsentation et isomtrie de structure
1. Des composs chimiques sont dits isomres sils ont la mme formule molculaire (mme
composition chimique). Ces substances diffrent par leur structure, cest--dire lenchane-
ment de leurs atomes, et par leurs proprits physiques et chimiques.
2. Lisomrie de structure est le type disomrie le plus gnral pouvant exister. La seule condi-
tion pour que deux substances soient dites isomres de structure est davoir la mme for-
mule molculaire.
Quant la stroisomrie, elle implique lorganisation spatiale des atomes. Sa reprsentation
fait appel la gomtrie et aux positions relatives de tous les substituants.
3. Il leur sufft davoir la mme formule molculaire.
4. a) Leurs proprits chimiques sont trs semblables ; elles se distinguent par leurs propri-
ts physiques.
b) Leurs proprits physiques et chimiques sont trs diffrentes.
5. Des substances isomres, mais ne faisant pas partie de la mme famille chimique, sont
appeles: isomres de constitution .
6. Des substances isomres faisant partie dune mme famille chimique sont appeles: iso-
mres de position .
7. Elles doivent:
avoir la mme formule molculaire
porter la mme fonction.
8. Note: dans le but dallger la prsentation, les atomes dhydrogne ports par les carbones
ne sont pas indiqus.
a)
+ d'autres de formules
gnrales:
et
40 Chapitre 3 Section 3.1et 3.2
8. (suite)
41 Chapitre 3 Section 3.3
8. (suite)
3.3 Stroisimrie
1. Lorientation dans lespace des diffrentes parties qui les constituent.
2. Cest un atome de carbone ayant
quatre substituants diffrents et dont
lhybridation est sp
3
.
e) Il y a des alcools et des thers:
alcools
thers
f)
Exemple:
42 Chapitre 3 Section 3.3
3. Les positions relatives des substituants autour dun carbone asymtrique.
4. Les carbones asymtriques sur les molcules suivantes sont encadrs:
a) b)
c)
d)
aucun c*
aucun c*
5. Confguration : ordre des substituants autour dun carbone asymtrique donn.
6. Deux faons. Elles sont des images lune de lautre dans un miroir.
7. Isomres optiques. Elles sont des images de miroir donc non superposables.
8. Un objet est chiral si son image dans un miroir ne lui est pas superposable.
9. Les deux isomres optiques du 1-bromo-2-mthylpentane :
10. nantiomres, nantiomorphes, antipodes optiques.
11. Il faut la prsence dau moins un carbone asymtrique.
12. Le pouvoir rotatoire. Toutes les molcules chirales ont la proprit de faire tourner le plan
de la lumire polarise dun certain angle. La valeur numrique de langle sappelle pouvoir
rotatoire et le polarimtre sert la mesurer. Deux nantiomres ont toujours la mme valeur
absolue du pouvoir rotatoire, mais de signe contraire.
13. Non. On na pas encore trouv de formule thorique ni de mthode gomtrique pour le pr-
voir. Le pouvoir rotatoire est mesur au moyen dun polarimtre.
14. Lnantiomre dextrogyre, (+), fait tourner le plan de la lumire polarise vers la droite.
Lnantiomre lvogyre, (-), la fait dvier vers la gauche.
15. (+)-pentan-2-ol pour lnantiomre dextrogyre.
(-)-pentan-2-ol pour lautre nantiomre.
(R)-1-bromo-2-mthylpentane (S)-1-bromo-2-mthylpentane
Miroir
43 Chapitre 3 Section 3.3
16. a) (R)-3-chloro-2-mthylpentane,
b) (R)-2-mthylpentan-3-ol.
Mlange racmique
17. Mlange quimolculaire de deux nantiomres.
18. On utilise () ou (RS).
19. Parce que toutes leurs proprits chimiques et physiques sont identiques sauf le pouvoir
rotatoire.
20. a) Faire ragir le mlange avec une troisime substance optiquement active de faon pro-
duire des composs deux carbones asymtriques. Les produits obtenus sont spars
par cristallisation et chacun des nantiomres peut tre rcupr sparment aprs cer-
taines ractions chimiques.
b) Faire dtruire lun des deux isomres par un micro-organisme et rcuprer lisomre res-
tant. Ce procd peut tre intressant, mais il a toujours le dsavantage de faire perdre la
moiti du mlange racmique.
21. a) C
4
H
10
O
b) 1-chloro-1-phnylpropane
Miroir
(S)-butan-2-ol (R)-butan-2-ol
Miroir
(R)-1-chloro-1-phnylpropane (S)-1-chloro-1-phnylpropane
44 Chapitre 3 Section 3.3
Cas des molcules deux carbones asymtriques
22 a)
b)
23. 2
n
o n = nombre de carbones asymtriques.
24. Parmis les isomres optiques gnrs par la prsence dau moins deux carbones asym-
triques, les molcules de chacune des paires sont dites diastroisomres par rapport aux
molcules des autres paires ; elles nen sont pas des images dans un miroir mais elles en
sont les stroisomres. Leurs proprits physiques et chimiques peuvent tre diffrentes, ce
qui permet de les sparer.
rythro
thro
R
S
S
R
R
R
S
S
thro
rythro
R
R
S
S
S
R
R
S
45 Chapitre 3 Section 3.3
25. Stroisomres du 3-bromobutan-2-ol:
26. a) 3 carbones asymtriques, donc deux possibilit de 8 stroisimres.
b) 2 carbones asymtriques, donc deux possibilit de 4 stroisimres.
c) Aucun.
d) Aucun.
27. a) 2-chloro-3-mthylbutane (un seul C asymtrique)
b) 4-bromo-2,3-dimthylhexane (deux C asymtriques):
nantiomres
nantiomres
diastroisomres
46 Chapitre 3 Section 3.3
28. Ces deux paires de molcules se diffrencient beaucoup plus que les deux nantiomres
entre eux dans chaque paire. En effet, les molcules de chacune des paires sont dites dia-
troisomres par rapport aux molcules des autres paires ; elles nen sont pas des images
dans un miroir ; elles en sont stroisomres. Leurs proprits physiques et chimiques
peuvent tre diffrentes, ce qui permet de les sparer.
29. Oui. Il est beaucoup plus facile de sparer deux diastroisomres. Leurs proprits phy-
siques et chimiques peuvent tre diffrentes, ce qui permet de les sparer. Dans le cas
dnantiomres sparer, la tche est beaucoup plus complexe parce que les deux mol-
cules possdent les mme proprits physiques et chimiques et ne diffrent que par le signe
du pouvoir rotatoire.
30. a) Dans le cas o il y a deux ou trois paires de substituants semblables sur les deux
carbones asymtriques.
b) Oui, puisquon trouve deux paires de substituants semblables (mthyle et hydrogne) sur
les carbones asymtriques.
31. Vrai.
32. Lisomre mso possde trois paires de substituants identiques rpartis sur chacun des deux
carbones asymtriques et, qui plus est, il est possible dclipser simultanment chaque
substituant de chacune des paires.
Par exemple:
33. Le nombre disomres passe trois: une paire thro et un isomre mso (optiquement inac-
tif).
34. a) 2-chloropentan-3ol
par rotation
autour de C2C3
S
R
R
S
R
R
S
S
47 Chapitre 3 Section 3.3
b) butane-2,3-diol
c) 2-bromo-3-chloro-4-mthylenpane.
35. Les composs (a), (b), (d), (f) et (h) sont thro.
Les composs (c) et (g) sont rythro.
Le compos (e) est mso et na pas de relation avec aucun des huit autres puisquil na
mme pas la mme formule molculaire.
Le compos (i) nest ni thro, ni rythro, ni mso puisquil na quun seul carbone asym-
trique. Cest un isomre de position des autres (sauf de (e), bien sr).
Tous les isomres thro (a), (b), (d), (f) et (h) sont des diastroisomres des isomres
rythro (c) et (g) et vise-versa.
(c) et (g) sont des nantiomres (sauf de (e), bien sr).
(a) et (h) sont conformres.
(b), (d) et (f) sont conformres.
(a) et (h) sont nantiomres de (b), (d), et (f) et vise-versa.
thro
mso
R
R
S
S
S
R
S
R
R
R
S
S
S
R
R
S
48 Chapitre 3 Section 3.3
36. a)
Ce sont deux nantiomres thro.
b)
Ce sont deux diastroisomres.
c)
Il sagit dun seul et mme compos thro, donc conformres.
Projections de Fischer
37. Les stroisomres
a) du 2-chloro-3-nitropentane, CH
3
UCH(CI)UCH(NO
2
)UCH
2
UCH
3
b) de HOCH
2
UCO(OH)UCO(OH)UCH
3
et
R
R
S
S
et
mso thro
R
S
S
S
et
S
S
S
S
49 Chapitre 3 Section 3.4
c) de CH
3
UCH(Cl)UCH(Br)UCH
3
38.
3.4 Isomrie gomtrique
1. Les cas les plus communs disomrie gomtrique se retrouvent chez les alcnes et les
cycles.
2. Les substituants sont rpartis diffremment de part et dautre de la liaison double (systme
rigide).
Les stroisomres du 1-bromo-2-chloropropne.
3. Ce type disomrie est d la prsence dun systme rigide, i.e. qui ne permet pas de rota-
tion libre autour de la liaison C=C. Cest le cas pour une liaison double ou pour un cycle. En
plus, il faut videment que les deux substituants ports par le carbones soient diffrents.
4. Les molcules b, c (autour de la liaison double de droite), et f peuvent donner lieu de
lisomtrie gomtrique.
5. a) Les isomres du 1-bromo-1-fuorobut-1ne:
Z E
(priorit au Br
et au )
50 Chapitre 3 Section 3.4
b) Les isomres du 1-bromo-2-chlorocyclopropane:
6. Non. La terminologie cis/trans convient sil ny a que deux substituants diffrents. La termi-
nologie E/Z doit prendre la relve quand il y a trois ou quatre substituants diffrents de part et
dautre du systme rigide.
7. a) 1,2-dichlorocyclopropane:
b) 1-bromo-3-chlorocyclobutane:
c) 2,4-dimthylhex-3-ne
Z
E
et
E E Z
Z E
E Z
51 Chapitre 3 Exercices complmentaires
8. a)
b)
Exercices complmentaires
1.
E E
*
*
Z Z
* *
E ou trans E ou trans
Z ou cis Z ou cis
1. a) 3-chloropent-1-ne
b) 3-chloro-4-mthylpent-1-ne
S R
S R
52 Chapitre 3 Exercices complmentaires
1. (suite)
2. a) Trois isomres seulement correspondent au 1,2-dimthylcyclopropane: deux nantio-
mres trans (ou E) et une structure mso (cis ou Z).
c)
R S
e)
f)
d)
S R
R
S
R S
53 Chapitre 3 Exercices complmentaires
b) Quatre stroisomres correspondent au 1-bromo-2-mthylcyclopropane.
3. Quatre stroisomres correspondent au 2-mthylcyclopropanol.
4. Lun est isomre de position de lautre. Ils portent les mmes halognes dans des positions
diffrentes.
1,2-dichloropropane 1,1-dichloropropane
La paire disomres cis ou Z.
La paire disomres trans ou E.
La paire disomres cis ou Z.
La paire disomres trans ou E.
Chapitre 4
RACTIVIT
RACTIFS
RACTIONS
Ractivit des substances organiques
4.1 et 4.2 Ractivit gnrale et polarit
1. Dans le cas des substances inorganiques, il est assez facile danalyser les ractions et den
prvoir les produits puisque, la plupart du temps, les sites positifs et ngatifs sont bien
localiss et bien dfnis ; ils se retrouvent souvent sur un petit nombre datomes (cations et
anions). Par contre, sur les molcules organiques, les ions sont rares. Les molcules portent
plusieurs liaisons CH peu polaires. On retrouve parfois des liaisons multiples et des l-
ments plus lectrongatifs comme O, N, ou X (halognes), mais rarement des ions. On doit
donc sattendre ce que les ractions soient assez lentes et ce que les points dattaque
des ractifs soient moins vidents.
2. Dabord, llectrongativit de latome doxygne dforme les deux liaisons OH, ce qui
cre des diples permanents ; ensuite laddition vectorielle de ces moments dipolaires (di-
ples) donne un moment > 0 cause du type dhybridation de loxygne qui cre un angle
de liaison de 104,5.
3. Le mthane ne porte pas dlment trs
lectrongatif comme loxygne ; mais ce ne
serait pas une raison suffsante pour le dcla-
rer non polaire. Sa structure prsentant une
symtrie parfaite, explique sa non polarit.
4. Le mthanol et leau portent tous deux la
liaison polaire OH dont la polarit nest pas
annule par la forme gomtrique. Les deux
molcules sont donc polaires et elles peuvent
sattirer lune lautre de faon trs effcace
par lentremise de liaisons hydrogne. Quant
lhexane, il est non polaire, contrairement
leau, donc possibilit trs rduite de sy dis-
soudre.
5. Non. On connat plusieurs cas o, malgr la prsence de liaisons trs polaires, la polarit
globale dune molcule peut tre nulle cause de sa gomtrie. Cest le cas notamment du
ttrachlorure de carbone et du dioxyde de carbone.
Quatre liaisons CH identiques.
Gomtrie ttradrique: parfaite symtrie.
Mthanol
56 Chapitre 4 Section 4.1 et 4.2
6. Laugmentation du nombre de liaisons CC (non polaires) et de liaisons CH (peu polaires)
rduit la polarit, do,
d) CH
3
U[CH
2
]
6
UOH < b) CH
3
UCH
2
UCH
2
UCH
2
UOH
< c) CH
3
UCH
2
UOH < a) CH
3
UOH
7.
8. Puisque lion hydroxyde possde un caractre ngatif, il sattaquera de prfrence aux car-
bones porteurs de charges partielles positives Q.
4.3 Effet inductif
1. Sur une molcule plusieurs carbones, la seule prsence dun lment trs lectrongatif
ne cre pas ncessairement une polarit importante. Mais sa prsence peut avoir des effets
importants sur le cours dune raction. Donc latome trs lectrongatif polarise de proche en
proche dautres liaisons, quoique de faon dcroissante, grce la polarisabilit des liaisons.
Cest ce quon appelle leffet inductif.
2. Le chlore attire lui le doublet dune liaison s. Il rend lgrement positif (dfcient en lec-
trons) le carbone auquel il est rattach, lequel son tour attire le doublet de la liaison sui-
vante, et ainsi de suite. Mais cet effet dcroit rapidement et devient trs faible aprs quatre
liaisons.
3. Ce sont deux acides faibles. Dans les deux cas, latome de brome est sur le carbone 5. Les
deux atomes Br identiques exercent le mme effet attractif. Ce qui fait la diffrence, cest
la prsence, dans b, dune liaison p, trs polarisable, qui transmet plus effcacement leffet
dattraction que ne le font les liaisons s dans a. Leffet parvient donc avec plus de force
jusquau doublet de la liaison OUH ; cest ce qui fait que lacide b possde une constante de
dissociation plus leve (acide relativement plus fort que a). En dautres mots, le dpart de
lion HQ est favoris par la prsence du Br et de la liaison double.
a) b)
c)
d)
(il existe d'autres
sites positifs sur
cette molcule; ils
sont prciss la
section 4.4)
a) b)
c)
d)
(Attaque surtout sur le carbone du
carbonyle, parce que les lectrons de
ce C sont attirs par deux oxygnes.)
attaque du ractif
(Ce carbone est lgrement favoris parce que la
charge positive du carbone voisin est partiellement
neutralise par la rpulsion du groupe thyle.)
(rpulsion)
57 Chapitre 4 Section 4.4
4. a) NH
2
< OH < I < Br < Cl < F
b CH
3
< CH
3
CH
2
< (CH
3
)
2
CH < (CH
3
)
3
C
c) Dans les effets inductifs rpulsifs, seules les liaisons CH sont impliques (faible diff-
rence dlectrongativit) alors que dans les effets inductifs attractifs, on retrouve des
liaisons fortement polarises telles que: CX, CO et CN. Donc leffet inductif attrac-
tif prdomine sur leffet inductif rpulsif.
5. a) 2. est plus acide parce que le chlore est plus lectrongatif que le brome.
b) 2. est plus acide parce quil contient moins deffets rpulsifs que 1.
c) 2. est plus acide parce que la fonction OH est plus prs de la fonction acide carboxy-
lique. Son effet inductif attractif se transmet plus effcacement.
6. a) 2. est une meilleure base parce que la disponibilit des lectrons sur loxygne est ampli-
fe par leffet rpulsif de la chane carbone.
b) 1. est plus fort pour la mme raison quen (a).
c) 2. est plus fort cause des effets rpulsifs de deux mthyles au lieu dun seul comme sur
1.
d) 2. est plus fort parce que la rsonance dans 1. nuit la disponibilit des lectrons sur
loxygne.
4.4 Effet msomre
1. a) Tous les C sont hybrids sp
2
.
b) Les 6 liaisons s CC sont identiques.
c) Les 6 lectrons p sont rpartis uniformment de part et dautre du plan contenant les
6 atomes C.
d) Les 6 liaisons CC ont la mme longueur: 0,140 nm.
e) Lenthalpie dhydrognation est environ 3/5 de celle prvue par un modle thorique de
la molcule.
2. La molcule de benzne est beaucoup plus stable que prvu partir dun modle thorique.
cause de la dlocalisation des lectrons p, le niveau nergtique de cette molcule est
abaiss, elle est donc plus stable. Lcart nergtique entre la molcule relle et le modle
est appel nergie de rsonance.
58 Chapitre 4 Section 4.4
3. Formation des orbitales p dans la molcule de benzne:
4. Il y a quivalence entre les formes limites de rsonance de la molcule de benzne.
5. Dcrire la msomrie dun systme consiste reprsenter par des fches courbes les dpla-
cements dlectrons dun systme conjugu afn den trouver les formes limites et lhybride
de rsonance.
6. Pour pouvoir affrmer quune molcule prsente le phnomne de msomrie, elle doit cor-
respondre aux deux critres suivants:
a) prsence dlectrons p et/ou de doublets dlectrons disponibles sur certains lments
comme O, N, S, X (halognes):
b) ces lectrons doivent faire partie dun systme conjugu ; en voici trois exemples:
cration
d'orbitales molculaires
orbitales p des C
(cycle dform pour
plus de clart)
interactions entre les
orbitales p des C
6
reprsentation
simplifie
0,109
nm
0,140
nm
120
(angle CCH)
6
caractristiques
gomtriques
formes limites de rsonance hybride de rsonance
formes limites de rsonance hybride de rsonance
59 Chapitre 4 Section 4.4
7. Un systme conjugu consiste en une alternance dlectrons faiblement lis (p ou doublets)
et de liaisons simples. Exemple:
La section encadre contient un
systme conjugu.
8. Formes limites et lhybride de rsonance:
a) le mthoxybenzne
b) lion benzyle
hybride de rsonance
+
+
hybride de rsonance
+
+
+
+
+
60 Chapitre 4 Section 4.4
8. (suite)
c) lallylphnylctone
d) la N-thylaniline
e) le penta-1,3-dine
hybride de rsonance
Note: la chane n'est pas
conjugue avec le reste de la molcule; elle
ne participe donc pas la rsonance.
hybride de rsonance
+
+ +
hybride de rsonance
--- --- ---
61 Chapitre 4 Section 4.4
f) le 3-chlorotolune
g) le benzonitrile
hybride de rsonance
hybride de rsonance
+
62 Chapitre 4 Section 4.4
8. (suite)
h) lion benzoate
9.
hybride de rsonance
+
b) l'acide benzoque a) le nitrobenzne
(entre de en
mta par dfaut)
c) l'ion benzoate
d) le bromobenzne e) l'actophnone f) l'aniline
(entre de sur les
positions actives
ortho et para)
(entre de en
mta par dfaut)
(entre de en
mta par dfaut)
(entre de en
mta par dfaut)
(entre de sur les
positions actives
ortho et para)
63 Chapitre 4 Section 4.5
Types de ractifs
4.5 Ractifs ioniques ou polaires
1. a) Les ractifs ioniques ou polaires: H
2
O, HO
W
, HBr
b) Les ractifs non polaires: Cl
2
, O
2
, H
2
, CH
2
uCH
2
.
2. Un nuclophile est un ractif qui a tendance donner des lectrons un substrat polaris ou
un cation. En voici quelques exemples:
(CH
3
)
3
CO
W
HO
W
CN
W
CH
3
O
W
CH
2
uCH
2
doublets dlectrons disponible doublet p disponible
3. Un lectrophile: toute particule (cation ou acide de Lewis) susceptible daccepter des
lectrons. En voici des exemples:
H
Q
R
Q
NO
Q
2
RUC
Q
uO RUN
Q
2
4. a) Les ractifs nuclophiles:
CH
2
uCH
2
RO
W
ROH
W
NH
2
H
W
CH
3
O
W
H
2
O R
W
RNH
2
HO
W
X
W
Br
W
CN
W
ROR RCOO
W
NH
3
b) Les ractifs lectrophiles:
HSO
3
+
H
+
CI
+
RUC
+
uO NO
+
2
R
+
RUN
+
2
acides de Lewis
5.
AICI
3
BF
3
ZnCI
2
trois acides de Lewis
AICI
3
ZnCI
2
BF
3
a)
trs fort cause
de la charge sur
N
plus fort que 3
cause des deux
effets rpulsifs des
mthyles
faible parce que le trs faible parce
que le doublet
sur N participe
la rsonance
avec le cycle
doublet de N est peu
disponible
1. 2. 3. 4.
> > >
b)
c)
(parce que l'lectrongativit varie comme suit: C < N < O)
> > >
> >
64 Chapitre 4 Section 4.6
5. (suite)
d)
trs fort cause de la
charge sur O
faible, parce que le
doublet sur O est peu
disponible
trs faible parce que le
doublet sur O participe la
rsonance avec le cycle
> >
e)
1 et 2 sont trs forts cause de la charge,
mais 1 est plus fort que 2 puisque N est
moins lectrongatif que O
nuclophile moyen puisque
la charge fait partie d'un
systme conjugu, les
lectrons sont dlocaliss
faible, le
doublet sur O
est peu
disponible
> > >
1. 2. 3. 4.
4.6 Autres ratifs
1.
2. Oxydation: diminution du nombre de liaisons CUH.
Rduction: augmentation du nombre de liaisons CUH.
3.
composs fortement oxygns: Molcules non polaires:
composs fortement hydrogns: mtaux:
Zn Pd Ni Pt
a)
b)
c)
d)
alcyne alcane
e)
(avec Ni ou Pt ou Pd)
ou
ou
(avec Ni ou Pt ou Pd)
ou
ou
ou
ou
ou ou
aldhyde acide carboxylique
h
65 Chapitre 4 Section 4.7
Ractions
4.7 Gnralits
1. Substrat: la molcule organique qui est transforme par un ractif inorganique ou organique.
2.
4.8 Thermodynamique et cintique des ractions
1. a) nergie potentielle: nergie associe aux interactions entre les molcules au niveau des
liaisons brises et formes et impliquant atomes et lectrons.
b) tat initial: niveau nergtique dans lequel se trouvent le substrat et le ractif avant
toute raction.
c) tat de transition: niveau dnergie instable correspondant la formation du complexe
activ.
d) tat fnal: niveau nergtique des produits de raction.
e) Complexe activ: structure temporaire instable impliquant le substrat et le ractif dans
lequel une liaison est en train de se briser et une autre en train de se former ; on ne peut
pas lisoler ; on ne peut que le dtecter ; mais cest suffsant pour ltudier.
f) nergie dactivation: nergie minimum requise pour atteindre le niveau dnergie asso-
ci ltat de transition.
g) Chaleur de raction ou enthalpie (H): diffrence nergtique entre ltat fnal et ltat
initial.
h) Intermdiaire: espce chimique (carbocation, carbanion ou radical libre) qui se forme au
cours dune raction chimique ; sa vie est trs courte ; il est diffcilement isolable.
i) Raction globale: ensemble des tapes dune raction ; elle comprend ltat initial, le
(ou les) tat(s) de transition, le (ou les) intermdiaire(s) et ltat fnal.
2. Diagramme nergtique montrant le droulement dune raction simple (celle qui seffectue
en une seule tape):
substrat
1 mole + 1 mole 1 mole
selon l'quation quilibre:
donc: x 0,100 mole
alors: x = 0,100 mole de HCl soit 3,65 g.
+ HCl
a) raction dont H < 0:
H < 0
tat
de transition
tat initial
(substrat et ractif)
tat final (produit)
nergie
potentielle
volution de la raction
66 Chapitre 4 Section 4.8
2 (suite)
3. En utilisant un catalyseur. Leffet du catalyseur est de diminuer la valeur de lnergie dactiva-
tion.
4. Diagramme nergtique montrant le droulement dune raction complexe (par exemple celle
qui seffectue en deux tapes):
H > 0
b) raction dont H > 0:
volution de la raction
tat
de transition
tat initial
(substrat et ractif)
tat final
(produit)
nergie
potentielle
a) raction dont H < 0:
b) raction dont H > 0.
H < 0
intermdiaire
tat
de transition
tat
de transition
tat initial
(substrat et ractif)
tat final (produit)
nergie
potentielle
volution de la raction
2
1
H > 0
intermdiaire
tat
de transition
tat
de transition
tat initial
(substrat et ractif)
tat final (produit)
nergie
potentielle
volution de la raction
67 Chapitre 4 Section 4.9
4.9 Types de ruptures et intermdiaires de raction
1.
2. a) Les ruptures htrolytiques correspondent des ractions caractre ionique, cest--
dire impliquant des ions (carbocations ou carbanions, du moins en ce qui concerne le
substrat).
b) Les ruptures homolytiques correspondent des ractions radicalaires, celles qui im-
pliquent des radicaux libres.
3. Le radical libre est neutre mais trs ractif cause de la prsence dun lectron libre. Les
ions sont chargs positivement (dfcience en lectrons, 1 lectron en gnral dans le cas de
lion issu du substrat) ou ngativement (excs de 1 lectron la plupart du temps).
4. On observe lordre de stabilit suivant: 3 > 2 > 1.
5.
6. Le carbocation tertiaire est plus stable cause de leffet inductif qui neutralise partiellement
la charge porte par le carbone central.
7. Stabilit relative des carbocations:
8. La molcule qui peut donner naissance au carbocation le plus stable:
a) La rupture homolytique:
b) La rupture htrolytique:
+
+
thane deux radicaux libres
2-chloro-2-mthylpropane un carbocation
a) un carbocation 3 b) un carbanion 3
c) un radical libre 3
plan
2p
+
b)
( cause de la rsonance)
a) > > >
> >
+
(c)
(tertiaire)
+
+
68 Chapitre 4 Section 4.10
4.10 Classication des ractions selon le bilan de raction
1. Mcanisme de raction: description (au moyen de fches courbes) de la rupture et de la
formation de toutes les liaisons impliques dans une raction.
2. Par ltude, entre autres, des vitesses de raction. Ceci permet de dceler les intermdiaires
et de proposer des tats de transition plausibles.
3. Les quatre grandes catgories de ractions: addition, limination, substitution et rarrange-
ment.
4.
5. a) S
N
b) S
E
c) addition
d) limination
e) rarrangement
f) S
R
g) addition
h) S
N
6. Les ractions b et f sont des oxydations alors que g est une rduction.
4.11 Description dun mcanisme de raction
1. Des fches courbes indiquent le dplacement de deux lectrons. Ces fches partent tou-
jours dune liaison, dune charge ngative, dun doublet libre ou dun doublet p pour aller
vers llectrophile. Exemple:
2. Des fches demi-pointe, puisquun seul lectron est dplac.
L'addition: modification d'un substrat par l'ajout d'atomes. Exemple:
+
+
+ NaOH
+
+ NaOH +
(chaleur)
b)
a)
L'limination . s e m o t a ' d e r b m o n n i a t r e c n u ' d t a r t s b u s e l r a p e t r e p :
Exemple:
c) La substitution: remplacement d'un ou plusieurs atomes du substrat
par d'autres atomes. Exemple:
d) Le rarrangement: rorganisation interne du substrat sans gain ni perte
d'atomes.
+ + NaCl
69 Chapitre 4 Section 4.11
3.
4.
NaCl a)
b)
+ +
+
+
c)
d)
HBr
+
+
+
a)
b)
c)
+
+
+ +
Br
70 Chapitre 4 Exercices complmentaires
Exercices complmentaires
1.
2.
Le phnol est plus acide cause de la rsonance qui dlocalise les lectrons vers le cycle.
Lhydrogne reli loxygne acquiert alors un caractre positif et devient plus disponible.
Dans le cyclohexanol, il ny a pas de rsonance.
3.
Dans laniline, le doublet dlectrons sur N est peu disponible parce quil participe la rso-
nance dans le cycle.
4.
d >
le Cl est plus
prs du COOH
a
le Cl est plus lectrongatif
que Br et I
> b > c
le Br est plus
lectrongatif que I
phnol
cyclohexanol
mthylamine aniline
hybride de rsonance
a)
+
71 Chapitre 4 Exercices complmentaires
4. (suite)
hybride de rsonance
a)
+
b)
hybride de rsonance
c)
hybride de rsonance
d)
hybride de rsonance
72 Chapitre 4 Exercices complmentaires
4. (suite)
5. 1. Nuclophile
2. Catalyseur
3. Oxydant
4. lectrophile
5. Nuclophile
6. Oxydant
7. Nuclophile
8. lectrophile ( cause du H
+
)
9. Rducteur
10. lectrophile ( cause du H
+
)
11. Nuclophile
12. Nuclophile
13. lectrophile
14. Nuclophile
15. Nuclophile
16. lectrophile
6. a) Lintermdiaire de raction (carbocation, carbanion, radical libre) a une existence relle,
alors que ltat de transition est une espce de photo (arrt sur image) dun moment du
droulement de la raction lorsque certaines liaisons commencent se rompre et que
dautres se forment.
b) Non, puisque tous les atomes demeurent en place. Dans la rsonance, il ny a que les
lectrons qui se dplacent.
c) Ce sont les lectrons s qui servent de lien principal entre les atomes ; ces lectrons
sont un niveau dnergie relativement bas de sorte que leur dplacement ne rduirait
pas lnergie globale de la molcule ; au contraire, leur dplacement aurait pour effet de
sparer les atomes, donc de dtruire la molcule.
d) Les lectrons p occupent un grand volume et ils sont plus loin des noyaux des atomes
que les lectrons s. Ils sont par consquent moins retenus par les noyaux positifs et plus
infuenables par des charges extrieures.
7. a) a) limination f) Substitution lectrophile
b) Substitution nuclophile g) Addition
c) Substitution nuclophile i) Substitution nuclophile
d) Rarrangement j) Addition
b) e) Oxydation (combustion)
h) Oxydation
j) Rduction
c)
hybride de rsonance
d)
hybride de rsonance
Chapitre 5
LES HYDROCARBURES
Alcanes Alcnes Alcynes
Introduction
5.1 Prsentation
1. Toute molcule ne contenant que C et H est classe comme hydrocarbure.
2. Le propane (gaz propane), le butane. Plusieurs autres sont trs utiliss: lessence (auto-
mobile, camion, motocyclette), tous les produits issus de la distillation du ptrole (mazout,
huiles lubrifantes, solvants, cire, vaseline, huile minrale, etc), le mthane (85 90% du gaz
naturel). Il y a aussi les produits transforms: polythylne, polystyrne, caoutchouc synth-
tique, etc. Le caoutchouc naturel (tir de larbre hva brasiliensis) et l -pinne (extrait des
aiguilles de pin) sont aussi des hydrocarbures.
5.2 Classication
1. Saturs et insaturs.
2. a) Cyclohexane C
6
H
12
b) Propane CH
3
UCH
2
UCH
3
C
3
H
8
c) Actylne HUCICUH C
2
H
2
d) thylne CH
2
uCH
2
C
2
H
4
e) Benzne C
6
H
6
3. Il augmente graduellement mesure que sallonge la chane carbone.
4. Il diminue graduellement mesure quaugmente le degr de ramifcation. Consulter le tableau
5.3 o les cinq molcules prsentes correspondent toutes la formule C
6
H
14
.
74 Chapitre 5 Section 5.3 et 5.4
Ptrole
5.3 et 5.4 Distillation, rafnage du ptrole et ptrochimie
1. Parce que le ptrole brut est un mlange complexe dhydrocarbures et de molcules diverses
considres comme des impurets. Il est donc plus utile de le sparer en ses diffrents com-
poss aux usages multiples. Les impurets polluantes comme le soufre, par exemple, doivent
en tre retires.
2. La distillation. Elle est dite fractionne parce quon recueille en continu les fractions du p-
trole correspondant diffrentes tempratures dbullition.
3. En-dessous de 20C. Le propane est donc gazeux la temprature ambiante. Voil pourquoi
on lutilise partir de contenants pressuriss.
4. Les masse molaires varient de 58 142 g/mol, ce qui correspond des hydrocarbures
contenant de 4 10 atomes de carbone, tel quindiqu sur la fgure 5.1.
5. Bris des molcules sous leffet de la chaleur intense utilise. Pour pouvoir isoler les asphaltes
et les gazoles.
6. Craquage catalytique.
7. Rupture de chane carbone, dshydrognation, isomrisation et cyclisation accompagne
de dshydrognation.
8. Le butane, tant plus volatil, favorise lallumage basse temprature. La temprature leve
le fait svaporer facilement des rservoirs essence. noter quenviron 10% de lessence
utilise ne se rend jamais dans les chambres de combustion des moteurs: elle svapore tout
simplement.
9. Le soufre. Sous forme de dioxyde et de trioxyde de soufre qui, au contact de leau contenue
dans lair, deviennent des acides sulfureux et sulfuriques, grands responsables de lacidifca-
tion de nos lacs et rivires (pluies acides).
Synthse des Hydrocarbures
Note : La consultation de lannexe 1 (p. 187), peut vous aider rsoudre les exercices partir de la section 5.5.
5.5 Synthse des hydrocarbures saturs
1. Lhydrognation catalytique et la condensation de deux halognures.
2.
75 Chapitre 5 Section 5.6
3.
(la raction se poursuit)
but-2-yne
butane
Ni
Ni
4.
+
Na
La formation de trois produits diffrents dans cette raction suggre dviter ce genre de
condensation partir de deux halognures diffrents.
5.6 Synthse des alcnes
1. Llimination.
2. Dihalognure vicinal: molcule organique portant deux atomes dhalogne sur des carbones
adjacents.
Exemple:
1,2-dibromopropane
3. Le zinc (Zn). Cet atome possde un doublet dlectrons relativement accessible au niveau
satur 4s, ce qui en fait un donneur dlectrons.
4. Lorsque le groupement amovible est OH, ce dernier doit tre proton, i.e. transform en
molcule deau potentielle davantage susceptible de se dtacher, puisque plus stable. Il faut
catalyser cette raction par un acide.
5. La protonation est lattaque dun des doublets libres de loxygne du groupement OH sur
lion hydrogne. Voici un exemple simple impliquant lthanol dans une limination E2. (avec
H
2
SO
4
conc.)
6. cause de leau forme dans cette raction. En effet, puisque cette raction est lquilibre,
la prsence deau dans lacide, catalyseur, pourrait nuire la formation de lalcne, principe
de Le Chtelier.
7. Le mcanisme E2 dlimination pouvant se produire entre le 1,2-dichloropropane et le zinc:
thanol thylne
+
+
1,2-dichloropropane
propne
76 Chapitre 5 Section 5.6
8.
9. Les halognures et les alcools. Dans le cas des alcools, une catalyse acide est ncessaire.
10. La dshydratation (limination deau) en prsence dacide sulfurique obit au mcanisme
suivant :
11. Ce type dlimination conduit prfrentiellement lalcne le moins ramif. Autrement dit, le
rsultat est linverse de ce que prvoirait la rgle de Saytsev.
12. Cette raction se droule par un mcanisme E2.
L'isomre
rythro
donnerait un
alcne E.
isomre thro
* Les deux atomes de brome
doivent tre opposs au
moment de la raction.
*
*
2,3-dibromopentane
isomre Z
a)
b)
NaOH
NaOH
3-bromo-2-mthylpentane
2-chloromthylcyclopentane
a)
b)
+
+
propan-2-ol
butan-2-ol
77 Chapitre 5 Section 5.7
13.
isomre thro
3-bromo-4-mthylhexane
isomre E
Lautre isomre thro donne aussi lalcne E, tandis que les isomres rythro donnent lal-
cne Z ; donc seulement deux alcnes peuvent tre obtenus partir de cet halognure. Cette
raction est strospcifque puisquun isomre donn ne donne quun seul produit.
5.7 Synthse des alcynes
1. Llimination.
2. NaOH, KOH et NaNH
2
3. Deux mthodes dobtention du propyne.
a) partir dun dihalognure vicinal:
b) partir dun dihalognure gmin:
4. Le seul produit possible est:
5. Parce que cette substance est le point de dpart de la synthse de plusieurs autres produits
chimiques. Elle sert galement dans la soudure et le travail des mtaux.
6.
3 C + CaO
2500C
a) partir du carbone et de la chaux.
b) partir du mthane.
1500C
+ CO
+
+ 2 +
2 3
78 Chapitre 5 Section 5.8
7. Voici deux substrats possibles pouvant conduire au but-1-yne:
et
8.
Ractivit des hydrocarbures
5.8 Combustion
1. Leau et le dioxyde de carbone.
2. Lthylne. La combustion de cette substance libre 1412 kJ/mol, compare au mthane
(principal constituant du gaz naturel) qui nen libre quenviron 891 (section 5.8). Cette utili-
sation de lthylne ne serait pas rentable, puisque cette substance sert de point de dpart
pour la synthse de nombreux produits dutilisation courante: polythylne, acide actique,
thanol, etc.
3.
5.9 Ractivit des alcanes
1. Les liaisons chimiques des alcanes sont trs peu polaires et, par consquent, leurs mol-
cules elles-mmes sont peu polaires et trs stables.
Parce que les alcanes sont trs stables, on doit utiliser des conditions de raction rigou-
reuses.
Leur faible polarit rend les ractions ioniques en phase liquide presque impossibles ; les
alcanes font plutt des ractions de type radicalaire en phase gazeuse, lesquelles demandent
plus dnergie.
a) b)
c)
hex-2-yne ou mthylpropylactylne
4-mthyl-1-phnylpent-2-yne ou
benzylisopropylactylne
oct-4-yne ou dipropylactylne
+ + a)
b)
2 25 16 18
octane
but-2-ne
6 4
4
2 15
6
benzne
12 c)
79 Chapitre 5 Section 5.10
2. Certainement. Le raffnage du ptrole permet dexploiter quatre types de ractions lors de la
pyrolyse:
a) raccourcir les chanes carbones, ce qui conduit des produits plus lgers et des
alcnes ;
b) dshydrogner des alcanes lgers pour produire des alcnes et de lhydrogne ;
c) isomriser des alcanes lgers pour abaisser leur point dbullition ;
d) cycliser des chanes pour obtenir du cyclohexane, par exemple, et mme dshydrogner
ce cycle pour produire le benzne.
3.
+
octane but-1-ne
butane
et bien d'autres produits selon le
point de rupture de la chane.
4. La substitution radicalaire. Cette raction est diffcilement contrlable quant aux produits que
lon dsire obtenir. On obtient toujours un mlange de plusieurs produits. Et qui dit mlange
dit aussi diffcult de sparation, opration primordiale en chimie organique.
5.
5.10 Ractivit des alcnes
1. Parce que ces molcules possdent des lectrons . Ces lectrons tant plus facilement
dplaables, ils ouvrent la porte une foule de produits grce la possibilit de former de
nouvelles liaisons.
2. Laddition et loxydation.
3.
dihalognure vicinal exemple de dihalognure vicinal
c)
4. Le carbocation tertiaire est le plus stable, le primaire le moins stable (voir section 4.9).
h
(...et plusieurs autres produits)
+
a)
b) + 9 6 6
+ + HCl
propane
cyclohexane
halohydrine exemple d'halohydrine nitrile exemple de nitrile
a) b)
80 Chapitre 5 Section 5.10
5.
6. La rgle de Markovnikov. Dans la raction daddition de YZ sur un alcne, le groupement
caractre positif se fxe de prfrence sur le carbone le plus hydrogn de la liaison double.
7.
8.
HCN
HCl
ClOH
b)
d)
e)
a)
c)
f)
propne
(autre produit; non favoris parce que sa
formation passe par un carbocation primaire)
produit majeur
2-mthylbut-1-ne
ion bromonium
propne
81 Chapitre 5 Section 5.10
9.
alcne cis alcne trans
10.
11. a) Ceux qui conduisent un diol:
KMnO
4
dilu RCO
3
H, H
2
O (H+) OsO
4
, H
2
O
b) Ceux qui causent la rupture complte de la liaison CUC:
O
3
, H
2
O / Zn KMnO
4
conc.,
12.
(E )-but-2-ne mso
Lattaque de lion bromure, soit par
devant, sur le C2, soit par derrire, sur
le C3, ne donne quun seul produit
puisquil n'y a qu un seul mso.
3
2
2
3
2-mthylpent-2-ne
+
(mme qu'en a)
a)
b)
c)
d)
e)
+
(diol anti )
1)
2)
3)
(diol syn )
82 Chapitre 5 Section 5.11
13. Propne trait au permanganate concentr et chaud:
14. Loxydation par le permanganate concentr et chaud. Elle permet la formation de CO
2
. Voir la
rponse du numro 13.
15.
16. Lthylne: CH
2
uCH
2
5.11 Ractivit des alcynes
1. Laddition, loxydation et la raction acidobasique (on pourrait ajouter la substitution nuclo-
phile qui est ensuite possible).
2. Ractions daddition:
3.
+
+
conc.
propne
+
1)
2)
3)
a) de lhydrogne sur le but-2-yne:
b) du chlore sur le pent-1-yne:
c) de lacide chlorhydrique sur le but-2-yne:
HCl
Pt
2
2
2
a)
b)
but-2-yne
pent-1-yne
a)
b)
but-2-yne
pent-1-yne
83 Chapitre 5 Section 5.11
4. partir de lactylne.
5. Les ractions doxydation employes sur les alcnes ne marchent pas effcacement avec les
alcynes. Loxydation au permanganate en milieu neutre ou fortement basique exige une solu-
tion concentre pour briser la liaison triple et produire des acides aprs acidifcation du milieu
ractionnel. Lozonolyse est possible, mais elle conduit exclusivement la formation dacides
carboxyliques.
6.
7. Ozonolyse du propyne:
+
+
8.
a) b)
alcyne terminal alcyne disubstitu
9.
+
+ NaBr +
propyne
bromothane
but-1-yne
10.
+
+ NaBr +
propyne
bromothane
but-1-yne
11. Ajout de deux carbones la chane carbone du bromothane en utilisant comme ractifs
lamidure de sodium,NaNH
2
, et un alcyne:
actylne
+
+ NaBr
12.
/ NaOH 1)
2) HCl
2
hex-3-yne
+ NaBr
+
actylne
hex-3-yne
84 Chapitre 5 Exercices complmentaires
Exercices complmentaires
1.
a)
b)
c)
d)
e)
HCN
Pt
conc.
dilu
Zn
2 HCl
2) , Zn
f)
g)
2-mthylpropne
ClOH
,
+
conc.
h)
+ + +
2) , Zn
85 Chapitre 5 Exercices complmentaires
1. (suite)
f)
g)
2-mthylpropne
ClOH
,
+
conc.
h)
+ + +
2) , Zn
2. a)
b)
c)
d)
e)
Pt
ou KOH
conc.
HBr
propan-1-ol
obtenu en (a)
propne
1,2-dibromopropane
2-bromopropane
propane
propan-2-ol
f)
g)
obtenu en (d)
(plus d'autres produits,
raction non slective)
obtenu en (b)
propyne
1-chloropropane
h)
obtenu en (g)
2
2 Na
+ 2 NaCl
hexane
i)
j)
obtenu en (f)
k)
l)
m)
n)
HCN
dilu
+
2
conc.
+
obtenu en (a)
2) , Zn
1,1,2,2-ttrabromopropane
+
o)
obtenu en (c)
p)
obtenu en (o)
Pt
2-mthylpentane
86 Chapitre 5 Exercices complmentaires
2. (suite)
3.
h)
obtenu en (g)
2
2 Na
+ 2 NaCl
hexane
i)
j)
obtenu en (f)
k)
l)
m)
n)
HCN
dilu
+
2
conc.
+
obtenu en (a)
2) , Zn
1,1,2,2-ttrabromopropane
+
o)
obtenu en (c)
p)
obtenu en (o)
Pt
2-mthylpentane
a)
conc.
protonation
mcanisme E1
+
2-mthylpentan-2-ol
87 Chapitre 5 Exercices complmentaires
3. (suite)
4.
5.
b)
+
c)
d) +
a) b) c)
changement de
conformation
rythro
isomre Z
thro racmique
A
B
C
isomre Z
+ + NaBr
1-bromo-1,2-diphnylpropane
+
+
En partant avec lisomre thro du 1-bromo-1,2-diphnylpropane, on obtient
lisomre E pour A, le mlange racmique rythro pour B et lisomre E pour C.
88 Chapitre 5 Exercices complmentaires
6. Raction globale:
Zn
+
Mcanisme de raction sur lisomre thro:
Mcanisme de raction sur lisomre rythro:
7. Mcanisme (en respectant la strochimie) de laddition de brome:
8.
isomre Z
thro
+
+
isomre E
rythro
mso
(E )-1,2-diphnylthylne
A
B
C
D
E
F
G
H
I
J
89 Chapitre 5 Exercices complmentaires
9. La solution complte de cet exercice est prsente ci-aprs.
A B C, F, H
D
E
G
J
K
L
I
A
J
B
C
E
H
I
D
F
G
K
L
dilu
HCN
Ni
Pd
HBr
KOH
Prsentation modifie du
systme dinconnues:
Solution complte de lexercice #9.
Le but de lexercice est de trouver la structure molculaire
de chacune des molculaires, en conformit aux ractions indi-
ques ci-contre.
Un tel exercice peut paratre droutant par complexit et la pr-
sence de plusieurs inconnues.
Pour le rsoudre, il faut analyser partir des informations
fournies (formules molculaires et ractifs) et faire plusieurs
dductions permettant de trouver la structure de chaque formule
molculaire.
Voici, en dtail, comment procder:
1. De la raction transformant J en K, on peut dduire quil sagit
dune addition puisque le nombre datomes de K est sup-
rieur celui de J. laddition tant une raction typique des
alcnes/alcynes, on peut supposer que J est peut-tre un
alcne ou une alcyne.
2. De la raction transformant J en L, on peut dduire quil sagit
dune oxydation douce cause de la solution dilue et que
le compos L est probablement un diol et non un acide (la
formation dun acide implique une solution concentre doxy-
dant, la coupure de la chane carbone et la prsence de CO
2
,
ce qui nest pas le cas ici).
3. De la raction transformant A en J, on peut dduire quil sagit
dune addition dhydrogne molculaire ; A ne peut donc pas
tre un alcne, car J serait un alcane qui ne peut pas ragir
dans une addition de HCN ; donc A est un alcyne (un alcyne
terminal avec un H une des extrmits de liaison triple)
trois carbones et sa structure peut tre dduite de faon uni-
voque (propyne) ; cela permet de trouver facilement les struc-
tures de J, K et L.
4. De la raction transformant A en I, on peut dduire quil sagit
dune addition de deux molcules de brome molculaire dans
une raction typique des alcynes (ce qui vient confrmer la
dduction prcdente).
5. De la raction transformant A en B, on dduit facilement que
lion amidure, une base forte, arrache le proton de la liaison
triple pour donner un ion actylure B (de sodium, bien en-
tendu).
90 Chapitre 5 Exercices complmentaires
9. (suite)
6. La transformation de B en C est une substitution nuclo-
phile ; C contient maintenant un groupe mthyle, en plus de
la liaison triple.
7. La transformation de C en D est une addition deau, propre
aux alcynes ; il se forme un intermdiaire nol qui se trans-
forme ensuite en ctone ; il est donc facile de dduire la struc-
ture molculaire de D, une ctone quatre carbones.
8. La transformation de C en E est une addition double (addi-
tion de deux molcules de HBr, puisque la formule molculaire
augmente de deux H et de deux Br) ; E est un dihalognure
gmin (rgle daddition de Markovnikov).
9. La transformation de E en H et de E en F est une double
limination de HBr ; la liaison triple se forme au centre de la
molcule (rgle de Saytzev) et on obtient le but-2-yne dans
les deux cas.
10. La transformation de F en G est une addition dhydrogne
(hydrognation totale) avec le catalyseur Ni (catalyseur trs
effcace, rduction totale) ; quatre atomes H se fxent sur F qui
devient lalcane G, dont la formule molculaire correspond
la formule gnrale des alcanes C
n
H
2n+2
.
A
J
B
C
E
H
I
D
F
G
K
L
dilu
HCN
Ni
Pd
HBr
KOH
Chapitre 6
LES COMPOSS
BENZNIQUES
Introduction
6.1 Prsentation et aromaticit
1. Le benzaldhyde, la vanilline, le salicylate de mthyle et bien dautres sont des composs
aromatiques utiliss dans lalimentation. Le benzne, le tolune et les xylnes sont des sol-
vants aromatiques.
2. Erich Hckel.
3. Les composs (a), (d) et (e) sont aromatiques.
Ractivit
6.2 La substitution
1. La substitution (ou remplacement) dun atome dhydrogne sur le cycle, sans que le cycle
ne soit modif. La forte densit lectronique dun cycle benznique attire effcacement les
ratifs lectrophiles (il y en a plusieurs), mais le noyau aromatique a tellement tendance
se converser quil se regnre aussitt en mme temps quun atome dhydrogne quitte la
molcule.
2. a) Lalkylation:
b) La nitration:
( RX + )
+ ( )
92 Chapitre 6 Section 6.2
c) Lhalognation:
d) La sulfonation:
e) Lacylation:
3.
4. Il sagit dune raction de Friedel-Crafts.
+ +
+ +
+ HCl
5. La prsence dun premier substituant sur le cycle a une infuence dterminante sur la positi-
ton dentre de tout substituant, parce quil modife lgrement la distribution lectronique du
noyau et, de ce fait, oriente toute substitution subsquente.
+ ( )
( ) +
( ) +
a) le nitrobenzne b) le chlorobenzne c) le tolune d) le styrne
f) l'aniline g) le phnol h) l'acide benzoque
e) l'acide benznesulfonique
93 Chapitre 6 Section 6.2
6. Les substituants qui activent fortement le cycle benznique face larrive dun ractif lec-
trophile sont donneurs dlectrons par effet msomre. Z peut tre lun des groupements
suivants :
Z =
.. ..
..
..
..
La prsence de l'un de ces substituants sur le cycle oriente toute
substitution subsquente vers les positions ortho et para.
7. Les substituants qui dsactivent fortement le cycle benznique face larrive dun ractif
lectrophile sont attracteurs dlectrons par effet msomre. Z peut tre lun des groupe-
ments suivants:
La prsence de l'un de ces substituants sur le
cycle oriente toute substitution subsquente
vers la position mta.
- acides
- ctones
- aldhydes
- amides
8. Hybride de rsonance du phnol mettant en vidence les positions dentre favorises pour
un ractif lectrophile (positions ortho et para):
9.
tolune p -xylne
10. La reprsentation de lhybride de rsonnance du benzaldhyde permet de constater que
lentre dun ractif lectrophile sur le cycle est dfavorise cause du caractre positif qui
sy dveloppe. Le ractif lectrophile se fxe alors en position mta par dfaut.
11.
nitrobenzne
a) + +
+
94 Chapitre 6 Section 6.3 et 6.4
11. (suite)
actophnone
b) + + +
+
12. On obtient de la substitution sur les groupes mthyle seulement. Cest une raction radica-
laire catalyse gnralement par la lumire ultraviolette. Le cycle nest attaqu que par les
ractions typiquement ioniques comme la substitution lectrophile.
h
13. A : B :
14.
(en excs)
6.3 et 6.4 L'addition d'hydrogne et l'oxydation
1. a) Faux. Il est trs diffcile de loxyder. La molcule affche une stabilit remarquable. Cette
stabilit, entre autres, contribue aux problmes ds la persistance des BPC et du DDT
dans lenvironnement.
b) Vrai. Alors quelles sont faciles sur les alcynes et les alcnes, il est presque impossible de
les effectuer sur le noyau benznique.
2. Rompre laromaticit du benzne nest pas chose facile. Pour le transformer en cyclohexane,
il faut utiliser un catalyseur, le Nickel de Raney, avec de lhydrogne et effectuer lopration
temprature et pression leves. La raction est de type radicalaire.
3. Loxydation sur les noyaux benzniques substitus se fait plus facilement parce quelle a lieu
sur les substituants eux-mmes plutt que sur le noyau benznique. Cette raction permet
dtudier les positions relatives des substituants puisque chacun des substituants est alors
transform en fonction acide carboxylique, plus facilement identifable.
95 Chapitre 6 Exercices complmentaires
4. Laddition lectrophile, malgr la forte densit lectronique du cycle benznique, est peu
probable puisquelle briserait laromaticit du cycle, laquelle tend toujours tre conserve
(stabilit = niveau dnergie plus bas, donc toujours favoris).
5. Lacide o-phtalique:
6.
1) NaOH (solide)
350 C
2)
conc.
chlorobenzne
cyclohexne
3
Ni
(Raney)
Exercices complmentaires
1.
a)
tolune
conc.
b)
c)
prdominant
conc.
Ni
(Raney)
3
96 Chapitre 6 Exercices complmentaires
2.
b)
a)
c)
obtenu en (b)
conc.
3. a) 1.
2. + + +
+ +
+
+
3. + +
97 Chapitre 6 Exercices complmentaires
3. (suite)
b)
+ +
prdominant substitution lectrophile
en ortho et para
+ +
+ + +
+
c)
d)
4. A
B
C
D
E
F
G
H
I
J
98 Chapitre 6 Exercices complmentaires
5.
A
B
C
D
E
F
G
H
I
J
mme que E
K
Chapitre 7
LES COMPOSS
HALOGNS
7.1 Gnralits
1. La diffrence dlectrongativit entre le carbone et les halognes nest pas suffsamment
leve pour entraner une sparation de charge + et -. Pour cette raison, les halognes et le
carbone forment des liaisons covalentes. Bien que fortes, ces liaisons conservent une pola-
rit importante les rendant aptes participer de multiples ractions (i.e. elles peuvent tre
rompues malgr tout).
2. Oui. On trouve plusieurs composs halogns dans la nature. Certains ont t dcels chez
des organismes marins vivant de grandes profondeurs et dans un milieu forte concentration
saline. Les volcans et les feux de forts, entre autres, en produisent beaucoup galement.
3. Non. Lhomme a invent de toutes pices beaucoup de drivs halogns organiques qui
nexistent pas dans la nature. Mais il navait pas prvu tous les problmes relis la persis-
tance de ces composs et leurs effets sur la couche dozone.
4. Ce sont surtout les CFC (chlorofuorocarbones) dont les principaux reprsentants sont les
frons 12, 13 et 22.
5. a) 2 b) 3 c) 1
Synthse des composs halogns
7.2 Par raction de substitution
1. Les hydrocarbures et les alcools.
2. Parce quil y a production dun mlange de produits, gnralement diffciles sparer.
Dailleurs, qui dit mlange de plusieurs produits dit aussi diminution de rendement pour
chacun des produits pris individuellement.
3. Le noyau aromatique li la partie hydrocarbure permet de contrler et de rduire le nombre
de produits forms. En effet, la substitution radicalaire na lieu que sur la ramifcation et non
sur le noyau aromatique (benznique ou autre).
4. Non. La liaison covalente CO est trs forte. Le carbocation et lion hydroxyde, rsultant
dune sparation du groupe OH davec la chane carbone, auraient tellement tendance se
runir quils ne sont pas du tout ports se sparer. Thermodynamique (stabilit) oblige!
100 Chapitre 7 Section 7.2
5. La protonation permet en quelque sorte un groupe OH de se transformer en molcule deau
potentielle. La molcule deau tant trs stable et lalcool proton devenu instable cause
de la charge positive, il sufft davoir un nuclophile dans le dcor pour que la molcule deau
quitte son lieu de formation simultanment la fxation du nuclophile. Parfois la molcule
deau quitte delle-mme lalcool proton lorsque le carbocation gnr est tertiaire (plus
grande stabilit).
6. a) Raction homolytique
(la raction peut se poursuivre)
b) Raction htrolytique (mcanisme S
N
1)
carbocation
tertiaire
1-mthylcyclohexan-1-ol
c) Raction homolytique
+ HCl
tolune
d) Raction htrolytique
butan-1-ol
e) Raction htrolytique
+
produit majeur phnol
7.3 Par raction d'addition
1. Alcne, alcyne et carbonyle.
2. a) + HCl
b)
+
cyclopentne
101 Chapitre 7 Section 7.4
c)
2 HBr
propyne
d)
2
but-2-yne
e)
+
benzaldhyde
3.
Pd
2,3-dibromohexane
4
+
cyclohexanone 1,1-dichlorocyclohexane
Ractivit des composs halogns
7.4 La substitution
1. Parce que ce sont des composs polariss au niveau de la liaison CUX. Cela rend possible
le dpart ventuel du groupe X dans une raction htrolytique de substitution ou dlimina-
tion.
2.
produit mineur
ion hydroxyde
eau
ion carboxylate
produit mineur
alcool
HO
ROH
ion alcoolate
102 Chapitre 7 Section 7.4
3.
ion cyanure ammoniac
2-bromo-2-mthylpropane
4. La fonction que lon dsire obtenir impose le choix du nuclophile. Mais on doit aussi tenir
compte de la force du nuclophile et du type dhalognure-substrat (1, 2 ou 3).
5.
Driv
halogn
1
2
3
Nuclophile
Stabilit
du
carbocation
Mcanisme
favoris
fort
moyen
faible leve
faible
6. Le substrat tant asymtrique, le nombre dtapes de la substitution (dordre 1 ou dordre 2)
est dune importance capitale en ce qui a trait aux produits obtenus (voir section 7.4).
7 Mlange racmique dans le cas dune S
N
1.
Inversion de confguration dans le cas dune S
N
2.
8. Les deux possibilits dattaque:
gauche du plan
droite du plan
103 Chapitre 7 Section 7.5
9. a)
(inversion de configuration) 3-chloro-2-mthylpentane
b) Puisque la substance de dpart est dextrogyre (+15) et quun mcanisme S
N
2 implique
une inversion de confguration, le produit fnal sera fort probablement lvogyre, mais avec
une valeur diffrente de 15, par exemple -25, parce quil ne sagit pas de limage de
miroir du substrat.
10. Mcanisme S
N
2
+ NaCl
+
7.5 L'limination
1. E1 et E2
2. Llimination. Elle peut tre E1 ou E2.
3.
KOH
2,3-dibromobutane
4.
trans ou E
b) a)
l'isomre thro
donne le cis ou Z
(mso )-2,3-dichlorobutane
7.6 La comptition substitution / limination
1. Les deux ractions mettent en jeu les mmes substrats et ractifs ; de plus, elles passent par
des phases intermdiaires analogues.
2. On peut favoriser la raction S
N
1en choisissant un RX tertiaire et en utilisant un Nu faible.
Un solvant polaire peut aussi aider.
3. On peut favoriser une limination par lemploi dune base forte. Si RX est primaire, il est
prfrable dutiliser une solution concentre de la base forte et/ou chauffer.
104 Chapitre 7 Section 7.6
4. a) limination, RX (3):
(base forte)
b) Substitution, RX (3):
(Nu faible)
c) Mme chose que a).
d) Substitution, RX (3):
(bon
nuclophile)
5. a)
b) Avec
la base est forte
l'halognure est primaire
donc substitution surtout mais avec passablement
d'limination.
beaucoup
Avec NaOH conc. + chaleur
Le produit d'limination est favoris par les conditions rigoureuses
dans lesquelles agit la base:
Avec NaCN
L'ion cyanure, , est un bon nuclophile, mais une base faible;
donc la substitution sera favorise pour produire:
+
105 Chapitre 7 Section 7.7
7.7 Ractivit avec un mtal
1. a)
b)
2. a) b) c)
3. a) CH
3
Li, mthyllithium et CH
3
MgBr, bromure de mthylmagnsium.
b) cause de la valence +1 du lithium.
4. Le ractif de Grignard se prpare ordinairement dans lthoxythane (lther) anhydre (i.e.
sans eau, sch chimiquement au moyen de sodium mtal). Les interactions entre les mol-
cules dthoxythane et lorganomtallique stabilisent ce dernier:
Mg
dans
l'thoxythane
anhydre
Ractivit des organomagnsiens
7.8 Le ractif de Grignard comme nuclophile
1. Aldhyde, ctone, ester, chlorure dacide, anhydride, oxyde dthylne (ce dernier allonge la
chane carbone de deux carbones).
2. Une ctone peut tre obtenue partir dun nitrile. On obtient un acide lorsque laddition est
faite sur le dioxyde de carbone.
3. a)
+
un alcool
hydrolyse
106 Chapitre 7 Section 7.8
3. (suite)
b)
+
un acide
hydrolyse
c)
+
noter le gain de
deux carbones
hydrolyse
4.
...et la raction se poursuit:
+
hydrolyse
107 Chapitre 7 Section 7.9
5. +
l'hydrolyse se poursuit
une imine instable
+
hydrolyse
propanenitrile
7.9 Le ractif de Grignard comme base
1. RUX et HUA
2.
3. Parce que cet atome dhydrogne li directement un lment plus lectrongatif, O, N, ou
X, acquiert un caractre positif et devient vulnrable lattaque dun ractif de Grignard (ce
dernier jouant le rle dune base forte).
4. En transformant le bromothane en ractif de Grignard puis en le faisant ragir avec le bro-
momthane:
+ Mg
thoxythane
bromothane propane
anhydre
5. a)
b)
c)
d)
+
+
+
+
+
+
+
+
thane
mthane
benzne
propane
mthanol
acide actique
108 Chapitre 7 Exercices complmentaires
6.
Mg
+
+
1-bromo-3-isopropyl-4-mthylcyclopentane
thoxythane
anhydre
Exercices complmentaires
1. a) Substitution nuclophile bimolculaire puisque lhalognure est primaire et le ractif une
base forte dilue, cette dernire jouant le rle dun nuclophile fort.
+ KBr
1-bromobutane
b) limination unimolculaire puisque lhalognure est tertiaire et la base forte. Appliquer la
rgle de Saytzev.
+
+ NaBr
+
E1
1-bromomthylcyclohexane
c) Substitution nuclophile unimolculaire puisque lhalognure est tertiaire et le nuclophile
faible.
+ +
109 Chapitre 7 Exercices complmentaires
d) +
butan-2-ol
e)
+ HBr
+
2-bromo-2-mthylpropane
f) Substitution radicalaire
h
+ HCl
etc.
g) Substitution lectrophile en ortho et para
+ +
prdominant
tolune
h)
+
thanol
i)
+ NaCN
NaBr +
1-bromo-1-phnylthane
110 Chapitre 7 Exercices complmentaires
j) Cette raction prsente deux possibilits dattaque :
(Mcanisme S
N
1, puisque lhalognure est tertiaire.)
carbocation
plan
attaque
gauche du plan
attaque
droite du plan
2-bromo-2-phnylbutane
mlange racmique
perte d'un
carbocation
plan
perte d'un
attaque
gauche du plan
attaque
droite
du plan
2. a) Mcanisme daddition sur une ctone
+
+
111 Chapitre 7 Exercices complmentaires
2. (suite)
b) Mcanisme de double raction sur un ester (substitution suivie dune addition) :
+
+
+
c)
+
+
(imine instable)
d)
+
+
+
e) Mcanisme de substitution nuclophile sur RX :
+ +
112 Chapitre 7 Exercices complmentaires
2. (suite)
f) Mcanisme de substitution nuclophile sur HA :
+ +
g) Mcanisme daddition sur un aldhyde :
+
+
h) Mcanisme comme sur un ester, la raction est double ; substitution suivie dune addition:
+
+
+
3. a)
Mg
1)
2)
thoxythane
anhydre
113 Chapitre 7 Exercices complmentaires
3. (suite)
b)
obtenu en (a)
1)
2)
c)
obtenu en (a)
1)
2)
d)
obtenu en (b)
conc.
HCl
e )
obtenu en (a)
2 +
2)
N.B. Ce substrat est choisi
en fonction du produit
recherch; le bromure de
phnylmagnsium est driv
du benzne.
f)
obtenu en (d)
g)
obtenu en (a)
114 Chapitre 7 Exercices complmentaires
4.
A B C D
E F G H
5.
A B C
D E F
G H I
J K
6.
A B C D
E F G H
115 Chapitre 7 Exercices complmentaires
7.
A B
C D E
F G H
I
J
K L M
N O
P
Q
R S
T
+
Chapitre 8
LES COMPOSS
OXYGNS SATURS
Alcools et thers
8.1 Gnralits
1. a)
alcools thers
b) alcools thers
c) thanol thoxythane
ou alcool thylique ou oxyde de dithyle
d) Lthanol, cause de la possibilit de formation dun plus grand nombre de liaisons
hydrogne.
2. a) thylneglycol. Ce liquide sert comme antigel dans les radiateurs des moteurs com-
bustion interne. Sa prsence en concentration importante dans leau de refroidissement
abaisse la temprature de conglation de leau en hiver et en lve la temprature dbul-
lition en t.
b) Glycrol. Il sagit dune seule et mme molcule. Liquide visqueux et lgrement sucr ;
se vend en pharmacie ou lpicerie et peut se retrouver comme ingrdient mineur dans
des aliments transforms, dans des cosmtiques ou des mdicaments. La glycrine (ou
glycrol) sert de substrat lors de la fabrication de la trinitroglycrine, un explosif.
3. Sous forme de gaz puisque sa temprature dbullition est de 34,5 C. La temprature nor-
male du corps est de 37,2 C. Les liaisons qui retiennent les molcules dther entre elles
sont donc trs faibles.
4. Le mthane bout -164 C et le mthanol 65,1 C la pression normale de 101,3 kPa.
a) La diffrence entre la taille de ces deux molcules nest pas suffsante pour justifer un
cart de 229,1 C. Seule la prsence de liaisons hydrogne entre les molcules de m-
thanol peut expliquer ce phnomne.
b) La diffrence dans les tempratures dbullition est de 167,1 C. Lcart pour ces deux
molcules est moins grand quen (a) en raison de leffet de la taille ou grosseur des mol-
cules. Les liaisons de type London augmentent et ceci a comme consquence dlever
les deux tempratures dbullition tout en rduisant lcart entre les deux par comparai-
son lcart entre les tempratures correspondantes pour le mthane et le mthanol.
c) Entre leau et le mthanol, on nobserve quune diffrence de 35 C. Mais, si on considre
la faible masse de la molcule deau (18,015 g/mol), cette diffrence est tonnante. La
possibilit pour leau de pouvoir tablir jusqu quatre liaisons hydrogne par molcule
justife raisonnablement la valeur observe de 100 C.
118 Chapitre 8 Section 8.1
4. (suite)
d) La diffrence ici nest que de 13,4 C. Ces deux molcules se ressemblent passablement.
Les deux peuvent tablir des liaisons hydrogne entre molcules identiques. Mais leur
grosseur est diffrente (interactions de London).
5. Oui, mais faiblement. Suffsamment cependant pour expliquer une faible solubilit.
6. Un certain nombre de liaisons hydrogne stablissent entre molcules deau et dthoxy-
thane.
7. a)
b)
mthanol
thoxythane
*
*
Le mthanol est plus soluble que lther dans leau en partie cause du pont hydrogne
entre leau et lhydrogne de sa fonction alcool.
8. a) propane-1,2-diol
b) p -hydroquinone ou 1,4-dihydroxybenzne ou p -dihydroxybenzne
c) 4-mthylpent-2-n-1-ol
d) 2,2-dimthoxypropane
e) isopropoxycyclohexane ou oxyde de cyclohexyle et disopropyle
f) acide 2-chloro-4-mthoxybenzoque.
Synthse des alcools et des thers
8.2 Par raction de substitution nuclophile
1. a) + NaCl
b) +
+
c)
d)
NaOH
NaCl +
+
+
+
+ Cl
+
+
+ Cl
* Ce pont hydrogne n'existe pas dans l'thoxythane.
119 Chapitre 8 Section 8.2
2.
3.
4.
a)
b)
c)
NaOH
+
NaCl +
KOH
KCl
chlorure de benzyle
2-bromo-2-mthylpropane
1-chloropentane
+
+
+ Br
_
5.
a)
+
b)
saponification
+
NaOH
benzoate d'thyle
thanol
actate de benzyle
alcool benzylique
6.
1) saponification
+
l'ion actate
deviendrait
2)
acide actique
En effet,
+ HCl
+ NaCl
120 Chapitre 8 Section 8.3
8.3 Par raction d'addition
1. Tableau des ractions daddition conduisant aux alcools.
Substrat Ractif Alcool produit
alcne
aldhyde
ou
ctone
de Grignard
un rducteur
1, 2 ou 3
2 ou 3 avec un nombre de C
plus lev que la substance
carbonyle de dpart
ester
chlorure d'acide
anhydride
3 exclusivement
aldhyde
ou
ctone
de Grignard
1 partir d'un aldhyde
2 partir d'une ctone
ester
deux alcools sparer
(facile si alcools trs diffrents)
rsiste la rduction ester
eau acidule
oxyde d'thylne de Grignard 1 exclusivement
2. 2. a)
b)
c)
d)
but-2-ne
2-mthylbut-2-ne
2,3-dimthylbut-2-ne
1-mthylcyclohex-1-ne
3.
2)
4. a)
2)
121 Chapitre 8 Section 8.3
b)
+
2)
c)
+
2)
d)
+
2)
e)
+ 2
2)
5. a)
b)
c)
d)
e)
f)
+
+
+
122 Chapitre 8 Section 8.4
6.
b)
a)
c)
et
8.4 Synthse des phnols
1. En industrie, le phnol est souvent prpar par loxydation du cumne.
2.
HCl
3. a)
350C
1) NaOH
2)
conc.
b)
(ce compos s'appelle
aussi acide picrique)
350C
1) NaOH
2)
c)
350C
1) NaOH
2)
8.5 Synthse d'autres composs oxygns importants
1. Parce quune partie des molcules dthanol subissent une dshydratation selon un mca-
nisme E2, cet alcool tant primaire:
thylne
thanol
+
..
123 Chapitre 8 Section 8.5
2. a) Combustible fondue ; on lutilise aussi comme liquide antigel dans les lave-glaces ; on
en trouve galement dans certains dcapants peinture.
b) Mis part lthanol que lon retrouve dans la bire et dans le vin, on retrouve de lthanol
dans des extraits dessences vgtales (ex. vanille), comme agent dsinfectant dans les
laboratoires, comme solvant et comme ingrdient dans certains mdicaments ou pro-
duits vendus en pharmacie.
Ractivit des alcools et des thers
8.6 Rupture de la liaison OH
1. a)
b)
c)
d)
aucune raction
Na
NaOH
aucune raction
Na
NaOH
+ 1/2
+ 1/2
2. a) Le phnol est environ 10
6
fois plus acide que le mthanol.
b) Le phnol est environ 10
5
fois moins acide que lacide actique.
3. Lion phnolate est stabilis par rsonance tel quindiqu la section 8.6, tandis que lion
thanolate ne lest pas.
4. Le b est plus facile former parce que le potassium est un meilleur rducteur. Le plus diffcile
former est a. Dans les trois cas on obtient le mme ion alcoolate tert -butanolate.
5. a)
b)
c)
+ +
+
2 Na
thane
un ester
conc.
+
2
+ 2 NaBr
A
propane-1,2-diol
_
+
_
+
124 Chapitre 8 Section 8.7
8.7 Rupture de la liaison CO
1. a)
b)
c)
2 HBr
HI
HCl
+
+
1-isopropoxypropane
isopropoxybenzne
2-mthylpropan-2-ol
2.
b)
a)
HCl
1-mthylcyclohexanol
3.
HI
HI
+
4. a) Lprouvette 1 contient lalcool primaire thanol ; il ne sest pas form de chlorothane.
b) Lprouvette 2 contient lalcool tertiaire, le 2-mthylbutan-2-ol ; il a bien ragi parce quil
peut former un carbocation stable conduisant au 2-chloro-2-mthylbutane, insoluble
dans le milieu ractionnel.
c) Lprouvette 3 contient lalcool secondaire, le propan-2-ol ; raction partielle (parce que
lente) pour former un peu de 2-chloropropane, insoluble dans le milieu ractionnel.
5.
a)
b)
HCl
aqueux
+
125 Chapitre 8 Section 8.8
8.8 Ractions d'oxydation des alcools
1.
c)
d)
Cu
b)
a)
2.
2 HI
NaOH
dilu
2
2 2
2-isopropoxypropane
actone
3.
b)
a)
Cu
Cu
Exercices complmentaires
1. a) +
un ester
+
(il y a quilibre;
raction incomplte)
b) aucune raction + NaOH
c) +
2)
126 Chapitre 8 Exercices complmentaires
1. (suite)
+
d)
e)
Cu
300 C
f)
+
+
+
g)
h)
Na
i) , puisque l'halognure de dpart est tertiaire.
HBr +
1/2 +
+
Br
Pt
j)
A
127 Chapitre 8 Exercices complmentaires
1. (suite)
k) +
+
un ester
l)
1)
2)
3
3 , OH
raction trs lente
m)
n)
o)
HCl
+
+
3 3 +
+ HCl
+
2.
b)
a)
c)
conc.
HBr
Mg
1)
2)
128 Chapitre 8 Exercices complmentaires
2. (suite)
d)
1)
2)
HBr
Mg
e)
2)
1)
f)
Cu
300C
dilu
NaOH
g)
1)
350C
2)
conc.
Pt
NaOH
h)
i)
Pt
j)
Mg
1) 2)
obtenu en (g)
129 Chapitre 8 Exercices complmentaires
3.
4.
b)
a)
Cu
+
130 Chapitre 8 Exercices complmentaires
4. (suite)
c)
d)
e)
f)
HCl
+ 2 Na + 2 NaCl
obtenu en (a)
obtenu en (d)
HBr
2
(thanolique)
KOH
g)
Mg
obtenu en (f)
1)
2)
obtenu en (a)
h)
conc.
i)
j)
obtenu en (g)
Cu
obtenu en (g)
conc.
KOH
5.
Premire mthode
Halognure tertiaire + nuclophile faible,
donc la substitution est favorise.
HCl
131 Chapitre 8 Exercices complmentaires
5. (suite)
Deuxime mthode
K
HCl
+
Halognure primaire + nuclophile fort,
donc la substitution est favorise.
6.
B A C D
F E G
7.
B A C
E D F
8.
D B A C
H F E G
132 Chapitre 8 Exercices complmentaires
8. (suite)
L
J I K
+
M
9.
+
aucune
raction
aucune
raction
aucune
raction
aucune
raction
a)
b)
c)
+
+
+ +
(rapide)
10.
B A C D
J I G H
+
E
F
+
K
133 Chapitre 8 Exercices complmentaires
10. (suite)
O N L M P
Q
+
Chapitre 9
LES COMPOSS
OXYGNS INSATURS
Aldhydes et ctones Acides
carboxyliques et drivs
9.1 Prsentation
1. Sel dacide carboxylique, ester, halognure dacide (acyle), amide et anhydride.
2. a)
b)
c)
le benzaldhyde
l'actate de mthyle
l'anhydride actique
9.2 Le groupe carbonyle
1. a) Chlorure dacide, donc substitution ;
b) anhydride dacide, donc substitution ;
c) ctone, donc addition ;
d) aldhyde, donc addition.
2. a) puisque lion chlorure, Cl
W
, form est une base plus faible que lion HO
W
libr dans le cas de lacide carboxylique.
b) libre un ion actate, CH
3
UCO
2
W
, une base plus faible que lion
CH
3
O
W
provenant de lester.
c) puisque lautre compos est une ctone qui ragit surtout par
addition.
d) puisque lion chlorure, Cl
W
, form est une base plus faible que lion NH
2
W
libr dans le cas de lamide.
136 Chapitre 9 Section 9.3
9.3 tat naturel
1. Lacide actique.
2. Les fonctions ctone et alcool.
3. La fonction ctone.
4. Les chlorures dacides et les anhydrides shydrolysent trop facilement.
5. La fonction ester.
9.4 Nomenclature des composs carbonyls
1. a) Amide f) acide carboxylique , -insatur
b) nitrile g) chlorure dacide (acyle)
c) dictone h) ester
d) anhydride dacide i) ctone
e) aminoacide j) sel dacide carboxylique.
2. a) Pentan-2-one n) N-mthyl-3-chloro-2-mthylbutanamide
b) acide trichloroactique o) mthanamide ou formamide
c) acide benzoque p) acide 2-aminopropanoque
d) chlorure de benzoyle q) actate de phnyle
e) anhydride actique r) butanedione
f) 2-hydroxy-3-mthylbutanal s) acide oxalique
g) acide butanoque ou butyrique t) cyclohex-2-n-1-one
h) propanoate de mthyle u) 2-mthoxybenzonitrile
i) butanedial v) N-phnylpropanamide
j) acide but-2-noque w) 4-mthylactophnone
k) benzoate de potassium x) acide 2-chloro-4-mthylpent-3-noque
l) propanenitrile ou propionitrile y) acide 2-mthylmalonique
ou cyanure dthyle
z) acide hexanedioque
m) hexanamide
3.
b)
a)
c)
+
d)
e)
f)
137 Chapitre 9 Section 9.4
3. (suite)
g)
h)
i)
j)
k)
l)
m)
n)
o)
p)
q)
r)
s)
t)
u)
v)
w)
+
x)
y)
z)
138 Chapitre 9 Section 9.4
4.
Formule Nom
a)
b)
c)
d)
e)
f)
g)
h)
a) acide palmitique
b) benzoate de benzyle
c) chlorure de 2-chloro-4-hydroxy-
benzoyle
d) acide 5-cyano-3-nitroheptanoque
e) 2-hydroxy-4-mthylpentanal
f) 3-mthyl-6-oxohept-4-noate
d'thyle
g) succinate de sodium
h) acide 2-oxopropanoque
(acide pyruvique)
+ +
Chapitre 10
LES ALDHYDES
ET LES CTONES
Synthse des aldhydes et des ctones
10.1, 10.2 et 10.3 partir de fonctions simples
1. a) + +
b)
c)
d)
Pd(S)
Cu
350 C
e) 2
MnO
2.
A
B
C
D
3. a) La butanone nest pas symtrique. Pour lobtenir par pyrolyse, il faudrait utiliser deux
acides carboxyliques diffrents (lacide actique et lacide propionique). Il y aurait donc
possibilit de former deux autres ctones: la pentan-3-one et lactone.
b) Le butan-2-ol :
4.
1)
2)
+
actone formaldhyde
, Zn
140 Chapitre 10 Section 10.4
Ractivit des aldhydes et des ctones
10.4 Addition nuclophile
1. a)
c)
2)
+
b) Aucune raction, le diol gminal qui pourrait se former est instable.
1)
2)
d)
A B C
2.
protection
de l'aldhyde
2
oxydation
(anhydre)
3. +
butan-2-one
(Acide ajout au
milieu ractionnel.)
4.
+
actophnone
141 Chapitre 10
Section 10.5
5. Raction de Cannizzaro avec le formaldhyde (petit aldhyde) pour obtenir un bon rende-
ment.
vanilline
+
1)
2)
KOH
+
formaldhyde
10.5 Disponibilit de l'hydrogne
1. a) Sur un aldhyde, il ny a quun seul carbone ; il y a donc formation dun seul aldol. Dans
une ctone, il peut y avoir deux carbones porteurs dhydrognes, ce qui a pour effet de
former plusieurs ctols.
b) Il faudrait choisir une ctone qui possde un hydrogne sur un seul des carbones .
2.
A
B
C
D
E
3. +
un aldol
2-mthylbutanal
142 Chapitre 10 Section 10.6
4.
Cu
350 C
2
NaOH
condensation aldolique
propan-1-ol
3-hydroxy-2-mthylpentanal
10.6 Oxydation des aldhydes et des ctones
1.
thanol acide actique
2. a)
b)
c)
par exemple:
par exemple:
Une ctone cyclique, par exemple:
10.7 Analyse qualitative des aldhydes et des ctones
1. a) Un driv est une substance solide obtenue par une raction spcifque un groupement
fonctionnel dans le but den dterminer le point de fusion. Un driv sert caractriser
un compos organique.
b) Oxime, phnylhydrazone et semicarbazone.
2. a) Cu
2
Q
. Il devient CuQ aprs raction. Il prend la forme dun prcipit rouge de Cu
2
O.
b) Le fructose est une ctone -hydroxyle ; il ragit donc avec la solution de Fehling.
3. En effectuant un test iodoforme avec de liode et de lhydroxyde de sodium. Un prcipit
jaune diodoforme prouve la prsence dune mthylctone.
4. Le benzaldhyde est mis en vidence par un test de Fehling, cest le seul aldhyde.
La cyclohexanone est identife parce quelle ne ragit pas au test iodoforme, les deux
autres ctones ragissent.
Lactone et la butan-2-one sont identifes en comparant le point de fusion dun driv,
oxime ou autre.
143 Chapitre 10 Exercices complmentaires
Exercices complmentaires
1. a)
b)
c)
d)
e)
f)
+
2. A
B
C
D
F
G
H
I
E
J
3. a) La spectroscopie IR permet de dtecter le butan-1-ol avec son absorption vers
3500 cm
-1
.
Le butanal donne un test de Fehling positif.
La butan-2-one donne un prcipit jaune au test iodoforme.
b) La spectroscopie IR permet de distinguer les deux alcools des autres composs (ils
absorberaient 3500 cm
-1
). Lacide pentanoque aussi se diffrencie des quatre autres
composs par son spectre IR (pics 2500-3000 cm
-1
et 1700 cm
-1
).
La pentan-2-one donne un test iodoforme positif ; lautre ctone, non.
On oxyde les deux alcools en ctones pour obtenir la pentan-2-one et la pentan-3-one ;
puis on procde comme pour la pentan-2-one.
144 Chapitre 10 Exercices complmentaires
4. A
B
C
D
E
5. a)
HCl
b) +
3-chloropentane
acide propanoque
c)
1)
2)
3-phnylpentan-3-ol
d) 2
MnO
actone
pentan-3-one
obtenu en b
6.
propan-1-ol
thanol
pentan-3-one
HBr
+
2)
Li
7. a)
b)
1)
2)
1)
2)
hexan-3-one
hexan-3-one
butanal
3-thylhex-2-ne
145 Chapitre 10 Exercices complmentaires
7. (suite)
c)
d)
hexan-3-one
1)
2)
hexan-3-one
hex-3-yne
chlorure de propanoyle
8. a)
cyclohexanol
cyclopentanone
b)
9.
C
D mme que A
pent-2-ne
A
B E
146 Chapitre 10 Exercices complmentaires
10.
+
2)
conc.
b)
Cu
350 C
2
KOH
benzonitrile
styrne
thanol
acide 3-oxobutanoque
a)
HBr
Mg
mthanol
c)
Cu
350 C
11. A
B
C
D
E
I
F
G
H
147 Chapitre 10 Exercices complmentaires
12.
HBr HCN
Mg
+
2)
1)
2)
MnO
Autre mthode:
thanol
Chapitre 11
LES ACIDES
CARBOXYLIQUES
ET LEURS DRIVS
tat physique et synthse des acides
carboxyliques
11.1 11.4 tat physique et synthse par...
1. Lacide benzoque forme des ponts hydrogne, le chlorure de benzoyle nen forme pas.
2. cause de la polarit et de la possibilit de former des ponts hydrogne avec leau, lacide
benzoque sera plus soluble dans leau que le benzoate dthyle.
3. Premirement, en passant par un nitrile ; deuximement, en passant par un Grignard.
Mg
1)
2)
NaCN
bromothane
acide propionique acide propionique
1 2
4.
K OH
+
+
butanoate d'isopropyle
+
+ +
+
150 Chapitre 11 Section 11.1 11.4
5.
1)
2)
2
conc.
b)
a)
NaOH
+
+
hexan-3-ol
butanone
c)
d)
Mg
HBr
propionitrile
thylne
e)
f)
+
propionate de mthyle ou par saponification
suivie d'une acidification
propionamide
acide propionique
6. A
B
C
D
7.
..
.
.
Cl
+
+
+
+ +
chlorure d'actyle
acide actique
..
.
.
151 Chapitre 11 Section 11.5 11.8
Ractivit des acides carboxyliques
11.5 11.8 Transformation des acides carboxyliques
1.
b)
a)
c)
d)
e)
+
Aucune raction; il se dissocie
lgrement:
+
2. c > b > a >> d
Lacide c est le plus fort parce que le chlore est plus prs du carboxyle.
Lacide b est un peu plus faible que c parce que le chlore est plus loign du carboxyle, mais
plus fort que a parce que le chlore est plus lectrongatif que le brome.
Lacide d est beaucoup plus faible que les trois autres parce que leffet inductif rpulsif du
propyle nuit lacidit.
3. a) Rendre la solution basique pour former le sel.
b) Acidifer le milieu.
+ NaOH HCl
sel soluble peu soluble
4. Cest une raction dquilibre dont la valeur de Kc est petite ; donc, les rendements sont
faibles.
5. A
B
C
D
152 Chapitre 11 Section 11.9
Drivs d'acides carboxyliques
11.9 Substitution nuclophile sur un carbonyle
1.
Cl
+
+
.
.
+
+
+
chlorure de benzoyle
benzamide
.
.
2. A
B
C
D
+
E
F
G
H
I
3.
+
+
+
+
actate de mthyle
anhydride actique mthanolate de
sodium
11.10 11.14 tat physique, synthse et ractivit
1. Avec les chlorures dacides, il faut toujours travailler dans un milieu parfaitement anhydre ; ils
shydrolysent trs facilement.
2. Les fruits, les plantes et les animaux contiennent des esters sous diffrentes formes: armes,
huiles et graisses.
3. Un acide gras possde souvent 16 18 carbones et forme la structure de base dun lipide
(gros ester). Lacide palmitique en est un exemple:
4. Un savon est un sel dacide gras (gnralement de sodium ou de potassium).
acide palmitique
153 Chapitre 11 Section 11.10 11.14
5. La molcule dactate de sodium est trop courte pour constituer un savon. Bien sr, cest un
sel dacide carboxylique mais pour agir comme savon, il lui faut une longue chane carbone
(16 18 carbones) pour lui permettre de dissoudre les graisses (les salets insolubles dans
leau). (Pour plus de dtails, voir chapitre 15).
6. A
B
+
C
D
F
G
+
E
H
+
7. a)
HBr
Mg
EtOH
1)
2)
thanol
propionate d'thyle
b)
anhydride actique
c)
obtenu en (b) actamide
2 2
8.
+
aspirine
2-mthylphnol
2 2
154 Chapitre 11 Section 11.15 11.16
Composs dicarbonyls
11.15 et 11.16 Les acides dicarboxyliques et les -dicarbonyls
1. Lacide malonique est plus acide cause de la prsence dune deuxime fonction acide
carboxylique exerant un effet inductif attractif assez fort pour infuencer lacidit de lautre
fonction acide.
2.
F
D
E
C
A
B
L
J
K
I
G
H Na
+
3.
+
EtO Na +
+
+
2)
+ EtOH
une -dictone
actophnone
155 Chapitre 11 Exercices complmentaires
Exercices complmentaires
1.
F
D
E
C
B
Q
O
P
N
L
M
A
+
G
H
I
J
K
S
T
U
R
2.
thylne
acide succinique
NaCN
b)
a)
conc.
HBr
2)
3)
1)
Mg
butan-1-ol
acide 2-mthylbutanoque
156 Chapitre 11 Exercices complmentaires
2. (suite)
c)
1)
2)
350C
Cu
propan-1-ol
butan-2-ol
d)
EtO Na
Na
EtOH
+
+
EtOH
Na
EtO Na
+
acide
malonique
acide hexanoque
thanol
1-bromobutane
+
benzne
2)
3)
1) Mg
acide benzoque
e)
3.
b)
a)
c)
4. Placer le mlange dans une ampoule dcanter avec de lther ; tout est soluble dans
lther. Ajouter une solution aqueuse dhydroxyde de sodium et agiter. Lacide benzoque se
transforme en sel et passe dans la phase aqueuse. Rpter deux fois et runir les phases
aqueuses. Acidifer la phase aqueuse avec de lacide chlorhydrique pour rcuprer lacide
benzoque, il prcipitera. Filtrer pour isoler lacide benzoque. Scher la phase thre sur du
sulfate de magnsium, fltrer, puis vaporer lther pour isoler le naphtalne solide.
157 Chapitre 11 Exercices complmentaires
5.
F
D
E
C
B
K
L
J
H
I A
G
M
O
+
N
O
mme que C
mme que A
6.
thanol
2)
3)
1) Mg
b)
a)
HBr
EtOH
propionate d'thyle
c)
obtenu en (a)
Mg
2)
1)
obtenu en (a)
3-thylpentan-3-ol
obtenu en (a)
conc.
dilu
propan-2-ol
158 Chapitre 11 Exercices complmentaires
6. (suite)
d)
e)
obtenu en (c)
2)
1) HBr
Mg
Cu 300C
2)
1)
hexan-3-one
obtenu en (c)
f)
2-mthylpropanoate d'isopropyle
2)
1)
HBr
Mg
1)
2)
Cu
300C
NaOH
3-hydroxybutanal
g)
obtenu en (f)
+
2)
obtenu en (b)
conc.
but-2-ne
h)
EtOH
2
EtO Na
+
3-oxobutanoate d'thyle
1)
2)
159 Chapitre 11 Exercices complmentaires
7.
b)
a)
Na OH
+
+
+
+
anhydride
succinique
+
+
+
acide succinique
.
.
..
Chapitre 12
LES GLUCIDES
12.1 Gnralits
1. C
12
H
22
O
11
et C
6
H
12
O
6
sont des glucides.
2. Les glycraldhyde :
3. Saccharose, glucose, fructose, cellulose, etc.
Classication et structure
12.2 12.4 Classication et structure
1.
a) un ctohexose,
le D-fructose
b) un oside dont l'aglycone
est un groupe mthyle
c) un hexose qui contient
un hmiactal
d) un -pyranose
e) un disaccharide,
le saccharose
162 Chapitre 12 Section 12.2 12.4
2. La mutarotation est la proprit davoir un pouvoir rotatoire variable dans le temps.
3. Dans la forme du glucose, le OH sur le carbone 1 (anomre) est en position quatoriale ;
donc, avec le minimum dencombrement strique.
4. Un carbone anomre est celui sur lequel il y a une fonction hmiactal ou actal.
Exemple:
carbone anomre
5. a)
b)
c)
6. a) -D-allopyranose
b) -L-galactopyranose.
7. a) Vrai ; d) vrai ;
b) faux, il y a un hmiactal ; e) vrai ;
c) faux ; f) vrai mais peu stable.
8. a et c (D-allose)
b, e et g (D-mannose)
d et f (L-mannose)
h (D-fructose)
163 Chapitre 12 Section 12.5
Les oses (monosaccharides)
12.5 Ractivit du carbonyle
1.
a)
b)
c)
a) b)
c)
A. Benzaldhyde B. D-galactose
+
d)
e)
f) +
e)
+
d)
f) le D-galactose, avec le ,
donne:
164 Chapitre 12 Section 12.5
2. a)
NaCN
+
D-throse
D-xylose
1)
2)
b) En continuant la synthse de Kiliani avec les deux isomres nitriles, on obtiendrait le
D-lyxose en plus du D-xylose.
c) Par la synthse de Kiliani, il est impossible dobtenir le D-ribose partir du D-throse
puisquils nont pas la mme confguration sur les deux derniers carbones asymtriques.
3.
L-gulose L-xylose
4. Le D-allose ou le D-altrose.
5. Le D-galactose.
6. Un sucre est rducteur sil ragit positivement avec une solution de Fehling. Il doit possder
une fonction aldhyde ou une fonction ctone -hydroxyle.
7. a)
b) Le D
ou
le L-rythrose:
L-rythrose D-rythrose
8. Seul le compos c est mso .
165 Chapitre 12 Section 12.6
9. a)
b)
c)
D-glucose
D-mannose
D-fructose
12.6 Ractivit des fonctions alcool
1. a) b)
c)
2. a) phnyl- -D-gulopyranoside
b) pentaactate du -L-idopyranose.
166 Chapitre 12 Section 12.7 et 12.8
3. a)
C anomre
b)
C anomre
a)
b) Ils ne sont pas rducteurs. Leur carbone anomre est bloqu par lactal ; donc, pas
dquilibre avec la forme aldhydique.
Les osides
12.7 et 12.8 Les htrosides et les holosides
1. a)
b) La maltase parce que laglycone est en position .
2. Un holoside est un oside constitu de deux ou de plusieurs oses.
3. Le lien des deux oses doit se faire au niveau de loxygne des deux carbones anomres de
faon ce quil ny ait pas dhmiactal sur aucun des oses.
4. a) Elles sont toutes les deux formes dunits D-glucose.
b) Dans la cellulose, les liens entre les units glucose sont de type alors quils sont de
type dans lamylose.
c) La cellulose peut tre hydrolyse par lmulsine.
5. Le D-glucose et le D-fructose.
6.
actal
hmiactal C anomre
C anomre
a)
b) Lmulsine.
167 Chapitre 12 Exercices complmentaires
6. (suite)
c)
7. Dans lamylopectine, il y a deux sortes de liens entre les glucoses:
liens 1,4 pour former les chanes,
liens 1,6 pour relier les chanes par le carbone 1 en bout de chane et le carbone 6
dune chane voisine.
8. partir de la cellulose, on peut prparer: la nitrocellulose, lactate de cellulose, la cello-
phane et la rayonne viscose.
9. a) Le sucre inverti est un mlange quimolculaire de D-glucose et de D-fructose obtenu par
hydrolyse du saccharose.
b) Le sucre inverti est globalement plus sucr que le saccharose cause de la prsence du
fructose, plus sucr.
c) Le sucre inverti ragit trs bien avec la solution de Fehling puisque le D-glucose et le
D-fructose sont deux sucres rducteurs.
10. Cest le OH axial en position 4 du pyranose de gauche (le galactose) qui empche le lactose
de former de longues chanes comme le fait si bien la cellobiose. En sallongeant, le lactose
aurait tendance former des petits cycles de quelques units de glucose seulement.
Exercices complmentaires
1.
a) b) c)
d) e)
168 Chapitre 12 Exercices complmentaires
2. a) Inactif et possde un total de 10 stroisomres ;
b) actif et possde un total de 32 stroisomres ;
c) actif et possde un total de 16 stroisomres ;
d) actif et possde un total de 8 stroisomres ;
e) actif et possde un total de 32 stroisomres.
3.
D-ribose
4. D-altrose, D-glucose, D-gulose, D-idose, D-mannose, D-talose.
5.
A
B
C D E
6.
A B C
7.
A
B ( ou )
169 Chapitre 12 Exercices complmentaires
7. (suite)
E
C
D
F G
(L-gulose)
ou
8. a) Par synthse de Kiliani:
170 Section x.x Chapitre 12
8. (suite)
b) Faux, la fonction aldhyde du carbone 1 rend le L-xylose asymtrique.
Le L-gulose possde la mme
la mme configuration que le
L-idose sur les carbones 3, 4 et 5.
9. a)
c)
10.
Chapitre 13
LES AMINES
13.1 Gnralits
1. a) 3-aminobutanal
b) N-tert-butylaniline ou tert-butylphnylamine
c) N-mthyl-4-amino-3-mthylbutan-2-one
d) N,N-dimthylthanamine ou thyldimthylamine
e) pent-3-n-2-amine
f) 4-aminobenzoate de mthyle ou p-aminobenzoate de mthyle
g) acide 2-aminopropanoque
h) 2-aminophnol ou o-aminophnol
2.
b)
c)
d)
a)
3. La cyclohexylamine est plus volatile parce quune amine forme des ponts hydrogne moins
forts que ceux des alcools.
cyclohexanol
b 161C
cyclohexylamine
b 134C
4.
> >> >
amine
secondaire
amine
primaire
amines aromatiques avec rsonance
d b c a
5.
+
A
B
C
D NaCl
6. Laniline passera dans leau en ajoutant de lacide chlorhydrique:
+
+ HCl
aniline sel d'ammonium
dissoci dans l'eau
172 Chapitre 13 Section 13.2 13.4
Synthse des amines
13.2 13.4 Synthse partir de ...
1. A
B
E
F
C
D
G
H
+
2.
b)
a)
1-bromopropane en excs
+
propan-1-amine
propanal
propan-1-amine
ou
thylne propan-1-amine
HCN
c)
d)
propan-1-amine
acide propanoque
173 Chapitre 13 Section 13.5 13.8
3.
KOH +
KOH
+
phtalate de
potassium
isopropylamine
2-chloropropane
4. La dgradation de Hofmann permet dobtenir une amine primaire (uniquement) possdant un
carbone de moins que lamide de dpart.
Ractivit des amines
13.5 13.8 Substitution, limination, sels de diazonium et analyse qualitative
1.
aniline
+
HCl
phnol
b)
a)
c)
d)
+
obtenu en (a) acide benzoque
bromobenzne
benzamide
KCN
+
obtenu en (a)
HBr
obtenu en (b)
e)
obtenu en (c)
Mg
1)
2)
oxyde d'thylne
conc.
styrne
f)
+
obtenu en (a) fluorobenzne
174 Chapitre 13 Section 13.5 13.8
2.
B
A
E
F
C
D
G
+
I
+
mme que E
I
H
3.
b)
a) le chlorure de benznesulfonyle.
thylmthylamine
+
prcipit
le prcipit demeure
NaOH
Exercices complmentaires
1.
b)
a)
acide benzoque
aniline
thanol
ou
Cu
350C
thylamine
NaOH
ou
en excs
175 Chapitre 13 Exercices complmentaires
1. (suite)
c)
d)
obtenu en (b) benzylamine
aniline
Sn
HCl
benzne
2. a) dithylamine ou N-thylthanamine
b) chlorure de trimthylphnylammonium
c) benzylphnylamine ou N-benzylaniline
d) N,N-dimthyl-3-aminobutan-1-ol
e) 2-nitroaniline ou o-nitroaniline
3. A
B
J
C
D
K
L
+
M
+
E
F
G
H
+
N
I
176 Chapitre 13 Exercices complmentaires
4.
nitrobenzne
Sn
HCl
propne
dilu
isopropylamine
b)
a)
bromobenzne
+
HBr
HCl
c)
avec l'amine
en excs
1-bromopropane
N-mthylpropan-1-amine
d)
+
KCN
HCl NaOH
benzamide
benzonitrile
en excs
177 Chapitre 13 Exercices complmentaires
4. (suite)
e)
+
KCN
HCl
p -toluidine
acide p -phtalique
Chapitre 14
LES AMINOACIDES
ET LES PROTINES
Les aminoacides
14.1 Prsentation et structure
1. a) Cest le groupe G de laminoacide
si G est neutre, laminoacide est neutre ;
si G contient une fonction acide, laminoacide est acide ;
si G contient une fonction amine, laminoacide est basique.
b)
acide aspartique
Voir tableau 14.1
2. La glycine est optiquement inactive: elle na pas de carbone asymtrique.
3. Un aminoacide essentiel est celui dont lorganisme ne peut faire la synthse.
4. Cet acide nest pas un -aminoacide.
5. Un aminoacide L est celui dont la fonction amine est gauche dans sa reprsentation de
Fischer.
6. Bien quionique, le zwitterion ne se dissocie pas dans leau ; cest dailleurs ce qui explique
sa faible solubilit. Quant au chlorure de sodium, il se dissocie compltement et est trs
soluble (quoique sa solubilit soit limite environ 40 g / 100 g deau 100 C).
7 La valine :
8. a)
forme anionique
pH 9,00
forme cationique
pH 1,00
9.
forme anionique
pH 7,00
180 Chapitre 14 Section 14.2 14.3
10. Ajouter une base jusqu pH 5,98. La leucine prcipite et on fltre.
leucine
forme cationique
pH 2.00
leucine
zwitterion
pH 5,98
Synthse des aminoacides
14.2 et 14.3 Synthse par substitution et par addition
1. a)
Cu
350 C
mthanol
HCN
glycine
b)
acide actique
glycine
P
Ractivit des aminoacides
14.4 14.6 Caractre acidobasique, formation d'esters et d'amides
1.
Ala-Gly-Val
Gly-Val Val-Gly
2.
Gly-Gly
Val-Val
181 Chapitre 14 Section 14.7 14.10
3. a)
valine
b) Lester ne peut pas former de zwitterion caractre ionique.
4
liaison peptidique
Gly-Ala
Les protines
14.7 14.10 Synthse, analyse et ractivit
1.
anhydride
phtalique
dilu
Phe-Ser
srine
phnylalanine
2. Lacide chlorhydrique.
3. La chromatographie sur couche mince, sur papier ou par change dions.
182 Chapitre 14 Exercices complmentaires
4.
Ala-Ser
5. a)
+ +
deux acylhydrazides amins
valine
b) Cette raction sert identifer laminoacide C-terminal, celui de droite, la valine.
6. TyrAspProGluIle.
Exercices complmentaires
1.
2.
2-phnylthanol
Cu
350 C
phnylalanine
3.
cation
addition
d'un acide
srine
pH 5,68
addition
d'une base
anion
183 Chapitre 14 Exercices complmentaires
4. X:
A:
PheAlaSer
B: C:
D:
5. a) CuSO
4
, ractif de Fehling ; il forme un prcipit rouge de Cu
2
O avec un sucre rducteur,
un aldhyde ou une ctone -hydroxyle.
b) le dinitrofuorobenzne forme un complexe avec laminoacide N-terminal dun peptide.
c) lhydrazine coupe les liaisons peptidiques pour former des acylhydrazides amins et per-
met ainsi didentifer laminoacide C-terminal dun peptide.
d) ZnCl2, HCl, est le ractif de Lucas qui permet de distinguer les alcools les uns des autres
1, 2 et 3 par la vitesse de raction (aspect laiteux de la suspension du chlorure form) ;
raction rapide avec un alcool tertiaire.
e) le sodium, Na, permet de distinguer les uns des autres les alcools 1, 2 et 3. La raction
(dgagement dhydrogne) est rapide avec un alcool primaire.
f) I
2
, NaOH : sert former liodoforme, CHl
3
(prcipit jaune), partir dune mthylctone.
g) AgNO3 a la mme utilit que CuSO
4
, mais il forme un miroir dargent (test de Tollens) au
lieu dun prcipit rouge.
Chapitre 15
LES LIPIDES
1. Lacide palmitique : CH
3
[CH
2
]
14
COOH
Lacide starique: CH
3
[CH
2
]
16
COOH
2. a) Lindice diode sert valuer le degr dinsaturation dun lipide.
b) Raction de liode molculaire sur une liaison double :
C C
I
2
C C
I
I
3. a) Ce sera une huile parce quil est trs insatur.
b) Puisquil contient plusieurs liaisons doubles, son indice diode sera trs lev.
4.
CH
2
O C
O
C
17
H
33
CH O C
O
C
17
H
33
CH
2
O C
O
C
17
H
33
olate de glycryle
5. Parce que la masse molaire globale des esters dacides gras, principalement saturs, conte-
nus dans le beurre (myristate, palmitate, starate) et, en tenant compte aussi des petits
esters butanoate et hexanoate, est plus leve que celle dune huile. La prsence de liaisons
doubles, comme dans une huile, conduit ncessairement une masse molaire globale moins
leve.
6. Dans un savon, la portion polaire est toujours un carboxylate alors que dans un dtergent,
cette partie polaire est autre chose comme un sulfate, un phosphate, etc.
7. Non, lactate de sodium CH
3
CO
2
-
Na
+
contient bel et bien un carboxylate comme dans
un savon, mais sa partie non polaire (CH
3
) est trop courte pour former une micelle avec les
huiles ou les graisses.
8. a)
CH
2
O C
O
C
15
H
31
CH O C
O
C
15
H
31
CH
2
O C
O
C
15
H
31
palmitate de glycryle
186 Chapitre 15
8. (suite)
b) Formation dun savon:
CH
2
O C
O
C
15
H
31
CH O C
O
C
15
H
31
CH
2
O C
O
C
15
H
31
3 KOH
CH
3
[CH
2
]
14
C
O
O
-
K
+
3
CH
2
OH
CH OH
CH
2
OH
+
palmitate de glycryle
palmitate de potassium glycrol
(savon)
c) Formation dun dtergent:
CH
2
O C
O
C
15
H
31
CH O C
O
C
15
H
31
CH
2
O C
O
C
15
H
31
palmitate de glycryle
rduction
OH
OH
OH
O SO
3
H
O SO
3
H
O SO
3
H
H
2
SO
4
NaOH
CH
3
[CH
2
]
15
O S
O
O
O
-
Na
+
3
un dtergent de type sulfate
9. a) Les crides.
b) Oui, par saponifcation, la cire dabeille C
15
H
31
COOC
30
H
61
donnerait un palmitate, un
carboxylate longue chane, donc un bon savon.
10. a) Lacide phosphorique.
b) La sphingosine.
11. a) Lisoprne : CH
2
C
CH
3
CH CH
2
b) Tous les strodes possdent ces 4 cycles:
12. Le cholestrol, la cortisone, lacide cholique et bien dautres. (voir section 15.5)
13. a) Vrai, son indice diode sera lev.
b) Faux. Comparer leur structure respective en 15.2.2 et au tableau 15.3.
c) Vrai, cest 3 fois le nombre de carbones de lisoprne (3 X 5 = 15).
14. Voir la description la section 15.2, mcanisme daction dun savon.
187 ANNEXE 1
Alcne
Alcyne
Addition
driv 1,2-dihalogn
driv monohalogn
alcool(addition deau)
cyanhydrine(addition de HCN)
halohydrine
Oxydation (diminution du nombre dH) :
- sans rupture de chane carbone
- avec rupture de chane carbone :
acides, ctones et/ou
aldhydes, ctones et/ou
Rduction (addition dH) alcane
alcane (rduction totale)
nol ctone ou aldhyde
alcne (rduction partielle)
Addition par hydroboration
alcool, ROH
Alcyne
(terminal)
Addition
dihalogn gmin
ttrahalogn
Raction acidobasique
actylure de sodium, RUCICWNaQ
RUCICUR
CuC
RUCICUH
Oxydation
acides carboxyliques
Substrat Ractions et produits
Alcane
RUH
Substitution radicalaire
halognures divers
pyrolyse (raffinage du ptrole)
rupture de liaisons CC :
alcne + alcane plus courts
dshydragnation:
alcne + H
2
isomrisation:
alcanes ramis:
(augm. de lindice doctane)
cyclisation:
benzne/dr.benzniques + H
2
Combustion
Annexe1 Substrats, ractifs, ractions et produits
H
2 avec Ni, Pt, ou Pd
KMnO
4 en solution dilue diol
O
3 en milieu rducteur(Zn/ H
CO +H
2
O
2
CO +H
2
O
2
O)
2 H
2
avec Ni, Pt, ou Pd
1 H
2
avec Pd(Lindlar)
X
2
seul
HX seul
H
2
O/H
3
O
+
HCN seul
KMnO
4 conc. ou K
2
Cr
2
O
7
ou O
3
en milieu oxydant(H
2
2
O
2
/NaOH)
1) BH
3
2) H
2
O
2
/NaOH
HOCl
2 HX
2 X
2
NaNH
2
H
2
O/H
2
SO
4
/HgSO
4
Ractifs
X
2
+ nergie (h )
T, P leves + catalyseurs
O
2
+ tincelle ou T, P levs
Rgle
de
Markovnikov
KMnO
4
conc. ou O
3
188 ANNEXE 1
ther
Ractif
de
Grimard
Oxydation
Substitution nuclophile (aprs protonation)
Substitution nuclophile (aprs protonation)
RX
RCl
RI + RI
OH + I
ROR
ROH
ROR
RMgX
OR
ROCH CH OH
Raction acidobasique
Substitution nuclophile
hydrocarbure
hydrocarbure
Addition
ctone
alcool
acide carboxylique
Substrat Ractions et produits
Annexe 1 Substrats, ractifs, ractions et produits (suite)
HA
RCHO, RCOR, RCOOR,
RCOCl, anhydride, oxyde dthylne
RCN
CO
RX
Ractifs
Alcool
limination deau
alcne
alcane
ester
Raction doxydorduction
alcoolate, RO
Na ou RO K + H
2
Raction acidobasique (rduction)
Raction de S
N
ROH 1 acide carboxyliqye
ROH 2 ctone tous les oxydants
aldhyde
H
2
SO
4
, ou H
3
PO
4
(anhydres)
Na ou K
RMgX
RCOOH + acide (H SO )
Cu/300C ou CrO
3
KMnO
4
conc. ou K
2
2 4
Cr
2
O
7
HCl, PCl
3
, SOCl
2
2
ou ZnCl
2
2 2
/HCl
ROH/H
+
ROH/H
+
sur oxyde dthylne
HX
HI
HI
189 ANNEXE 1
190 ANNEXE 1
Amine
Hydrolyse acide
Saponification
Rduction
Substrat Ractions et produits
Acide
carboxylique
Ester
RUCUOH
Rupture de COH
Substitution sur le carbone
Acidobasique
Substitution nuclophile
Acidobasique
RCOO + H
3
O
RCOO Na + H
2
O
RUCOUCl (chlorure dacyle)
RUCHBr + COOH
RUCOOH + RUOH
RCOO Na + RUOH
RUOH + RUOH
RUNH
4
+ OH
amine 2, 3 ou sel quaternaire
amide
alcne (rgle de Hofmann)
sel de diazonium, RUN
2
Cl
sel quaternaire: RUN(CH
3
)
3
I
RUNH
4
X
H
2
SO
4
/H
2
O
H
2
O
H
2
O/Ag
2
O + chaleur
NaNO
2
/HCl
HX
RUX
CH
3
UI (en excs)
RCOCl ou anhydride
Br
2
/P
4
NaOH/H
2
O ou KOH/H
2
O
LiAlH
4
RCOOR (estrification)
RH + CO
2
(difficile ; facile avec
carbonyle en ou en )
Annexe 1 Substrats, ractifs, ractions et produits (suite)
Ractifs
H
2
O
PCl
3
, PCl
5
ou SOCl
2
limination partir de RUN(CH
3
)
3
I
Diazotation dune amine 1
ROH/HQ
chauffage haute temprature
NaOH
Q
Q
Q
Q
Q
Q
Q
W
W
W
W
W
W
W
W
u
O
RUCUOUR
u
O
RUNH
2
191 ANNEXE 1
Substrat Ractions et produits
Benzne
Composs
benzniques
Drivs chlors
benzniques
Substitution lectrophile :
Rduction totale
Oxydation
Fusion alcaline
Rduction totale
cyclohexane (C
6
H
12
)
driv du cyclohexane
driv benznique acide (COOH)
phnol ou driv phnolique
introduction de NO
2
(nitration)
introduction de SO
3
H (sulfonation)
introduction de X (halognation)
introduction de R (alkylation)
introduction de RUCuO (acylation)
H
2
avec Ni (Raney)
K
2
Cr
2
O
7
/KMnO
4
1) NaOH (350C), 2) H
3
O
Annexe 1 Substrats, ractifs, ractions et produits (suite)
Ractifs
3 H avec Ni (Raney)
2
NO
2
venant de HNO
2
/H
2
SO
4
HSO
3
venant de SO
3
/H
2
SO
4
X venant de X
2
/AlX
3
ou X
2
FeX
3
R venant de RUX/AlX
3
RUCuO venant de RCOX/AlX
3
Q
Q
Q
Q
Q
Q
R
193 ANNEXE 2
Acides carboxyliques
et drivs
Produits
chlorure dacyle
groupe amovible A:
groupe amovible A:
groupe amovible A:
groupe amovible A:
groupe amovible A:
* Raction favorise par une catalyse acide.
anhydride
ester
amide
acide carboxylique
UCl
acide carbox: RCOOH
sel dacide: RCOO Na
ester: RCOOR + H
2
O
ester: RCOOR
anhydride
amide
amide
Substitution nuclophile sur le carbonyle des acides Annexe 2
carboxyliques et de leurs drivs: ractifs et produits
Ractifs
H
2
O
Na OH
RUOH
RO Na
RCO
2
Na
NH
3
ou RUNH
2
Na NH
2
W
W
W
W
W
U U CU O
U
UNH
2
ou UNHR
OR
R
u
O
UCU R A
u
O
UOH
Q
Q
Q
acides: RCOOH + RCOOH
sel dacide: RCOO Na
ester: RCOOR
ester: RCOOR
amide + RCOOH
amide + RCOOH
acide carbox: RCOOH
et alcool ROH
un nouvel ester: RCOOR +
ROH (aprs acidif.)
un nouvel ester: RCOOR +
ROH (aprs acidif.)
un amide + ROH
un amide + ROH
acide carbox.: RCOOH
ester: RCOOR
amide
chlorure dacide
sel dacide: RCOO Na
sel dacide RCOO Na et
alcool ROH
W Q
Q
Q
Q
Q
H
2
O
H
2
O*
H
2
O*
Na OH
RUOH*
RUOH*
RO Na
NH
3
ou RUNH
2
NH
3
ou RUNH
2
NH
3
ou RUNH
2
(difficile)
PCl
3
, PCl
5
ou SOCl
2
Na NH
2
W
W
W
W
W
Q
Na OHW Q
Na OH
RUOH*
W Q
Q
RO Na W Q
Q
Na NH
2
W Q
194 Table internationale des masses atomiques
Actinium
Aluminium
Amricium
Antimoine
Argent
Argon
Arsenic
Astate
Azote
Baryum
Berklium
Bryllium
Bismuth
Bohrium
Bore
Brome
Cadmium
Calcium
Californium
Carbone
Crium
Csium
Chlore
Chrome
Cobalt
Cuivre
Curium
Dubnium
Dysprosium
Einsteinium
Erbium
tain
Europium
Fer
Fermium
Fluor
Francium
Gadolinium
Gallium
Germanium
Hafnium
Hassium
Hlium
Holmium
Hydrogne
Indium
Iode
Iridium
Krypton
Lanthane
Lawrencium
Lithium
Lutcium
Magnsium
Manganse
Li
Lu
Mg
Mn
89 227,028
13 26,982
95 243
51 121,757
47 107,868
18 39,948
33 74,922
85 210
7 14,007
56 137,327
97 247
4 9,012
83 208,980
107 262
1 1 8 , 0 1 5
35 79,904
48 112,411
20 40,078
98 251
6 12,011
58 140,15
55 132,905
17 35,453
24 51,996
27 58,933
29 63,546
96 247
105 262
66 162,50
99 252
68 167,26
0 1 7 , 8 1 1 0 5
63 151,965
26 55,847
100 257
9 18,998
87 223
64 157,25
31 69,723
32 72,61
72 178,49
108 265
2 4,002
67 164,930
1 1,008
49 114,82
53 126,904
77 192,22
36 83,80
57 138,906
103 260
109 268
101 258
80 200,59
42 95,94
60 144,24
10 20,180
93 237,048
28 58,693
41 92,906
102 259
79 196,967
76 190,2
8 15,999
46 106,42
15 30,974
78 195,08
82 207,2
94 244
84 209
19 39,098
59 140,907
61 145
91 231,036
88 226,025
86 222
75 186,207
45 102,906
37 85,468
44 101,07
104 261
62 150,36
21 44,956
106 263
34 78,96
14 28,086
11 22,990
16 32,066
38 87,62
73 180,948
43 98
52 127,60
65 158,925
81 204,383
90 232,038
69 168,934
22 47,88
74 183,85
92 238,029
23 50,942
54 131,29
70 173,04
39 88,90
30 65,39
40 91,22
Meitnerium
Mendelevium
Mercure
Molybdne
Nodyme
Non
Neptunium
Nickel
Niobium
Noblium
Or
Osmium
Oxygne
Palladium
Phosphore
Platine
Plomb
Plutonium
Polonium
Potassium
Prasodyme
Promthium
Protactinium
Radium
Radon
Rhnium
Rhodium
Rubidium
Ruthnium
Rutherfordium
Samarium
Scandium
Seaborgium
Slnium
Silicium
Sodium
Soufre
Strontium
Tantale
Techntium
Tellure
Terbium
Thallium
Thorium
Thullium
Titane
Tungstne
Uranium
Vanadium
Xnon
Ytterbium
Yttrium
Zinc
Zirconium
Mt
Md
Hg
Mo
Nd
Ne
Np
Ni
Nb
No
Au
Os
O
Pd
P
Pt
Pb
Pu
Po
K
Pr
Pm
Pa
Ra
Rn
Re
Rh
Rb
Ru
Rf
Sm
Sc
Sg
Se
Si
Na
S
Sr
Ta
Tc
Te
Tb
Tl
Th
Tm
Ti
W
U
V
Xe
Yb
Y
Zn
Zr
Nom Symbole
Numro
atomique
Masse
atomique
Nom Symbole
Numro
atomique
Masse
atomique
Ac
Al
Am
Sb
Ag
Ar
As
At
N
Ba
Bk
Be
Bi
Bh
B
Br
Cd
Ca
Cf
C
Ce
Cs
Cl
Cr
Co
Cu
Cm
Db
Dy
Es
Er
Sn
Eu
Fe
Fm
F
Fr
Gd
Ga
Ge
Hf
Hs
He
Ho
H
In
I
Ir
Kr
La
Lr
3 6,941
71 174,9
12 24,305
25 54,938
Table internationale des masses atomiques
195 Tableau priodique des lments
1
H
1
.
0
0
8
2
H
e
4
.
0
0
3
L
i
6
.
9
4
4
B
e
9
.
0
1
5
B
1
0
.
8
1
6
C
1
2
.
0
1
1
7
N
1
4
.
0
1
8
O
1
6
.
0
0
9
F
1
9
.
0
0
1
0
N
e
2
0
.
1
8
1
1
N
a
2
2
.
9
9
1
2
M
g
2
4
.
3
1
1
3
A
l
2
6
.
9
8
1
4
S
i
2
8
.
0
9
1
5
P
3
0
.
9
7
1
6
S
3
2
.
0
7
1
7
C
l
3
5
.
4
5
1
8
A
r
3
9
.
9
5
1
9
K
3
9
.
1
0
2
0
C
a
4
0
.
0
8
2
1
S
c
4
4
.
9
6
2
2
T
i
4
7
.
8
8
2
3
V
5
0
.
9
4
2
4
C
r
5
2
.
0
0
2
5
M
n
5
4
.
9
4
2
6
F
e
5
5
.
8
5
2
7
C
o
5
8
.
9
3
2
8
N
i
5
8
.
6
9
2
9
C
u
6
3
.
5
5
3
0
Z
n
6
5
.
3
9
3
1
G
a
6
9
.
7
2
3
2
G
e
7
2
.
6
1
3
3
A
s
7
4
.
9
2
3
4
S
e
7
8
.
9
6
3
5
B
r
7
9
.
9
0
3
6
K
r
8
3
.
8
0
3
7
R
b
8
5
.
4
7
3
8
S
r
8
7
.
6
2
3
9
Y
8
8
.
9
1
4
0
Z
r
9
1
.
2
2
4
1
N
b
9
2
.
9
1
4
2
M
o
9
5
.
9
4
4
3
T
c
(
9
8
)
4
4
R
u
1
0
1
.
0
7
4
5
R
h
1
0
2
.
9
1
4
6
P
d
1
0
6
.
4
2
4
7
A
g
1
0
7
.
8
7
4
8
C
d
1
1
2
.
4
1
4
9
I
n
1
1
4
.
8
2
5
0
S
n
1
1
8
.
7
1
5
1
S
b
1
2
1
.
7
6
5
2
T
e
1
2
7
.
6
0
5
3
I
1
2
6
.
9
0
5
4
X
e
1
3
1
.
2
9
5
5
C
s
1
3
2
.
9
1
5
6
B
a
1
3
7
.
3
3
5
7
L
a
*
1
3
8
.
9
1
7
2
H
f
1
7
8
.
4
9
7
3
T
a
1
8
0
.
9
5
7
4
W
1
8
3
.
8
5
7
5
R
e
1
8
6
.
2
1
7
6
O
s
1
9
0
.
2
7
7
I
r
1
9
2
.
2
2
7
8
P
t
1
9
5
.
0
8
8
0
H
g
2
0
0
.
5
9
8
1
T
l
2
0
4
.
3
8
7
9
A
u
1
9
6
.
9
7
8
2
P
b
2
0
7
.
2
8
3
B
i
2
0
8
.
9
8
8
4
P
o
(
2
1
0
)
8
5
A
t
(
2
1
0
)
8
6
R
n
(
2
2
2
)
8
7
F
r
(
2
2
3
)
8
8
R
a
2
2
6
.
0
3
8
9
A
c
(
2
2
7
)
1
0
4
R
f
(
2
6
1
)
1
0
5
D
b
(
2
6
2
)
1
0
6
S
g
(
2
6
6
)
1
0
7
B
h
(
2
6
4
)
1
0
8
H
s
(
2
7
7
)
1
0
9
M
t
(
2
6
8
)
*
5
8
C
e
1
4
0
.
1
2
A
c
t
i
n
i
d
e
s
L
a
n
t
h
a
n
i
d
e
s
5
9
P
r
1
4
0
.
9
1
6
0
N
d
1
4
4
.
2
4
6
1
P
m
(
1
4
5
)
6
2
S
m
1
5
0
.
3
6
6
3
E
u
1
5
1
.
9
7
6
4
G
d
1
5
7
.
2
5
6
5
T
b
1
5
8
.
9
3
6
6
D
y
1
6
2
.
5
0
6
7
H
o
1
6
4
.
9
3
6
8
E
r
1
6
7
.
2
6
6
9
T
m
1
6
8
.
9
3
7
0
Y
b
1
7
3
.
0
4
7
1
L
u
1
7
4
.
9
7
9
0
T
h
2
3
2
.
0
4
9
1
P
a
2
3
1
.
0
4
9
2
U
2
3
8
.
0
3
9
3
N
p
2
3
7
.
0
5
9
4
P
u
(
2
4
4
)
9
5
A
m
(
2
4
3
)
9
6
C
m
(
2
4
7
)
9
7
B
k
(
2
4
7
)
9
8
C
f
(
2
5
1
)
9
9
E
s
(
2
5
2
)
1
0
0
F
m
(
2
5
7
)
1
0
1
M
d
(
2
5
8
)
1
0
2
N
o
(
2
5
9
)
1
0
3
L
r
(
2
6
0
)
6
C
1
2
.
0
1
1
S
y
m
b
o
l
e
N
u
m
r
o
a
t
o
m
i
q
u
e
M
a
s
s
e
a
t
o
m
i
q
u
e
1
2
1
3
1
4
1
5
1
6
1
7
1
8
3
4
5
6
7
8
1
1
1
2
9
1
0
1
1
0
1
1
1
1
1
2
(
L
a
m
a
s
s
e
a
t
o
m
i
q
u
e
a
p
p
r
o
x
i
m
a
t
i
v
e
d
e
l
i
s
o
t
o
p
e
l
e
p
l
u
s
s
t
a
b
l
e
e
s
t
i
n
d
i
q
u
e
e
n
t
r
e
p
a
r
e
n
t
h
s
e
s
.
)
(
2
7
2
)
(
2
8
1
)
(
2
8
5
)
D
s
R
g
U
u
b
1
1
3
(
2
8
4
)
U
u
t
1
1
4
(
2
8
9
)
U
u
q
1
1
5
(
2
8
8
)
U
u
p
T
a
b
l
e
a
u
p
r
i
o
d
i
q
u
e
d
e
s
m
e
n
t
s
Fides ducation, 2011
Vous aimerez peut-être aussi
- Stéréochimie organique: Les Grands Articles d'UniversalisD'EverandStéréochimie organique: Les Grands Articles d'UniversalisPas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Chimie PDFDocument384 pagesChimie PDFomayma chouiekh100% (2)
- Maxi Fiches de Chimie Générale - 2e Édition - 83 Fiches - 83 Fiches - Yann Verchier & Anne-Laure Valette Delahaye & Frédéric Lemaître - Dunod - Mai, 2011Document224 pagesMaxi Fiches de Chimie Générale - 2e Édition - 83 Fiches - 83 Fiches - Yann Verchier & Anne-Laure Valette Delahaye & Frédéric Lemaître - Dunod - Mai, 2011rodrigue yanPas encore d'évaluation
- Intro Chimie OrganiqueDocument46 pagesIntro Chimie OrganiqueSam H. SalehPas encore d'évaluation
- Chimie Organique 1année MedecineDocument217 pagesChimie Organique 1année MedecineSomah DOUMBIA100% (2)
- Chimie - Chimie Organique 02Document268 pagesChimie - Chimie Organique 02NAJIM ITTOBANEPas encore d'évaluation
- Cours de Chimie OrganiqueDocument114 pagesCours de Chimie Organiqueosefresistance100% (1)
- Chimie Des Solutions - Chapitre 1Document19 pagesChimie Des Solutions - Chapitre 1Aziz DahhaPas encore d'évaluation
- Exercices Organique Corrige WebDocument3 pagesExercices Organique Corrige WebGelo Ratouvo100% (1)
- Chimie OrganiqueDocument266 pagesChimie OrganiqueOussam OuadidiPas encore d'évaluation
- Olympiades Nationales de La Chimie - Annales Vol. 1Document240 pagesOlympiades Nationales de La Chimie - Annales Vol. 1Olympiades_Chimie100% (3)
- Livre Chimie 1ere AnnéeDocument173 pagesLivre Chimie 1ere AnnéeToons Land100% (1)
- COF - Fascicule de TP Printemps 2018Document11 pagesCOF - Fascicule de TP Printemps 2018Silvia Costa50% (2)
- Exercices Chimie en Solution PDFDocument2 pagesExercices Chimie en Solution PDFDenarius67% (6)
- Chimie Inorganique ExperiencesDocument61 pagesChimie Inorganique ExperiencesMakhloufi Med100% (1)
- Chimie Organique Fonctionelle S5Document120 pagesChimie Organique Fonctionelle S5fskPas encore d'évaluation
- Cours Chimie Org 01 PDFDocument80 pagesCours Chimie Org 01 PDFChaimae ezzahy100% (1)
- Chimie Analytique TD N3Document7 pagesChimie Analytique TD N3Boukalmoune IbrahimPas encore d'évaluation
- Nomenclature OrganiqueDocument10 pagesNomenclature Organiqueshadowkyllers89% (9)
- Chimie Generale Et Organique Par (WWW - Heights Book - Blogspot.com)Document154 pagesChimie Generale Et Organique Par (WWW - Heights Book - Blogspot.com)djamilio50% (2)
- Polycopie DR FalekDocument61 pagesPolycopie DR Falekjamjamal100% (1)
- 400 Manipulations Commentées De: Chimie Des SolutionsDocument9 pages400 Manipulations Commentées De: Chimie Des SolutionsLinda Koundzi100% (1)
- Fascicule Chimie OrganiqueDocument65 pagesFascicule Chimie OrganiqueBacksland100% (1)
- 11 Thermochimie1 Td-EnonceDocument3 pages11 Thermochimie1 Td-Enoncecours importantPas encore d'évaluation
- Exercices Supplementaires en Chimie Analytique PDFDocument18 pagesExercices Supplementaires en Chimie Analytique PDFyacine100% (1)
- QCM. de Chimie Générale. - AyadimDocument44 pagesQCM. de Chimie Générale. - AyadimJunior Charles0% (1)
- Milcent René, Chimie Organique.Document827 pagesMilcent René, Chimie Organique.Jonathan C Montealegre100% (3)
- Biophysique Cours 1Document105 pagesBiophysique Cours 1Smail FreeManPas encore d'évaluation
- Chimie OrganiqueDocument32 pagesChimie OrganiqueDarian HerascuPas encore d'évaluation
- Exercice Chimie Analytique PDFDocument2 pagesExercice Chimie Analytique PDFPhillip33% (3)
- .Chimie Organique - 1658685300000Document558 pages.Chimie Organique - 1658685300000Aymar OuedraogoPas encore d'évaluation
- Annales Medecine Lyon Est 2012-2013 PACESDocument189 pagesAnnales Medecine Lyon Est 2012-2013 PACESAurikPas encore d'évaluation
- Chimie Pour Les Étudiants en Médecine... Et Pour Tous Ceux Qui Ne Seront Pas ChimistesDocument315 pagesChimie Pour Les Étudiants en Médecine... Et Pour Tous Ceux Qui Ne Seront Pas Chimistessaid3232100% (2)
- ThermochimieDocument9 pagesThermochimieAntes de Partir, A.C.Pas encore d'évaluation
- Chimie Analytique - (Chap 3)Document14 pagesChimie Analytique - (Chap 3)Omar AbdelkefiPas encore d'évaluation
- Chimie en SolutionDocument36 pagesChimie en SolutionOuedraogo HarounaPas encore d'évaluation
- Cours Chimie OrganiqueDocument223 pagesCours Chimie Organiqueأمين حسوني100% (1)
- Cours 1 Reactions Acide BaseDocument12 pagesCours 1 Reactions Acide Basemoughit12100% (1)
- SP 08 PDFDocument36 pagesSP 08 PDFOlivier Giroud le BâtonnierPas encore d'évaluation
- Cours Complet de BiochimieDocument124 pagesCours Complet de BiochimieNiamatelah Lahkim100% (1)
- Chimie ch8Document10 pagesChimie ch8nadpharm13Pas encore d'évaluation
- Examen Correction L1 Chimie Organique 2006 2Document7 pagesExamen Correction L1 Chimie Organique 2006 2med madPas encore d'évaluation
- Cours de Chimie OrganiquesDocument118 pagesCours de Chimie OrganiquesUrbain VODOUNNOU100% (1)
- Chimie Organique - Les Cours de Paul Arnaud - 20e Édition (Brigitte Jamart, Jacques Bodiguel Etc.)Document697 pagesChimie Organique - Les Cours de Paul Arnaud - 20e Édition (Brigitte Jamart, Jacques Bodiguel Etc.)Taouil Mohamed100% (2)
- Oxy Do ReductionDocument39 pagesOxy Do ReductionKHALIFPas encore d'évaluation
- Exercices Chimie Organique PDFDocument2 pagesExercices Chimie Organique PDFErinPas encore d'évaluation
- 4 6021331281822876178Document32 pages4 6021331281822876178Ikeo100% (2)
- Cours Chimie Organique FS Ben M'Sik 2012-2013Document47 pagesCours Chimie Organique FS Ben M'Sik 2012-2013Mahfoud ZakiPas encore d'évaluation
- 04extrait Chimie OrganiqueDocument11 pages04extrait Chimie OrganiqueZakaria BstPas encore d'évaluation
- Chromatographie: Les Grands Articles d'UniversalisD'EverandChromatographie: Les Grands Articles d'UniversalisPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Nanocapteur: Développer des nanocapteurs intelligents en réseau pour éclairer la chimie du cerveau et détecter précocement le cancerD'EverandNanocapteur: Développer des nanocapteurs intelligents en réseau pour éclairer la chimie du cerveau et détecter précocement le cancerPas encore d'évaluation
- Macromolécules: Les Grands Articles d'UniversalisD'EverandMacromolécules: Les Grands Articles d'UniversalisPas encore d'évaluation
- Microbiologie médicale II: stérilisation, diagnostic de laboratoire et réponse immunitaireD'EverandMicrobiologie médicale II: stérilisation, diagnostic de laboratoire et réponse immunitairePas encore d'évaluation
- Structure Moleculaire PDFDocument44 pagesStructure Moleculaire PDFAliEle2013Pas encore d'évaluation
- StereochimieDocument17 pagesStereochimieDarel NadjieraPas encore d'évaluation
- Chimie Orga Cpge 1Document189 pagesChimie Orga Cpge 1Jean AnanPas encore d'évaluation
- Algerie TosyaliDocument16 pagesAlgerie TosyaliKhalil Barbari0% (1)
- Chapitre 2 SreirDocument20 pagesChapitre 2 SreirKhalil BarbariPas encore d'évaluation
- Atomistique & Liaisons Chimique Deug s1Document75 pagesAtomistique & Liaisons Chimique Deug s1almohaydi89% (38)
- Caractéristiques de L'entrepreneurDocument19 pagesCaractéristiques de L'entrepreneurKhalil BarbariPas encore d'évaluation
- .Chimie Organique - 1658685300000Document558 pages.Chimie Organique - 1658685300000Aymar OuedraogoPas encore d'évaluation
- 171 Stereo Exo LivreDocument10 pages171 Stereo Exo LivreFawzi ChakirPas encore d'évaluation
- StereochimieDocument17 pagesStereochimieDarel NadjieraPas encore d'évaluation
- Cour Chimie Organique S2 2017 2018Document70 pagesCour Chimie Organique S2 2017 2018Hakimi Abderrahmane100% (1)
- Chimie Organique s2Document70 pagesChimie Organique s2Fatima zahra ZianiPas encore d'évaluation
- Ejercicios Resueltos de Isomeria OpticaDocument113 pagesEjercicios Resueltos de Isomeria Opticaargentina-2009100% (2)
- Serie 2Document3 pagesSerie 2amy78213Pas encore d'évaluation
- ExercicesrsolusDocument196 pagesExercicesrsolusKhalil Barbari100% (5)
- Courschim 3Document42 pagesCourschim 3Firaş BenzaidPas encore d'évaluation
- Molecules Possedant Plusieurs Carbones AssymetriquesDocument8 pagesMolecules Possedant Plusieurs Carbones AssymetriquesKallel JihenePas encore d'évaluation
- AniqueDocument54 pagesAniquedoudouPas encore d'évaluation
- Chimie OrganiqueDocument8 pagesChimie OrganiqueYou Brussels100% (1)
- TD II Sol 2016Document15 pagesTD II Sol 2016Ammar BoutarfaPas encore d'évaluation
- Chapitre 2. StéréochimieDocument12 pagesChapitre 2. StéréochimieYoussef JayedPas encore d'évaluation
- Chimie OrgaDocument32 pagesChimie OrgaYeo Ouanan LassinaPas encore d'évaluation
- Note de Cours - Chimie Orga I 2022Document34 pagesNote de Cours - Chimie Orga I 2022Exaucé DjololoPas encore d'évaluation
- ConfigurationDocument9 pagesConfigurationImed SeghierPas encore d'évaluation
- Chapitre II - Sétéréochimie B. MESSAOUDI - 04!03!2022Document67 pagesChapitre II - Sétéréochimie B. MESSAOUDI - 04!03!2022Abderrahmane AEPas encore d'évaluation
- Chap 4 2021Document20 pagesChap 4 2021jaureskobon2Pas encore d'évaluation
- Cours Chimie Organique FS Ben M'Sik 2012-2013Document47 pagesCours Chimie Organique FS Ben M'Sik 2012-2013Mahfoud ZakiPas encore d'évaluation
- Chapitre IiiDocument11 pagesChapitre Iiimessitaguedit10Pas encore d'évaluation
- Difo CHAPITRE III CHIMIE ORGA HERMESDocument57 pagesDifo CHAPITRE III CHIMIE ORGA HERMESDifo Voukang HarounaPas encore d'évaluation
- Chapitre 2 StéréochimieDocument31 pagesChapitre 2 StéréochimieBirane BaPas encore d'évaluation
- Chimie OrganiqueDocument29 pagesChimie OrganiqueRubyPas encore d'évaluation
- Composés Organiques SNV 2018-19Document18 pagesComposés Organiques SNV 2018-19meriembatoul lachehebPas encore d'évaluation
- Chimie IsomerieDocument11 pagesChimie Isomerielistesel788100% (4)
- TD SMC3 SMP3 Serie 3 Avec Corrige 2020 2021Document8 pagesTD SMC3 SMP3 Serie 3 Avec Corrige 2020 2021khaoula elPas encore d'évaluation