Académique Documents
Professionnel Documents
Culture Documents
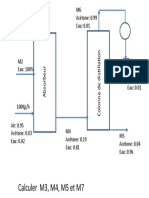
Fiche TP N°1
Transféré par
BeichaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Fiche TP N°1
Transféré par
BeichaDroits d'auteur :
Formats disponibles
Université Ahmed draïa – ADRAR Première année Master : Génie Chimique
Faculté des Sciences et de la Technologie Module : TP Opérations Unitaires 1
Départ Hydrocarbures et énergies renouvelables Année universitaire : 2018-2019
TP n° 1: Extraction de la caféine du Thé ou Café
1. BUT de TP :
Le but de l’expérience consistera à extraire la caféine du thé en utilisant deux solvants : l’eau et le chloroforme.
2. Introduction :
La caféine (ou 1,3,7-trimétylxantine) a pour formule brute C8H10N4O2. Elle fait partie de la
famille des méthylxanthines (ou xanthines). On la retrouve dans plusieurs plantes tropicales :
elle est présente dans les grains de café, les feuilles de thé, le cacao (chocolat) ou la noix de
kola. Dans sa forme pure elle consiste en une poudre blanche d’un goût extrêmement amer.
3. Principe :
Dans un premier temps, On procède à une extraction liquide-solide (eau chaude - feuilles de thé), lors de l’infusion
du thé, les petites molécules polaires telle la caféine se dissolvent dans l’eau chaude et sont séparées des grosses
molécules non polaires telles la cellulose, les protéines et les lipides des feuilles de thé. On sépare ensuite la caféine
de l’eau grâce à une extraction liquide-liquide et le solvant organique est ensuite évaporé pour permettre d’obtenir
des cristaux, dont on mesurera la température de fusion.
4. Matériels, Verreries et produits chimiques nécessaires :
Balance numérique.
Système de chauffage à reflux (chauffe ballon, ballon de 500 ml, réfrigérant).
Système de filtration sous vide (fiole à vide, filtre Büchner, pompe à air) ou centrifugeuse.
Ampoule à décanter de 500 mL.
Agitateur magnétique muni d’une plaque chauffante.
Evaporateur rotatif.
15 g de thé ou de café.
Verreries : Erlenmeyer 200 mL, Cristalisoir, Entonoirs,
Produits chimiques : Carbonate de calcium (CaCO3), Chloroforme, Sulfate de sodium (Na2SO4), acétone.
5. Mode Opératoire :
5.1. Infusion du thé :
Préparer un montage de chauffage à reflux simple.
Dans un ballon de 500 ml, introduire 15 g de thé (réduit en poudre) ou de café, 8 g de CaCO3 et 150 ml d’eau.
Ajouter quelques pierres ponce.
Adapter le réfrigérant à reflux, mettre sous agitation et chauffer pendant 30 mn.
Laisser refroidir, puis filtrer le thé pour enlever le liquide.
Dr Khelifi Omar TP Opérations Unitaires 1
5.2. Décantation :
Fixer un anneau à l’aide d’une noix sur un support et placer l’ampoule à décanter.
Verser le filtrat dans l’ampoule et ajouter 20 mL de chloroforme. Fermer avec un bouchon rodé.
Prendre l’ampoule à deux mains. Tenir le bouchon d’une main en le maintenant bien appuyé pour éviter toute
fuite. Tenir le robinet de l’autre main.
Renverser l’ampoule, l’orienter vers une paroi et ouvrir doucement le robinet afin d’éviter les surpressions.
Agiter vigoureusement en laissant " dégazer " de temps en temps. Dans tous les cas, bien maintenir le bouchon
avec le pouce.
Laisser les liquides non miscibles se séparer : les deux liquides non miscibles se séparent progressivement,
jusqu’à ce qu’on observe deux phases bien distinctes.
Isoler la phase organique dans un bécher. Recommencer l’opération deux fois.
5.3. Séchage :
Ajouter le desséchant (Na2SO4) dans l’erlenmeyer contenant le liquide. Agiter doucement.
Continuer à ajouter le desséchant jusqu’à ce que les cristaux ne s’agglomèrent plus et forment une pluie de
cristaux fins. Boucher l’erlenmeyer et agiter quelques minutes.
Le desséchant hydraté est éliminé par filtration, à l’aide d’un entonnoir posé sur un anneau et muni d’un filtre
plissé. Le liquide organique est recueilli dans un erlenmeyer sec et bouché.
5.4. Evaporation et Cristallisation :
Nous allons donc évaporer le solvant organique et le piéger avec un évaporateur rotatif. On récupère dans le ballon
chauffé une poudre claire, jaune, constituée de petits cristaux, dont certains sont des cristaux de caféine mais qui
contiennent encore des impuretés. Dissoudre le résidu solide, restant au fond du ballon de distillation, dans 10 mL
d’acétone à chaud. Ajouter lentement de l’éther de pétrole jusqu’à cristallisation. Refroidir dans la glace. Essorer
les cristaux sur büchner.
5.5. Caractérisation du produit obtenu :
On mesure la température de fusion du produit obtenu, sachant que la température de la caféine pure est de 235 °C.
6. Compte rendu :
Quel est l’intérêt de l’ajout du carbonate de calcium ?
Quel est l’intérêt du montage à reflux ?
Calculer le rendement de l’extraction.
Quel est le rôle de l’ajout du sulfate de magnésium anhydre ?
La caféine est-elle une substance naturelle ou artificielle ?
Quelle est la différence entre caféine et théine ?
7. Référence :
[1]. http://nadia-boulekras.e-monsite.com/medias/files/5-extraction-de-la-cafeine-4.pdf.
[2]. http://physicus.free.fr/premiere_S/pdf/CHAP-10-TP-Extraction-cafeine.pdf.
[3]. https://docplayer.fr/15218089-Experience-3-extraction-de-la-cafeine-du-the.html.
[4]. https://physique-chimie.discip.ac-caen.fr/IMG/pdf/4.fiche_prof_tp_the_ou_cafe.pdf.
Dr Khelifi Omar TP Opérations Unitaires 1
Vous aimerez peut-être aussi
- TP Opu 2Document12 pagesTP Opu 2Amani mimoPas encore d'évaluation
- Extraction de La Cafeine PDFDocument6 pagesExtraction de La Cafeine PDFahmedchimiste100% (3)
- CaféineDocument7 pagesCaféinehocine bariPas encore d'évaluation
- Expérience # 3. Extraction de La Caféine Du ThéDocument5 pagesExpérience # 3. Extraction de La Caféine Du Thékrim gasmi100% (2)
- TP Phy 1Document18 pagesTP Phy 1Dhiab ArtPas encore d'évaluation
- TP Extraction de La Cafeine Des FeuillesDocument12 pagesTP Extraction de La Cafeine Des FeuillesIslam Lakat67% (3)
- Hydro DistillationDocument3 pagesHydro DistillationAbdÊn NøurPas encore d'évaluation
- 14 TP ExtractionDocument6 pages14 TP Extractionkrim gasmi100% (2)
- Compte Rendu TP HydrodistillationDocument13 pagesCompte Rendu TP HydrodistillationAbderrahmane Djelloul Daouadji100% (1)
- TP 2Document13 pagesTP 2Bargui NadaPas encore d'évaluation
- Sans Photo Extraction CorrigeDocument10 pagesSans Photo Extraction CorrigeMedPas encore d'évaluation
- Extraction Liquide-Liquide de L'iode: 3 Année LicenceDocument5 pagesExtraction Liquide-Liquide de L'iode: 3 Année LicenceÖyku SonuPas encore d'évaluation
- ManipulationDocument7 pagesManipulationsafemindPas encore d'évaluation
- TP ExtractionDocument15 pagesTP Extractionamina ennoualPas encore d'évaluation
- TP No01 Extraction de L EugenolDocument7 pagesTP No01 Extraction de L Eugenolkrim gasmi100% (2)
- TP Extraction Liq-LiqDocument10 pagesTP Extraction Liq-LiqEmna LahmarPas encore d'évaluation
- TP N° 03: Adsorption D'un Colorant (Bleu de Méthylène) Sur Un Matériau Adsorbant (Charbon Actif)Document2 pagesTP N° 03: Adsorption D'un Colorant (Bleu de Méthylène) Sur Un Matériau Adsorbant (Charbon Actif)RaoufyyPas encore d'évaluation
- TP L'extraction Liquide LiquideDocument7 pagesTP L'extraction Liquide LiquideryanlostmanPas encore d'évaluation
- TP.3.Génie Chimie Et Chimie Physique (ADSORPTION)Document6 pagesTP.3.Génie Chimie Et Chimie Physique (ADSORPTION)Sam SifouPas encore d'évaluation
- TP Op PDFDocument30 pagesTP Op PDFImad HanouAr100% (2)
- Exposé Cristallisation Du SelDocument15 pagesExposé Cristallisation Du SelNede 17Pas encore d'évaluation
- TP4 Distillation Fractionnée 2Document3 pagesTP4 Distillation Fractionnée 2Fouad MihoubPas encore d'évaluation
- TP3 - AdsorptionDocument9 pagesTP3 - Adsorptionxv kipPas encore d'évaluation
- TP N°4. Séchage D'une Phase OrganiqueDocument2 pagesTP N°4. Séchage D'une Phase OrganiqueMebarka Tim100% (1)
- TP Extraction OpuDocument20 pagesTP Extraction OpuRochdanePas encore d'évaluation
- Thermo - TP - Compte Rendu Du TP Miscibilité Partielle 6664Document7 pagesThermo - TP - Compte Rendu Du TP Miscibilité Partielle 6664Jonquille NergisPas encore d'évaluation
- Recristallisation 11Document4 pagesRecristallisation 11Bamogo Bōezemwendé JöelPas encore d'évaluation
- TP 2 Mise en Evidence D'un Excipient FiniDocument7 pagesTP 2 Mise en Evidence D'un Excipient FiniHamdaoui douniaPas encore d'évaluation
- Membrane LiquideDocument5 pagesMembrane LiquideBichou Derres100% (1)
- Chapitre II Extraction Liq-LiqDocument20 pagesChapitre II Extraction Liq-LiqSavana BellaPas encore d'évaluation
- TP Analyse Et Contrôle Des MédicamentsDocument25 pagesTP Analyse Et Contrôle Des MédicamentsHamdaoui douniaPas encore d'évaluation
- Extraction Liquide-Liquide de L'acide Benzoïque: 3 Année LicenceDocument5 pagesExtraction Liquide-Liquide de L'acide Benzoïque: 3 Année LicenceÖyku SonuPas encore d'évaluation
- TP Distillaion SimpleDocument5 pagesTP Distillaion SimpleMïss MïmãPas encore d'évaluation
- Operations Unitaires PlanDocument5 pagesOperations Unitaires PlanMedPas encore d'évaluation
- Chapitre IIIDocument12 pagesChapitre IIIsafaa farah100% (1)
- Tpn2 Etude Dela Reaction de Saponification Dans Un Reacteur Agite FermeDocument10 pagesTpn2 Etude Dela Reaction de Saponification Dans Un Reacteur Agite FermeChaimaa SenoussaPas encore d'évaluation
- Décantation Et La FiltrationDocument4 pagesDécantation Et La Filtrationzizou ghanjatiPas encore d'évaluation
- TP RéacteurDocument14 pagesTP RéacteurBah SidahmedPas encore d'évaluation
- Production Des PlastifiantsDocument3 pagesProduction Des PlastifiantsHadjer zit67% (3)
- Méthode Extraction Liquide LiquideDocument1 pageMéthode Extraction Liquide Liquidephysique100% (2)
- Compte Rendu Simulateurs 1 1527259661Document14 pagesCompte Rendu Simulateurs 1 1527259661Gasmi Kr100% (3)
- TP ExtractionDocument4 pagesTP Extractionsafemind100% (1)
- Techniques D'analyse - Cours (Chap 1) Chomatographie L3 GPDocument28 pagesTechniques D'analyse - Cours (Chap 1) Chomatographie L3 GPamina ennoualPas encore d'évaluation
- TP AbsorptionDocument13 pagesTP AbsorptionEvaPas encore d'évaluation
- T PT Out El ExtractionDocument14 pagesT PT Out El ExtractionBamogo Bōezemwendé JöelPas encore d'évaluation
- TP Finale AdsorptionDocument12 pagesTP Finale AdsorptionEvaPas encore d'évaluation
- TP 07Document10 pagesTP 07hiba boussaadaPas encore d'évaluation
- TP Réacteurs HomogènesDocument4 pagesTP Réacteurs Homogènesoubechou oubechouPas encore d'évaluation
- TP 1 Emulsions Double m1Document5 pagesTP 1 Emulsions Double m1Chaima HamadiPas encore d'évaluation
- TP 1Document5 pagesTP 1selmi nourelhouda100% (1)
- Fichier 2 Template Du TP de Chimie Physique 2 Et Génie Chimique 2. Docs L.LARBIDocument3 pagesFichier 2 Template Du TP de Chimie Physique 2 Et Génie Chimique 2. Docs L.LARBIrania djdPas encore d'évaluation
- N4-Distillation Continue Eau EthanolDocument11 pagesN4-Distillation Continue Eau EthanolАпцгдк Ьфш БгднчллPas encore d'évaluation
- Reforme STL2011 2012 Distillations Simple Et Fractionnée Gpe3Document6 pagesReforme STL2011 2012 Distillations Simple Et Fractionnée Gpe3جعدبندرهم100% (1)
- TP Technique D AnalyseDocument10 pagesTP Technique D AnalyseAhmed YounsiPas encore d'évaluation
- TP 1 Operation UnitaireDocument3 pagesTP 1 Operation Unitaireداودي عبد الرحمان50% (2)
- Charbon Actif1Document8 pagesCharbon Actif1soumia boudjenanePas encore d'évaluation
- RecristalisationDocument10 pagesRecristalisationMoed Moed0% (1)
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- TP Operation UnitaireDocument9 pagesTP Operation UnitaireBòû ChŔâ ÑePas encore d'évaluation
- TP 2Document9 pagesTP 2Omar Ben AmeurPas encore d'évaluation
- Programme Pédagogique Master GC PDFDocument49 pagesProgramme Pédagogique Master GC PDFAbed Med MedPas encore d'évaluation
- Chapitre II Opérations D'humidificationDocument7 pagesChapitre II Opérations D'humidificationBeicha50% (2)
- Flux TMPDocument1 pageFlux TMPBeichaPas encore d'évaluation
- Controle 01 Master M1 Simulateurs 2020Document1 pageControle 01 Master M1 Simulateurs 2020BeichaPas encore d'évaluation
- Chapitre III Séchage Et Evaporation (1ère Partie)Document7 pagesChapitre III Séchage Et Evaporation (1ère Partie)BeichaPas encore d'évaluation
- Chapitre IDocument11 pagesChapitre IBeichaPas encore d'évaluation
- Controle Simulateurs 2020Document1 pageControle Simulateurs 2020BeichaPas encore d'évaluation
- TD2S3 2007Document2 pagesTD2S3 2007BeichaPas encore d'évaluation
- Cor TD2 2007 2008 PDFDocument4 pagesCor TD2 2007 2008 PDFBeichaPas encore d'évaluation
- Corrig Exerc 2Document5 pagesCorrig Exerc 2BeichaPas encore d'évaluation
- Présentation 3Document1 pagePrésentation 3BeichaPas encore d'évaluation
- CompresseurDocument1 pageCompresseurBeichaPas encore d'évaluation
- Présentation 2Document1 pagePrésentation 2BeichaPas encore d'évaluation
- Dist Chap14Document8 pagesDist Chap14jojoPas encore d'évaluation
- Simulateurs de Procédés Partie 2Document7 pagesSimulateurs de Procédés Partie 2Fatima YahiaPas encore d'évaluation
- Polycopié EnergieRenouvelableDocument3 pagesPolycopié EnergieRenouvelableBeichaPas encore d'évaluation
- Syllabus Fours Et Chaudières PDFDocument1 pageSyllabus Fours Et Chaudières PDFBeichaPas encore d'évaluation
- Travail Pratique N°4Document2 pagesTravail Pratique N°4BeichaPas encore d'évaluation
- Lettre Daccueil - Pour Co Encadrement - PROFAS B - 2018Document1 pageLettre Daccueil - Pour Co Encadrement - PROFAS B - 2018BeichaPas encore d'évaluation
- Fiche TD AbsorptionDocument1 pageFiche TD AbsorptionBeicha100% (1)
- Partie 1Document7 pagesPartie 1BeichaPas encore d'évaluation
- Travail Pratique N°4Document2 pagesTravail Pratique N°4BeichaPas encore d'évaluation
- Les Équations d'état-Hysys-Partie-4Document7 pagesLes Équations d'état-Hysys-Partie-4BeichaPas encore d'évaluation
- Partie 1Document7 pagesPartie 1BeichaPas encore d'évaluation
- TPCdensite Solubilite CorrigeDocument2 pagesTPCdensite Solubilite CorrigeBeichaPas encore d'évaluation
- Travail Pratique N°4Document2 pagesTravail Pratique N°4BeichaPas encore d'évaluation
- Fndae 14Document71 pagesFndae 14guiguimol100% (1)
- Wegener FRfrPub759Document13 pagesWegener FRfrPub759simoPas encore d'évaluation
- Serie N3Document8 pagesSerie N3BeichaPas encore d'évaluation
- جذاذة conjigaisonDocument18 pagesجذاذة conjigaisonNour El Houda Mellouli100% (1)
- Gâteau Au Chocolat Fondant La Meilleure RecetteDocument1 pageGâteau Au Chocolat Fondant La Meilleure Recetteckk8y4xwxfPas encore d'évaluation
- Pathologie Du Cacao PDFDocument36 pagesPathologie Du Cacao PDFthierry19 oscarPas encore d'évaluation
- Carte: Des BoissonsDocument17 pagesCarte: Des BoissonsSengelPas encore d'évaluation
- Frances Intermedio 2 Tarea 1Document5 pagesFrances Intermedio 2 Tarea 1Francis GarciaPas encore d'évaluation
- Dépliant SOLDESDocument48 pagesDépliant SOLDESBellaminePas encore d'évaluation
- Catalogue WhiskyDocument8 pagesCatalogue WhiskyHanse NgoyPas encore d'évaluation
- 2nd PUC FRENCH MODEL QUESTION PAPER PATTERN PDFDocument3 pages2nd PUC FRENCH MODEL QUESTION PAPER PATTERN PDFShreya BiwalkarPas encore d'évaluation
- Cours CacaoDocument19 pagesCours CacaoDavid MaddalenaPas encore d'évaluation
- Le Conditionnel Cours Illustré Et ExercicesDocument8 pagesLe Conditionnel Cours Illustré Et Exercicesbesmakina12Pas encore d'évaluation
- Fiche - Technique MDC Alginate de SodiumDocument2 pagesFiche - Technique MDC Alginate de SodiumSébastien RichezPas encore d'évaluation
- Quel Café Choisir?Document8 pagesQuel Café Choisir?MaudePas encore d'évaluation
- Dre - CMV - V3 - 06.23 (T2)Document28 pagesDre - CMV - V3 - 06.23 (T2)celo.maPas encore d'évaluation
- Composition Paniers RamadanDocument4 pagesComposition Paniers RamadanAlves DésiréPas encore d'évaluation
- Les Verbes Pouvoir Vouloir Devoir Et SavoirDocument1 pageLes Verbes Pouvoir Vouloir Devoir Et SavoiricepeakvlPas encore d'évaluation
- LivresDocument80 pagesLivresSolenePas encore d'évaluation
- Les 100 Meilleurs Chocolatiers 2008Document4 pagesLes 100 Meilleurs Chocolatiers 2008EL KANDOUSSI KMPas encore d'évaluation
- Dany Laferriere - J'ecris Comme Je Vis - 2000Document232 pagesDany Laferriere - J'ecris Comme Je Vis - 2000David Muñoz100% (1)
- 1.3 Atelier ConjugaisonDocument3 pages1.3 Atelier ConjugaisonLIZ MARIANA RAIGOSA FLOREZPas encore d'évaluation
- Devoir, Pouvoir, Vouloir, SavoirDocument1 pageDevoir, Pouvoir, Vouloir, Savoiralexxx34100% (1)
- Fiche LaChandeleur 2018Document5 pagesFiche LaChandeleur 2018Eduarda FernandesPas encore d'évaluation
- D É Mon StrationDocument5 pagesD É Mon StrationFarid Ben100% (1)
- Anne Dufour & Carole Garnier - Mes Petites Recettes Magiques Régressives (FR)Document185 pagesAnne Dufour & Carole Garnier - Mes Petites Recettes Magiques Régressives (FR)Rosemary GuérinPas encore d'évaluation
- L'élaboration Du CaféDocument4 pagesL'élaboration Du CaféNib HarborPas encore d'évaluation
- Handy Servings Guide French Final For WebDocument4 pagesHandy Servings Guide French Final For WebAminePas encore d'évaluation
- Test A2.2Document3 pagesTest A2.2Trang Triều HuânPas encore d'évaluation
- Les ViennoiseriesDocument3 pagesLes Viennoiserieskhalida1Pas encore d'évaluation
- III. Colonisation - Version ÉlèveDocument8 pagesIII. Colonisation - Version ÉlèveJehanne ThomasPas encore d'évaluation
- La Negation Intermediaire Exercices Et Corrige-2Document12 pagesLa Negation Intermediaire Exercices Et Corrige-2Mounir MoezPas encore d'évaluation
- Notice - Bouilloire SerenaDocument16 pagesNotice - Bouilloire SerenaPICARDPas encore d'évaluation