Académique Documents
Professionnel Documents
Culture Documents
Document Sans Titre
Transféré par
الغزيزال الحسن EL GHZIZAL HassaneCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Document Sans Titre
Transféré par
الغزيزال الحسن EL GHZIZAL HassaneDroits d'auteur :
Formats disponibles
TS LES PILES C 08
1. Transfert spontané d’électrons
1.1. Transfert spontané direct
Lorsque deux espèces de deux couples oxydant/réducteur sont mélangées, il y a transfert spontané
d’électrons entre l’oxydant d’un couple et le réducteur de l’autre couple.
L’application du critère d’évolution spontané permet de connaitre le sens de la transformation chimique et
rend compte de ce qui est observé.
Expérience :
Dans un bécher,
de solution de sulfate de cuivre (II) de concentration en soluté apporté ;
de solution de sulfate de zinc (II) de concentration en soluté apporté
On plonge une lame de zinc, une lame de cuivre et de la poudre de zinc.
Observations : après filtration pour récupérer la poudre de zinc et voir qu’elle est rouge
la couleur bleue de la solution s’atténue
apparition d’un dépôt de cuivre rouge sur la lame de zinc et la poudre de zinc.
La température de la solution augmente : la réaction dégage de l’énergie.
Confrontation avec la théorie :
Couples intervenant :
Équation de la réaction associée à la transformation chimique :
de constante .
Calcul du quotient de réaction à l’état initial :
car et .
Donc , le système évolue dans le sens direct ( ) ce qui est bien le sens observé.
Les ions cuivre (II) et le métal zinc ont échangé des électrons directement car ils sont en contact : le zinc à
cédé des électrons aux ions .
De l’énergie a été libérée.
1.2. Transfert spontané indirect
Le transfert spontané d’électrons peut se réaliser par l’intermédiaire d’un circuit électrique extérieur.
Les couples oxydant/réducteur sont séparés et la transformation chimique n’a lieu que si on les relie par un
pont conducteur.
P .PECORELLA Page 1/9 18/06/2009
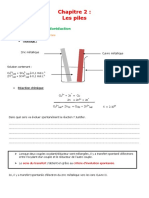
Expérience 1 : un bécher avec solution de sulfate de cuivre et une lame de
cuivre plongée dedans.
Un bécher avec une solution de sulfate de zinc et une lame de zinc plongée
dedans.
On relie les deux plaques métallique avec un ampèremètre en série avec une résistance ( ) (ou une
DEL).
Dés que les solutions sont reliées par un pont, on constate qu’un courant circule dans le circuit électrique
fermé de la plaque de cuivre vers la plaque de zinc.
On a ainsi réalisée une pile.
Expérience 2 : Pile Daniell, montage
A de 1836.
Le vase poreux remplace le pont salin.
V
Lame
Lame
2.deLame Constitution d’une
V
pile Lame dede zinc
cuivre de zinc
2.1.entoure
qui Définition
le Pont salin cuivre
Une pile convertit une énergie chimique en énergie électrique (voir cours de 1°S) grâce à un transfert
vase poreux
spontané indirect d’électrons entre deux couples oxydant/réducteur
Vase poreux via un circuit électrique extérieur.
2.2. Les composants d’une pile
Une pile est constituée de deux demi-piles.
Solution de
ChaqueSolution
demi-pile
de contient l’oxydant etde
Solution le réducteur d’un couple.
Les demi piles sont reliées par un pont salin (ou séparées par une paroi poreuse).
Solution⮚deDemi pile redox
Une demi-pile est constituée d’un métal M plongeant dans une solution de ses ions Mn+.
La lame métallique constitue l’électrode.
La solution est appelée solution électrolytique.
⮚ Le pont salin
Un pont salin contient un électrolyte.
Le pont salin sert : à fermer le circuit afin de permettre la circulation du courant électrique
À assurer l’électroneutralité des solutions de chaque
demi-pile.
⮚Pile redox
La pile ainsi constituée met en jeu un transfert spontané d’électrons d’un réducteur vers un oxydant.
L’oxydant et le réducteur ne sont pas mis en contact direct et le transfert d’électron peut être canalisé et
utilisé dans un circuit électrique extérieur à la pile.
Les réactions d’oxydation et de réduction ont lieu à la surface des électrodes.
⮚ Schéma conventionnel (chimique)
Pour une pile constituée par deux demi-piles associées aux couples redox et :
Les électrodes sont les deux lames métalliques et le pont électrolytique est représenté par un double trait.
Les deux demi-piles peuvent être identiques, différer par la nature des couples redox ou présenter des
électrodes identiques avec des concentrations des ions différentes.
⮚ TP les piles
3. Fonctionnement d’une pile
3.1. Réaction aux électrodes
On distingue les électrodes suivant la réaction qui a lieu à leur surface.
Par définition :
P .PECORELLA Page 2/9 18/06/2009
L’anode est l’électrode qui est le siège d’une oxydation
La cathode est l’électrode qui est le siège d’une réduction.
3.2. Mouvement des porteurs de charge
Lorsqu’on relie la pile à un circuit électrique fermé, un courant électrique circule.
On étudie par exemple la pile Daniell (pile zinc-cuivre).
⮚ Mouvement des électrons dans le circuit électrique
Les réactions d’oxydoréduction se produisant à la surface des lames métalliques sont appelées réactions aux
électrodes.
À l’électrode de zinc, , la réaction fournit des électrons, il s’agit donc de l’oxydation du
zinc, cette éléectrode est l’anode.
La concentration en ion zinc (II) augmente au cours du temps et la lame perd de sa matière, sa masse
diminue.
À l’électrode de cuivre, , la réaction capte des électrons, il s’agit donc de la réduction
des ions cuivre (II), cette électrode est la cathode.
La concentration en ion cuivre (II) diminue au cours du temps et la lame gagne de la matière, sa masse
augmente (par suite du dépôt de cuivre).
⮚ Mouvement des ions et rôle du pont électrolytique
Les électrons n’existent pas à l’état libre dans les solutions aqueuses électrolytiques. Dans les solutions
comme dans le pont salin, la circulation du courant est assurée par un déplacement d’ions.
Dans la demi-pile au cuivre, les ions disparaissent et la neutralité électrique de la solution est assurée
par l’arrivée des ions en provenance du pont salin.
Dans la demi-pile au zinc, les ions apparaissent et la neutralité électrique de la solution est assurée
par l’arrivée des ions en provenance du pont salin.
3.3. Prévision du critère d’évolution spontanée
I I
On a déjà vu dans le cas de la pile Daniell :
Zoom Zoom
La réaction d’oxydoréduction a pour bilan : de constante .
Avec une pile « neuve » : les concentrations en ions métalliques de chacune des demi pile sont égale et
Pont salin
voisines d’une mole par litre donc . Le sens d’évolution spontanée est donc le sens
direct.
Comment retrouver le sens de circulation des porteurs de charges dans une pile ?
Le critère d’évolution permet de connaître le sens de la réaction qui se déroule pour atteindre l’état
d’équilibre et on en déduit les réactions aux électrodes qui donnent ensuite le déplacement des porteurs de
charge.
Exemple : La pile cuivre argent. Couples intervenant, et .
Les concentrations en ions métalliques à l’état initiale sont égales à .
Réactions qui peuvent avoir lieu entre ces couples :
à 25°C (réaction ①)
à 25°C (réaction ②)
P .PECORELLA Page 3/9 18/06/2009
Dans l’état initial : donc la réaction évolue en sens inverse.
donc la réaction
évolue dans le sens direct.
La réaction spontanée est donc la réaction ②. donc la réaction est totale.
L’électrode de cuivre cède des électrons qui sont captés par les ions au contact de l’électrode
d’argent.
À l’extérieure de la pile les électrons vont de l’électrode de cuivre vers l’électrode d’argent. Le courant
circule dans l’autre sens.
L’électrode de cuivre est le siège d’une oxydation, c’est l’anode, elle constitue la borne de la pile car elle
cède les électrons.
L’électrode d’argent est le siège d’une réduction, c’est la cathode, elle constitue le borne + de la pile car
dans le circuit extérieur, les électrons arrivent à cette électrode
Les ions positifs du pont salin vont se diriger vers la demi-pile argent afin de compenser la disparition des
ions .
Les ions négatifs du pont salin vont se diriger vers la demi-pile cuivre afin de compenser l’apparition des
ions .
3.4. La pile, système hors équilibre
Au cours de son fonctionnement, la pile est un système chimique hors équilibre.
La réaction d’oxydoréduction dont elle est le siège est spontanée, la pile tend alors vers un état d’équilibre
qui est atteint lorsqu’elle est usée.
4. Étude quantitative d’une pile
4.1. Intensité du courant débité par une pile
• Si pendant une durée , il circule à travers une section S de conducteur N électrons de charge
individuelle , la charge totale qui a traversé la section S est .
• L’intensité du courant continu est définie comme un débit de charges (soit un débit d’électrons) :
avec Q la valeur absolue de la charge.
Donc et
• Si N électrons sont transférés entre les deux demi-piles, avec la quantité de matière
d’électrons transféré en mol.
Donc
• Le produit est une constante appelée le Faraday, noté F (ou F) , c’est la valeur absolue de la charge
d’une mole d’électrons.
• L’intensité I du courant continu débité pendant une durée est donc
4.2. Bilan de matière dans la pile
P .PECORELLA Page 4/9 18/06/2009
Cas de la pile cuivre-aluminium :
Les équations aux électrodes indiquent que pour un avancement de x de la réaction, 6 x moles d’électrons
ont été échangées.
Le nombre d’électrons échangés est donc : avec la constante
d’Avogadro.
La charge électrique totale transportée
Si la charge est transférée pendant la durée , l’intensité I du courant : .
Donc on peut relier les quantités de matière des réactifs consommées à l’intensité du courant fourni par la
pile pendant la durée : pour la pile cuivre-aluminium.
Dans le cas général d’une pile dont la réaction d’oxydoréduction met en jeu y électrons : .
I en ampères, en secondes, F le faraday et y est un nombre sans dimension, c’est le « nombre
stœchiométrique des électrons ».
Application : calcul de la masse d’aluminium consommée dans une pile cuivre-aluminium après qu’elle a
débité une intensité de 10 mA pendant 2,0 heures. M(Al) = 27 g/mol
et donc .
D’après l’équation et le tableau précedent, et
Donc et .
A.N. : , valeur négative car la masse a diminuée.
4.3. La pile usée
Une pile est usée ou déchargée lorsqu’elle a atteint son état d’équilibre donc quand .
Des réactifs ont été consommés, et comme la réaction est totale elle atteint son avancement maximum
et .
Cette quantité est liée aux quantités de matières des réactifs présents dans la pile et la pile est déchargée
lorsqu’au moins l’un des réactifs est entièrement consommé. Une pile n’est pas rechargeable.
P .PECORELLA Page 5/9 18/06/2009
Pour une pile donnée, la quantité totale d’électricité qu’elle peut fournir est appelée capacité C de la pile.
La capacité est égale à la valeur absolue de la charge électrique transportée au cours de la durée totale de
fonctionnement de la pile.
. Unités : Ah si le temps est en heures, C si le temps est en secondes (1 A.s = 1 C).
Exemple :
Soit une pile argent-cuivre : la demi pile à l’argent contient V = 25 mL de nitrate d’argent de concentration
1,0 mol/L. L’intensité du courant débité est .
1°/ Calculer la durée maximale de fonctionnement de cette pile si l’ion argent est le réactif limitant.
On a vu précédemment que la réaction de cette pile est .
La réaction est totale donc , l’ion argent est réactif limitant donc
. De plus .
soit environ 13 h.
2°/ Calculer la masse de cuivre ayant réagi et dire s’il s’agit d’un dépôt ou d’une perte de masse.
, il y a perte de masse.
.
P .PECORELLA Page 6/9 18/06/2009
5. Force électromotrice d’une pile (document élève)
5.1. Rappel de 1°S
La f.e.m d’une pile correspond à la tension à vide de la pile.
On mesure la f.e.m. en plaçant un voltmètre entre les deux électrodes de la pile quand aucun courant ne
circule.
Lorsqu’une pile débite du courant, la tension U (ou ) à ses bornes est inférieure à sa tension à vide et
dépend de l’intensité I du courant. (Voir cours de physique de 1°S)
5.2. Convention générateur et sens de circulation du courant
Rappel du schéma électrique de la pile avec les polarités.
Flécher et I.
La mesure de la f.é.m. permet de trouver le sens du courant.
(Un ampèremètre permet également de trouver le sens du I
courant.)
E r
5.3. Bilan énergétique électrochimique
I
🞻 Loi de fonctionnement d’un générateur :
avec tension aux bornes du générateur en volts
E force électromotrice (f.é.m.) en volts
r résistance interne en ohms.
🞻 Bilan de puissance :
EI correspond à la puissance consommée par le générateur
r I² à la puissance consommé par effet Joule dans le générateur (perte).
P est la puissance fournie par le générateur au reste du circuit électrique connecté entre les bornes P et N
Soit
🞻 Bilan d’énergie :
représente l’énergie électrique fournie au circuit par le générateur.
représente l’énergie dissipée sous forme thermique par effet Joule.
est l’énergie totale fournie par la pile. C’est « l’énergie chimique » contenue dans la pile dans l’état
initial du système et libérée par la réaction d’oxydoréduction.
🞻 Rendement :
6. Les piles usuelles
6.1. La pile saline ou pile Leclanché
Les demi piles font intervenir les couples et reliés par une solution acide de
chlorure d’ammonium.
Ex : écrire l’équation de la réaction.
L’électrolyte est gélifié pour rendre la pile transportable et utilisable dans toutes les positions, c’est pourquoi
ce type de pile a été appelé « pile sèche ».
Pour éviter de consommer tout le zinc qui sert de boîtier, le dioxyde de manganèse est le réactif limitant.
La représentation symbolique de cette pile est variable (en réalité présence de ZnCl2).
Sa f.é.m. est voisine de 1,5 V.
Problème : cette pile est le siège d’une réaction secondaire qui consomme du zinc.
P .PECORELLA Page 7/9 18/06/2009
Cette réaction de cinétique lente réduit la capacité de la pile et peut provoquer la rupture du boîtier en zinc et
laisser fuir l’électrolyte acide. Le mercure permettait de ralentir davantage cette réaction.
6.2. La pile alcaline
La pile alcaline de Mallory comprend les mêmes réactifs que la pile saline de Leclanché mais avec un
électrolyte basique KOH. Cet électrolyte est un meilleur conducteur et la résistance interne des piles
alcalines est plus faible que les salines, elles fonctionnent plus longtemps.
Ex : écrire l’équation de la réaction. Attention les ions zinc (II) donnent des complexes en milieu basique.
LES PILES USUELLES
Pile saline dite Leclanché Pile alcaline Pile bouton à oxyde
d’argent
• Poudre de graphite reliée à
• Bâton de graphite • Poudre de graphite
un boitier en acier
Pôle • Électrolyte gélifie • Électrolyte gélifie
• Électrolyte gélifie
(dioxyde de manganèse) (oxyde d’argent)
(dioxyde de manganèse)
Milieu acide Milieu très basique
Milieu très basique
• Couple
• Couple
• Couple
• Plaque de zinc • Poudre de zinc répartie
Pôle • Poudre de zinc
• Électrolyte gélifié et autour d’un clou en acier
• Électrolyte gélifié
• Électrolyte gélifié
• Couple
• Couple • Couple
Énergie
volumiqu
e( 0,4 0,8 1,8
)
Exploitation :
1°/ Principe de fonctionnement d’une pile saline.
1.1. Écrire les demi-équations des réactions qui ont lieu au niveau de chaque pôle de cette pile.
1.2. En déduire que l’équation de la réaction au sein de la pile est :
1.3. Pourquoi cette pile est-elle qualifiée de saline ?
P .PECORELLA Page 8/9 18/06/2009
Car et sont des composés appelés « sels ».
1.4. Pourquoi ces piles sont-elles dites « sèches » ?
Car l’électrolyte est gélifié ce qui évite les écoulements, alors que les premières piles avaient un
électrolyte liquide donc difficilement transportables (pile de Volta, de Daniell…)
1.5. Lorsque le zinc de l’électrode négative est consommé, c’est le fer du boitier en acier qui pourrait le
remplacer. Expliquer alors l’intérêt d’avoir pour réactif limitant le dioxyde de manganèse.
Si c’est le réactif limitant, le zinc est toujours en excès donc la réaction s’arrête avant que le
boitier en fer ne puisse être consommé, la pile ne se perce pas, les composés quelle contient ne s’en
échappent pas.
1.6. Cette pile est le siège d’une réaction secondaire lente entre les couples et .
Écrire les demi-équations et l’équation de la réaction qui a lieu dans la pile.
Si cette réaction a lieu, que peut-elle provoquer ?
Il y a formation de gaz, qui fait gonfler la pile, donc risque de rupture du boitier et fuite de l’électrolyte
acide.
2°/ Principe de fonctionnement d’une pile alcaline.
2.1. Écrire les demi-équations des réactions qui ont lieu au niveau de chaque pôle de cette pile.
2.2. En déduire que l’équation de la réaction au sein de la pile est :
2.3. Pourquoi ce type de pile est-elle appelée « pile alcaline » ?
La potasse est une base autrefois appelée alcali.
Le potassium appartient à la première colonne de la classification périodique, les métaux alcalins.
3°/ Quels sont les avantages et les inconvénients des piles boutons par rapport aux piles salines et aux piles
alcalines ?
Avantages : énergie volumique importante, plus compactes.
Inconvénient : elles peuvent contenir des traces de mercure.
4°/ Dans la pile au lithium, le lithium remplace le zinc de la pile alcaline classique et l’électrolyte referme
un solvant organique et non de l’eau.
4.1. Écrire l’équation de la réaction au sein de la pile. (couple et ).
4.2. Expliquer pourquoi on utilise un solvant organique.
Le lithium est un métal alcalin qui réagit violemment avec l’eau en produisant du dihydrogène. (voir
cours de seconde)
P .PECORELLA Page 9/9 18/06/2009
Vous aimerez peut-être aussi
- Piles Et OxydoréductionDocument7 pagesPiles Et Oxydoréductionmehdi benmassoudPas encore d'évaluation
- Chapitre 2 - Piles ElectrochimiquesDocument38 pagesChapitre 2 - Piles ElectrochimiquesabdellatifPas encore d'évaluation
- Chapitre 11 Piles CORRIGEDocument7 pagesChapitre 11 Piles CORRIGECharles GoPas encore d'évaluation
- Chapitre 7 ETUDE DE LA PILE DANIELLDocument22 pagesChapitre 7 ETUDE DE LA PILE DANIELLarmandngongontongaPas encore d'évaluation
- 1 - Transformation Spontanées Dans Le Piles Et Production D'énergieDocument7 pages1 - Transformation Spontanées Dans Le Piles Et Production D'énergieTaha BoulmanePas encore d'évaluation
- C9Chim Transformations Forcees PDFDocument2 pagesC9Chim Transformations Forcees PDFAzizElheni100% (1)
- 1s Ch20 TP Piles Et Oxydoreduction Corrige PDFDocument2 pages1s Ch20 TP Piles Et Oxydoreduction Corrige PDFL'aigle ImposantPas encore d'évaluation
- I. Principes de Piles Galvaniques: Demi-PileDocument15 pagesI. Principes de Piles Galvaniques: Demi-PileMOHAMMED ZOUINIPas encore d'évaluation
- Hiba PresentationDocument36 pagesHiba Presentationmostapha lamchichiPas encore d'évaluation
- Cours Les Piles Elouarde 2biofDocument9 pagesCours Les Piles Elouarde 2biofabderrazak boubekriPas encore d'évaluation
- Cours 1 Les Piles Et Récupération D'énergieDocument6 pagesCours 1 Les Piles Et Récupération D'énergieBOURASSPas encore d'évaluation
- Piles Corriges D ExercicesDocument3 pagesPiles Corriges D ExercicesAmine AlaoUii AlaouiPas encore d'évaluation
- Site TS C 09 L'ElectrolyseDocument4 pagesSite TS C 09 L'ElectrolysePecorellaPas encore d'évaluation
- 10 Electrolyse CorrectionDocument5 pages10 Electrolyse CorrectionChartier Julien100% (1)
- 7 Les PilesDocument4 pages7 Les PilesDalmareen CusubPas encore d'évaluation
- Chap Piles CouleurDocument4 pagesChap Piles CouleurIsmail ait talebPas encore d'évaluation
- Chap7 BtsDocument16 pagesChap7 BtsImen HammoudaPas encore d'évaluation
- Transformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 5Document5 pagesTransformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 5qwerty aertyPas encore d'évaluation
- Exemples Sur Les Piles Et LDocument4 pagesExemples Sur Les Piles Et Lrotorania2Pas encore d'évaluation
- Résumé de Cours Sur Les Piles Électrochimiques Pile DaniellDocument6 pagesRésumé de Cours Sur Les Piles Électrochimiques Pile DaniellchadaPas encore d'évaluation
- Chimie 3èmeDocument19 pagesChimie 3èmenaababaongo052Pas encore d'évaluation
- C8Chim Les Piles PDFDocument3 pagesC8Chim Les Piles PDFAzizElheniPas encore d'évaluation
- TP Chimie PhysiqueDocument9 pagesTP Chimie PhysiquekhaledrevialPas encore d'évaluation
- Transformations Spontanées Dans Les PilesDocument4 pagesTransformations Spontanées Dans Les PilesHassan OubassourPas encore d'évaluation
- PilesDocument6 pagesPilesmohamed laghribPas encore d'évaluation
- Pile DaniellDocument16 pagesPile DaniellYassir IbralPas encore d'évaluation
- 09 Les Piles CorrectionDocument6 pages09 Les Piles CorrectionChartier Julien100% (1)
- Transformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 1 1Document3 pagesTransformations Spontanees Dans Les Piles Et Production D Energie Exercices Non Corriges 1 1Ibtihel BoughanmiPas encore d'évaluation
- Chapitre-7 - Transformations Spontanés Dans Les PilesDocument7 pagesChapitre-7 - Transformations Spontanés Dans Les Pilesa houssPas encore d'évaluation
- RedoxDocument4 pagesRedoxCidss CssPas encore d'évaluation
- Cours S5 Chapitre 5 Pile Daniel PDFDocument10 pagesCours S5 Chapitre 5 Pile Daniel PDFSabeur KhemakhemPas encore d'évaluation
- PilesDocument21 pagesPilesMohamed El Amine SELMANIPas encore d'évaluation
- Chapitre 2 2011-2012 Les Piles ElectrochimiqueDocument8 pagesChapitre 2 2011-2012 Les Piles ElectrochimiqueHAMADA19720% (1)
- Les Piles 1Document4 pagesLes Piles 1lamia lamiaPas encore d'évaluation
- Chapitre IIIDocument17 pagesChapitre IIIahlsidihommadefatimaPas encore d'évaluation
- Cours RedoxDocument19 pagesCours RedoxSam DallaliPas encore d'évaluation
- Les PilesDocument5 pagesLes PilesMål ÆkPas encore d'évaluation
- Serie 16 ElectrolyseDocument3 pagesSerie 16 Electrolysee.maskarPas encore d'évaluation
- 26 Electrolyse Td-CorrigeDocument10 pages26 Electrolyse Td-CorrigeChiboubPas encore d'évaluation
- 0809 CpilesDocument4 pages0809 CpilesHarilaza Ny aina RZFPas encore d'évaluation
- Partie Ii Reaction Oxydo-ReductionDocument31 pagesPartie Ii Reaction Oxydo-ReductionAmr BahriPas encore d'évaluation
- La, PileDocument7 pagesLa, PileBoukhelif BoualemPas encore d'évaluation
- Chimie C Chap10 Les PilesDocument7 pagesChimie C Chap10 Les PilesImed LatrechPas encore d'évaluation
- Chimie C Chap11 ElectrolyseDocument5 pagesChimie C Chap11 Electrolysemghaete100% (1)
- Electrolyse CoursDocument6 pagesElectrolyse CoursMehdi BnmssdPas encore d'évaluation
- Serie Electrolyse Transformations ForcéesDocument6 pagesSerie Electrolyse Transformations ForcéesDaghsni Said100% (4)
- Pile de DanielleDocument3 pagesPile de DanielleAnis NissouPas encore d'évaluation
- Exercices 10 Les Piles Et Récupération D'énergieDocument1 pageExercices 10 Les Piles Et Récupération D'énergiemadaniPas encore d'évaluation
- TP - Les Piles - CorrectionDocument3 pagesTP - Les Piles - CorrectionClément CholotPas encore d'évaluation
- Cours - Chimie Electrolyse - Bac Technique (2011-2012) MR Ouerghemmi PDFDocument5 pagesCours - Chimie Electrolyse - Bac Technique (2011-2012) MR Ouerghemmi PDFLotfi Bouchareb100% (3)
- 15 C3a9lectrolyseDocument10 pages15 C3a9lectrolyseazerfazPas encore d'évaluation
- CHAPITRE II Cinetique ÉlectrochimiqueDocument13 pagesCHAPITRE II Cinetique Électrochimiquefadoua lakouissiPas encore d'évaluation
- Electro Chimie 01Document7 pagesElectro Chimie 01t123medPas encore d'évaluation
- C8Chim - Les - Piles - Exos - Alessandro Volta PDFDocument4 pagesC8Chim - Les - Piles - Exos - Alessandro Volta PDFAzizElheniPas encore d'évaluation
- 1 - Transformation Forcées - L'électrolyseDocument5 pages1 - Transformation Forcées - L'électrolyseTaha BoulmanePas encore d'évaluation
- Pile Électrochimique2024Document15 pagesPile Électrochimique2024Barhoumi MouradPas encore d'évaluation
- Electrochimie 2Document51 pagesElectrochimie 2maian saja100% (1)
- ElectroDocument30 pagesElectrofatimazahragramziPas encore d'évaluation
- 2003 Liban Correction Exo2 PileCuAg 3ptsDocument1 page2003 Liban Correction Exo2 PileCuAg 3ptskjnokinikoPas encore d'évaluation
- 2 P O2 Imagerie MedicaleDocument6 pages2 P O2 Imagerie MedicalePecorellaPas encore d'évaluation
- Decryptage Loi TravailDocument14 pagesDecryptage Loi TravailPecorellaPas encore d'évaluation
- 2 P 03.etude de MouvementDocument2 pages2 P 03.etude de MouvementPecorellaPas encore d'évaluation
- 2 P 03.observation Et Analyse de MouvementsDocument3 pages2 P 03.observation Et Analyse de MouvementsPecorellaPas encore d'évaluation
- 2 P-01 Activite2-Page15Document1 page2 P-01 Activite2-Page15PecorellaPas encore d'évaluation
- Argu Groupe SRCDocument4 pagesArgu Groupe SRCPecorellaPas encore d'évaluation
- Site TS-P 06 Les Reactions NucleairesDocument5 pagesSite TS-P 06 Les Reactions NucleairesPecorellaPas encore d'évaluation
- 2 C O3Molecules Presentes Dans Les MedicamentsDocument4 pages2 C O3Molecules Presentes Dans Les MedicamentsPecorellaPas encore d'évaluation
- 2 P O1.Analyse Signaux PeriodiquesDocument4 pages2 P O1.Analyse Signaux PeriodiquesPecorellaPas encore d'évaluation
- 2 C O2 Composition Des MedicamentsDocument8 pages2 C O2 Composition Des MedicamentsPecorellaPas encore d'évaluation
- 2 C O2 Materiel SecuriteDocument1 page2 C O2 Materiel SecuritePecorellaPas encore d'évaluation
- Site TS-P 04 La Radioactivite (Prof)Document5 pagesSite TS-P 04 La Radioactivite (Prof)PecorellaPas encore d'évaluation
- 2 C O4 Fabrications Des MedicamentsDocument3 pages2 C O4 Fabrications Des MedicamentsPecorellaPas encore d'évaluation
- 2 C O1 Des Atomes Aux IonsDocument6 pages2 C O1 Des Atomes Aux IonsPecorella100% (1)
- SiteTS-P 07 Le Dipole RCDocument10 pagesSiteTS-P 07 Le Dipole RCPecorellaPas encore d'évaluation
- 3 C 03 La Matiere Se Trans For MeDocument2 pages3 C 03 La Matiere Se Trans For MePecorellaPas encore d'évaluation
- C6 La Pile ElectrochimiqueDocument7 pagesC6 La Pile ElectrochimiquePecorellaPas encore d'évaluation
- Site TS-P 05 La Decroissance RadioactiveDocument5 pagesSite TS-P 05 La Decroissance RadioactivePecorellaPas encore d'évaluation
- C2 AtomesDocument4 pagesC2 AtomesPecorellaPas encore d'évaluation
- C3 Comprendre La Conduction ÉlectriqueDocument4 pagesC3 Comprendre La Conduction ÉlectriquePecorellaPas encore d'évaluation
- Site TS-P 09 Oscillations Dans Un Circuit RLC SerieDocument7 pagesSite TS-P 09 Oscillations Dans Un Circuit RLC SeriePecorellaPas encore d'évaluation
- Site TS-P 08 Le Dipole RLDocument7 pagesSite TS-P 08 Le Dipole RLPecorellaPas encore d'évaluation
- Site TS-P 06 Les Reactions NucleairesDocument5 pagesSite TS-P 06 Les Reactions NucleairesPecorellaPas encore d'évaluation
- C4 Reconnaissance de Quelques IonsDocument5 pagesC4 Reconnaissance de Quelques IonsPecorella100% (2)
- Site TS-P 04 La Radioactivite (Prof)Document5 pagesSite TS-P 04 La Radioactivite (Prof)PecorellaPas encore d'évaluation
- Site TS-P 02 Ondes Mecaniques Progressives PeriodiquesDocument5 pagesSite TS-P 02 Ondes Mecaniques Progressives PeriodiquesPecorella50% (2)
- Site TS-P 03 Modele Ondulatoire de La LumiereDocument3 pagesSite TS-P 03 Modele Ondulatoire de La LumierePecorella100% (1)
- Site TS C 12 CatalyseDocument3 pagesSite TS C 12 CatalysePecorellaPas encore d'évaluation
- Site TS-P 01 Ondes Mecaniques ProgressivesDocument6 pagesSite TS-P 01 Ondes Mecaniques ProgressivesPecorella100% (1)
- Site Ts C 07 Evolution - SpontaneeDocument3 pagesSite Ts C 07 Evolution - SpontaneePecorellaPas encore d'évaluation
- ETL437-Chapitre 7Document14 pagesETL437-Chapitre 7vcontrerasjPas encore d'évaluation
- Ilovepdf MergedDocument78 pagesIlovepdf MergedabdoPas encore d'évaluation
- Penas MDocument97 pagesPenas Mgranza2773Pas encore d'évaluation
- Crime Coast Code Triche Astuce Hack 2015 TelechargerDocument1 pageCrime Coast Code Triche Astuce Hack 2015 Telechargermattie8cooke6Pas encore d'évaluation
- AutorouteDocument74 pagesAutorouteRomain ThomasPas encore d'évaluation
- IoT1 CoursDocument15 pagesIoT1 CoursIsmael NOUEMSSIPas encore d'évaluation
- td3 CorrectionDocument10 pagestd3 Correctionmr nono100% (1)
- Abdelhakim Hamzaoui-1Document1 pageAbdelhakim Hamzaoui-1Hakim HamzaouiPas encore d'évaluation
- Catalogue de Vente Téléprésence: Systèmes D'Imagerie, Documentation, Éclairage, Chariots D'AppareillageDocument224 pagesCatalogue de Vente Téléprésence: Systèmes D'Imagerie, Documentation, Éclairage, Chariots D'AppareillageMoussaPas encore d'évaluation
- 13 PDFDocument26 pages13 PDFTojonirina M. RanosyPas encore d'évaluation
- Sunezy PDFDocument23 pagesSunezy PDFWalid GhrairiPas encore d'évaluation
- JM Reynaud AbscisseDocument5 pagesJM Reynaud AbscissemickygeorgescuPas encore d'évaluation
- Ex2 2009 PDFDocument6 pagesEx2 2009 PDFCap TainPas encore d'évaluation
- Strategie Marketing Maroc TelecomDocument11 pagesStrategie Marketing Maroc TelecomRasasi40% (5)
- TP ConvertisseurDocument17 pagesTP ConvertisseurMhadheb Med AminePas encore d'évaluation
- Des Textes Avec Des QuestionsDocument4 pagesDes Textes Avec Des Questionslok100% (1)
- Nikola Tesla Article Complet Wikipedia (16 Pages - 1,5 Mo)Document16 pagesNikola Tesla Article Complet Wikipedia (16 Pages - 1,5 Mo)med islem BenharkatPas encore d'évaluation
- Tecnico Linear P-CHL-FRDocument18 pagesTecnico Linear P-CHL-FREduardo CastilloPas encore d'évaluation
- Bpi m3 enDocument155 pagesBpi m3 enjohndeerePas encore d'évaluation
- Alimentation 15V 3A Ua723Document4 pagesAlimentation 15V 3A Ua723solensiPas encore d'évaluation
- Exercice No 12 CorrigéDocument4 pagesExercice No 12 CorrigéAbderrazak LemiaPas encore d'évaluation
- Elt Réseaux ElectriqueDocument31 pagesElt Réseaux ElectriqueGuenaoui Mohammed seif eddinPas encore d'évaluation
- CH 1les Radioelements PDFDocument24 pagesCH 1les Radioelements PDFZAOUIPas encore d'évaluation
- TP 2 A 1Document10 pagesTP 2 A 1Samagassi SouleymanePas encore d'évaluation
- Cours 3Document22 pagesCours 3haha2012Pas encore d'évaluation
- Livret de La formation-ENSA PDFDocument43 pagesLivret de La formation-ENSA PDFOtman Chakkor100% (1)
- Le Son-CoderDocument4 pagesLe Son-CoderSam FairirePas encore d'évaluation
- FICHE DE TDDocument5 pagesFICHE DE TDBryan NdzanaPas encore d'évaluation
- Cours Élémentaire D'électronique Vol 1 Et 2 - Ecole Armée de Terre-1Document111 pagesCours Élémentaire D'électronique Vol 1 Et 2 - Ecole Armée de Terre-1JankullPas encore d'évaluation
- HTDocument28 pagesHTDerouich2019Pas encore d'évaluation