Académique Documents
Professionnel Documents
Culture Documents
2015 071 PSI PhC1
Transféré par
TOUVOLITitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
2015 071 PSI PhC1
Transféré par
TOUVOLIDroits d'auteur :
Formats disponibles
Physique-chimie 1
Oral
Oral PSI – Physique-Chimie 1
PSI
MK34
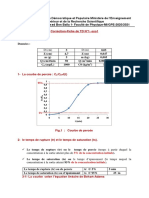
Vibrations du chlorure d’hydrogène
Vibrations du chlorure d’hydrogène
On considère une molécule de chlorure d’hydrogène (fig.1a) dont on ne s’intéresse qu’au mouvement de
vibration. L’étude est menée dans le référentiel du centre de masse de la molécule, galiléen.
On considère une molécule de chlorure d’hydrogène (figure 1) dont on ne s’intéresse qu’au mouvement de
vibration. L’étude est menée dans le référentiel du centre de masse de la molécule, galiléen.
(𝑘, ℓ0 )
A 𝐺 B
(k,l0) 𝑟
A 𝑟𝐺 (𝑡) = 0
G B
𝑟H (𝑡) r
rCl(t) rG(t) er rH(t)
𝑟Cl (𝑡)
=
0
1 - Molécule de chlorure
(a) Molécule d’hydrogène
de chlorure d’hydrogène 2 - Spectre
(b) Spectre d’absorption
d’absorption I.R. de HCl.I.R. de≠1HCl
‡(cm ) = 1/⁄(cm).
Bande d’absorption –1
centrée
𝜎(cm ) = sur la pulsation propre de la
1/𝜆(cm)
molécule.
Bande d’absorption centrée sur la
pulsation propre de la molécule
1
0,5
Amplitude
𝑉 (𝑟)
−0,5
−1
0 1 2 3 4 5
𝑟 (distance interatomique)
𝑡 (ps)
(c) Relaxation vibrationnelle de HCl (d) Allure du potentiel de Morse
3 - Relaxation vibrationnelle de HCl 4 - Allure du potentiel de Morse
longueur de la liaison H ≠ Cl d = 128 pm
énergie de liaison EH≠Cl = 4, 47 eV
masses atomiques mH = 1, 66.10≠27 kg, mCl = 5, 90.10≠26 kg
longueur de la liaison
constante de Planck H − Cl h=𝑑=6, 128 µm
63.10 ≠34
J.s
énergie de liaison 𝐸H−Cl
(e) Données = 4,47 eV
numériques
masses atomiques 𝑚H = 1,66 × 10–27 kg, 𝑚Cl = 5,90 × 10–26 kg
constante de Planck ℎ = 6,63 × 10–34 J⋅s
mHCl mH
1. On suppose les oscillations harmoniques. Déterminer rCl (t) et rH (t). On posera µ = .
5 - Données numériques m Cl + mH
2. Déterminer la constante de force k de la liaison.
3. Déterminer le facteurharmoniques.
de qualité associé à la molécule 𝑚HCl 𝑚H
1. On suppose les oscillations Déterminer 𝑟Cl (𝑡) etHCl.
𝑟H (𝑡). On posera 𝜇 = .
𝑚 +𝑚
4. A plus haute énergie, on modélise l’interaction interatomique par le potentiel deClMorseH(fig.1d) :
! "2
2. Déterminer
V (r) la
= constante de force
De 1 ≠ e≠—(r≠r e ) 𝑘 de la liaison.
. Commenter et exploiter.
3. Déterminer le facteur de qualité associé à la molécule HCl.
4. À plus haute énergie, on modélise l’interaction interatomique par le potentiel de Morse (figure 4) :
2
𝑉 (𝑟) = 𝐷𝑒 (1 − e−𝛽(𝑟−𝑟𝑒 ) ) . Commenter et exploiter.
24 mai 2016 12:28 2015-071-PSI-PhC1
CONCOURS CENTRALE-SUPELEC 1
Vous aimerez peut-être aussi
- Simple Huckel CH404Document3 pagesSimple Huckel CH404ami rPas encore d'évaluation
- Chapiii IrDocument94 pagesChapiii IrSara LouaarPas encore d'évaluation
- Corrige CF 2015-2016 PDFDocument6 pagesCorrige CF 2015-2016 PDFAsmahane FaslaPas encore d'évaluation
- Cisko Atomistikjanv. 2021Document16 pagesCisko Atomistikjanv. 2021mame gor fayePas encore d'évaluation
- Atmosphère Planétaire 4 - Cours Du 12oct2023Document19 pagesAtmosphère Planétaire 4 - Cours Du 12oct2023theimenetafatPas encore d'évaluation
- BCPST1 - Complément Cinétique - chpII - 2022Document4 pagesBCPST1 - Complément Cinétique - chpII - 2022Fannes DesignPas encore d'évaluation
- 5 - Effets électriquesDocument12 pages5 - Effets électriqueshoussam.mouhtadiPas encore d'évaluation
- Spectrscopie InfraRouge - TextMarkDocument5 pagesSpectrscopie InfraRouge - TextMarkDjohra BEDGHIOUPas encore d'évaluation
- Lesson 5 NDocument39 pagesLesson 5 Nroger odahPas encore d'évaluation
- RMN 2023Document77 pagesRMN 2023Mohamed Teigne FayePas encore d'évaluation
- PC T ch2 BilanDocument1 pagePC T ch2 BilanJihen Ben SlimaPas encore d'évaluation
- 1 AHLAFI Cours Infra RougeDocument33 pages1 AHLAFI Cours Infra RougeZerPas encore d'évaluation
- Atomistique NchoDocument14 pagesAtomistique NchonizarbouchnitaaPas encore d'évaluation
- TD OhqDocument1 pageTD OhqHicham Al FalouPas encore d'évaluation
- Chsol-Chapitre IDocument10 pagesChsol-Chapitre IelkhiatmohammedaminePas encore d'évaluation
- Spécialité Physique-Chimie - Sujet Zéro - Corrigé EXERCICE 1 - Dépolluer Une Eau Avec Des Carapaces de Crevettes (10 Points)Document7 pagesSpécialité Physique-Chimie - Sujet Zéro - Corrigé EXERCICE 1 - Dépolluer Une Eau Avec Des Carapaces de Crevettes (10 Points)Mamadou Lamine NianePas encore d'évaluation
- Preparation Des Candidats A L'Examen Du Bac 2023: Cle de CorrectionDocument7 pagesPreparation Des Candidats A L'Examen Du Bac 2023: Cle de CorrectionAgasroPas encore d'évaluation
- Corrigé Fiche N°1 Exo 1Document5 pagesCorrigé Fiche N°1 Exo 1Elaziouti AbdelkaderPas encore d'évaluation
- CH.18.Controle Qualite Dosage PDFDocument3 pagesCH.18.Controle Qualite Dosage PDFAbbassi100% (1)
- CH.18.Controle Qualite Dosage PDFDocument3 pagesCH.18.Controle Qualite Dosage PDFAbbassiPas encore d'évaluation
- Chap 11Document10 pagesChap 11Bouchra BenabdallahPas encore d'évaluation
- Ravy Diffusion DiffractionDocument84 pagesRavy Diffusion Diffractionessajdi assiaPas encore d'évaluation
- LC202 Devoir2 10-11Document4 pagesLC202 Devoir2 10-11Lo MomathPas encore d'évaluation
- DS 1 S1 - 2SP BiofDocument3 pagesDS 1 S1 - 2SP BiofBa HassanPas encore d'évaluation
- Chap IVDocument32 pagesChap IVMamadou lamine DiattaPas encore d'évaluation
- 05 Spectroscopie Dans UltravioletDocument6 pages05 Spectroscopie Dans UltravioletBibi BibaPas encore d'évaluation
- Cours Liaisons Chimiques 20-20Document57 pagesCours Liaisons Chimiques 20-20ussamautshihaPas encore d'évaluation
- A2 Niveaux D Energie AtomesDocument11 pagesA2 Niveaux D Energie AtomesfaslaPas encore d'évaluation
- 5 Spectroscopie IRDocument98 pages5 Spectroscopie IRZora El BouloulPas encore d'évaluation
- Série N° 14: Oscillations Mécaniques Forcées - Classification Des Acides Et Des BasesDocument3 pagesSérie N° 14: Oscillations Mécaniques Forcées - Classification Des Acides Et Des BasesGhada DaddouPas encore d'évaluation
- Chloroforme Deutérié (CDCL) Tétrachlorure de Carbone CCL Méthanol-D Eau Lourde (D O) ..Document13 pagesChloroforme Deutérié (CDCL) Tétrachlorure de Carbone CCL Méthanol-D Eau Lourde (D O) ..ChTri LyricsPas encore d'évaluation
- Concours 2012 (+sol.) Proposition EPST23Document19 pagesConcours 2012 (+sol.) Proposition EPST23Nidal BestPas encore d'évaluation
- TP de L'adsorptionDocument4 pagesTP de L'adsorptionBrave ZinebPas encore d'évaluation
- Bac 2015Document3 pagesBac 2015DaniokoPas encore d'évaluation
- Classification Des Principales Méthodes Électrochimiques D'analyse PDFDocument11 pagesClassification Des Principales Méthodes Électrochimiques D'analyse PDFFatima BenPas encore d'évaluation
- Corrigé+d... PDF SectroDocument25 pagesCorrigé+d... PDF SectroMohamed Belbaraka100% (2)
- TPCoaxialDocument5 pagesTPCoaxialAbdessamad EzzoubayduPas encore d'évaluation
- Cours en Diapo Cho l2 Sfa 2020Document402 pagesCours en Diapo Cho l2 Sfa 2020aymane-lamraniPas encore d'évaluation
- Evaluation N - 1 Baba El HoussineDocument2 pagesEvaluation N - 1 Baba El Houssineennassiki83% (6)
- Spectrometrie de MasseDocument7 pagesSpectrometrie de MasseSi AhmedPas encore d'évaluation
- Cin Exo PDFDocument10 pagesCin Exo PDFImed SeghierPas encore d'évaluation
- TD2 2023Document1 pageTD2 2023Malak DamichePas encore d'évaluation
- Sujet de Révision N°03Document7 pagesSujet de Révision N°03BI biPas encore d'évaluation
- Spect. Vibr. 1Document20 pagesSpect. Vibr. 1bouchra boudjPas encore d'évaluation
- Chimie Quantitative: Chapitre 1Document9 pagesChimie Quantitative: Chapitre 1Mohamed lamine CamaraPas encore d'évaluation
- Chimie - Riad BenchouchaDocument30 pagesChimie - Riad BenchouchaBrahim MerakchiPas encore d'évaluation
- Cinétique Expérimentale, Énoncés Des ExercicesDocument25 pagesCinétique Expérimentale, Énoncés Des ExercicesWafae LahjoujiPas encore d'évaluation
- Atmosphère Planétaire 5 - Cours Du 19oct2023Document16 pagesAtmosphère Planétaire 5 - Cours Du 19oct2023theimenetafatPas encore d'évaluation
- Quelques Techniques Expérimentales Mesurant Des Grandeurs PhysiqueDocument3 pagesQuelques Techniques Expérimentales Mesurant Des Grandeurs Physiquetiennou.lololPas encore d'évaluation
- Chapitre 3 Reaction NucleaireDocument36 pagesChapitre 3 Reaction NucleaireMomoBj100% (1)
- Effets Inductifs Et MesomeresDocument5 pagesEffets Inductifs Et MesomeresJunior ALLODJIPas encore d'évaluation
- MQ - SMP - S4 - Complément - Série 1 PDFDocument6 pagesMQ - SMP - S4 - Complément - Série 1 PDFRIDA ElABROUJPas encore d'évaluation
- Série 1 Chimie Generale AU 2020Document1 pageSérie 1 Chimie Generale AU 2020rekik hibaPas encore d'évaluation
- Correction Série D'exercices 1 RMNDocument4 pagesCorrection Série D'exercices 1 RMNToulmoutine ManelPas encore d'évaluation
- Devoir 1/S1 - Matière: Physique Chimie - Classe: 2 Bac STEDocument3 pagesDevoir 1/S1 - Matière: Physique Chimie - Classe: 2 Bac STEElmessaoudi100% (1)
- CM Phys SolideDocument45 pagesCM Phys SolideBenali RerbalPas encore d'évaluation
- Examen Blanc PC Prof AitouarabDocument8 pagesExamen Blanc PC Prof Aitouarabmohamed laghribPas encore d'évaluation
- Annales Du Bac - 1995-2005Document30 pagesAnnales Du Bac - 1995-2005Japhet BAOUNDOULAPas encore d'évaluation
- Cours N4 C511 (Méthodes D'analyse I) - 221021 - 225546Document28 pagesCours N4 C511 (Méthodes D'analyse I) - 221021 - 225546Jaafar ChirigPas encore d'évaluation
- Relativité restreinte, mécanique quantique et relativité générale: Base physique et mathématique de la relativité restreinte et générale et de la mécanique quantiqueD'EverandRelativité restreinte, mécanique quantique et relativité générale: Base physique et mathématique de la relativité restreinte et générale et de la mécanique quantiquePas encore d'évaluation
- Spectre AtomiqueDocument17 pagesSpectre AtomiqueFarouk MessaoudPas encore d'évaluation
- 0 TD Liaisons Chimiques 19 20Document24 pages0 TD Liaisons Chimiques 19 20Dieu-donné AkinPas encore d'évaluation
- Atome de Béryllium Et Ses Ions PDFDocument2 pagesAtome de Béryllium Et Ses Ions PDFAlaaEddineBoukhrisPas encore d'évaluation
- Solutionaqueusechap 2Document6 pagesSolutionaqueusechap 2Kawthar MokhtarPas encore d'évaluation
- CH6-orbitales HybridesDocument18 pagesCH6-orbitales HybridesRavaka DiamondraPas encore d'évaluation
- 2.2.24. Spectrophotométrie D'Absorption Dans L'InfrarougeDocument4 pages2.2.24. Spectrophotométrie D'Absorption Dans L'InfrarougeGuillaume merlaudPas encore d'évaluation
- Correction Examen Normal Coordination 20-21Document2 pagesCorrection Examen Normal Coordination 20-21Nabil mifdal100% (1)
- Chimie OrganiqueDocument8 pagesChimie OrganiqueTarik ZaidPas encore d'évaluation
- 05 - Spectrophotometerie InfrarougeDocument68 pages05 - Spectrophotometerie InfrarougeYas Miine100% (1)
- Support Cours Liaison Chimique S1 PR JENNAN 2023-2024Document37 pagesSupport Cours Liaison Chimique S1 PR JENNAN 2023-2024idmarwaa2Pas encore d'évaluation
- UV Visible CoursDocument10 pagesUV Visible CoursNadjmo Ben MessaoudPas encore d'évaluation
- Cour Exercice SpectroscopieDocument67 pagesCour Exercice SpectroscopieChk YahyaPas encore d'évaluation
- Chapitre Chimie st2sDocument6 pagesChapitre Chimie st2snabil douadiPas encore d'évaluation
- Spec AtomDocument43 pagesSpec AtomMouna MoonPas encore d'évaluation
- TD Chimie G N°2Document2 pagesTD Chimie G N°2CoulibalyPas encore d'évaluation
- Pharm2an16 Chimie Anal Saa SeaDocument13 pagesPharm2an16 Chimie Anal Saa SeaMorad RachidaPas encore d'évaluation
- RamanDocument6 pagesRamanuyuyiuiuiPas encore d'évaluation
- Questions RMN CorrDocument7 pagesQuestions RMN Corrmed yahyaPas encore d'évaluation
- TD L3 - ENS - (2) - Stabilite&CC - ElementCorrDocument7 pagesTD L3 - ENS - (2) - Stabilite&CC - ElementCorrmceciPas encore d'évaluation
- Cours 2Document27 pagesCours 2Linda MansourPas encore d'évaluation
- Correction de Serie Dexercices 1Document4 pagesCorrection de Serie Dexercices 1LAHCIENE ELHOUCINEPas encore d'évaluation
- 1.spectres Ultraviolet - Visible PDFDocument5 pages1.spectres Ultraviolet - Visible PDFkimmikPas encore d'évaluation
- TP FTIRDocument3 pagesTP FTIRMerry MerryPas encore d'évaluation
- PH Et SolubilitéDocument34 pagesPH Et SolubilitésafemindPas encore d'évaluation
- Cma 2Document11 pagesCma 2Abdou SaiPas encore d'évaluation
- Chap 1 Liaison Covalente - Théorie de LewisDocument68 pagesChap 1 Liaison Covalente - Théorie de Lewisyassineredone4Pas encore d'évaluation
- Séance 12 - P3 - CH4Document27 pagesSéance 12 - P3 - CH4Mohsine DriowyaPas encore d'évaluation
- Reactions de ComplexationDocument2 pagesReactions de ComplexationVghjhPas encore d'évaluation
- AI2 SpectroMasseDocument32 pagesAI2 SpectroMasseMartin van HammePas encore d'évaluation
- PlanDocument9 pagesPlanFati MaPas encore d'évaluation