Académique Documents
Professionnel Documents
Culture Documents
TD Chimie Appliquã - Ecinã - Tique Chimique
Transféré par
Adja Aïta BaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
TD Chimie Appliquã - Ecinã - Tique Chimique
Transféré par
Adja Aïta BaDroits d'auteur :
Formats disponibles
TD CHIMIE APPLIQUÉE CINÉTIQUE CHIMIQUE
Exercice I
L’énergie d’activation d’une réaction est 160 kJ/mol ; un catalyseur multiplie sa vitesse par
un facteur 500 à 25°C.
1) À quelle température la vitesse de la réaction est-elle la même, en l’absence de
catalyseur ?
2) Que devient la valeur de l’énergie d’activation en présence du catalyseur ?
Exercice II
Soient les deux réactions parallèles du 1er ordre conduisant, toutes deux, à la consommation
du réactif A pour donner des produits différents selon :
A → P1 et A → P2 avec k1 et k2, les constantes de vitesse respectives des deux réactions.
1) Établir l'expression de la variation de la concentration CA de A en fonction du temps.
2) Exprimer les concentrations x1 et x2 des produits P1 et P2, respectivement, en fonction
du temps. (Pensez à établir le tableau de variation chimique)
Exercice III
Dans le cas de réactions consécutives du 1er ordre : A → B → C (kA et kB sont les constantes de
vitesse) où le produit B formé se transforme lui-même en C, établir la relation qui donne la
concentration de B.
Nb : On supposera que la concentration initiale de B est nulle.
Exercice IV
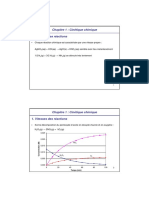
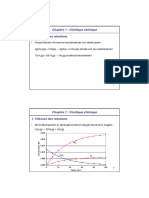
Pour la réaction : SO2Cl2(g) → SO2(g) + Cl2(g), les résultats suivants ont été obtenus :
Expérience [SO2Cl2(g)]0/mol.L-1 (Vitesse de réaction)0/mol.L-1.s-1
1 0,74 1,63x10-5
2 1,25 2,75x10-5
3 1,86 4,09x10-5
Déterminez l’ordre de la réaction et la constante de vitesse.
Nota : l’indice 0 signifie la concentration et la vitesse initiales respectivement.
Vous aimerez peut-être aussi
- TDcinét Chim.17-18Document3 pagesTDcinét Chim.17-18Joseph AmondPas encore d'évaluation
- Série Corrigé CinétiqueDocument8 pagesSérie Corrigé Cinétiquejakobslimani02Pas encore d'évaluation
- TD - Cpgo - 2023-2024 - Cinetique ChimiqueDocument4 pagesTD - Cpgo - 2023-2024 - Cinetique Chimiquedieudonnepooda71Pas encore d'évaluation
- TD de Cinetique ChimiqueDocument6 pagesTD de Cinetique ChimiquefernandPas encore d'évaluation
- TD1 023 024Document7 pagesTD1 023 024ilyesfares49Pas encore d'évaluation
- M28 Cinétique TD1Document2 pagesM28 Cinétique TD1Hassan DriouachPas encore d'évaluation
- Exercice Corrigé CinétiqueDocument13 pagesExercice Corrigé Cinétiquejakobslimani02Pas encore d'évaluation
- TD Cin & Cat SMC s5 Série 1-5 Enoncés 2020-2021Document11 pagesTD Cin & Cat SMC s5 Série 1-5 Enoncés 2020-2021Chai MaePas encore d'évaluation
- Cinétique TDDocument5 pagesCinétique TDBadr MouslimPas encore d'évaluation
- Série 1 Cinétique 2020 2021Document4 pagesSérie 1 Cinétique 2020 2021Li Na0% (1)
- Cinétique Expérimentale, Énoncés Des ExercicesDocument25 pagesCinétique Expérimentale, Énoncés Des ExercicesWafae LahjoujiPas encore d'évaluation
- Devoir Maison 1ADocument3 pagesDevoir Maison 1Atapilybintou47Pas encore d'évaluation
- TD de CinétiqueDocument14 pagesTD de CinétiqueDieu-donné Akin100% (2)
- Travaux Diriges de Cinetique Chimique L1Document4 pagesTravaux Diriges de Cinetique Chimique L1Mama El karimiPas encore d'évaluation
- Cinétique Chimique Exercices 04.TextMarkDocument16 pagesCinétique Chimique Exercices 04.TextMarkAbedPas encore d'évaluation
- 106 Thermo TDDocument16 pages106 Thermo TDEmmanuel KetPas encore d'évaluation
- TD2 Chimie Generale +CORRIGE 2016-2017Document10 pagesTD2 Chimie Generale +CORRIGE 2016-2017Awatif BePas encore d'évaluation
- TD 2Document3 pagesTD 2Simo ELyamani100% (2)
- TDtherm2023 24Document4 pagesTDtherm2023 24ines.michalonPas encore d'évaluation
- Projet Série Thermo PC 2023Document5 pagesProjet Série Thermo PC 2023fatma zahra azzouzPas encore d'évaluation
- Cinétique Chimique Exercices 01.TextMarkDocument4 pagesCinétique Chimique Exercices 01.TextMarkAbedPas encore d'évaluation
- TD 4 La ThermochimieDocument6 pagesTD 4 La Thermochimiekouma100% (1)
- Exercices Cinétique (Loi de Vitesse) - EtingueDocument2 pagesExercices Cinétique (Loi de Vitesse) - EtingueLenz Daniel Jean PaulPas encore d'évaluation
- Travaux DirigésDocument9 pagesTravaux Dirigéssad girlPas encore d'évaluation
- Cinétique Chimie Chap 1Document28 pagesCinétique Chimie Chap 1Sebastien HerdiesPas encore d'évaluation
- Exercices de Soutien Sur La Cinetique 2023-2024Document3 pagesExercices de Soutien Sur La Cinetique 2023-2024JHGPas encore d'évaluation
- Série 3-SMPC-S1-20-21Document3 pagesSérie 3-SMPC-S1-20-21BOUKHLIFIPas encore d'évaluation
- Devoir de Contrôle N°1 - Physique - Bac Math (2009-2010)Document4 pagesDevoir de Contrôle N°1 - Physique - Bac Math (2009-2010)fethi175% (4)
- Serie 2, 2014-2015 PDFDocument5 pagesSerie 2, 2014-2015 PDFongaPas encore d'évaluation
- Série TD 2 Chimie 2-2022Document1 pageSérie TD 2 Chimie 2-2022salma koudriPas encore d'évaluation
- S Rie D Exercices Corrig S Cin TiqueDocument6 pagesS Rie D Exercices Corrig S Cin Tiqueanie KheliliPas encore d'évaluation
- Cin Exo PDFDocument10 pagesCin Exo PDFImed SeghierPas encore d'évaluation
- TD Cinetique ChimiqueDocument3 pagesTD Cinetique ChimiqueSimplice Assemien100% (3)
- Travaux Dirigés de Chimie N° C2: Exercice 1: Méthode Des Vitesses InitialesDocument3 pagesTravaux Dirigés de Chimie N° C2: Exercice 1: Méthode Des Vitesses InitialesAbderrahman IGHNIHPas encore d'évaluation
- Thermochimie SMPC - TDDocument26 pagesThermochimie SMPC - TDoulaidPas encore d'évaluation
- Cinetique-chimique-Exercices 01 CompressedDocument4 pagesCinetique-chimique-Exercices 01 Compressedelmadani boutayebPas encore d'évaluation
- TD Cin & Cat SMC S5 .Document32 pagesTD Cin & Cat SMC S5 .Chai Mae100% (3)
- TD Equilibre Chimique 2016Document4 pagesTD Equilibre Chimique 2016Oumar TraoréPas encore d'évaluation
- TD Equilibre 23-24Document2 pagesTD Equilibre 23-24diderPas encore d'évaluation
- Polyc SMC s5 2021-22Document17 pagesPolyc SMC s5 2021-22Lamsaaf MohamedPas encore d'évaluation
- 6 TDPCSIcinetique 2015Document8 pages6 TDPCSIcinetique 2015Nguissaly SonkoPas encore d'évaluation
- Exercices CINETIQUE L2-2016-2017Document4 pagesExercices CINETIQUE L2-2016-2017Fati Fleur100% (5)
- Srie Dexos Cintique L3-GPDocument6 pagesSrie Dexos Cintique L3-GPFatima YahiaPas encore d'évaluation
- TD Thermodynamique Des ÉquilibresDocument19 pagesTD Thermodynamique Des Équilibresbrahimza61Pas encore d'évaluation
- Syllabus de Chimie 2Document143 pagesSyllabus de Chimie 2LucasPas encore d'évaluation
- CNTRL Cinétique PDFDocument8 pagesCNTRL Cinétique PDFAyoub EtterchPas encore d'évaluation
- TD4+Solution Thermodynamique Et Cinétique ChimiqueDocument8 pagesTD4+Solution Thermodynamique Et Cinétique ChimiqueAmira MiraPas encore d'évaluation
- Fiche de TD Valopro ThermoDocument5 pagesFiche de TD Valopro Thermomarcelina24Pas encore d'évaluation
- TD Thermodynamique BONDocument6 pagesTD Thermodynamique BONmbiguioPas encore d'évaluation
- Modelisation Des Transformations Chimiques Bilan de La Matiere Exercices Non Corriges 2 2Document5 pagesModelisation Des Transformations Chimiques Bilan de La Matiere Exercices Non Corriges 2 2ZoujKooraPas encore d'évaluation
- td6 Cinetique ChimiqueDocument2 pagestd6 Cinetique ChimiqueAdri LebPas encore d'évaluation
- TD2 Calculs Sur Les Réacteurs ChimiquesDocument2 pagesTD2 Calculs Sur Les Réacteurs ChimiquesBALANAPas encore d'évaluation
- Fiche de TD N°2 PDFDocument15 pagesFiche de TD N°2 PDFPaola DjeugaPas encore d'évaluation
- Série N°7: Cinétique ChimiqueDocument4 pagesSérie N°7: Cinétique ChimiquekerdartsPas encore d'évaluation
- TD N8 10 Variance Pot Chim Équilibres Chimiques Et Diagrammes UnairesDocument6 pagesTD N8 10 Variance Pot Chim Équilibres Chimiques Et Diagrammes Unairesemnabenslim7Pas encore d'évaluation
- Série 2 - Thermochimie - 2AP - 2024Document3 pagesSérie 2 - Thermochimie - 2AP - 2024Ayoub AitboubkerPas encore d'évaluation
- Exercices 14 Suivi Temporel PDFDocument2 pagesExercices 14 Suivi Temporel PDFYassir Ksakass50% (2)
- Chimie: Les Deux Parties Sont Indépendantes (7points) Partie 1: Réactions Acido-Basiques en Milieu Aqueux (4,75 Points)Document7 pagesChimie: Les Deux Parties Sont Indépendantes (7points) Partie 1: Réactions Acido-Basiques en Milieu Aqueux (4,75 Points)othman HassounPas encore d'évaluation
- TD Cinetiqueserie n07Document2 pagesTD Cinetiqueserie n07YASSINE AZNAGPas encore d'évaluation
- Chapitre IV Plans Pour Surface de Séponse 2024Document24 pagesChapitre IV Plans Pour Surface de Séponse 2024Adja Aïta BaPas encore d'évaluation
- TD5 DitDocument1 pageTD5 DitAdja Aïta BaPas encore d'évaluation
- TD4 DitDocument1 pageTD4 DitAdja Aïta BaPas encore d'évaluation
- TD2Document1 pageTD2Adja Aïta BaPas encore d'évaluation
- Cours Enzymologie 2022Document86 pagesCours Enzymologie 2022Adja Aïta BaPas encore d'évaluation
- Cours PsychormétrieDocument8 pagesCours PsychormétrieAdja Aïta BaPas encore d'évaluation
- Rédaction Rapport de StageDocument23 pagesRédaction Rapport de StageAdja Aïta BaPas encore d'évaluation
- Chimie Industrielle IIDocument26 pagesChimie Industrielle IIAdja Aïta BaPas encore d'évaluation