Académique Documents
Professionnel Documents
Culture Documents
2008 Dosage D'un Comprimé de Vitamine C
Transféré par
cheikhna lemrabettTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
2008 Dosage D'un Comprimé de Vitamine C
Transféré par
cheikhna lemrabettDroits d'auteur :
Formats disponibles
Accueil Ministère de l'Education nationale RESAFAD A propos de examen.sn ?
Contact
OK
ACTUALITES TERMINALE L TERMINALE G TERMINALE S1 ET S3 TERMINALE S2 INFOS PRATIQUES TELECHARGEMENTS
I
Vous êtes ici : Accueil Sciences Physiques Chimie organique Exercices du BAC 2008 : Dosage d'un comprimé de vitamine
C
Terminale S1 et S3
2008 : Dosage d'un comprimé de vitamine C Conseils
Mathématiques Détails Épreuves de l'année
Sciences Physiques Catégorie : Exercices du BAC dernière
SVT Vidéos pour réviser
Vous êtes ici :Chimie organique>2008 : Dosage d'un comprimé de vitamine
C
L'acide ascorbique de formule brute
couramment dénommé vitamine C, est un réducteur
naturel que l'on qualifie usuellement d'antioxydant. On le
trouve dans de nombreux fruits et légumes. On a montré
que la vitamine C peut prévenir des petits maux
Free Joomla 2.5 Extensions
quotidiens tels que le rhume et aider dans le traitement Joomla module Joomla Plugin
de certains cancers. En pharmacie, il est vendu sous
forme de comprimés "500 mg".
1. Un élève de terminale S se propose de vérifier
l(indication de masse d'un comprimé de "500 mg" de
vitamine C Pour cela il dissout un comprimé dans un
volume d'eau. Soit la solution obtenue.
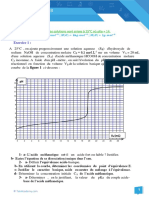
Il procède au dosage d'un volume v = 20 mL de la
solution par une solution de soude de contration
en présence d'un indicateur coloré
approprié. Le virage de l'indicateur est obtenu quand le
volume de la solution de soude versé est 11,7 mL
1.1. Qu'entend-on par indicateur coloré approprié
1.2. Ecrire l'équation bilan de la réaction de l'acide
ascorbique avec ela soude
(l'acide ascorbique sera noté , sa base conjuguée
)
1.3. A l'équivalence le pH est de 8. Justifier
qualitativemnt le caractère basique de la solution.
1.4. Déterminer la concentration de l'acide dans la
solution , puis la masse d'acide ascorbique présente
dans le comprimé. Conclure.
2. L'élève lit plus attentivement la notice du médicament
et y trouve les indications suivantes : vitamine C
tamponnée, acide ascorbique ; 247,7 mg, ascorbate de
sodium : 281,4 mg, acide ascorbique totale : 500 mg.
1.2.1 Calculer à partir des indications de la notice, les
quantités de matière d'acide ascorbique et d'ions
ascorbate présentes dans un comprimé.
2.2. On aadamet que les quantités de matière d'acide
ascorbique et d'ions ascorbates présentes dans la
solution obtenue par l'élève sont les mêmes que dans le
comprimé.
Ecrire la relation liant le pH de la soltion au pKa du
couple et en déduire la valeur prrévisible du pH de la
solution . Quelles propriétés présente la solution
? Quel est son intérêt ?
2.3. Sachant que le pH à l'intérieur de l'estomac est
voisin de 1, justifier alors, par le calcul l'indication "acide
ascorbique total : 500 mg" portée sur la notice.
Données : pKa du couple ; masses
molaires : ;
< Précédent
Suivant >
EXAMEN.SN V2.0 © RESAFAD SENEGAL - Avenue Bourguiba x rue 14 Castors, Dakar
(Sénégal) - Tél/Fax : +221 33864 62 33
Vous aimerez peut-être aussi
- TP N 2 - Titrages PH-M Triques (Titrage de L'aspirine)Document12 pagesTP N 2 - Titrages PH-M Triques (Titrage de L'aspirine)Safae Rezzouk100% (1)
- Bac 2023 Physique-Chimie - Sujet - Jour 2Document9 pagesBac 2023 Physique-Chimie - Sujet - Jour 2LETUDIANTPas encore d'évaluation
- Module 1 - Élaborer Et Adapter en Continu L'offre de Produits Et de ServicesDocument22 pagesModule 1 - Élaborer Et Adapter en Continu L'offre de Produits Et de ServicesThomas RoyPas encore d'évaluation
- NF DTU 34.1 P2 Mise en Oeuvre Des Fermetures Et StoresDocument21 pagesNF DTU 34.1 P2 Mise en Oeuvre Des Fermetures Et StoresPatrick GARCIAPas encore d'évaluation
- GP Chut Je Lis PDFDocument240 pagesGP Chut Je Lis PDFsherrie_gimenezPas encore d'évaluation
- B1 Rédiger Une Lettre de Motivation EnseignantDocument10 pagesB1 Rédiger Une Lettre de Motivation EnseignantRexeyPas encore d'évaluation
- TP #1 TabDocument3 pagesTP #1 TabNarimane DendenPas encore d'évaluation
- DST TS 2022Document26 pagesDST TS 2022dexiya94Pas encore d'évaluation
- Reactions Acide BaseDocument5 pagesReactions Acide BaseRitaj-Rayane KarimPas encore d'évaluation
- Suivi Titrage ExercicesDocument12 pagesSuivi Titrage Exercicespatatake2.0Pas encore d'évaluation
- St2s Sciences Physiques Chimiques 2015 Polynesie Sujet OfficielDocument9 pagesSt2s Sciences Physiques Chimiques 2015 Polynesie Sujet OfficielRafael CastilloPas encore d'évaluation
- Vinaigre 111819Document3 pagesVinaigre 111819Messan Corneille AbotsiPas encore d'évaluation
- Questionnaireécrit13 14Document10 pagesQuestionnaireécrit13 14Nadia Ait AhmedPas encore d'évaluation
- Chimie Pratique - Lycee Bilingue de Tougang Ii - Baccalaureat Blanc - Série C&D - Mai 2022 - CamerounDocument3 pagesChimie Pratique - Lycee Bilingue de Tougang Ii - Baccalaureat Blanc - Série C&D - Mai 2022 - CamerounclarencePas encore d'évaluation
- Eval Solutions Aqueuses 2021Document2 pagesEval Solutions Aqueuses 2021ÉnoraPas encore d'évaluation
- Bepc Blanc N°1 PCT 2021-2022Document2 pagesBepc Blanc N°1 PCT 2021-2022APPOLON Le NackyPas encore d'évaluation
- 2023 Metropole J2 Exo1 Sujet KiwiVitamineC 9ptsDocument3 pages2023 Metropole J2 Exo1 Sujet KiwiVitamineC 9ptsmoezbouchnak80Pas encore d'évaluation
- 1cm3jftoi 866968Document2 pages1cm3jftoi 866968bipPas encore d'évaluation
- tp18 Dosage Phmetrique Aspirine PDFDocument3 pagestp18 Dosage Phmetrique Aspirine PDFČhîmïî Štā100% (1)
- Epreuve CHIMIE TLe C, D E &TI 2023 02 18 10 17 33Document2 pagesEpreuve CHIMIE TLe C, D E &TI 2023 02 18 10 17 33b60032595Pas encore d'évaluation
- S Physique Chimie Obligatoire 2020 Polynesie Remplacement Sujet OfficielDocument15 pagesS Physique Chimie Obligatoire 2020 Polynesie Remplacement Sujet OfficielShahnas HAMITHPas encore d'évaluation
- Dosage Acide Ascorbique Jus de FruitDocument3 pagesDosage Acide Ascorbique Jus de FruitAli KhedirechePas encore d'évaluation
- Exercices Sur Le DosageDocument13 pagesExercices Sur Le DosageNaouma ChahdPas encore d'évaluation
- Epreuve Bac 2022 Chimie Série C D e Cameroun PDFDocument2 pagesEpreuve Bac 2022 Chimie Série C D e Cameroun PDFAmza Farel100% (2)
- TD MD ChimieDocument2 pagesTD MD ChimieMatthias KingPas encore d'évaluation
- Ece 22 PC 31Document6 pagesEce 22 PC 31ydee.margaux62Pas encore d'évaluation
- 1.série TD N°1-TABDocument2 pages1.série TD N°1-TAByacinePas encore d'évaluation
- 9-Série de TD N°9 Physique Pharmaceutique 2021-2022Document2 pages9-Série de TD N°9 Physique Pharmaceutique 2021-2022fadia sellami100% (1)
- 2023 Metropole J2 Exo1 Sujet KiwiVitamineC 9pts - 0 PDFDocument3 pages2023 Metropole J2 Exo1 Sujet KiwiVitamineC 9pts - 0 PDFMarshPas encore d'évaluation
- Bac CD Zéro Chmie Pratique 2022Document1 pageBac CD Zéro Chmie Pratique 2022hitmanPas encore d'évaluation
- Spe Physique Chimie 2021 Asie 2 Sujet OfficielDocument18 pagesSpe Physique Chimie 2021 Asie 2 Sujet OfficielGaston MichelPas encore d'évaluation
- Épreuve 2nde C CHIMIE Seq3 FONDATIONDocument2 pagesÉpreuve 2nde C CHIMIE Seq3 FONDATIONRomario nzouPas encore d'évaluation
- Serie Acide Fort - Base Forte TS2Document3 pagesSerie Acide Fort - Base Forte TS2Amadou Oury DialloPas encore d'évaluation
- AspirineDocument3 pagesAspirinemariem outahmiditPas encore d'évaluation
- Exercices 1transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseDocument1 pageExercices 1transformations Liées À Des Réactions Acido - Basiques Dans Une Solution AqueuseAyoub ShaitPas encore d'évaluation
- Série Acide Base DosageDocument5 pagesSérie Acide Base DosageBac TechniquePas encore d'évaluation
- Chap09 ExercicesDocument3 pagesChap09 ExercicesR VMPas encore d'évaluation
- Sujet 1Document5 pagesSujet 1Lilia AlouiPas encore d'évaluation
- NEW EVAL CHIMIE TC, D CrucialDocument3 pagesNEW EVAL CHIMIE TC, D Crucialb60032595Pas encore d'évaluation
- 1 EXAMEN BLANC PCT Tle C CEPG LA PROSPERITEDocument7 pages1 EXAMEN BLANC PCT Tle C CEPG LA PROSPERITEVadius COCOUPas encore d'évaluation
- Ds N 3 2016Document3 pagesDs N 3 2016Nassim TayabiPas encore d'évaluation
- Compo Du 2ème Trim Tle DDocument5 pagesCompo Du 2ème Trim Tle DMohamed MOUSSEPas encore d'évaluation
- TD Tampon 2019 LSLL WahabdiopDocument2 pagesTD Tampon 2019 LSLL WahabdiopOumou Khaïry DiopPas encore d'évaluation
- TP 03Document3 pagesTP 03Chkil AekPas encore d'évaluation
- TP2 - Détermination D'un Coefficient de PartageDocument7 pagesTP2 - Détermination D'un Coefficient de PartageOmairPas encore d'évaluation
- 2020 Polynesie Exo1 Sujet Boisson 9pts - 0Document6 pages2020 Polynesie Exo1 Sujet Boisson 9pts - 0Jœël Crèspœ KhæmænœPas encore d'évaluation
- TP Chimie 1ère Année MédecineDocument11 pagesTP Chimie 1ère Année Médecineabderrahmane lalaouiPas encore d'évaluation
- SOLUTIONS AQUEUSES AU BAC TSE-STI-TSExpDocument6 pagesSOLUTIONS AQUEUSES AU BAC TSE-STI-TSExpModibo CoulibalyPas encore d'évaluation
- 2015-Pondichery-Exo1-Correction-Vitamine C-9 PtsDocument3 pages2015-Pondichery-Exo1-Correction-Vitamine C-9 Ptsanasdiouri2020Pas encore d'évaluation
- Chimie-TleC D TI-Eval4Document6 pagesChimie-TleC D TI-Eval4hamidaPas encore d'évaluation
- TD Master BiopharmacieDocument17 pagesTD Master BiopharmacieIbrahim KAMBAPas encore d'évaluation
- Chimie Exemple 3Document9 pagesChimie Exemple 3Serge DemirdjianPas encore d'évaluation
- DST TS 2021Document35 pagesDST TS 2021Naila BakirPas encore d'évaluation
- Simili - 6h de Physique Chimie Pour Les SM MR SABOUR 2023Document10 pagesSimili - 6h de Physique Chimie Pour Les SM MR SABOUR 2023SABOUR MOHAMMEDPas encore d'évaluation
- 26 Dosage 3Document3 pages26 Dosage 3Ilyes Ben Jemaa0% (1)
- 2022 Examen 2 Chimie Solutions Corrigé LDDocument7 pages2022 Examen 2 Chimie Solutions Corrigé LDLaurent KeletaonaPas encore d'évaluation
- Solutions AqueuesDocument3 pagesSolutions AqueuesnorelPas encore d'évaluation
- Bac S 2018 Metropole Correction © Exercice IDocument2 pagesBac S 2018 Metropole Correction © Exercice IRemi Laloy100% (1)
- Serie 9 CHIMIE DES SOLUTIONS AQUEUSES 2Document2 pagesSerie 9 CHIMIE DES SOLUTIONS AQUEUSES 2deyinPas encore d'évaluation
- tp18c Dosage Phmetriq AspirineDocument3 pagestp18c Dosage Phmetriq AspirineMartialPas encore d'évaluation
- TP 2 L3 de Chimie Physique 1Document4 pagesTP 2 L3 de Chimie Physique 1Djahina bdPas encore d'évaluation
- Bac Blanc - Acides Bases Avec Correction MR SABOURDocument7 pagesBac Blanc - Acides Bases Avec Correction MR SABOURHassanEssoufiPas encore d'évaluation
- Bac C 2019Document7 pagesBac C 2019eveabaghePas encore d'évaluation
- Capture D'écran . 2023-04-05 À 11.49.07 PMDocument9 pagesCapture D'écran . 2023-04-05 À 11.49.07 PMcheikhna lemrabettPas encore d'évaluation
- Capture D'écran . 2023-11-21 À 20.00.04Document7 pagesCapture D'écran . 2023-11-21 À 20.00.04cheikhna lemrabettPas encore d'évaluation
- Capture D'écran . 2023-11-21 À 20.00.04Document7 pagesCapture D'écran . 2023-11-21 À 20.00.04cheikhna lemrabettPas encore d'évaluation
- Imo 3APIC 2019 KhénifraDocument1 pageImo 3APIC 2019 Khénifracheikhna lemrabettPas encore d'évaluation
- Controle 19 (PR Y. EL FATIMY) Partie ChimieDocument2 pagesControle 19 (PR Y. EL FATIMY) Partie Chimiecheikhna lemrabettPas encore d'évaluation
- La ProcreationDocument2 pagesLa ProcreationRihane FarahPas encore d'évaluation
- Pubquest 01Document6 pagesPubquest 01cheikhna lemrabettPas encore d'évaluation
- SC Phys S1 S1a S3 GP1 2019Document4 pagesSC Phys S1 S1a S3 GP1 2019cheikhna lemrabettPas encore d'évaluation
- Série Dexercice Courant ElactriqueDocument1 pageSérie Dexercice Courant Elactriquecheikhna lemrabettPas encore d'évaluation
- QcmcorDocument2 pagesQcmcorkalifa ben cheick konatePas encore d'évaluation
- QCM Worms CorrecDocument16 pagesQCM Worms CorrecMohamed HmamouchPas encore d'évaluation
- Serie Energie Potentielle Et MecaniqueDocument2 pagesSerie Energie Potentielle Et Mecaniquecheikhna lemrabettPas encore d'évaluation
- Targum Ou TargoumDocument5 pagesTargum Ou TargoumyeshuaPas encore d'évaluation
- Tarea 4 Conversacion Francesa 1 Exercices - Du - Devoir - 4. LewinDocument5 pagesTarea 4 Conversacion Francesa 1 Exercices - Du - Devoir - 4. LewinDilenny APas encore d'évaluation
- Tapie: L'arrêt de La Cour de CassationDocument21 pagesTapie: L'arrêt de La Cour de CassationLaurent MAUDUITPas encore d'évaluation
- Classification Des LogementsDocument1 pageClassification Des LogementsPaul KoudougouPas encore d'évaluation
- PIP Attendes Et Besoin Plan D'action Délai Responsable: ClientDocument1 pagePIP Attendes Et Besoin Plan D'action Délai Responsable: ClientEimad BlyPas encore d'évaluation
- Chapitre-4 Démographie L1Document9 pagesChapitre-4 Démographie L1Khalil ByPas encore d'évaluation
- PrezentareDocument34 pagesPrezentareA. C. E.Pas encore d'évaluation
- Actionnariat SalariéDocument4 pagesActionnariat SalariéLamyaa ErrayPas encore d'évaluation
- Chap 5 Transistor JFET MOSFETDocument15 pagesChap 5 Transistor JFET MOSFETBLYNK STEELPas encore d'évaluation
- Formation Sur L'évaluation Au Cycle SecondaireDocument3 pagesFormation Sur L'évaluation Au Cycle Secondairemourad oumansourPas encore d'évaluation
- Rapport Hebdomadaire CHECDocument31 pagesRapport Hebdomadaire CHECSoria LouboungouPas encore d'évaluation
- Emma Et La Perle Blanche PDFDocument25 pagesEmma Et La Perle Blanche PDFMonica M EtchegarayPas encore d'évaluation
- Croquer La Vie À Pleines Dents Exprime L AccordDocument3 pagesCroquer La Vie À Pleines Dents Exprime L AccordylonikaPas encore d'évaluation
- 02 InitiationDocument13 pages02 InitiationTRAOREPas encore d'évaluation
- 16 M.ncaDocument132 pages16 M.ncaAbdouli Roukaya100% (1)
- 7 Étapes Pour Lancer Sa Marque de VêtementsDocument13 pages7 Étapes Pour Lancer Sa Marque de VêtementsmedhiferrosPas encore d'évaluation
- Ar Bilan Sci 2021Document1 pageAr Bilan Sci 2021thivoyonPas encore d'évaluation
- Management Des Systemes Dinformation - ExposeDocument13 pagesManagement Des Systemes Dinformation - Exposepascal sohoPas encore d'évaluation
- Le Message PhotographiqueDocument13 pagesLe Message PhotographiqueericooalPas encore d'évaluation
- Chap2 GSM PDFDocument55 pagesChap2 GSM PDFNisrine BahriPas encore d'évaluation
- Evenements 2Document24 pagesEvenements 2Daniela BunoaicaPas encore d'évaluation
- Bacacier-Pannes ZDocument4 pagesBacacier-Pannes ZM MEHENNIPas encore d'évaluation
- Rapport Reconstruction PDFDocument37 pagesRapport Reconstruction PDFsamvipPas encore d'évaluation
- Dossier Steeman Biblio FilmoDocument36 pagesDossier Steeman Biblio FilmoWriterIncPas encore d'évaluation
- Chap 07Document30 pagesChap 07Issam Sembati100% (1)
- Les Destins de La MasturbationDocument20 pagesLes Destins de La MasturbationBruno KinoshitaPas encore d'évaluation