Académique Documents
Professionnel Documents
Culture Documents
Suivi Temporel D Une Transformation Chimique Vitesse de Reaction Activites 2
Transféré par
lhoussine.bg0 évaluation0% ont trouvé ce document utile (0 vote)
25 vues1 pageTitre original
Suivi Temporel d Une Transformation Chimique Vitesse de Reaction Activites 2
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
25 vues1 pageSuivi Temporel D Une Transformation Chimique Vitesse de Reaction Activites 2
Transféré par
lhoussine.bgDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 1
CHIMIE / Unité :1
LA TRANSF. D'UN
SYSTEME CHIMIQUE
EST-ELLE TOUJOURS
RAPIDE
-A l’aide d’une éprouvette graduée, prélever 30 mL d’une solution d’iodure de potassium (K +(aq) + I-(aq)) de
concentration C1=0,50 mol.L-1.
-A l’aide d’une autre éprouvette graduée, prélever 30 mL d’une solution de peroxodisulfate de sodium
réaction étudié
(2Na+(aq) + S2O82-(aq)) de concentration C2=0,05mol.L-1.
-Verser simultanément les deux solutions dans un bécher de 100 mL et déclencher le chronomètre.
la transformation redox entre les ions péroxodisulfate S2O82- et les ions iodures I- est modélisée par l’équation
chimique : S2O82-(aq) + 2I-(aq) → 2 SO42-(aq) + I2(aq) (1)
Au cours de cette transformation lente, le diiode donne progressivement une couleur brune à la solution.
1-Déterminer les deux couples mis en jeu lors de la réaction (1). Ecrire les demi-équations redox correspondantes.
2-Dresser le tableau d’avancement de la réaction correspond à la transformation étudiée (1) et déterminer
l’expression de la quantité de matière n (I2) du diiode formée à l’instant t en fonction de l’avancement x .
- A différents instants de date t, on prélève un volume V = 5 mL de mélange réactionnel à l’aide d’une pipette
jaugée.
- Le prélèvement est alors refroidi brusquement en le versant dans un bécher contenant de l’eau glacée.
- Le diiode est dosé par une solution de thiosulfate de sodium
(2Na+(aq)+S2O32(aq)) de concentration C3=0,010mol.L-1, en présence de quelques
gouttes d’empois d’amidon jouant le rôle d’indicateur colorée. Cette réaction
Technique de mesure
est rapide et totale.
- L’empois d’amidon prend une teinte bleue en présence de traces de diiode.
- Lors de ce dosage, les couples suivants sont mis en jeu : S4O62-(aq) / S2O32-(aq)
et I2(aq) / I-(aq) .
- Les résultats sont donnés au tableau ci-dessous.
A-Pourquoi est-il nécessaire de refroidir brusquement le contenu de la
pipette ? Quels facteurs cinétiques sont mis en jeu ?
B-Ecrire l’équation chimique de la réaction de dosage entre le diiode I2 et les
ions thiosulfate S2O32-.
C-Comment repère-t-on l’équivalence du dosage ?
D-A l’équivalence, exprimer n’(I2) en fonction de la concentration molaire C en thiosulfate de sodium et le
volume Véq , puis en déduire la quantité de matière de diiode n(I2) apparu dans le mélange réactionnel à
l’instant t.
3- complété le tableau.
Date de prélèvement
1 3 6 9 12 15 20 30 40 60 80
effective ti (min)
Veq(mL) 3,1 7,2 12 14,8 17 18,7 20,6 21,8 22,3 22,4 22,4
x(t) (mol)
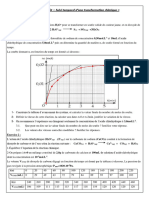
- A l’aide des résultats expérimentaux et d’un tableur on obtient le graphe x = f (t) ci-contre
Les résultats
4-Déterminer graphiquement la vitesse volumique de la réaction à l’instant t=0 et t=20min.
5- Comment varie la vitesse au cours du temps lors de cette transformation chimique ? Donner une interprétation de cette
variation.
6- déterminer graphiquement le temps de demi-réaction t1/2 : « temps au bout duquel l’avancement a atteint la moitié de sa
valeur maximale ».
www.hammoumouna.jimdo.com
Vous aimerez peut-être aussi
- SuiviDocument3 pagesSuivihahaPas encore d'évaluation
- Série D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument8 pagesSérie D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDMoulayMouly100% (6)
- Serie C1 PDFDocument4 pagesSerie C1 PDFMofid PC100% (3)
- Série N°3 Avec Correction Chimie Série Cinétique 2007 2008 (Tlili Touhami)Document14 pagesSérie N°3 Avec Correction Chimie Série Cinétique 2007 2008 (Tlili Touhami)Ltaief Chayma100% (2)
- Série D'exercices N°2 - Sciences Physiques Cinétique Chimique - Bac Sciences Exp (2013-2014) MR Alibi AnouarDocument6 pagesSérie D'exercices N°2 - Sciences Physiques Cinétique Chimique - Bac Sciences Exp (2013-2014) MR Alibi AnouarKais GuesmiPas encore d'évaluation
- Suivi CinetiqueDocument7 pagesSuivi CinetiqueMed BriniPas encore d'évaluation
- Série Cinétique Chimique 2bac: P T P T RDocument9 pagesSérie Cinétique Chimique 2bac: P T P T Rrkibi.khadija2006Pas encore d'évaluation
- Exercices 1 Suivi TemporelDocument2 pagesExercices 1 Suivi TemporelayoubbouuderqaPas encore d'évaluation
- Dev de Controle 1 Bac SC - ExpDocument5 pagesDev de Controle 1 Bac SC - ExpImed OmranePas encore d'évaluation
- SerieDocument7 pagesSeriemehdi benmassoudPas encore d'évaluation
- TSP2SP2Ch9T4-exos Resolus p245n11 246n15 250n25Document5 pagesTSP2SP2Ch9T4-exos Resolus p245n11 246n15 250n25mohPas encore d'évaluation
- Série Chimie Cinétique Chimique 2011 2012 (Dahmani Lotfi)Document4 pagesSérie Chimie Cinétique Chimique 2011 2012 (Dahmani Lotfi)Aicha DaouPas encore d'évaluation
- Exercices 1 Suivi TemporelDocument1 pageExercices 1 Suivi Temporelayoub himoune0% (1)
- Exercices 4 Suivi TemporelDocument1 pageExercices 4 Suivi TemporelOmar HibaPas encore d'évaluation
- Chimievalution PDFDocument37 pagesChimievalution PDFAnis DahnenPas encore d'évaluation
- SUIVI TEMPOREL de L'avancementDocument2 pagesSUIVI TEMPOREL de L'avancementSahbi Mabrouki YamenPas encore d'évaluation
- 651d3e5278640 Magazine1Document6 pages651d3e5278640 Magazine1yasminmarouani02Pas encore d'évaluation
- Série D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriDocument5 pagesSérie D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriTawfiq Weld EL Arbi0% (1)
- Correction TP4 de CinétiqueDocument5 pagesCorrection TP4 de CinétiqueDjaafeurMenouar80% (5)
- Vitesse 2Document5 pagesVitesse 2lemiaPas encore d'évaluation
- Capture D'écran . 2023-11-16 À 19.24.58Document14 pagesCapture D'écran . 2023-11-16 À 19.24.58azeddineelghazoui637Pas encore d'évaluation
- Avancement 2Document2 pagesAvancement 2Foudil LaouiciPas encore d'évaluation
- Ob s1 Cinetique ChimiqueDocument2 pagesOb s1 Cinetique Chimiquemedabdellahisamba34Pas encore d'évaluation
- Série D'exercices - Sciences Physiques Préparez Votre Baccalauréat Cinetique Chimique - Bac Sciences Exp (2013-2014) MR Sdiri Anis PDFDocument4 pagesSérie D'exercices - Sciences Physiques Préparez Votre Baccalauréat Cinetique Chimique - Bac Sciences Exp (2013-2014) MR Sdiri Anis PDFAzizElheniPas encore d'évaluation
- 12 Chimie TSe 1Document5 pages12 Chimie TSe 1foud18Pas encore d'évaluation
- Activité Suivi Temporel Par TitrageDocument1 pageActivité Suivi Temporel Par TitrageAicha Daou100% (1)
- Exercice 9 Suivi Temporel Dune Transformation ChimiqueDocument1 pageExercice 9 Suivi Temporel Dune Transformation ChimiqueCatuk Ella100% (2)
- Exercices 7 Suivi TemporelDocument1 pageExercices 7 Suivi Temporelكورة لايفPas encore d'évaluation
- Chim 03 TP 1Document2 pagesChim 03 TP 1Mouhieddine KhailiPas encore d'évaluation
- 0607DM2 PDFDocument3 pages0607DM2 PDFFoudil Laouici100% (1)
- 1 - Suivi Temporel D'une Transformation - Vitesse de RéactionDocument12 pages1 - Suivi Temporel D'une Transformation - Vitesse de RéactionTaha BoulmanePas encore d'évaluation
- Serie Avancement1Document2 pagesSerie Avancement1amine touatiPas encore d'évaluation
- 02 TP Cinetique DosagesDocument3 pages02 TP Cinetique Dosagesssg100% (1)
- Local Media6834814526131562016Document296 pagesLocal Media6834814526131562016Raouf Elwazr100% (1)
- Serie Revision n1 Chimie HS 21Document5 pagesSerie Revision n1 Chimie HS 21Mh RaouenPas encore d'évaluation
- Exercices - Cinétique Chimique - Chapitre 6Document3 pagesExercices - Cinétique Chimique - Chapitre 6Marwan Azerty100% (2)
- TS2TDC42013Document4 pagesTS2TDC42013Najimou Alade TidjaniPas encore d'évaluation
- Ex 1Document2 pagesEx 1soulaimaneelaouni220Pas encore d'évaluation
- Série 2 2 Bac SMDocument3 pagesSérie 2 2 Bac SMYns Frakchi92% (12)
- Ahim NoureddineDocument4 pagesAhim NoureddineAlaoui Amine100% (1)
- Série Révision Mars 23Document8 pagesSérie Révision Mars 23Ahmed Baba Mohameden HamdiPas encore d'évaluation
- Chimie TD 3 Cinétique Chimique PDFDocument4 pagesChimie TD 3 Cinétique Chimique PDFOussama El BouadiPas encore d'évaluation
- Chimie TD 3 Cinétique ChimiqueDocument4 pagesChimie TD 3 Cinétique ChimiqueFranck Momo100% (1)
- Sciences Physiques - Cinetique Chimique-Gazzah MahmoudDocument3 pagesSciences Physiques - Cinetique Chimique-Gazzah MahmoudMahmoud GazzahPas encore d'évaluation
- Correction Du TP - Suivi Temporel D'une Transformation Chimique Par ...Document3 pagesCorrection Du TP - Suivi Temporel D'une Transformation Chimique Par ...WaliD MerabeT0% (1)
- TP Chimie n1Document4 pagesTP Chimie n1Adel Laimeche100% (1)
- 2-Cinetique ChimiqueDocument5 pages2-Cinetique ChimiqueAnis Dahnen0% (1)
- MR Amara: Devoir de Contrôle N°1 ChimieDocument10 pagesMR Amara: Devoir de Contrôle N°1 ChimieFadhel Fourat BoughanmiPas encore d'évaluation
- 5 - Etude Quantitative DDocument1 page5 - Etude Quantitative Dkarlaboujaoude99Pas encore d'évaluation
- Exercices 4 Suivi TemporelDocument1 pageExercices 4 Suivi TemporelThe KuuPas encore d'évaluation
- Revision T°s ChimieDocument4 pagesRevision T°s ChimiebipPas encore d'évaluation
- Applications Suivi20.21Document3 pagesApplications Suivi20.21Phobos ElfaPas encore d'évaluation
- Série D'exercices - Chimie Cinétique Chimique - Bac Sciences Exp (2011-2012) MR Dahmani LotfiDocument0 pageSérie D'exercices - Chimie Cinétique Chimique - Bac Sciences Exp (2011-2012) MR Dahmani LotfiMouf55Pas encore d'évaluation
- Cinétique Chimique App PDFDocument6 pagesCinétique Chimique App PDFAzizElheni100% (1)
- Toxiques DomestiquesDocument5 pagesToxiques DomestiquesAyoub BENSAKHRIAPas encore d'évaluation
- Serie 1 Generalites Sur La Chimie OrganiqueDocument2 pagesSerie 1 Generalites Sur La Chimie OrganiquePretty QueenPas encore d'évaluation
- BCH 200 Acides NucleiquesDocument30 pagesBCH 200 Acides NucleiquesS.Théophile KOURAPas encore d'évaluation
- API20EDocument56 pagesAPI20EbenniaPas encore d'évaluation
- Mémoire 2016 CéramiqueDocument88 pagesMémoire 2016 Céramiqueimene benaliPas encore d'évaluation
- 2014 387 389 Juil. Aout Sept. Oct. p166 Boulliard - HDDocument4 pages2014 387 389 Juil. Aout Sept. Oct. p166 Boulliard - HDlaetitia.flowerainbowPas encore d'évaluation
- Cours 1 Polymères (Polymérisation Radicalaire) 2022Document12 pagesCours 1 Polymères (Polymérisation Radicalaire) 2022omatrPas encore d'évaluation
- 10 GlycogeneDocument34 pages10 GlycogeneTatapong LauraPas encore d'évaluation
- 1729316434Document2 pages1729316434saad_m12100% (1)
- Serie C5 Composes Oxygenes 1S1 WWW - Axloutoth.snDocument7 pagesSerie C5 Composes Oxygenes 1S1 WWW - Axloutoth.snthierno DialloPas encore d'évaluation
- Tfe Kalunga MawazoDocument81 pagesTfe Kalunga Mawazoamitthai MasengoPas encore d'évaluation
- PhisiqueDocument8 pagesPhisiquejessee-petit-4524Pas encore d'évaluation
- Exercices (Chimie Organique) DR ZAABAT.N PDFDocument5 pagesExercices (Chimie Organique) DR ZAABAT.N PDFlibrairie- papeterie des allees seddikPas encore d'évaluation
- 11Document31 pages11Anonymous rqSbi4Pas encore d'évaluation
- TP EquilibrechimiqueDocument8 pagesTP Equilibrechimiquecherazer67% (3)
- UntitledDocument293 pagesUntitledMohamed AIT KASSIPas encore d'évaluation
- Charbon Hydrocarbures Pfe 2020 S6Document42 pagesCharbon Hydrocarbures Pfe 2020 S6HIND LAMRANIPas encore d'évaluation
- Diagramme Scholler BerkalofDocument6 pagesDiagramme Scholler BerkalofAbdou Miringhi100% (1)
- Chimie OrganiqueDocument52 pagesChimie OrganiqueRivaldo Nvo Nguema Avomo100% (1)
- TH4533Document104 pagesTH4533Dòùñïã ĎòùPas encore d'évaluation
- Tableau Periodique Des ElementsDocument2 pagesTableau Periodique Des Elementsdamien_roule5728Pas encore d'évaluation
- Ph-Solution Aqueuse-Autoprotolyse de L'eau-TsDocument2 pagesPh-Solution Aqueuse-Autoprotolyse de L'eau-TsSeydina WadePas encore d'évaluation
- Les Caractères Généraux Des LipidesDocument10 pagesLes Caractères Généraux Des Lipidesرزقي إبن فلسطينPas encore d'évaluation
- Bensefa RMI 2011 VFDocument29 pagesBensefa RMI 2011 VFBenahmed IsmailPas encore d'évaluation
- 3 PermeabilitéDocument4 pages3 PermeabilitéRaouf BoushabaPas encore d'évaluation
- RAPPORT Ocp 2019Document41 pagesRAPPORT Ocp 2019Youssef Hidane100% (2)
- Chapitre 6 - Reaction Chimique Complements IDocument5 pagesChapitre 6 - Reaction Chimique Complements IAmir NadeauPas encore d'évaluation
- Cours Heterocycliques Aromatiques BicycliquesDocument11 pagesCours Heterocycliques Aromatiques Bicycliquesزهير محيصرPas encore d'évaluation
- Série D'exercices Suivie TemporelDocument12 pagesSérie D'exercices Suivie Temporelamribtzahra2Pas encore d'évaluation
- TD N°8-2 PDFDocument4 pagesTD N°8-2 PDFWalid GLPas encore d'évaluation
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Manuel pour les débutants Fabriquez des savons naturelsD'EverandManuel pour les débutants Fabriquez des savons naturelsÉvaluation : 3 sur 5 étoiles3/5 (2)
- Anatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursD'EverandAnatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursPas encore d'évaluation
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- Technologie automobile: Les Grands Articles d'UniversalisD'EverandTechnologie automobile: Les Grands Articles d'UniversalisPas encore d'évaluation
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- Le B.A.-Ba de la communication: Comment convaincre, informer, séduire ?D'EverandLe B.A.-Ba de la communication: Comment convaincre, informer, séduire ?Évaluation : 3 sur 5 étoiles3/5 (1)
- Manuel de fabrication du savon: Je fabrique mes savons facilementD'EverandManuel de fabrication du savon: Je fabrique mes savons facilementÉvaluation : 5 sur 5 étoiles5/5 (4)
- Géobiologie de l'habitat et Géobiologie sacrée: Pour un lieu sainD'EverandGéobiologie de l'habitat et Géobiologie sacrée: Pour un lieu sainÉvaluation : 4.5 sur 5 étoiles4.5/5 (2)
- 500 secrets pour avoir un potager merveilleuxD'Everand500 secrets pour avoir un potager merveilleuxÉvaluation : 2 sur 5 étoiles2/5 (1)
- Conception & Modélisation CAO: Le guide ultime du débutantD'EverandConception & Modélisation CAO: Le guide ultime du débutantPas encore d'évaluation
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Histoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsD'EverandHistoire de la psychologie scientifique: De la naissance de la psychologie à la neuropsychologie et aux champs d'application les plus actuelsPas encore d'évaluation
- L'Ombre à l'Univers: La structure des particules élémentaires XIIfD'EverandL'Ombre à l'Univers: La structure des particules élémentaires XIIfPas encore d'évaluation
- Géologie de l'Amérique: Les Grands Articles d'UniversalisD'EverandGéologie de l'Amérique: Les Grands Articles d'UniversalisPas encore d'évaluation
- Jus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTD'EverandJus de Fruits et de Légumes Crus: 57 recettes faciles et un Guide Pratique Complet pour améliorer votre alimentation .: Santé, Vitalité et Minceur, avec ... ET DURABLEMENTPas encore d'évaluation
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)