Académique Documents
Professionnel Documents
Culture Documents
Grandeurs Physiques Liées Aux Quantités de Matière
Transféré par
Bahcin Ait Oumghar0 évaluation0% ont trouvé ce document utile (0 vote)
22 vues2 pagesTitre original
Grandeurs physiques liées aux quantités de matière
Copyright
© © All Rights Reserved
Formats disponibles
DOCX, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
22 vues2 pagesGrandeurs Physiques Liées Aux Quantités de Matière
Transféré par
Bahcin Ait OumgharDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
Grandeurs physiques liées aux quantités de matière
I. Détermination de la quantité de matière d’une espèce chimique solide ou liquide :
1. Définition de la quantité de matière :
♣ La quantité de matière, notée n, est la grandeur utilisée pour spécifier un nombre d'entités microscopiques (atomes,
molécules, ions, etc.). Son unité est la mole (mol).
♣ Une mole est la quantité de matière d'un système contenant NA, entités élémentaires (atomes, molécules, ions ...)
NA= 6,02.1023 est appelé : le nombre d'Avogadro.
♣ La quantité de matière n d’un échantillon est le rapport du nombre d’élément N qu’il contient sur le nombre d’Avogadro
NA.
N ( X)
n( X )= 2. Relation entre la masse et la quantité de matière :
NA
♣ La quantité de matière contenue dans un échantillon de masse m est donnée par la relation suivante :
m( X )
n ( X )= ♣ Cette relation s'applique pour les solides les liquides (et même pour les gaz) mais il est plus commode de
M (X)
caractériser un gaz par son volume que par sa masse.
♣ M(X) est la masse molaire de l’espèce chimique X en g.mol-1.
Application 1:
Avec une balance électronique , on mesure successivement la masse m 1 d’un échantillon d’eau et m2 d’un échantillon de fer
Fe . On trouve : m1 = m2 = 100g
1. Calculer la masse molaire M(H2O) des molécules d’eau .
2. Calculer les quantités de matière contenue dans chaque échantillon.
Données : M(H) = 1g/mol , M(O) = 16g/mol , M(Fe) = 56g/mol
3. Le volume et la quantité de matière :
3.1. La masse volumique et la densité :
♣ La masse volumique ρ d’une espèce chimique est égale au rapport de sa masse m par son volume V.
m( X )
ρ ( X )= Son unité dans S.I est kg/m3
V (X )
♣ La densité d est le rapport entre la masse d’un volumique ρ du corps considéré et la masse volumique d’un corps de
référence ρ0 (l’eau pour les liquides et les solides).
m( X) ρ( X)
♣ Pour un liquide ou solide : d ( X)= =
meau ρeau
Remarque 1: À 25°C, la masse volumique de l’eau est égale à ρeau = 1,00 kg.L-1 = 1,00 g.mL-1
Remarque 2: La densité est un nombre qui s’exprime sans unité.
3.2. Relation entre le volume et la quantité de matière :
♣ Connaissant le volume V d’un échantillon d’une espèce chimique et la masse volumique ρ de cette espèce, on en déduit la
masse de l’échantillon : m ( X )= ρ ( X ) . V ( X)
m( X )
On a aussi : n ( X )=
M (X)
ρ ( X ) . V ( X)
♣ On en déduit donc la relation entre la quantité de matière et le volume de l’échantillon : n ( X )=
M (X)
Ainsi, la masse volumique ρ d’un corps et sa densité d par rapport à l’eau sont liées par la relation : ρ ( X ) =d ( X ) . ρ eau
d ( X ) . ρeau . V (X )
On écrit donc : n ( X )=
M(X )
Application 2:
Lors de la synthèse de l’acétate de benzyle, on utilise un volume V(al) = 20,0ml d’alcool benzylique C7H8O de densité par
rapport à l’eau d(al) = 1,04. La masse volumique de l’eau ρeau = 1,00g/ml.
Quelle est la quantité de matière n(al) d’alcool benzylique utilisée ?
II. Détermination de la quantité de matière de matière d’un gaz :
1. La loi de Boyle-Mariotte :
1.1. Expérience :
♣ On comprime un gaz, en faisant varier le volume V, dans une seringue, et on mesure la pression P du gaz correspondant.
1.2. Résultat :
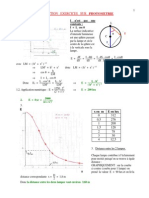
V(m3) 1,5.10-5 2,0.10-5 2,5.10-5 3,5.10-5
P(Pa) 9985 7490 5990 4280
P.V(Pa.m3) 0,1498
1- Remplir le tableau ci-dessous.
2- A partir du tableau de mesures, indiquer comment évolue la pression de l’air
3- Tracer la courbe de variation de P en fonction de 1/V.
4- A température constante T et pour une quantité de matière n d’un gaz donné, quelle relation remarquable lie les grandeurs
P (pression) et V (volume).
1.3. Conclusion :
♣ La loi de Boyle Mariotte définit une relation entre le volume, la température et la pression. Elle explique que la pression
varie en fonction du volume, à température constante. P ⋅V =Ctⅇ
2. Echelle absolue de la température :
La température absolue T en degré Kelvin (K) est la grandeur macroscopique qui caractérise l’agitation moléculaire du gaz.
La température usuelle θ en degré Celsius (°C) et la température absolue T sont liées par la relation suivante :
T ( k )=θ( °C)+273 , 153. Relation des gaz parfaits :
♣ L’équation d’état des gaz parfaits est une relation entre la pression P, le volume V, et la température T d’un gaz pour une
quantité de matière n : P ⋅V =n . R .T
P : est la pression en pascal Pa
V : le volume du gaz en m3
n : la quantité de matière en mol
T : la température en kelvin K
R : la constante des gaz parfait, sa valeur est : R = 8,314 SI
♣ Connaissant la température, la pression et le volume d’un gaz, on peut donc à l’aide de cette équation déterminer la
quantité de matière correspondante :
P ⋅V
n ( X )=
R ⋅T
4. Le volume molaire :
♣ Définition : Le volume molaire d’un gaz (Vm) est le volume occupé par une mole de ce gaz dans des conditions données
(dépend de la pression P et de la température T).
Remarque 1 : Pour des conditions usuelles (θ=20°C et P=1 bar),le volume molaire est 24 L.mol -1.
Pour des conditions normales (θ=0°C et P=1 bar),le volume molaire vaut 22,4L.mol -1.
Remarque 2 : Le volume molaire d'un gaz est donc indépendant de la nature de ce gaz et ne dépend que de la pression P et de
la température T de ce gaz.
♣ Connaissant le volume V d’un échantillon de gaz, à température et pression connues, on peut calculer la quantité de
matière n contenue dans cet échantillon à partir du volume molaire V m des gaz dans les mêmes conditions de température et
de pression :
V (X )
n ( X )= III. la quantité d’une soluté moléculaire en solution :
Vm
La concentration molaire C(X) d’un solut ́e moléculaire X dissous dans une solution homogène est égale au quotient de la
n(X)
quantité n(X) par le volume V de la solution . C ( X )=
V
En déduit la quantité de matière de soluté X en solution par la relation : n ( X )=C ( X ) . V
♣ Relation entre concentration massique Cm et la concentration molaire C.
m
On sait que : C m= et m=n⋅ M
V
n⋅M n
En déduit que : C m= = ⋅M
V V
→ C m=C ∙ M
Vous aimerez peut-être aussi
- 676 - Analyseionnelle Et Similitudes en Mécanique Des Fluides - Chemloul - TDMDocument4 pages676 - Analyseionnelle Et Similitudes en Mécanique Des Fluides - Chemloul - TDMChaker Ben ZidPas encore d'évaluation
- Lecon N°2 Grandeurs Physiques Liées...Document3 pagesLecon N°2 Grandeurs Physiques Liées...Jihad ELPas encore d'évaluation
- Grandeurs Physiques Liees A La Quantite de Matiere Cours 4 4Document4 pagesGrandeurs Physiques Liees A La Quantite de Matiere Cours 4 4Zouhair TajePas encore d'évaluation
- Lecon N°2 Grandeurs Physiques Liées Aux Quantité de MatièreDocument3 pagesLecon N°2 Grandeurs Physiques Liées Aux Quantité de MatièreJihad ELPas encore d'évaluation
- Grandeurs Physques Liées Aux Quantités de MatièreDocument9 pagesGrandeurs Physques Liées Aux Quantités de MatièrePtcProPas encore d'évaluation
- 1 - Les Grandeurs Physiques Liées À La Quantité de MatièreDocument14 pages1 - Les Grandeurs Physiques Liées À La Quantité de MatièreRafik RidaPas encore d'évaluation
- Chapitre 3 Les Grandeurs Physiques Liées À La Quantité de MatièreDocument3 pagesChapitre 3 Les Grandeurs Physiques Liées À La Quantité de Matièreateich simohamedPas encore d'évaluation
- Les Grandeurs Physiques Liées À La Quantité de Matière - AnwalDocument5 pagesLes Grandeurs Physiques Liées À La Quantité de Matière - AnwalMohamed ElouakilPas encore d'évaluation
- Grandeurs Physiques Liees A La Quantite de Matiere Resume de Cours 1Document2 pagesGrandeurs Physiques Liees A La Quantite de Matiere Resume de Cours 1Aissam1 RenaultPas encore d'évaluation
- Resumer Onde Et SuiviDocument27 pagesResumer Onde Et SuiviZiad BounejmaPas encore d'évaluation
- La Mole TC BiofDocument3 pagesLa Mole TC BiofMinou MouchouPas encore d'évaluation
- Grandeurs Physiques Liees A La Quantite de Matiere Resume de Cours 1Document2 pagesGrandeurs Physiques Liees A La Quantite de Matiere Resume de Cours 1Omhajar HananPas encore d'évaluation
- 1 BIOF Grandeurs Liées À La Quantité de Matière CH1Document4 pages1 BIOF Grandeurs Liées À La Quantité de Matière CH1mohamedagzaiel45Pas encore d'évaluation
- E Ph1psi2017 PDFDocument8 pagesE Ph1psi2017 PDFBrandy OdonnellPas encore d'évaluation
- 1ere S 2020Document51 pages1ere S 2020sbrv69hxpkPas encore d'évaluation
- TherDocument9 pagesTherSaliou SENEPas encore d'évaluation
- MoleDocument3 pagesMolea houssPas encore d'évaluation
- Cours La Mole Unite de Quantite de Matiere 3Document4 pagesCours La Mole Unite de Quantite de Matiere 3awaisaazoumiPas encore d'évaluation
- Cours 5 (PR Hmmou Mouna)Document2 pagesCours 5 (PR Hmmou Mouna)Amine AlaoUii AlaouiPas encore d'évaluation
- TD PCE DecourDocument122 pagesTD PCE DecourGildo TamenePas encore d'évaluation
- Cours ConductanceDocument1 pageCours Conductanceفيديو بالعربي100% (1)
- Chapitre 6 - Reaction Chimique Complements IDocument5 pagesChapitre 6 - Reaction Chimique Complements IAmir NadeauPas encore d'évaluation
- Chap 3 Quantite de MatiereDocument5 pagesChap 3 Quantite de Matieretoto TOTOROTOPas encore d'évaluation
- Les Bases de La Chimie Cours LatexDocument5 pagesLes Bases de La Chimie Cours LatexYoussra mhaouiPas encore d'évaluation
- 151 1s Ii.0 Formulaire PDFDocument2 pages151 1s Ii.0 Formulaire PDFYassir RochdPas encore d'évaluation
- 1 Thermodynamique Classique Et Appliquée LicenceDocument85 pages1 Thermodynamique Classique Et Appliquée LicenceJean Luc NgouafongPas encore d'évaluation
- Cours Thermo PDFDocument28 pagesCours Thermo PDFKarime AminePas encore d'évaluation
- Cours ThermoDocument28 pagesCours Thermosarazin93Pas encore d'évaluation
- Exam Phys Stat 2010Document4 pagesExam Phys Stat 2010Hadjer JojoPas encore d'évaluation
- Chap II Aspect Cinétique de La ThermodynamiqueDocument21 pagesChap II Aspect Cinétique de La ThermodynamiqueJean Marc LengePas encore d'évaluation
- Cours Quantité de MatiereDocument2 pagesCours Quantité de MatiereYoussef ArbaPas encore d'évaluation
- c2 CoursDocument14 pagesc2 Coursmohktarahmad38Pas encore d'évaluation
- Thème 1 Et 11 UVDocument30 pagesThème 1 Et 11 UVSophiath Modoukpè SOULEPas encore d'évaluation
- 7-La Mole Et Les Grandeurs Molaires (1)Document10 pages7-La Mole Et Les Grandeurs Molaires (1)Abderrahim ZgrPas encore d'évaluation
- ExtraitDocument8 pagesExtraitStéphane WilliamPas encore d'évaluation
- c7 TC Inter Prof Sbiro (WWW - Pc1.ma)Document2 pagesc7 TC Inter Prof Sbiro (WWW - Pc1.ma)cpm fessaisPas encore d'évaluation
- TD MP-2Document17 pagesTD MP-2Ali Said100% (1)
- Les Grandeurs Physiques Liees A La Quantite de Matiere Cours 1Document6 pagesLes Grandeurs Physiques Liees A La Quantite de Matiere Cours 1Mahfoud Natsu67% (3)
- Chimie-Chapitre1-Mesures Quantite Matiere PDFDocument3 pagesChimie-Chapitre1-Mesures Quantite Matiere PDFRedouane Reda100% (1)
- Chimie-Chapitre1-Mesures Quantite MatiereDocument3 pagesChimie-Chapitre1-Mesures Quantite Matierela physique selon le programme Français100% (2)
- Partiel Phys Stat 2011Document4 pagesPartiel Phys Stat 2011Andrew BenPas encore d'évaluation
- 1.les Lois PhysiquesDocument5 pages1.les Lois PhysiquesMétatron GamesPas encore d'évaluation
- Thermodynamique Part 3Document39 pagesThermodynamique Part 3Mohammed AjjorPas encore d'évaluation
- Chap3-4 Lp105Document22 pagesChap3-4 Lp105lile aichaPas encore d'évaluation
- THERMODYNAMIQUE Des GAZ PARFAITSDocument30 pagesTHERMODYNAMIQUE Des GAZ PARFAITSM LPas encore d'évaluation
- Cadre Théorique OK - New1Document15 pagesCadre Théorique OK - New1Oumar TraoréPas encore d'évaluation
- c2 1bac Biof - Les Grandeurs Liées À La Quantité de Matière Prof - Sbiro (WWW - Pc1.ma)Document2 pagesc2 1bac Biof - Les Grandeurs Liées À La Quantité de Matière Prof - Sbiro (WWW - Pc1.ma)HAMADA1972100% (1)
- c2 1bac Biof - Les Grandeurs Liées À La Quantité de Matière Prof - Sbiro (WWW - Pc1.ma) PDFDocument2 pagesc2 1bac Biof - Les Grandeurs Liées À La Quantité de Matière Prof - Sbiro (WWW - Pc1.ma) PDFHAMADA1972100% (2)
- Les Grandeurs Liées À La Quantité de MatièreDocument2 pagesLes Grandeurs Liées À La Quantité de MatièreHoda hodatiPas encore d'évaluation
- Cours Masse Molaire ConcentrationDocument4 pagesCours Masse Molaire ConcentrationFlorence Clerc Zanin100% (1)
- TDThermo 1Document3 pagesTDThermo 1Ihsan Mokhlisse0% (1)
- C2 CH 1bacDocument4 pagesC2 CH 1bacAnass El MansouriPas encore d'évaluation
- Les Grandeurs Physiques Liés Aux Quantités de MatièresDocument3 pagesLes Grandeurs Physiques Liés Aux Quantités de MatièresraysouhaylPas encore d'évaluation
- 1ere Partie La MOLEDocument3 pages1ere Partie La MOLEkapalab108Pas encore d'évaluation
- Chapitre 1Document9 pagesChapitre 1abderrahmane lalaouiPas encore d'évaluation
- TD1 Corr ThérmoIIDocument7 pagesTD1 Corr ThérmoIIhafydsalah11Pas encore d'évaluation
- PH402Document27 pagesPH402ALI DOCTAR MASSIBOUPas encore d'évaluation
- Thermo-SMPC1 Chap 2Document21 pagesThermo-SMPC1 Chap 2aamrica695Pas encore d'évaluation
- Série1 ThermodynamiqueDocument2 pagesSérie1 Thermodynamiquentji sangarePas encore d'évaluation
- TP 2Document6 pagesTP 2mouna zouaouiPas encore d'évaluation
- BUL t.61 z.2Document130 pagesBUL t.61 z.2joPas encore d'évaluation
- Tel 00002564Document27 pagesTel 00002564Hubert DjemnePas encore d'évaluation
- Etude EolienneDocument124 pagesEtude Eoliennetoto100% (2)
- Chapitre 1 Généralités Sur La Compatibilité ÉlectromagnétiqueDocument31 pagesChapitre 1 Généralités Sur La Compatibilité Électromagnétiqueسمير المتوليPas encore d'évaluation
- Hyperstatisme CoursDocument5 pagesHyperstatisme CoursAmina AzmiPas encore d'évaluation
- Compte Rendu EpuDocument55 pagesCompte Rendu EpuKooraNow HD100% (1)
- Balastros Sola BasicDocument15 pagesBalastros Sola BasicscatmaPas encore d'évaluation
- 4195 Dossier Reponses Epreuve E11 Bac Pro RC 2013Document14 pages4195 Dossier Reponses Epreuve E11 Bac Pro RC 2013Kouchad FouadPas encore d'évaluation
- KANBANDocument15 pagesKANBANYoussef AmhinePas encore d'évaluation
- Partie 1 Chap 3.modèle OndulatoireDocument8 pagesPartie 1 Chap 3.modèle OndulatoiredPas encore d'évaluation
- Biomécanique Et Course À PiedDocument47 pagesBiomécanique Et Course À Piedsb aliPas encore d'évaluation
- Activité L' Énergie CinétiqueDocument2 pagesActivité L' Énergie CinétiqueShakib MesbahiPas encore d'évaluation
- Cours MQ 2016-2017 Definitive - PR BENABICHA PDFDocument83 pagesCours MQ 2016-2017 Definitive - PR BENABICHA PDFSoukainaPas encore d'évaluation
- TD1 Calcul Des Impédances (1562)Document7 pagesTD1 Calcul Des Impédances (1562)Ridha KasriPas encore d'évaluation
- CAJ9513T: Compresseur / CompressorDocument2 pagesCAJ9513T: Compresseur / Compressorali zalatPas encore d'évaluation
- Chapitre 1Document27 pagesChapitre 1Mohamed Dia-eddinePas encore d'évaluation
- Série Révision.4ScT.Document8 pagesSérie Révision.4ScT.Hichem Hamdi0% (1)
- EXAMEN CM CNAM Sujet 2 Session 1Document2 pagesEXAMEN CM CNAM Sujet 2 Session 1Nwilfried WiillyPas encore d'évaluation
- R Sum Ondes Et Vibrations FRDocument2 pagesR Sum Ondes Et Vibrations FRahmed ahmadPas encore d'évaluation
- Mprendre La RheologieDocument223 pagesMprendre La RheologieJmp Klm100% (2)
- 2 Serie TD ADocument3 pages2 Serie TD Ayugensh2Pas encore d'évaluation
- CH I Rappel de Thermodynamique10-11Document15 pagesCH I Rappel de Thermodynamique10-11SirineJamoussiPas encore d'évaluation
- Correction Exercices Photometrie 2Document4 pagesCorrection Exercices Photometrie 2DJ Sly Kimo67% (3)
- Rappel de Notions Fondamentales Sur Les Circuits ÉlectriquesDocument7 pagesRappel de Notions Fondamentales Sur Les Circuits ÉlectriquesBanany Az-eddinePas encore d'évaluation
- Colle 7 Tsi PFS 6Document1 pageColle 7 Tsi PFS 6yasser bhPas encore d'évaluation
- Chapitre Matériaux Magnétiques FinisDocument23 pagesChapitre Matériaux Magnétiques Finismiss khanPas encore d'évaluation
- Flambage EC3Document12 pagesFlambage EC3BESSIEREPas encore d'évaluation