Académique Documents
Professionnel Documents
Culture Documents
Exercices Loi de Beer Lambert (Révison Contrôle Commun)
Transféré par
Asmae Elm0 évaluation0% ont trouvé ce document utile (0 vote)
40 vues2 pagesexercice loi de beer lambert
Titre original
exercices Loi de Beer Lambert (révison contrôle commun)
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentexercice loi de beer lambert
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
40 vues2 pagesExercices Loi de Beer Lambert (Révison Contrôle Commun)
Transféré par
Asmae Elmexercice loi de beer lambert
Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
Exercices: Loi de Beer-Lambert.
Exercice 1:
Document 1 :
Matériel disponible:
- Solution étalon de permanganate de potassium
KMnO4 à 0,0500 mol/L.
- Colorimètre : longueurs d’onde proposées : 430,
470, 565 et 635nm.
- Eau distillée
- Solution de permanganate de potassium KMnO4 de
concentration inconnue.
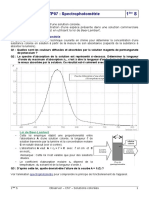
Document 2 : Spectre d’absorbance du permanganate
de potassium.
Document 3 : Cercle chromatique:
On règle le colorimètre, on mesure les absorbances des solutions étalon et inconnue, elles valent respectivement
1,32 et 0,47.
1. Quelle est la couleur de la solution étudiée ?
2. Quelle longueur d’onde de travail sélectionne-t-on sur le colorimètre ?
3. Avant de faire la mesure des absorbances des 2 solutions, comment nomme-t-on la manipulation à effectuer sur le
colorimètre ? En quoi consiste cette manipulation ?
4. Etablir l’expression littérale de la concentration de la solution inconnue en fonction des données.
5. Calculer la valeur de cette concentration.
Exercice 2 : Dosage spectrophotométrique.
Donnée: M(CuSO4) = 249,6 g/mol
Matériel disponible:
- Solution mère de sulfate de cuivre CuSO4 à 47,0 g/L
- Colorimètre réglé à la longueur d’onde adaptée à la solution étudiée et dont le «blanc» a été réalisé.
- Eau distillée
- Râtelier contenant 5 tubes à essais + bouchons.
- 2 burettes graduées.
- Solution de sulfate de cuivre CuSO4 de concentration inconnue.
1. Déterminer la valeur de la concentration de solution mère en mol/L.
2. Expliquer le principe d’un dosage spectrophotométrique.
3. Expliquer comment on réalise expérimentalement l’échelle de teintes.
4. Déterminer la valeur des concentrations (en g/L) des solutions de sulfate de cuivre constituant l’échelle de teinte.
5. On mesure l’absorbance de chaque solution puis on trace la courbe : absorbance A en fonction de la concentration
massique t.
a. Qu’obtient-on comme type de courbe ? Justifier.
b. Comment fait-on pour connaitre la valeur de la concentration de la solution inconnue (proposer 2 méthodes).
6. L’absorbance de la solution inconnue vaut 0,63.
a. Noter l’ordonnée et l’abscisse de la courbe ci-dessous.
b. Déterminer par les 2 méthodes la valeur de la concentration en sulfate de cuivre de la solution inconnue.
0,80
0,60
0,40
0,20
10,0 20,0 30,0 40,0 50,0
7. Pourquoi ne détermine-t-on pas plus simplement la valeur de la concentration de la solution inconnue c’est-à-dire
avec la même méthode que dans l’exercice 1 ?
Vous aimerez peut-être aussi
- L3 TAA Toutes Les Series TD TABCorrigésDocument27 pagesL3 TAA Toutes Les Series TD TABCorrigésIbtissam HmPas encore d'évaluation
- Détermination Par Spectrophotométrie de La Quantité de Cuivre Dans Une Solution de Cuso .5H O de Concentration InconnueDocument11 pagesDétermination Par Spectrophotométrie de La Quantité de Cuivre Dans Une Solution de Cuso .5H O de Concentration InconnueNoélie BarrèrePas encore d'évaluation
- Spectrophotometrie MnO4Document4 pagesSpectrophotometrie MnO4Anaëlle Avril88% (8)
- 61 CoursbeerlambertprofDocument6 pages61 CoursbeerlambertprofDanaPas encore d'évaluation
- TP1 Dosage_Par_Etalonnage_UV-Visible v élèveDocument3 pagesTP1 Dosage_Par_Etalonnage_UV-Visible v élèveyjz2sp8kk7Pas encore d'évaluation
- LYTP Dosage Par Étalonnage - Utilisation de La Loi de Beer LambertDocument3 pagesLYTP Dosage Par Étalonnage - Utilisation de La Loi de Beer LambertZineb Khadrane0% (1)
- TP AbidiDocument11 pagesTP AbidiLara sennaouiPas encore d'évaluation
- TD Ndeg7 - Spectro Uv-Visible To PDFDocument2 pagesTD Ndeg7 - Spectro Uv-Visible To PDFSaoud HadjerPas encore d'évaluation
- TD Methodes Danalyse 19 20Document15 pagesTD Methodes Danalyse 19 20stani kamdoum0% (1)
- Université Batna 2 Département D'électroniqueDocument4 pagesUniversité Batna 2 Département D'électroniqueAbdealaziz BouhoreiraPas encore d'évaluation
- TP 2 Tda L3 GDPDocument3 pagesTP 2 Tda L3 GDPLina alikh100% (2)
- TP 2 Tda l3 Gdp-1Document3 pagesTP 2 Tda l3 Gdp-1Mål ÆkPas encore d'évaluation
- TP 2 Tda L3 GDPDocument3 pagesTP 2 Tda L3 GDPMål ÆkPas encore d'évaluation
- spectro kmno4Document1 pagespectro kmno4sihem ayadiPas encore d'évaluation
- DS1spe 1Document2 pagesDS1spe 1zaydscameurPas encore d'évaluation
- Td n3 Tech AnalyseDocument2 pagesTd n3 Tech AnalyseMeriem SmadhiPas encore d'évaluation
- Uv Visible 04Document12 pagesUv Visible 04NaoumichaimaaPas encore d'évaluation
- TP 2 Dosage Par Etalonnage de L Eau de Dakin EleveDocument5 pagesTP 2 Dosage Par Etalonnage de L Eau de Dakin Elevekarim maziz100% (3)
- Corrigé tp06Document3 pagesCorrigé tp06lmd2009100% (11)
- TP Chimie Compte Rendu TitrageDocument9 pagesTP Chimie Compte Rendu TitrageYosr Rhouma100% (1)
- SpectrophotométrieDocument1 pageSpectrophotométriesana aitmimiPas encore d'évaluation
- TP 02 Dosage Par SpectrophotométrieDocument3 pagesTP 02 Dosage Par SpectrophotométrieleilaPas encore d'évaluation
- Série TD 1Document3 pagesSérie TD 1Čœür Dê MįēlPas encore d'évaluation
- A1-Loi de Beer Lambert (Bis)Document3 pagesA1-Loi de Beer Lambert (Bis)nicoflixPas encore d'évaluation
- Ch1 TP2 Et 3 Absorbance Dune Solution ColoreeDocument5 pagesCh1 TP2 Et 3 Absorbance Dune Solution ColoreeEvaPas encore d'évaluation
- Chapitre_2_Dosage_sprectrophotom_trique_PROFDocument4 pagesChapitre_2_Dosage_sprectrophotom_trique_PROFzabsi533Pas encore d'évaluation
- TD SpectroDocument6 pagesTD SpectroHk Eh50% (2)
- 1.série TD N°1-TABDocument2 pages1.série TD N°1-TAByacinePas encore d'évaluation
- TD HPLC Énoncé EtuDocument6 pagesTD HPLC Énoncé EtuDiallo Katy100% (1)
- Travaux Pratique 3 de Chimie PDFDocument9 pagesTravaux Pratique 3 de Chimie PDFBenouna Rajae Amina100% (1)
- Chimie TP6 ProfDocument4 pagesChimie TP6 ProfBrahim ABAGHOUGHPas encore d'évaluation
- Exercices UV-visible 2023-24Document7 pagesExercices UV-visible 2023-24oumayma oufirPas encore d'évaluation
- Examen2 Techniques Danalyses BiologiqueDocument5 pagesExamen2 Techniques Danalyses BiologiqueaxelPas encore d'évaluation
- TP #01 - 2e Année - Fiche de TP 2021-2022Document3 pagesTP #01 - 2e Année - Fiche de TP 2021-2022asma belkheirPas encore d'évaluation
- TDDocument7 pagesTDHaddad NiâmaPas encore d'évaluation
- Série DosageDocument8 pagesSérie DosageAicha Daou100% (1)
- TP Titrage Ions Chlorure Par MohrDocument3 pagesTP Titrage Ions Chlorure Par MohrNarimene Ch100% (2)
- Raport Aa VFDocument14 pagesRaport Aa VFypxbwpd4fhPas encore d'évaluation
- TP3.1 Chimie Générale Spectro UV-VisDocument4 pagesTP3.1 Chimie Générale Spectro UV-VisGaetan BenoitPas encore d'évaluation
- PC GENE SUJET 041 Exo2 Chi PiscineClBeerDocument6 pagesPC GENE SUJET 041 Exo2 Chi PiscineClBeerElias AthanassiadisPas encore d'évaluation
- No13 10 Mai 2022 Sujetexa - ComDocument2 pagesNo13 10 Mai 2022 Sujetexa - ComNgouen AnouarPas encore d'évaluation
- Polycopié de Travaux PratiquesDocument19 pagesPolycopié de Travaux PratiquesEL Hassania EL HERRADIPas encore d'évaluation
- TP 01 Itroduction Au SpectrophotométrieDocument3 pagesTP 01 Itroduction Au SpectrophotométrieAhmed SaciPas encore d'évaluation
- Loi de Beert LambertDocument3 pagesLoi de Beert LambertMalak El jadiriPas encore d'évaluation
- TP5 SpectrophotoDocument4 pagesTP5 SpectrophotoKerherve Julien100% (1)
- Correction DST12015 16Document4 pagesCorrection DST12015 16cavabPas encore d'évaluation
- 2d 1s tle D (n'dali) 22-23Document7 pages2d 1s tle D (n'dali) 22-23Vadius COCOUPas encore d'évaluation
- Master (PACQ)Document1 pageMaster (PACQ)Imane MouamrPas encore d'évaluation
- No15 2ndACD 25 Mars 2023 Sujetexa - ComDocument2 pagesNo15 2ndACD 25 Mars 2023 Sujetexa - ComGjhgPas encore d'évaluation
- Adsorption Du de Méthylène Sur La Sciure de Bois FinDocument10 pagesAdsorption Du de Méthylène Sur La Sciure de Bois Finعبد الكريمPas encore d'évaluation
- TP2b Chimie Cinetique-Spectrophotometrie Correct PDFDocument8 pagesTP2b Chimie Cinetique-Spectrophotometrie Correct PDFMariemBoujmalPas encore d'évaluation
- Compte Rendu AlginatesDocument4 pagesCompte Rendu AlginatesSibylle Kary-PotesPas encore d'évaluation
- TP:SpectrophotometreDocument11 pagesTP:Spectrophotometreghamoudraid90Pas encore d'évaluation
- Compte-Rendu (HPLC) - 04:03Document7 pagesCompte-Rendu (HPLC) - 04:03Jade100% (1)
- TD N°1 VolumDocument2 pagesTD N°1 VolumAbderrahmane AmzidPas encore d'évaluation
- TD N°1 VolumDocument2 pagesTD N°1 VolumAbderrahmane AmzidPas encore d'évaluation
- TD N°1 VolumDocument2 pagesTD N°1 VolumAbderrahmane AmzidPas encore d'évaluation
- Adsorption Du de Méthylène Sur La Sciure de Bois FinDocument10 pagesAdsorption Du de Méthylène Sur La Sciure de Bois Finhamza layachi100% (6)
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Receuil Des Exercices RDMDocument11 pagesReceuil Des Exercices RDMGhizlane AâdelPas encore d'évaluation
- Bouchelliga HocineDocument66 pagesBouchelliga HocineYazid HelalPas encore d'évaluation
- Validation de La Methode Volum - MENDIL Jihane - 3293Document37 pagesValidation de La Methode Volum - MENDIL Jihane - 3293kaltoum0% (1)
- razafnitsalamaManohinainaMG ESPA ING 10Document116 pagesrazafnitsalamaManohinainaMG ESPA ING 10RatovoarisoaPas encore d'évaluation
- Amalgames DentairesDocument31 pagesAmalgames DentairesBESSAIH RymPas encore d'évaluation
- EXERCICES Bilan de La MatièreDocument25 pagesEXERCICES Bilan de La Matièresine abdellahPas encore d'évaluation
- Chapitre 33 Structure Comportement Des PolymeresDocument21 pagesChapitre 33 Structure Comportement Des PolymeresCHERIFPas encore d'évaluation
- Metabolisme Du GlycogeneDocument4 pagesMetabolisme Du GlycogeneJérémie barakaPas encore d'évaluation
- PRO52 7H133CTFR - Rev 8 - 01 21Document4 pagesPRO52 7H133CTFR - Rev 8 - 01 21h.akid.sosvertigePas encore d'évaluation
- D1 TS2 2024 LSLL - WahabdiopDocument2 pagesD1 TS2 2024 LSLL - WahabdiopNDEYE FATOU CISSE NIASSEPas encore d'évaluation
- PRESENTATION DU MEMOIRE Sur L'Evolution Du Phénomène D'eutrophisation Barrage de Boukoudane Wilaya de TipazaDocument38 pagesPRESENTATION DU MEMOIRE Sur L'Evolution Du Phénomène D'eutrophisation Barrage de Boukoudane Wilaya de TipazaIbrahima KonePas encore d'évaluation
- Direction Des Etudes Et RecherchesDocument147 pagesDirection Des Etudes Et RecherchesYasmine BekhtiPas encore d'évaluation
- CompDéfini MG ZNDocument4 pagesCompDéfini MG ZNChikov ÆminePas encore d'évaluation
- Memoire de Fin D'Etude: Tomentosa. LDocument70 pagesMemoire de Fin D'Etude: Tomentosa. Lmaroua henkaPas encore d'évaluation
- La CarbonatationDocument3 pagesLa CarbonatationNasro Ouahab100% (2)
- Travaux Pratiques: Traitements Des EauxDocument12 pagesTravaux Pratiques: Traitements Des EauxAbPas encore d'évaluation
- Fiche Progression 1ere APCDocument8 pagesFiche Progression 1ere APCFREDERIC NOUGEPas encore d'évaluation
- Dosage Acido Basique Cours LatexDocument3 pagesDosage Acido Basique Cours LatexSaif Yassine Touil100% (1)
- La Liaison Céramo DR - benaCHI.HDocument4 pagesLa Liaison Céramo DR - benaCHI.HDrissa KonatéPas encore d'évaluation
- Piles Et OxydoréductionDocument7 pagesPiles Et Oxydoréductionmehdi benmassoudPas encore d'évaluation
- CH Gene Cours Atomistique Et Liaison ChimiqueDocument25 pagesCH Gene Cours Atomistique Et Liaison ChimiqueMbaye AbouPas encore d'évaluation
- 4 6037156664350606938Document80 pages4 6037156664350606938MR. PROPas encore d'évaluation
- TP 1 OptiqueDocument8 pagesTP 1 OptiqueHafsa SlamiPas encore d'évaluation
- SANGLERAT Tome 1 PDFDocument285 pagesSANGLERAT Tome 1 PDFMohammed Kamel BerraniPas encore d'évaluation
- S+ Rie51011Document5 pagesS+ Rie51011Rami MouadPas encore d'évaluation
- Chi CoordDocument11 pagesChi CoordAbderrahim BelmJouJPas encore d'évaluation
- Exercice 1Document2 pagesExercice 15i99 Tuuyg9Pas encore d'évaluation
- Problématique?: Colorants Pollution EnvironnementDocument47 pagesProblématique?: Colorants Pollution EnvironnementBouchra NasriPas encore d'évaluation
- Escalier Metallique SecondaireDocument3 pagesEscalier Metallique SecondaireQuentin BindziPas encore d'évaluation
- Masse VolumiqueDocument2 pagesMasse VolumiqueOussama Lamhili100% (1)