Académique Documents
Professionnel Documents
Culture Documents
Ato 06
Transféré par
Diallo Ibrahima SoryTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Ato 06
Transféré par
Diallo Ibrahima SoryDroits d'auteur :
Formats disponibles
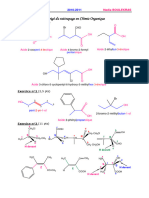
Corrigé exercice 6
BENZÈNE ET MOLÉCULES DÉRIVÉES
Le benzène
1) Le benzène peut être décrit par deux formules mésomères équivalentes :
H H
H C H H C H
C C C C
C C C C
H C H H C H
H H
Ces deux formules mésomères sont de même représentativité, ce qui rend compte de l’équivalence
stricte des six liaisons carbone-carbone du cycle ; elle sont toutes rigoureusement de même longueur
et intermédiaires entre simple et double liaison comme le montrent les données expérimentales.
La notation de Robinson et Shortland peut être vue comme une représentation topologique (seules les
liaisons C − C figurent) de l’hybride des deux formules mésomères : le « noyau aromatique », c’est-à-
dire le cercle figurant au centre de l’hexagone régulier, représente les trois doublets conjugués,
délocalisés sur les six liaisons carbone-carbone.
Le cyclopentadiène
2) Structure du cyclopentadiène :
H H
C C
C C
H C H
H H
Les deux doublets sont conjugués, mais toute autre formule mésomère ferait apparaître une
séparation de charges et une lacune sur un atome de carbone :
H H H H H H
C C
)
C C C C
H
C
C
C
H
( H
+C
C
C
_
H
_
H
C C+
H
C
H H H H H H
formules trËs peu reprÈsentatives
formules très peu représentatives
(‡ ne
(àpas Ècrire
ne pas a priori
écrire !) !)
a priori
Seule la formule sans séparation de charges représente correctement la molécule, celle-ci contient
donc deux liaisons doubles et trois liaisons simples bien distinctes :
Les liaisons doubles sont plus courtes que les simples.
3) En cédant un proton H! à une base, le cyclopentadiène est transformé en sa base conjuguée,
l’anion cyclopentadiényle :
Chimie organique Exercice 6 Page 1 sur 4
H H base H H
C C _ C C
+ B + BH
C C C C
H C H H _ C H
H H H
cyclopentadiËne
cyclopentadiène anionanion
cyclopentadiényle
cyclopentadiÈnyle
On constate alors que l’on peut écrire cinq formules mésomères équivalentes de cet anion :
H H H _ H H H H H H _ H
C C C C C C C C C C
C C C C C C C C C C
H _ C H H C H H _ C H H C
_
H H C H
H H H H H
On en conclut que les cinq liaisons carbone-carbone sont exactement de même longueur.
4) Pour passer d’une formule mésomère à une autre, on déplace à chaque fois deux doublets ; pour
obtenir l’ensemble des cinq formules, c’est un total de trois doublets qu’il faut tour à tour déplacer,
tous les autres restant à la même position. On dit que l’anion cyclopentadiényle contient trois
doublets conjugués autour du cycle. Il est ainsi similaire au benzène ; cette conjugaison lui apporte
une stabilité particulière et lui confère une géométrie plane :
Le cyclopentadiène est un composé aromatique.
Cet anion est un pentagone régulier. On utilise également la notation de Robinson et Shortland pour le
décrire, en y ajoutant la charge – au centre :
Le cyclopentadiène vu à la question 2 ne possède que deux doublets conjugués, il n’est pas aromatique.
Quelques dérivés substitués du benzène
5) Dans toutes les molécules de cette question, le groupe C" H# désigne le groupe phényle, c’est-à-
dire le substituant dérivé du benzène, que l’on peut noter de différentes façons :
semi-développée
semi-dÈveloppÈe C6H5 X ou Ph X
H H H H
C C C C
dÈveloppÈe
développée H C C X H C C X
C C C C
H H H H
topologique
X X
Robinson et Shortland X
Chimie organique Exercice 6 Page 2 sur 4
Afin de ne pas répéter à chaque fois les deux formules mésomères, tout en gardant une bonne lisibilité
du cycle benzénique, on choisit ici la notation de Robinson et Shortland. On peut ainsi se concentrer
sur l’écriture du substituant X selon Lewis, qui est visiblement l’objectif de cette question.
O O _
nitrobenzène + +
nitrobenzËne N N
O _ O
H
aniline N
H
ion ion +
benzènediazonium
benzËnediazonium N N
6) Dans le nitrobenzène, le type VSEPR autour de l’atome d’azote est AX$ .
La géométrie est donc triangulaire plane. Les angles ne valent pas exactement 120°, car il y a deux
types de liaisons :
- la liaison simple C − N ;
- les deux liaisons N − O parfaitement équivalentes (car la molécule est l’hybride des deux formules
mésomères équivalentes), intermédiaires entre une simple et une double liaison, donc plus répulsives
que la liaison simple C − N.
L’angle ONO est donc légèrement supérieur à 120°(valeur expérimentale : 123,2°) :
O
a
Ph N b
a
O
𝛼 < ~120° et 𝛽 > ~120°
Dans l’aniline, le type VSEPR autour de l’azote est AX$ E% .
La géométrie est donc une pyramide à base triangulaire de sommet l’azote.
Le doublet non liant étant a priori plus répulsif que les liaisons simples, on pourrait s’attendre à des
angles CNH et HNH mesurant moins de 109°. En réalité, cette valeur est supérieure !
Ce cas (difficile !) s’explique par le fait que le doublet libre de l’azote est partiellement délocalisé, car il
est conjugué avec les doublets du cycle aromatique voisin :
_
H + H
N N
H H
_ + H + H
N N
H _ H
Les trois formules de droite sont très peu représentatives de l’aniline car il y a une séparation de
charges. On ne les écrit donc pas en temps normal. Mais ces trois formules ont tout de même une petite
contribution dans l’hybride. Or dans ces trois formules, il n’y a pas de doublet non liant autour de
Chimie organique Exercice 6 Page 3 sur 4
l’azote ; si on raisonnait sur ces formules, le type VSEPR serait AX$ et les angles devraient donc y être
de 120° !
En définitive, l’angle mesuré est légèrement supérieur à 109° (la valeur exacte est difficile à mesurer
en raison d’oscillations de la molécule) :
Ph N
H
>109∞ H
>109°
Dans l’ion benzènediazonium, le type VSEPR est AX& . La géométrie est linéaire.
180° +
180∞
Ph N N
Le naphtalène
7) Comme dans le benzène, on peut déplacer (formellement) les liaisons multiples conjuguées,
dans le cycle de droite ou dans le cycle de gauche :
8) Chacune des formules mésomères précédentes contribue probablement à peu près autant à la
description de la molécule. On s’aperçoit ainsi qu’il y a deux types de liaisons dans le naphtalène :
- celles (en gras ci-dessous) qui sont simples dans deux formules mésomères sur trois et
doubles dans la troisième formule ;
- celles qui sont doubles dans deux formules mésomères sur trois et simples dans la troisième.
Les liaisons en gras ont donc davantage un caractère de liaison simple que de liaison double : elles sont
donc plus longues (141,0, 142,1 et 142,5 pm) que les autres qui, au contraire, sont plus proches d’une
liaison double que d’une liaison simple (136,1 pm).
Chimie organique Exercice 6 Page 4 sur 4
Vous aimerez peut-être aussi
- Exercices 41 CorrigeDocument11 pagesExercices 41 Corrige130660LYC OMAR BENABDELAZIZ NEDROMAPas encore d'évaluation
- L'Encyclopédie Des Plantes Bio-Indicatrices Alimentaires Et Médicinales Guide de Diagnostics Des Sols Vol 1Document356 pagesL'Encyclopédie Des Plantes Bio-Indicatrices Alimentaires Et Médicinales Guide de Diagnostics Des Sols Vol 1La-nature Sauvage100% (2)
- TD Chimie Organique (Epst23-2012)Document23 pagesTD Chimie Organique (Epst23-2012)Äbđøú ÆzízPas encore d'évaluation
- EXERCICES Géométrie de Quelques MoléculessDocument11 pagesEXERCICES Géométrie de Quelques MoléculessdhoubzainabPas encore d'évaluation
- 1 StereochimieDocument37 pages1 StereochimieChadrack kapukuPas encore d'évaluation
- Chapitre 4-Série BDocument45 pagesChapitre 4-Série BsextansPas encore d'évaluation
- Cours APC de Chimie Premiere C DDocument90 pagesCours APC de Chimie Premiere C Dmarc kamdemPas encore d'évaluation
- Ato 05Document2 pagesAto 05polskapepcio72Pas encore d'évaluation
- Chimie - Fiche 5 - Structure Des Composés OrganiquesDocument5 pagesChimie - Fiche 5 - Structure Des Composés OrganiquesCamille DucastelPas encore d'évaluation
- Analyse-Fonct 2023Document33 pagesAnalyse-Fonct 2023Abidli IchrakPas encore d'évaluation
- A/ Différentes Formules Pour Représenter Une MoléculeDocument4 pagesA/ Différentes Formules Pour Représenter Une MoléculeJeremy ForoiPas encore d'évaluation
- Correction DS3Document2 pagesCorrection DS3LordWazzPas encore d'évaluation
- Livre Final de Chimie P (C D)Document90 pagesLivre Final de Chimie P (C D)Valeria PeredaPas encore d'évaluation
- Analyse ConformationnelleDocument7 pagesAnalyse ConformationnelleJean-François Abena100% (1)
- T02 FJ Resolu2Document2 pagesT02 FJ Resolu2Kenza BnPas encore d'évaluation
- Cours IsomerieDocument11 pagesCours IsomerieJean-François Abena100% (1)
- Chapitre 4Document34 pagesChapitre 4sextansPas encore d'évaluation
- Chapitre 4 Explication SupplDocument3 pagesChapitre 4 Explication SupplBrahim ABAGHOUGHPas encore d'évaluation
- Cours HydrocarburesDocument8 pagesCours HydrocarburesDavy Mougin-sisini100% (1)
- 171 Stereo Exo LivreDocument10 pages171 Stereo Exo LivreFawzi ChakirPas encore d'évaluation
- Serie TD 2 L2BCGS 2022 - 2023-5Document2 pagesSerie TD 2 L2BCGS 2022 - 2023-5Daour NdiayePas encore d'évaluation
- Stereochimie Chim 201-05-06cDocument13 pagesStereochimie Chim 201-05-06cToumany FofanaPas encore d'évaluation
- td02 Chimie4Document3 pagestd02 Chimie4Samba BarhamPas encore d'évaluation
- Exercices Corriges Sur La Polarite de Quelques Molecules en ChimieDocument2 pagesExercices Corriges Sur La Polarite de Quelques Molecules en ChimienzalakandaguymydhaPas encore d'évaluation
- Organique 15-16 SolutionDocument1 pageOrganique 15-16 Solutiondrisszekraoui14Pas encore d'évaluation
- Chimie-Organique Cor CH4 PDFDocument9 pagesChimie-Organique Cor CH4 PDFCatherine DebeiPas encore d'évaluation
- Alcane Chimie OrganiqueDocument16 pagesAlcane Chimie OrganiqueFaculté De Médecine BécharPas encore d'évaluation
- Organique 13-14 SolutionDocument2 pagesOrganique 13-14 Solutiondrisszekraoui14Pas encore d'évaluation
- Planche 2 - 3Document2 pagesPlanche 2 - 3Ayoub MahiPas encore d'évaluation
- TD II Sol 2016Document15 pagesTD II Sol 2016Ammar BoutarfaPas encore d'évaluation
- Cours SMP SMC Chapitre IVDocument81 pagesCours SMP SMC Chapitre IVHamza Samir100% (1)
- Poly 13x14 Polymères Structure PropriétésDocument18 pagesPoly 13x14 Polymères Structure PropriétéssirinsirinbzbzPas encore d'évaluation
- Serie N°02 Chimie OrganiqueDocument4 pagesSerie N°02 Chimie Organiqueyacine habbiPas encore d'évaluation
- PC 3ème - L7 - Les AlcanesDocument9 pagesPC 3ème - L7 - Les AlcanesGedion Doua100% (1)
- Td11chim2019 2020Document3 pagesTd11chim2019 2020Med Stu DentPas encore d'évaluation
- Chap 3 StèrèoisomèrieDocument81 pagesChap 3 StèrèoisomèrieZakia Medad100% (1)
- Edoc - Pub - Corrige Hei Chimie Organique 1999 ChimieDocument7 pagesEdoc - Pub - Corrige Hei Chimie Organique 1999 ChimieMohamed DahmanePas encore d'évaluation
- L02 Chimie - AlcanesDocument6 pagesL02 Chimie - AlcanessouffotalonfookorogalvaniPas encore d'évaluation
- Auto Eval 21Document4 pagesAuto Eval 21petitaudeliePas encore d'évaluation
- Correction s5 Jan 2016 Org MekDocument6 pagesCorrection s5 Jan 2016 Org MekLamsaaf MohamedPas encore d'évaluation
- Orga 03Document3 pagesOrga 03Emmanuel LoubahasraPas encore d'évaluation
- Chap 2, AlcènesDocument8 pagesChap 2, AlcènesChTri LyricsPas encore d'évaluation
- Polycopie 1 TD Chimie OrganiqueDocument11 pagesPolycopie 1 TD Chimie OrganiqueNadia amelPas encore d'évaluation
- CorrigéDocument3 pagesCorrigéSi smailPas encore d'évaluation
- Corrige Exercices 14 21 Chimie OrganiqueDocument33 pagesCorrige Exercices 14 21 Chimie OrganiqueFofo BokovouPas encore d'évaluation
- Exo ISI 13 14 NomenclatureDocument2 pagesExo ISI 13 14 NomenclatureJoseph 27Pas encore d'évaluation
- ch3 Alcanes Et CycloalcanesDocument61 pagesch3 Alcanes Et CycloalcanesMoussa DiaPas encore d'évaluation
- Top Exos ChimieDocument54 pagesTop Exos ChimieAlban tienouPas encore d'évaluation
- Série-2 CorrigéeDocument16 pagesSérie-2 CorrigéeOudjoud Keddour100% (3)
- Chimie TP3Document6 pagesChimie TP3Yassine HasnaouiPas encore d'évaluation
- Série 3 SMC4Document5 pagesSérie 3 SMC4anwar jakriPas encore d'évaluation
- Cours de Chimie Organique S1 Master MEPCDocument52 pagesCours de Chimie Organique S1 Master MEPCOumayma El YamaniPas encore d'évaluation
- Chimie Organique Examens Corr 05Document1 pageChimie Organique Examens Corr 05sosoukr123Pas encore d'évaluation
- Cours en Diapo Cho l2 Sfa 2020Document402 pagesCours en Diapo Cho l2 Sfa 2020aymane-lamraniPas encore d'évaluation
- Famille Et Nomenclature Des Molecules OrganiquesDocument5 pagesFamille Et Nomenclature Des Molecules OrganiquesUlysse HubertPas encore d'évaluation
- UntitledDocument3 pagesUntitledAbdeldjalil MayachePas encore d'évaluation
- Mecanismes Reactionnels PDFDocument6 pagesMecanismes Reactionnels PDFJérémie Nimpagaritse100% (1)
- Mecanismes ReactionnelsDocument6 pagesMecanismes ReactionnelsJean-François Abena100% (1)
- Mecanismes Reactionnels PDFDocument6 pagesMecanismes Reactionnels PDFJérémie NimpagaritsePas encore d'évaluation
- TD 1 Enzymologie PDFDocument2 pagesTD 1 Enzymologie PDFines znetiPas encore d'évaluation
- Nutrient Schedule FRDocument2 pagesNutrient Schedule FRkungPas encore d'évaluation
- Série Sup - Corr. Chap - IIDocument3 pagesSérie Sup - Corr. Chap - IIOudjoud KeddourPas encore d'évaluation
- Biologie Moléculaire Résumé 02 PDFDocument35 pagesBiologie Moléculaire Résumé 02 PDFbiotech microPas encore d'évaluation
- Métabolisme Des GlucidesDocument28 pagesMétabolisme Des GlucidesilaPas encore d'évaluation
- Polymères Et ElastomèresDocument42 pagesPolymères Et ElastomèresRayhanPas encore d'évaluation
- 66 623 1 PBDocument9 pages66 623 1 PBchefameera13Pas encore d'évaluation
- Les Matières Plastiques (Seconde MRA)Document9 pagesLes Matières Plastiques (Seconde MRA)Saminou OumarouPas encore d'évaluation
- Controle 2021Document6 pagesControle 2021Mouad BadaouiPas encore d'évaluation
- EXTRACTION Theory1-ConvertiDocument32 pagesEXTRACTION Theory1-ConvertimahjoubPas encore d'évaluation
- CHAP1 - PV - Chap2 - Nutrition Carbonée Part2Document7 pagesCHAP1 - PV - Chap2 - Nutrition Carbonée Part2Sagacious IvejutenPas encore d'évaluation
- Chimie Organique FlashcardsDocument6 pagesChimie Organique Flashcardsmariem OuriPas encore d'évaluation
- V6 Guide Dechets-2Document12 pagesV6 Guide Dechets-2Hector-le-troyenPas encore d'évaluation
- DS06 ChimieDocument14 pagesDS06 ChimiebenyairjeremiePas encore d'évaluation
- 10.03.2016 Les EnzymesDocument14 pages10.03.2016 Les EnzymesEaPas encore d'évaluation
- PDFDocument171 pagesPDFDominique RosaliePas encore d'évaluation
- Biochimie Microbienne - 9-Voie-Pentoses-Phosphates PDFDocument19 pagesBiochimie Microbienne - 9-Voie-Pentoses-Phosphates PDFliliPas encore d'évaluation
- Chapitre 1Document4 pagesChapitre 1M LPas encore d'évaluation
- Thèse Osteo AlgerieDocument83 pagesThèse Osteo AlgerieFatima zahra ZarbiPas encore d'évaluation
- BioénergétiqueDocument35 pagesBioénergétiqueMax MoussimaPas encore d'évaluation
- DPD ChloramineDocument4 pagesDPD ChloramineMohamed TouahriPas encore d'évaluation
- Aldehydfes Et Cetones1Document6 pagesAldehydfes Et Cetones1Abdoul karim SamakePas encore d'évaluation
- Exercice D'élucidation de Structure - TD en Ligne Du 11 Mai - CORRIGEDocument3 pagesExercice D'élucidation de Structure - TD en Ligne Du 11 Mai - CORRIGECha KibPas encore d'évaluation
- CatalyseDocument4 pagesCatalyseRoudaina BenzeguirPas encore d'évaluation
- 1S ChimieDocument10 pages1S ChimiePFE100% (4)
- Anatomie Aortheses - PlantairesDocument18 pagesAnatomie Aortheses - PlantairesGhita ArradPas encore d'évaluation
- Interaction Contenu ContenantDocument13 pagesInteraction Contenu ContenantAmeziane Youcef OualiPas encore d'évaluation
- 2005 09 Antilles Correction Exo3 Menthe 4ptsDocument3 pages2005 09 Antilles Correction Exo3 Menthe 4ptsAnthea MallaPas encore d'évaluation
- Bac S 2019 Antilles Guyane Ex 1Document4 pagesBac S 2019 Antilles Guyane Ex 1Harvey SpecterPas encore d'évaluation