Académique Documents
Professionnel Documents
Culture Documents
Résumé Du Chap 2 2023
Transféré par
mélanie robertTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Résumé Du Chap 2 2023
Transféré par
mélanie robertDroits d'auteur :
Formats disponibles
Résumé du chap 2 : Couleurs d’une solution et loi de Beer-Lambert
➢ Couleur d’une solution :
Une solution est colorée si elle absorbe dans le domaine du visible (400 nm à 750 nm).
La couleur de la solution est la couleur complémentaire de la couleur absorbée (utiliser le
cercle chromatique pour trouver la couleur complémentaire).
➢ Dosage spectrophotométrique :
Doser une solution, c’est déterminer sa concentration ! (concentration en masse ou concentration en
quantité de matière).
Un spectrophotomètre permet de réaliser des mesures d’absorbance.
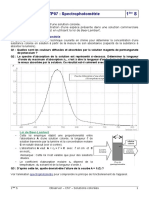
1ère étape : Tracer le spectre d’absorption de la
solution colorée : il s’agit de mesurer l’absorbance A en
fonction de la longueur d’onde λ : A = f(λ) .
Cela nous permet de déterminer la valeur de la longueur
d’onde λ pour laquelle la solution absorbe le plus.
ex : λ ≈ 640 nm sur le graphique ci-contre.
2ème étape :
- Réaliser plusieurs dilutions d’une solution colorée de concentration connue cette fois : on
obtient des solutions filles, appelées encore solutions étalons. (Connaitre le protocole de dilution).
- Régler le spectrophotomètre sur la longueur d’onde pour laquelle la solution absorbe le plus, ce
qui permet une plus grande précision des mesures.
- « Faire le blanc » : cela consiste à mesurer l’absorbance du solvant pour ensuite la soustraire à
l’absorbance de l’espèce colorée.
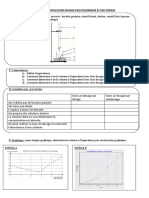
- Mesurer ensuite l’absorbance des solutions étalons puis tracer la courbe d’étalonnage : A = f(C).
Ex :
Loi de Beer-Lambert : A = k x C
Rappel : l’absorbance A est une grandeur sans unité.
La courbe obtenue est une droite qui passe par l’origine,
donc les deux grandeurs A et C sont proportionnelles : la
loi de Beer-Lambert est bien vérifiée.
k = coefficient directeur de la droite.
Attention : Loi vérifiée que pour des solutions diluées !
- On mesure alors l’absorbance de notre solution colorée de concentration inconnue (ici : A =0,14)
puis on en déduit sa concentration grâce à la courbe :
✓ Soit directement par lecture graphique (ici : C =12,5 mmol.L-1).
✓ Si la lecture graphique est difficile à faire, utiliser l’équation de la droite A = k x C donc :
𝑨
C= (soit k est donné, soit il faut le calculer donc il faut savoir calculer un coefficient directeur! )
𝒌
Vous aimerez peut-être aussi
- Spectrophotometrie MnO4Document4 pagesSpectrophotometrie MnO4Anaëlle Avril88% (8)
- Chap04D ExosBeerLambertDocument1 pageChap04D ExosBeerLambertlilPas encore d'évaluation
- Chapitre XIV: Les Techniques de La Chimie: A KXCDocument8 pagesChapitre XIV: Les Techniques de La Chimie: A KXCOuaazizPas encore d'évaluation
- Chapitre 2 Dosage Sprectrophotom Trique PROFDocument4 pagesChapitre 2 Dosage Sprectrophotom Trique PROFzabsi533Pas encore d'évaluation
- Exercices Loi de Beer Lambert (Révison Contrôle Commun) CORRECTIONDocument2 pagesExercices Loi de Beer Lambert (Révison Contrôle Commun) CORRECTIONnadjet polyPas encore d'évaluation
- Doc-20221003-Wa0000 231010 164536Document8 pagesDoc-20221003-Wa0000 231010 164536alex.g.khouryPas encore d'évaluation
- Fiche Loi de Beer Lambert Premiere Specialite Physique Chimie 1Document1 pageFiche Loi de Beer Lambert Premiere Specialite Physique Chimie 1Océane SAÏMPas encore d'évaluation
- Fiches Méthodo Expérimentale Dosage ETALLONAGEDocument5 pagesFiches Méthodo Expérimentale Dosage ETALLONAGEMeryam MessaoudiPas encore d'évaluation
- Loi de Beert LambertDocument3 pagesLoi de Beert LambertMalak El jadiriPas encore d'évaluation
- TSP2SP1Ch18T4-Corrige p478n6 n7Document1 pageTSP2SP1Ch18T4-Corrige p478n6 n7Rafael CastilloPas encore d'évaluation
- Mission - N°4 - Pka - BBT - Version ConfinementDocument2 pagesMission - N°4 - Pka - BBT - Version ConfinementAmélie D.Pas encore d'évaluation
- UntitledDocument3 pagesUntitledLéo DemonPas encore d'évaluation
- Essentiel Espèce Colorée Partie 2Document2 pagesEssentiel Espèce Colorée Partie 2maelgiraud17Pas encore d'évaluation
- YassineDocument43 pagesYassinecerveaumental80Pas encore d'évaluation
- Tpbeer LambertDocument2 pagesTpbeer LamberthenryPas encore d'évaluation
- Fiche D'introduction Aux TP de Chimie PDFDocument9 pagesFiche D'introduction Aux TP de Chimie PDFseth-anderson okaPas encore d'évaluation
- Absorbance Et Loi de Beer-Lambert - Fiche de Révision - AnnabacDocument4 pagesAbsorbance Et Loi de Beer-Lambert - Fiche de Révision - AnnabacfatmamazharPas encore d'évaluation
- Loi de Beer LambertDocument2 pagesLoi de Beer Lambertamine100% (1)
- Spectroscopie Uv-VisibleDocument2 pagesSpectroscopie Uv-VisibleČhîmïî ŠtāPas encore d'évaluation
- Ach13 Corrige ExercicesDocument3 pagesAch13 Corrige ExercicesmohamedPas encore d'évaluation
- TPG 12 - SpectrophotométrieDocument6 pagesTPG 12 - SpectrophotométrieLouiPas encore d'évaluation
- CH.18.Controle Qualite Dosage PDFDocument3 pagesCH.18.Controle Qualite Dosage PDFAbbassi100% (1)
- CH.18.Controle Qualite Dosage PDFDocument3 pagesCH.18.Controle Qualite Dosage PDFAbbassiPas encore d'évaluation
- Chimie B Chap8 Titrage - Acidobasique PDFDocument6 pagesChimie B Chap8 Titrage - Acidobasique PDFMouloud IssaadPas encore d'évaluation
- S Amerique Du Nord 30 Mai 2014Document7 pagesS Amerique Du Nord 30 Mai 2014aliza.mordoPas encore d'évaluation
- C13 - Correction D'exercicesDocument5 pagesC13 - Correction D'exercicesSans SnoqPas encore d'évaluation
- c10 - Correction DexercicesDocument3 pagesc10 - Correction DexercicesmohamedPas encore d'évaluation
- SpectroscopieDocument3 pagesSpectroscopieMeriem KerboubPas encore d'évaluation
- CH 4 Dosages Nov 2020Document10 pagesCH 4 Dosages Nov 2020jhxsnnpf9gPas encore d'évaluation
- TP Cours - AfortBforte - v2 2vincent EB 2Document8 pagesTP Cours - AfortBforte - v2 2vincent EB 2ayoub dahbiPas encore d'évaluation
- ChimieDocument7 pagesChimieYves-donald MakoumbouPas encore d'évaluation
- DS 3 B - CorrigéDocument11 pagesDS 3 B - Corrigéhedidbz38Pas encore d'évaluation
- 61 CoursbeerlambertprofDocument6 pages61 CoursbeerlambertprofDanaPas encore d'évaluation
- Evaluation Chap. 1: Le Dosage Par ÉtalonnageDocument4 pagesEvaluation Chap. 1: Le Dosage Par ÉtalonnagePersona CualquieraPas encore d'évaluation
- Ds Destop CorrecDocument11 pagesDs Destop CorrecDenis BurettePas encore d'évaluation
- Correction DST12015 16Document4 pagesCorrection DST12015 16cavabPas encore d'évaluation
- Chimie A Chap2 Spectrophotometrie PDFDocument3 pagesChimie A Chap2 Spectrophotometrie PDFGüzęl BârãæPas encore d'évaluation
- Analyses PhysiquesDocument4 pagesAnalyses PhysiquesPhilzyPas encore d'évaluation
- 2017 Asie Exo1 Correction AcideGlycolique 9ptsDocument5 pages2017 Asie Exo1 Correction AcideGlycolique 9ptsgrajzgrPas encore d'évaluation
- Chimie A Chap2 Correction - ExosDocument1 pageChimie A Chap2 Correction - ExosRoumaissa LbPas encore d'évaluation
- Lycee Chimie Exercice DosageEtalonnageTitrage 1266274Document3 pagesLycee Chimie Exercice DosageEtalonnageTitrage 1266274Marius MissiPas encore d'évaluation
- Exercices Application Dosage Par Etalonnage Et Par TitrageDocument3 pagesExercices Application Dosage Par Etalonnage Et Par TitrageMohamed Ali MahjoubPas encore d'évaluation
- TP Dosage Espece Coloree Par SpectrophotometrieDocument5 pagesTP Dosage Espece Coloree Par SpectrophotometrieLarusanPas encore d'évaluation
- Chimie B Chap8 Titrage AcidobasiqueDocument6 pagesChimie B Chap8 Titrage AcidobasiqueSamantha Farah100% (1)
- Formules Chimie Bac SDocument3 pagesFormules Chimie Bac SMathieuPas encore d'évaluation
- Fiche de Revision Terminale SpeDocument22 pagesFiche de Revision Terminale SpehnrylucksonPas encore d'évaluation
- Principe Des Dosages VolumetriquesDocument1 pagePrincipe Des Dosages VolumetriquesEssassi AmmarPas encore d'évaluation
- Chap 5 ChiDocument7 pagesChap 5 ChiMahmoud FerhatPas encore d'évaluation
- Chapitre 104 - Dosages TitragesDocument3 pagesChapitre 104 - Dosages TitragesPatapouf CoincoinPas encore d'évaluation
- Spectro TPDocument5 pagesSpectro TPجعدبندرهمPas encore d'évaluation
- Corrige Td1 Uv Visible TsaDocument5 pagesCorrige Td1 Uv Visible TsaELAssaliAziz100% (4)
- Examen National Physique Chimie SPC 2014 Normale SujetDocument7 pagesExamen National Physique Chimie SPC 2014 Normale SujetaarabkholoudPas encore d'évaluation
- QCMBACCorrectionDocument26 pagesQCMBACCorrectionNour El KamelPas encore d'évaluation
- TP2b Chimie Cinetique-Spectrophotometrie Correct PDFDocument8 pagesTP2b Chimie Cinetique-Spectrophotometrie Correct PDFmohPas encore d'évaluation
- TP5 SpectrophotoDocument4 pagesTP5 SpectrophotoKerherve Julien100% (1)
- TPC05 DeterminationdepKaDocument3 pagesTPC05 DeterminationdepKaArnold Murphy Elouma NdingaPas encore d'évaluation
- .Spectroscopie VisibleDocument3 pages.Spectroscopie Visibleayoub dahbiPas encore d'évaluation
- TP Correction La Masse VolumiqueDocument2 pagesTP Correction La Masse VolumiqueDouae AkahouchPas encore d'évaluation
- Fiches de Cours ChimieDocument43 pagesFiches de Cours ChimieSalah Eddine DjilaniPas encore d'évaluation
- Épreuve Sciences Physiques Classe 4ème Sciences 1 Prof: Chebbi RachidDocument4 pagesÉpreuve Sciences Physiques Classe 4ème Sciences 1 Prof: Chebbi RachidMohamed SaidiPas encore d'évaluation
- Meda AirDocument1 pageMeda AirManiaPas encore d'évaluation
- Bentouhami & OmamasDocument119 pagesBentouhami & Omamasilyass elgourmyPas encore d'évaluation
- These Belkaid Ep Bouhadjer SorayaDocument191 pagesThese Belkaid Ep Bouhadjer SorayaDan sumailiPas encore d'évaluation
- CHAPITRE V Liaisons Chimiques Partie I Dec 2021Document11 pagesCHAPITRE V Liaisons Chimiques Partie I Dec 2021Monxef BlrPas encore d'évaluation
- CAP Math Group C Septembre 2018Document11 pagesCAP Math Group C Septembre 2018castinelPas encore d'évaluation
- Edoc - Pub - Examen Correction l1 Chimie Organique 2006 2Document7 pagesEdoc - Pub - Examen Correction l1 Chimie Organique 2006 2Mohamed DahmanePas encore d'évaluation
- Cours 4 MIMST M1Document13 pagesCours 4 MIMST M1Νour HoudaPas encore d'évaluation
- Diagramme À FuseauDocument8 pagesDiagramme À FuseauAmina Merabti100% (1)
- TP 2 Epuration Des Eaux PDocument4 pagesTP 2 Epuration Des Eaux PuserrPas encore d'évaluation
- Synthese de BiologieDocument5 pagesSynthese de BiologieToon landPas encore d'évaluation
- CHap-II Solutions PropriétésDocument48 pagesCHap-II Solutions PropriétésDô FlamîîngoPas encore d'évaluation
- Recette Gels Douche MaisonDocument24 pagesRecette Gels Douche MaisonMaude100% (1)
- 8710-Kaeltemittelfibel 2020 F WebDocument24 pages8710-Kaeltemittelfibel 2020 F WebMahmoud MecharaPas encore d'évaluation
- Etude de L'élimination Du Plomb, Du Zinc Et Du Cadmium Par Adsorption Sur Un Charbone Actif Préparé À Base Des Noyaux de JujubaDocument156 pagesEtude de L'élimination Du Plomb, Du Zinc Et Du Cadmium Par Adsorption Sur Un Charbone Actif Préparé À Base Des Noyaux de JujubaSoussou Perla100% (1)
- Corrigé Série 1Document5 pagesCorrigé Série 1Mohamed ECHAMAI100% (2)
- Activité Optique Sans Carbone AsymétriqueDocument3 pagesActivité Optique Sans Carbone Asymétriquejoel chahiddPas encore d'évaluation
- Index - Leçons de ChimieDocument226 pagesIndex - Leçons de ChimieCharles CostesPas encore d'évaluation
- Decarbonatation 1Document223 pagesDecarbonatation 1imad haouiPas encore d'évaluation
- STRUCTURE DES MATERIAUX - Cours 6Document33 pagesSTRUCTURE DES MATERIAUX - Cours 6Aug Nels Mathieu AnvouliPas encore d'évaluation
- TD-corrigé THER 2015Document4 pagesTD-corrigé THER 2015Mohamed EL FAGHLOUMIPas encore d'évaluation
- 2020 Etude Caractérisations de La Production Du Lessence Sans PlombDocument101 pages2020 Etude Caractérisations de La Production Du Lessence Sans PlombMohammed SahnounePas encore d'évaluation
- Froid Et ClimatisationDocument17 pagesFroid Et ClimatisationNourelhouda AbdelazizPas encore d'évaluation
- Serie D'exxercicesDocument3 pagesSerie D'exxercicesAissam BrqPas encore d'évaluation
- Cours de Mécanique Des Fluides - S2&S5DDocument36 pagesCours de Mécanique Des Fluides - S2&S5DHenriPas encore d'évaluation
- B06 CongelationDocument8 pagesB06 CongelationLandryPas encore d'évaluation
- L'Activité Anti-Oxydante Des Deux Tissus (Blanc Et Pigmenté) de Quelques Variétés de Datte CommunesDocument66 pagesL'Activité Anti-Oxydante Des Deux Tissus (Blanc Et Pigmenté) de Quelques Variétés de Datte CommunesRanda BenPas encore d'évaluation
- Biochimie Microbienne PDFDocument25 pagesBiochimie Microbienne PDFبدر الدين100% (1)
- Cours:: Qui Veut Dépasser Son Maître Doit Écouter, Observer Et Appliquer Ses Leçons.Document10 pagesCours:: Qui Veut Dépasser Son Maître Doit Écouter, Observer Et Appliquer Ses Leçons.Emmanuelle PatriPas encore d'évaluation
- Chimie Analytique Acides BasesDocument19 pagesChimie Analytique Acides Basesawara237Pas encore d'évaluation