Académique Documents
Professionnel Documents
Culture Documents
1 2 2022 ControleVFMole AB Etalonage
Transféré par
aliijaberr552Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
1 2 2022 ControleVFMole AB Etalonage
Transféré par
aliijaberr552Droits d'auteur :
Formats disponibles
Nom : Prénom : Date : Classe : Tle Spé 2
Contrôle n°1 de Sciences-Physiques
Toute copie sale et/ou raturée sera sanctionnée.
Problème: Indigo et carmin d’indigo
Un tissu, daté de 6000 ans, a été retrouvé sur un site archéologique de la côte nord du Pérou. Il présente
d’anciennes traces d’utilisation d’une teinture bleue : l’indigo qui colore aujourd’hui encore les blue-jeans.
L’indigo peut être synthétisé ou extrait d’un arbuste : l’indigotier.
L’objectif de cet exercice est tout d’abord d’étudier la synthèse de l’indigo et le principe de la teinture d’un
tissu, puis de s’intéresser aux propriétés du carmin d’indigo qui peut aussi être extrait de l’indigotier.
A. Synthèse de l’indigo
L’indigo peut être synthétisé à partir du 2-nitrobenzaldéhyde et de l'acétone selon la transformation
modélisée par l’équation de réaction suivante :
Protocole de la synthèse :
- Introduire 0,50 g de 2-nitrobenzaldéhyde dans un erlenmeyer.
- Ajouter 5,0 mL d’acétone puis environ 10 mL d’eau distillée et boucher.
- Utiliser l’agitateur magnétique pour dissoudre totalement le solide.
- Ajouter lentement 5,0 mL de solution d’hydroxyde de sodium à 2,0 mol·L-1 et poursuivre l’agitation
pendant 5 min.
- Filtrer sous vide. Rincer le solide avec de l’eau puis avec de l’éthanol. Sécher le solide.
Données :
1. a. Entourer les groupes caractéristiques sur la formule topologique de l’indigo, et nommer les familles
fonctionnelles correspondantes.
b. Nommer l’acétone dans la nomenclature officielle.
2. Déterminer les quantités de matière introduites de 2-nitrobenzaldéhyde et d’acétone.
L’hydroxyde de sodium est introduit en excès.
3. En supposant la transformation chimique comme totale, identifier le réactif limitant et en déduire la
masse maximale d’indigo qui peut être obtenue.
Après séchage, la masse de solide obtenue est de 0,35 g.
4. Déterminer la valeur du rendement de la synthèse chimique.
B. Teinture d’un tissu par l’indigo
L’indigo, sous sa forme oxydée notée Ind (s), est un colorant solide bleu, insoluble dans l’eau. Il ne peut
imprégner la fibre à teindre que sous sa forme réduite, de couleur jaune pâle, dont la formule est IndH2
(aq). Pour réduire l’indigo on utilise des ions dithionite S2O42- (aq).
Donnée : demi-équation électronique associée aux ions dithionite :
S2O42-(aq) + 2 H2O(ℓ) = 2 SO32-(aq) + 4 H+(aq) + 2 e-
1. a. On note Ind/IndH2, le couple oxydant-réducteur de l’indigo. Ecrire la demi-équation électronique
associée.
b. Établir l’équation de la réaction modélisant la transformation prenant place entre l’indigo et les ions
dithionite.
c. Le tissu imprégné de la forme réduite IndH2 est ensuite exposé à l’air. L’indigo se forme par oxydation de
IndH2 et reste emprisonné dans le tissu pour lui donner sa couleur bleue.
Nommer l’oxydant mis en jeu dans cette transformation.
2. Les ions dithionite S2O42- (aq) sont obtenus par dissolution du dithionite de sodium Na2S2O4(s) dans de
l’eau. Pour que la teinture prenne, il faut que la concentration en soluté apporté de dithionite de sodium
soit de 0,01 mol.L-1.
On souhaite vérifier rapidement la concentration de la solution utilisée par conductimétrie.
On mesure la conductivité de la solution fournie et on trouve 𝝈 = 𝟎, 𝟐𝟔𝟓 𝑺. 𝒎−𝟏
Déterminer la concentration de la solution en dithionite de sodium Na2S2O4(s) et conclure.
DONNEES : conductivités molaires ioniques λi (S.m2.mol-1) de quelques ions à 25°C.
H3O+ Na+ Fe3+ HO- Cℓ- Br- S2O42-
35,0.10-3 5,0.10-3 20,4.10-3 19,8.10-3 7,6.10-3 7,8.10-3 17,0.10-3
C. Le carmin d’indigo, un indicateur coloré acido-basique
Le carmin d'indigo est un colorant bleu de synthèse (E132) qui dérive de l’indigo. Il est utilisé comme
indicateur coloré acido-basique car sa couleur dépend du pH du milieu : il est bleu pour pH <11 et jaune
pH > 12. Sa formule chimique en milieu acide est : C16H8N2Na2O8S2, notée H2In. C’est un diacide.
1. La formule topologique du carmin d’indigo est donnée ci-dessous :
Identifier, en les entourant, les atomes d’hydrogène responsables de l’acidité de la molécule. Justifier.
Données des électronégativités des atomes dans l’ordre décroissant: O > N >S > C et H
2. On souhaite préparer une solution aqueuse de carmin d’indigo de couleur bleue, de pH = 6,0.
a. On suppose que la réaction du carmin d’indigo H2In avec l’eau est totale.
Ecrire l’équation de cette réaction.
Données : Couple acide/ base : H2In / HIn- ; H3O+(aq)/H2O(ℓ)
b. Calculer la concentration en ions H3O+(aq) de la solution de carmin d’indigo, de pH = 6,0.
c. En déduire la masse de carmin d’indigo que l’on doit dissoudre dans 250mL d’eau pour obtenir cette
solution bleue de pH = 6,0 ?
Donnée : M(carmin d’indigo) = 466 g.mol-1
D. Utilisation médicale du carmin d’indigo
Le carmin d’indigo est utilisé dans le domaine médical pour colorer l’urine d’un patient en bleu afin de
réaliser certains diagnostics.
On dispose d’une solution injectable S de carmin d’indigo. L’objectif de cette partie est de déterminer la
concentration en masse de cette solution pour en déduire le volume maximal à injecter pour ne pas
dépasser la dose journalière admissible.
On donne ci-dessous le spectre d’absorption du carmin d’indigo :
Donnée : cercle chromatique
On réalise un dosage spectrophotométrique par étalonnage de la solution S.
1. Réalisation de l’échelle de teinte
On prépare un ensemble de solutions de carmin d’indigo à partir d'une solution mère Sm de concentration
connue cm = 80,0 mg·L-1 en carmin d’indigo.
On dispose de la verrerie suivante : fioles jaugées de 25 mL, 50 mL, 100 mL ; pipettes jaugées de 5 mL, 10
mL, 20 mL, 25 mL ; béchers de 50 mL et de 100 mL ; éprouvettes graduées de 20 mL et 50 mL.
Décrire le protocole pour préparer 50 mL de la solution S3 à partir de la solution mère Sm.
2. La courbe d’étalonnage
On mesure l'absorbance de chacune
des solutions avec un
spectrophotomètre. On obtient les
résultats suivants :
On trace la courbe A = f(C) et on obtient le graphe suivant :
A=f(C) y = 0,0197x
1,4 R² = 0,9988
1,2
1
Absorbance A
0,8
0,6
0,4
0,2
0
0 10 20 30 40 50 60 70
Conentration C(en mg/L)
a. Déterminer la longueur d’onde adaptée à la réalisation de ce dosage dans le domaine visible.
b. Justifier la couleur du carmin d’indigo.
c. La solution injectable S est diluée 200 fois pour obtenir la solution Sd dont on mesure l’absorbance : A =
0,75. La dose journalière admissible, notée DJA, de carmin d’indigo que l’on peut injecter à un patient est
5,0 mg/jour/kg de masse corporelle.
Déterminer le volume de la solution S que l’on peut injecter sans danger en une journée à un patient de de
masse 70 kg.
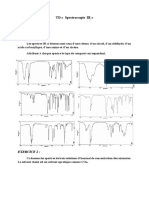
E. Identification de la molécule obtenue par spectroscopie infrarouge.
Après l’étape 4 du protocole de synthèse, le spectre infrarouge en phase liquide de la molécule synthétisée
a été réalisé. http://chimieorganique-jeanlouis-migot.over-blog.com/article-7-micro-synthese-de-la-
septieme-couleur-de-l-arc-en-ciel-87423348.html
1. Nommer la grandeur et l’unité qui
se trouve sur l’axe des abscisses
d’un spectre infra-rouge.
2. En utilisant les données infra-
rouge ci-dessous, montrer que le
spectre ci-dessus peut correspondre
à la formule chimique de l’indigo.
Vous aimerez peut-être aussi
- Ciments Verres Ionomères Et Matériaux Hybrides (23-065-K-10)Document18 pagesCiments Verres Ionomères Et Matériaux Hybrides (23-065-K-10)nhakhoanhungoc100% (2)
- Série de TD N°2 - Équilibres Acido-BasiquesDocument2 pagesSérie de TD N°2 - Équilibres Acido-Basiqueskim namjoon100% (1)
- Karl Von Eckartshausen - LES PLUS RÉCENTES DÉCOUVERTES PDFDocument8 pagesKarl Von Eckartshausen - LES PLUS RÉCENTES DÉCOUVERTES PDFkimonthPas encore d'évaluation
- Fascicule de TP de Chimie 1Document28 pagesFascicule de TP de Chimie 1Karim Kisserli100% (1)
- Annale Chimie 1Document16 pagesAnnale Chimie 1Sinem SinemPas encore d'évaluation
- Alimentation - Santé-Atelier Energies Et SantéDocument49 pagesAlimentation - Santé-Atelier Energies Et SantéSekou SawadogoPas encore d'évaluation
- TP Dakin Prepa (ML2011) PDFDocument3 pagesTP Dakin Prepa (ML2011) PDFMelania MelaniaPas encore d'évaluation
- Page de TitreDocument72 pagesPage de Titreelkhateb linaPas encore d'évaluation
- PC GENE SUJET 042 Exo1 Chi VertMalachiteBeerDocument4 pagesPC GENE SUJET 042 Exo1 Chi VertMalachiteBeerElias AthanassiadisPas encore d'évaluation
- Es2 Sem2 ExtraDocument3 pagesEs2 Sem2 ExtraMostafa IbrahimPas encore d'évaluation
- DS2 LMA 09 11 2019 Avancement - RedoxDocument2 pagesDS2 LMA 09 11 2019 Avancement - Redoxcloe.garrotPas encore d'évaluation
- TP AbidiDocument11 pagesTP AbidiLara sennaouiPas encore d'évaluation
- Exercices Revisions Physiques Chimie 1Document13 pagesExercices Revisions Physiques Chimie 1Loup Jouandet-DahlenPas encore d'évaluation
- Exercices de Re Visions - PC - Ts-2Document16 pagesExercices de Re Visions - PC - Ts-2baatout oumaymaPas encore d'évaluation
- Exercice 1:: TD Spectroscopie IRDocument8 pagesExercice 1:: TD Spectroscopie IRGenie des procede Promotion 2022100% (1)
- TD CHIMIE N°5 Acide BaseDocument3 pagesTD CHIMIE N°5 Acide BaseJuste Landry OngoloPas encore d'évaluation
- 1 Ere S Eval Decembre 2014Document4 pages1 Ere S Eval Decembre 2014Hadri MohamedPas encore d'évaluation
- 2012 Pondichery Exo2 Sujet Spectrophotometrie 5 5ptsDocument4 pages2012 Pondichery Exo2 Sujet Spectrophotometrie 5 5ptsrahmaniPas encore d'évaluation
- 2012 Pondichery Exo2 Sujet Spectrophotometrie 5 5ptsDocument4 pages2012 Pondichery Exo2 Sujet Spectrophotometrie 5 5ptsRafael CastilloPas encore d'évaluation
- DS1spe 1Document2 pagesDS1spe 1zaydscameurPas encore d'évaluation
- 2 Ex ch5Document2 pages2 Ex ch5Le dab Des îlesPas encore d'évaluation
- 27 TD Chimie Termrnale C D Avril N°1Document2 pages27 TD Chimie Termrnale C D Avril N°1AnaëllePas encore d'évaluation
- Cours de VirologieDocument5 pagesCours de VirologieFrancisca AgboviPas encore d'évaluation
- Chimie TleDocument2 pagesChimie TleHaman Bello OumarouPas encore d'évaluation
- 15chi1es E1Document6 pages15chi1es E1Hussein AbdallahPas encore d'évaluation
- 1 Exercices Vitesse de Reaction EleveDocument8 pages1 Exercices Vitesse de Reaction EleveYassine FerdoudiPas encore d'évaluation
- Énoncés Exos Chap2 SpectroDocument6 pagesÉnoncés Exos Chap2 Spectrobahijmalak4Pas encore d'évaluation
- Serie 3 ChimieDocument3 pagesSerie 3 Chimiejridimouna91Pas encore d'évaluation
- Chimie Tle Cde Trim 1Document2 pagesChimie Tle Cde Trim 1Häm's Ham'sPas encore d'évaluation
- No49 08 Fev 2022 Sujetexa - ComDocument2 pagesNo49 08 Fev 2022 Sujetexa - ComJuste Landry OngoloPas encore d'évaluation
- Exercice 1: Dosage de L'iode: I-Préparation de La Solution de Thiosulfate de SodiumDocument4 pagesExercice 1: Dosage de L'iode: I-Préparation de La Solution de Thiosulfate de Sodiumkhaoula elhansaliPas encore d'évaluation
- Exercices Sur Les Ions en SolutionDocument7 pagesExercices Sur Les Ions en Solutionmustapha zaamPas encore d'évaluation
- Bac Blanc 2 C Faucon 21-22Document4 pagesBac Blanc 2 C Faucon 21-22alfpicturesdrawingPas encore d'évaluation
- Ex Chap1 CorrectionDocument13 pagesEx Chap1 CorrectionFabrice hsuPas encore d'évaluation
- TP7 - Synthese ColorantsDocument3 pagesTP7 - Synthese ColorantsSurbroPas encore d'évaluation
- Ex Chapitre 2Document8 pagesEx Chapitre 2الدعم الجامعيPas encore d'évaluation
- PC Gene Sujet 061 Exo1 Chi BetadinebeerDocument3 pagesPC Gene Sujet 061 Exo1 Chi BetadinebeerQuentin BlanchardPas encore d'évaluation
- Chimie TleC D TI Eval2Document11 pagesChimie TleC D TI Eval2bryanprince673Pas encore d'évaluation
- G1SPHCH02730 Sujet 046Document8 pagesG1SPHCH02730 Sujet 046acer pcPas encore d'évaluation
- CEEMS 2013 Chimie-1Document5 pagesCEEMS 2013 Chimie-1Aida MbodjiPas encore d'évaluation
- Bac CH 2006Document3 pagesBac CH 2006Haman Bello OumarouPas encore d'évaluation
- No15 2ndACD 25 Mars 2023 Sujetexa - ComDocument2 pagesNo15 2ndACD 25 Mars 2023 Sujetexa - ComGjhgPas encore d'évaluation
- Annalee 214Document16 pagesAnnalee 214Zineb KhadranePas encore d'évaluation
- Chimie TleDocument2 pagesChimie TleHaman Bello OumarouPas encore d'évaluation
- 1cm5jshkp 287157Document2 pages1cm5jshkp 287157Mamadou bilo DialloPas encore d'évaluation
- No12 19 Mars 2023 Sujetexa - ComDocument2 pagesNo12 19 Mars 2023 Sujetexa - Commariewachom53Pas encore d'évaluation
- 2016 AmSud Exo2 Sujet Benzaldehyde 9ptsDocument7 pages2016 AmSud Exo2 Sujet Benzaldehyde 9ptsRichad NaziralyPas encore d'évaluation
- TD Methodes Danalyse 19 20Document15 pagesTD Methodes Danalyse 19 20stani kamdoum0% (1)
- DS 3 A - ÉnoncéDocument7 pagesDS 3 A - Énoncéhedidbz38Pas encore d'évaluation
- Sample Chemistry Entrance Exam 2020 - 2021-sDocument7 pagesSample Chemistry Entrance Exam 2020 - 2021-sAli RammalPas encore d'évaluation
- PC Gene 059 Sujet Exo1 Chi AllantoineDocument3 pagesPC Gene 059 Sujet Exo1 Chi Allantoineclovis.darchevillePas encore d'évaluation
- Alcool Amine Acide CarboxDocument5 pagesAlcool Amine Acide CarboxEssohanam AwatePas encore d'évaluation
- Ccs 2018Document19 pagesCcs 2018hajbaoui zakariyaaPas encore d'évaluation
- TD N°2 Chimie Et BiochimieDocument4 pagesTD N°2 Chimie Et BiochimieSabir NacerPas encore d'évaluation
- Les Dosages Ou Titrages Directs Exercices Non Corriges 1Document5 pagesLes Dosages Ou Titrages Directs Exercices Non Corriges 1Zeineb BiadPas encore d'évaluation
- Série Amine AT 23 TS2Document2 pagesSérie Amine AT 23 TS2y7mdwxk9x6Pas encore d'évaluation
- 18-Devoir de Vacances - Chimie 1S - TSDocument4 pages18-Devoir de Vacances - Chimie 1S - TSHussein AbdallahPas encore d'évaluation
- Exo Acide Carboxylique Et DérivésDocument3 pagesExo Acide Carboxylique Et DérivésOusmane DiarraPas encore d'évaluation
- TD Alcool-2024-Llss-WahabdiopDocument4 pagesTD Alcool-2024-Llss-Wahabdiopbibos8318Pas encore d'évaluation
- EstérificationDocument11 pagesEstérificationAya KhaouidPas encore d'évaluation
- Serie 1 2 3 Les Alcools Les Amines Et Les Acides Carboxyliques T°sDocument15 pagesSerie 1 2 3 Les Alcools Les Amines Et Les Acides Carboxyliques T°smor seck100% (5)
- Analyse Des Eaux UséesDocument8 pagesAnalyse Des Eaux UséesNINA RAISSONPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Acice Fort Base Forte Exercice 1Document8 pagesAcice Fort Base Forte Exercice 1Hamidou Diatta100% (1)
- Les Acides Et Les Bases - 3 ACDocument3 pagesLes Acides Et Les Bases - 3 ACaznag hicham0% (1)
- Gonflement Des ArgilesDocument4 pagesGonflement Des ArgilesTshinko SadPas encore d'évaluation
- Guide HemodialyseDocument79 pagesGuide HemodialysemecherguiPas encore d'évaluation
- Comp Chimiques DOSAPRO (FR)Document2 pagesComp Chimiques DOSAPRO (FR)PascalORIOPas encore d'évaluation
- CHAPITRE I - Chimie en SolutionDocument3 pagesCHAPITRE I - Chimie en SolutionNikabou Napo TCHANDIKOUPas encore d'évaluation
- Cours - Action Des Sol Ac Et Bs Sur Les MétauxDocument2 pagesCours - Action Des Sol Ac Et Bs Sur Les MétauxAgnaou MohamedPas encore d'évaluation
- Chapitre Iv Les Acides Et Les Bases FinalDocument15 pagesChapitre Iv Les Acides Et Les Bases FinalEl HadiPas encore d'évaluation
- AlcoolsDocument4 pagesAlcoolsamath ndiayePas encore d'évaluation
- Transformations Associées...Document3 pagesTransformations Associées...abderrahimebaouzinePas encore d'évaluation
- Chimie TleDocument2 pagesChimie TleHaman Bello OumarouPas encore d'évaluation
- Examen Local 8 Physique Chimie 3ac Sujet 1Document3 pagesExamen Local 8 Physique Chimie 3ac Sujet 1Hbn S'hra100% (1)
- Chimie Tout 345Document95 pagesChimie Tout 345Nemir MimirPas encore d'évaluation
- 18 Acide-Base 1Document3 pages18 Acide-Base 1Ilyes Ben JemaaPas encore d'évaluation
- # 02 Cours Chap 1 Réactions Acide-Base ProfDocument2 pages# 02 Cours Chap 1 Réactions Acide-Base ProfLouisPas encore d'évaluation
- 5-Fiche Professeur-Dosages Acido - BasiquesDocument4 pages5-Fiche Professeur-Dosages Acido - Basiquescamarayvan78Pas encore d'évaluation
- Devoir P.C 09-10Document53 pagesDevoir P.C 09-10naababaongo052Pas encore d'évaluation
- Stage Onm Mohamed Tawel Omro Sidi AbdallaDocument27 pagesStage Onm Mohamed Tawel Omro Sidi Abdallamsidiabdalla4100% (1)
- CHAPITRE III D CarbonatationDocument14 pagesCHAPITRE III D CarbonatationHaniDjekrifPas encore d'évaluation
- TD - Acido-BasiqueDocument12 pagesTD - Acido-BasiqueChaymae AyatiPas encore d'évaluation
- AcidesDocument20 pagesAcidesKhalil LasferPas encore d'évaluation
- Equilibre ChimiqueDocument42 pagesEquilibre ChimiqueTrekOff OfficielPas encore d'évaluation
- 2 - Les Acides Et Les BasesDocument21 pages2 - Les Acides Et Les BasesAmine CompanPas encore d'évaluation
- Devoir de Contrôle N°1 Lycée Pilote - Sciences Physiques - Bac Mathématiques (2012-2013) MR Ahmed KadriDocument4 pagesDevoir de Contrôle N°1 Lycée Pilote - Sciences Physiques - Bac Mathématiques (2012-2013) MR Ahmed KadriDeadly TokyoPas encore d'évaluation
- TP Mesure Du PH de Solution (Elèves)Document2 pagesTP Mesure Du PH de Solution (Elèves)la physique selon le programme FrançaisPas encore d'évaluation
- Rapport de Stage Mamadou SèneDocument34 pagesRapport de Stage Mamadou SèneAbdrahmane BaPas encore d'évaluation