Académique Documents
Professionnel Documents
Culture Documents
Sujet Examen Thermodynamique 2023-2024
Transféré par
elongoTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Sujet Examen Thermodynamique 2023-2024
Transféré par
elongoDroits d'auteur :
Formats disponibles
INSTITUT INTERNATIONAL POLYTECHNIQUE ET COMMERCE
EXAMENS PARTIELS DU SEMESTRE 1
Epreuve : Thermodynamique Niveau d’étude : Licence 1 Option : Tronc commun
(GM+GE+GPER+GEN+QHSE+GC) Durée : 2H00 ; Année : 2023-2024
Enseignant : Docteur-Ingénieur Bertrand Guelor ELONGO
Questions de cours (05 pts). Répondez par vrai ou faux et justifiez les réponses fausses:
1) En thermodynamique, la température t= - 273°C est définie comme la température Zéro absolu où les
atomes et les molécules constituant la matière sont figés.
2) Un système thermodynamique est défini exclusivement par ses variables intensives
3) Un système thermodynamique est délimité par des frontières à travers lesquelles peut se faire les échangent
de matière avec le milieu extérieur.
4) Les systèmes thermodynamiques sont également caractérisés par les fonctions d’état dont on peut les
mesurer de façon directe.
5) Un système thermodynamique c’est un ensemble réel ou imaginaire délimité par une surface à travers
laquelle se font exclusivement les échanges ou non d’énergie.
6) La température de Zéro absolu est équivalente à t = 273°C, les atomes et les molécules qui constituent la
matière sont figées.
EXERCICE 1 (07pts)
Trois récipients contiennent respectivement H2, O2 et N2 dans les conditions suivantes :
H2 (V1= 2,25 L ; P1= 0,33 atm ; T1= 25° C), O2 ( V2= 5,5 x10-3 m3 ; P2= 250 mmHg ; T2= 293° K) et
N2 (V3= 1,4 L ; P3= 1,bar ; T3= 0° C)
1. Calculer les masses de chaque gaz (gaz supposés parfaits)
2. On mélange les gaz dans un même récipient de volume V=18,5 L à la température T=273°K. On suppose que
le mélange formé soit parfait, calculez :
a) La pression totale b) La fraction molaire de chaque gaz c) La pression partielle de chaque gaz
On donne M(O)= 16g/mol M(N)= 14g/mol M(H)= 1g/mol
EXERCICE 2 ( 08 Pts)
On considère une masse m d'azote, considéré comme gaz parfait, dans les conditions normales de pression et de
température (état A).
1) Le gaz est comprimé de façon isotherme et réversible jusqu'à la pression PB= 10 Po (état B). Calculer le
travail et la quantité de chaleur reçus par le gaz.
2) Après avoir été ramené à l'état A, le gaz est comprimé de façon adiabatique et réversible jusqu’à la pression
PB' = PB (état B'). Calculer le travail reçu par le gaz.
3) Représenter dans le diagramme (P,V) les transformations (AB) et (AB').
4) Partant du point A, le gaz est comprimé de façon isotherme réversible jusqu'à la pression PB; il est ensuite
détendu de façon adiabatique jusqu'à une pression Pc = Po. Calculer Vc et Tc et représenter la transformation
ABC.
Examen de Thermodynamique/ Licence1/ Session ordinaire 2023-2024
Docteur-ingénieur Bertrand Guelor ELONGO
Vous aimerez peut-être aussi
- TD Thermo Série N 1Document2 pagesTD Thermo Série N 1sa raPas encore d'évaluation
- TDThermo 5Document5 pagesTDThermo 5Ihsan MokhlissePas encore d'évaluation
- Series Thermodynamique 2011 Zradba Avec CorrectionDocument26 pagesSeries Thermodynamique 2011 Zradba Avec CorrectionTaha Blr100% (1)
- Série 4 19Document9 pagesSérie 4 19Abdelhakim BailalPas encore d'évaluation
- Serie III Thermo (19 20)Document2 pagesSerie III Thermo (19 20)Yassine EL FAKHAOUIPas encore d'évaluation
- Examen 2021Document4 pagesExamen 2021Mohammed AmliehPas encore d'évaluation
- Chimie-2 Generalités 2022Document5 pagesChimie-2 Generalités 2022Anas KhaldiPas encore d'évaluation
- Devoir de Thermodynamique L1-2023-2024Document1 pageDevoir de Thermodynamique L1-2023-2024elongoPas encore d'évaluation
- TD1 GMP2 2022Document3 pagesTD1 GMP2 2022Hassan ChehouaniPas encore d'évaluation
- TDTH 5Document2 pagesTDTH 5nakavouagrace64Pas encore d'évaluation
- TD 2 Mip - Mipc 2020Document2 pagesTD 2 Mip - Mipc 2020HEBATONPas encore d'évaluation
- M1PM Tmsa TD1Document2 pagesM1PM Tmsa TD1Samado Tips46Pas encore d'évaluation
- 8dfk1-Serie2 11 12Document2 pages8dfk1-Serie2 11 12Alpha Draxler BarryPas encore d'évaluation
- TD Isa 1 2021Document2 pagesTD Isa 1 2021Hassan ChehouaniPas encore d'évaluation
- TD Premier Deuxieme PrincipesDocument5 pagesTD Premier Deuxieme Principessamim1971Pas encore d'évaluation
- TRAVAUX DIRIGES DE THERMODYNAMIQUE 2020aDocument8 pagesTRAVAUX DIRIGES DE THERMODYNAMIQUE 2020aarmel nganji100% (1)
- Td1 - Thermodynamique - 1Document5 pagesTd1 - Thermodynamique - 1abderrahmane lalaouiPas encore d'évaluation
- TD Thermo L2PCSM 2023Document3 pagesTD Thermo L2PCSM 2023Ibrahima KonatePas encore d'évaluation
- Thermodynamique 23 24 Chap 1Document9 pagesThermodynamique 23 24 Chap 1Aziz TorkhaniPas encore d'évaluation
- 1.série N°1 de Chimie II - 1er CP - 2018-2019 ModDocument7 pages1.série N°1 de Chimie II - 1er CP - 2018-2019 ModLAICHAOUI NOURELIMANEPas encore d'évaluation
- Série N°01Document3 pagesSérie N°01mimostarPas encore d'évaluation
- Examen MKA 2 BTS 2020 Partie 1 & 2Document2 pagesExamen MKA 2 BTS 2020 Partie 1 & 2Josué DZUDIEPas encore d'évaluation
- TD2 Chimie Generale +CORRIGE 2016-2017Document10 pagesTD2 Chimie Generale +CORRIGE 2016-2017Awatif BePas encore d'évaluation
- Serie 3Document3 pagesSerie 3hartiPas encore d'évaluation
- Thermo TD2 2024Document4 pagesThermo TD2 2024Lodvert T. POATYPas encore d'évaluation
- TD Thermo en LigneDocument16 pagesTD Thermo en LigneDavi Nordel NgondzaPas encore d'évaluation
- 2019-2020 TD Total.Document7 pages2019-2020 TD Total.asics tigerPas encore d'évaluation
- (TP23) EnonceDocument4 pages(TP23) EnonceAdam Ait FarsPas encore d'évaluation
- Cours Exercices Thermo4Document9 pagesCours Exercices Thermo4Fatou SECKPas encore d'évaluation
- EXOS Thermo 2009 2010 PDFDocument71 pagesEXOS Thermo 2009 2010 PDFmathieu_coco0% (1)
- Masterexam 2006Document4 pagesMasterexam 2006gawojew756Pas encore d'évaluation
- TD Serie 1 PDFDocument4 pagesTD Serie 1 PDFmohamed saadiPas encore d'évaluation
- Série de Tdn°1 de Chimie-2Document4 pagesSérie de Tdn°1 de Chimie-2Feriel ZekriPas encore d'évaluation
- TD Thermo L1chi 23 24 022637Document6 pagesTD Thermo L1chi 23 24 022637milandcalebPas encore d'évaluation
- TD N2Document3 pagesTD N2Esperance TchibindaPas encore d'évaluation
- Série TD 1Document6 pagesSérie TD 1Manuel ArzolaPas encore d'évaluation
- SérieN3 2020-2021Document2 pagesSérieN3 2020-2021MounirPas encore d'évaluation
- Serie TD1 ThermoDocument2 pagesSerie TD1 ThermoRachid RekioukPas encore d'évaluation
- TD Thermodynamique Des ÉquilibresDocument19 pagesTD Thermodynamique Des Équilibresbrahimza61Pas encore d'évaluation
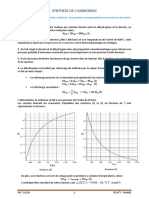
- TD Chimie No7 - Synthese de L AmmoniacDocument3 pagesTD Chimie No7 - Synthese de L AmmoniacKouakou Yves Boris Yao100% (1)
- TD Physique Iii FinDocument2 pagesTD Physique Iii FinfjosephfabricePas encore d'évaluation
- Thermo 3Document4 pagesThermo 3lilian01.larochePas encore d'évaluation
- Série TD N°1. Chimie IIDocument2 pagesSérie TD N°1. Chimie IIchaima gasmi100% (1)
- TD Revision Thermo I Sigma Premier Et Second Principe Janv 2022Document2 pagesTD Revision Thermo I Sigma Premier Et Second Principe Janv 2022Yoan NyockPas encore d'évaluation
- TD 1 ThermoDocument2 pagesTD 1 Thermomoney makerPas encore d'évaluation
- Thermo DS1 3a 2021Document2 pagesThermo DS1 3a 2021Quentin MoalPas encore d'évaluation
- Série N°1Document2 pagesSérie N°1Mohamed Ben-HmamePas encore d'évaluation
- L1PHY ThermodynamiqueDocument2 pagesL1PHY ThermodynamiqueLodvert T. POATYPas encore d'évaluation
- L1PHY ThermodynamiqueDocument2 pagesL1PHY ThermodynamiqueLodvert T. POATYPas encore d'évaluation
- Examen Thermo L2 ERSE 22Document1 pageExamen Thermo L2 ERSE 22ezmabelloPas encore d'évaluation
- Ex Thermo 1Document10 pagesEx Thermo 1ArthurpetitPas encore d'évaluation
- TD N°1 2020Document2 pagesTD N°1 2020Ismahane BenPas encore d'évaluation
- Travaux Dirigés de Thermo-1Document42 pagesTravaux Dirigés de Thermo-1anajjarbrahim0308Pas encore d'évaluation
- TD Thermo1Document10 pagesTD Thermo1Ayoub Tesla OuakaniPas encore d'évaluation
- TD6 Evolution Equilibre ChimiqueDocument4 pagesTD6 Evolution Equilibre ChimiqueBelaadelPas encore d'évaluation
- TD2 Thermo 2017-2018-1Document3 pagesTD2 Thermo 2017-2018-1Joseph AmondPas encore d'évaluation
- Correction Du TD3Document19 pagesCorrection Du TD3Sa Nae NacerPas encore d'évaluation
- TD3 Chaleur Travail UAM 2021Document2 pagesTD3 Chaleur Travail UAM 2021Serigne Alassane DiengPas encore d'évaluation
- Cours Microbio AlimetaireDocument70 pagesCours Microbio AlimetaireelongoPas encore d'évaluation
- Hygiene 598e86891723ddd16954293bDocument53 pagesHygiene 598e86891723ddd16954293bbessama84Pas encore d'évaluation
- Guide FroidDocument31 pagesGuide FroidelongoPas encore d'évaluation
- SulfitageDocument20 pagesSulfitageVasile BratuPas encore d'évaluation
- Modèle de Statuts D'association Loi 1901 Dont Le Siège Est Fixé À L'université Paris-Est CréteilDocument3 pagesModèle de Statuts D'association Loi 1901 Dont Le Siège Est Fixé À L'université Paris-Est CréteilelongoPas encore d'évaluation
- Modele de Statuts: Article 1Document3 pagesModele de Statuts: Article 1elongoPas encore d'évaluation
- ELONGO-BG - Thèse FinalDocument172 pagesELONGO-BG - Thèse FinalelongoPas encore d'évaluation
- CV Elongo ActualiséDocument6 pagesCV Elongo ActualiséelongoPas encore d'évaluation
- Cours de Chauffage& 197Document197 pagesCours de Chauffage& 197OULDITTOU MohamedPas encore d'évaluation
- PFE FINAL 2-ConvertiDocument52 pagesPFE FINAL 2-ConvertiMehdi ElfazniPas encore d'évaluation
- M24 Analyse de Circuits Pneumatiques ÉlectropneumatiquDocument338 pagesM24 Analyse de Circuits Pneumatiques ÉlectropneumatiquHassan AbaPas encore d'évaluation
- TP Loi+de+Gay-LussacDocument6 pagesTP Loi+de+Gay-Lussaclachi nadia100% (1)
- 2BTP1 2223 S THERM 1 CO-CORRIGE Echanges ThermiquesDocument2 pages2BTP1 2223 S THERM 1 CO-CORRIGE Echanges ThermiquesghannemiPas encore d'évaluation
- Gaz ParfaitDocument5 pagesGaz Parfaitsohane MdiPas encore d'évaluation
- 7 Interprétation Statistique de L'entropie - Troisième Principe de La Thermodynamique PDFDocument10 pages7 Interprétation Statistique de L'entropie - Troisième Principe de La Thermodynamique PDFfatima100% (1)
- Exp01 - MariotteDocument8 pagesExp01 - Mariotteothmane026Pas encore d'évaluation
- Exp01 - MariotteDocument8 pagesExp01 - Mariottei k0% (1)
- Corrige Des Exercices Transformation Des AlimentsDocument11 pagesCorrige Des Exercices Transformation Des AlimentsHicham Ishem83% (6)
- 1925 Thermométrie Et Dilatation. Cours de Physique 20111110Document15 pages1925 Thermométrie Et Dilatation. Cours de Physique 20111110Mirado Ram'sPas encore d'évaluation
- Les Capteurs de TempératureDocument17 pagesLes Capteurs de TempératureBelaid Hadji100% (1)
- Les Grands Principes de Froid D'une Climatisation - Tout Comprendre.Document15 pagesLes Grands Principes de Froid D'une Climatisation - Tout Comprendre.Bongouanou TanossoPas encore d'évaluation
- MemoireDocument7 pagesMemoiresaifu.jakePas encore d'évaluation
- Dilatation ThermiqueDocument25 pagesDilatation Thermiquedomitille.montavonPas encore d'évaluation
- Calorimetrie - CopieDocument20 pagesCalorimetrie - CopiefontainePas encore d'évaluation
- MemoireDocument17 pagesMemoirejokPas encore d'évaluation
- Métrologie Des TempératuresDocument56 pagesMétrologie Des TempératuresAnis AichourPas encore d'évaluation
- Module 4 La ThermométrieDocument6 pagesModule 4 La Thermométriesamy martialPas encore d'évaluation
- Chvetz, Kondak - Thermique Générale - Mir - 1969Document511 pagesChvetz, Kondak - Thermique Générale - Mir - 1969Hicham YangPas encore d'évaluation
- Unité A Substances Pures Et MélangesDocument86 pagesUnité A Substances Pures Et Mélangesgiseleaubin1Pas encore d'évaluation
- Pages Extraites de 00 - Les Grandeurs Physiques Liées Aux Quantités de Matière - Cours 18-19 - V-FinaleDocument4 pagesPages Extraites de 00 - Les Grandeurs Physiques Liées Aux Quantités de Matière - Cours 18-19 - V-FinaleNada khennibaPas encore d'évaluation
- Support de Cours FST BENI MELLAL: Matière: Mesure Et InstrumentationDocument70 pagesSupport de Cours FST BENI MELLAL: Matière: Mesure Et InstrumentationYassine ZahriPas encore d'évaluation
- TemperatureDocument5 pagesTemperatureShabanianzuruni ShabaniPas encore d'évaluation
- Feuille TageDocument130 pagesFeuille TageEL BAKRI KHALIDPas encore d'évaluation
- Système PneumatiqueDocument45 pagesSystème PneumatiqueYoussef ErramiPas encore d'évaluation
- Thermographie InfrarougeDocument11 pagesThermographie InfrarougeYasmine HammamiPas encore d'évaluation
- Bon Photo Interieur Climatis Les Machines ThermiquesDocument37 pagesBon Photo Interieur Climatis Les Machines ThermiquesAmrani AbdennasserPas encore d'évaluation
- Mémoire 2022Document47 pagesMémoire 2022nohaila nohaPas encore d'évaluation
- II Mesure de TempératureDocument11 pagesII Mesure de TempératureKhene Mohamed LaminePas encore d'évaluation