Académique Documents
Professionnel Documents
Culture Documents
Cours Chapitre 4 Titrages Colorimétriques
Transféré par
erlingx7220 évaluation0% ont trouvé ce document utile (0 vote)
2 vues2 pagesTitre original
cours chapitre 4 titrages colorimétriques
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
2 vues2 pagesCours Chapitre 4 Titrages Colorimétriques
Transféré par
erlingx722Droits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
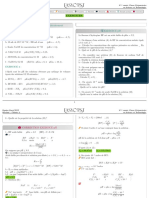
Sciences physiques 1er spécialité
Cours chapitre 4 : Titrages colorimétriques.
• Un dosage permet de déterminer la quantité de matière ou la concentration d’une espèce chimique dissoute dans une solution.
• Un dosage par titrage, ou titrage, est une technique de dosage mettant en jeu une réaction chimique appelée réaction support de titrage.
La réaction support de titrage doit être :
totale (le réactif limitant est entièrement consommé).
rapide (une réaction rapide se fait immédiatement à l’œil nu).
unique (la seule à se réaliser)
Cas général d’un titrage direct Exemple d’un titrage direct
On cherche à déterminer la concentration CA ou la quantité nA de l’espèce A On cherche à déterminer la concentration CH2O2 ou la quantité nH2O2 de l’espèce H2O2 dans
dans un échantillon. un échantillon.
Equation de la réaction support du Le montage :
Equation de la réaction support du titrage :
titrage : -
5 H2O2(aq) + 2 MnO4 (aq) + 16 H+(aq) → 2 Mn2+(aq) + 8 H2O(l) + 5 O2(g) + 10 H+(aq)
a A + b B +… → c C + d D + …
B : CB Lors du titrage, le réactif titré H2O2, dont on cherche à Le montage :
Lors du titrage, le réactif titré A, dont on VE déterminer la concentration CH2O2 ou la quantité nH2O2
cherche à déterminer la concentration CA -
réagit avec le réactif titrant MnO4 de concentration
-
MnO4 (aq) :
ou la quantité nA réagit avec le réactif
titrant B de concentration CB connue. CMnO4- = 2,00.10-2 mol. CMnO4- = 2,0.10-2 mol/L
VE = 17,8.10-3 mL
A: -
À l'équivalence, le réactif titrant B et le À l'équivalence, le réactif titrant MnO4 et le réactif
CA ?
HO
réactif à titrer A ont été introduits dans nA ? à titrer 2 2 ont été introduits dans l’erlenmeyer H2O2(aq) :
l’erlenmeyer en proportions VA en proportions stœchiométrique, ils ont totalement CH2O2 ? ; nH2O2 ?
stœchiométrique, ils ont totalement réagi réagi et il y a changement de réactif limitant.
et il y a changement de réactif limitant. 5 H2O2(aq) + 2 MnO4 (aq)
- VH2O2 = 10 mL
aA + bB À l'équivalence nH2O2 - 5.xE = 0 nEMnO4 - 2.xE = 0 H+(aq)
Quantité de matière
À l'équivalence nA – a . xE = 0 nEB – b . xE = 0 présente (A, B) dans
l’erlenmeyer en fonction A l’équivalence : on a introduit dans l’erlenmeyer un volume Quantité de matière
-
A l’équivalence : on a introduit dans l’erlenmeyer un du volume de réactif VE = 17,8 mL de réactif titrant MnO4 et une quantité nEMnO4- = CMnO4- .VE présente (H2O2, MnO4-)
volume VE de réactif titrant B et une quantité titrant B versé V. -
nEMnO4- = 2,00.10-2 . 17,8.10-3= 3,56.10-5 mol de réactif titrant MnO4 . dans l’erlenmeyer en
nEB = CB .VE de réactif titrant B. n nH2O2 nEMnO4− nEMnO4−
fonction du volume de
nH2O2 - 5.xE = 0 mol → xE = = → nH2O2 = 𝟓𝟓. réactif titrant MnO4
-
𝟓𝟓 𝟐𝟐 𝟐𝟐
nA nBE nEB versé V.
nA - a.xE= 0 mol → xeq = = → nA = 𝐚𝐚. CH2O2 .VH2O2 CMnO4− .VE 𝟓𝟓 CMnO4− .VE
𝐚𝐚 𝐛𝐛 𝐛𝐛 A nEMnO4 - 2.xE = 0 mol →
𝟓𝟓
=
𝟐𝟐
→ CH2O2 = .
𝟐𝟐 VH2O2
n
nEB - b.xE= 0 mol →
CA .VA
=
CB .VE
→ CA = .
𝐚𝐚 CB .VE 3,56. 10−5 𝟓𝟓 3,56. 10−5 H2O2
𝐚𝐚 𝐛𝐛 𝐛𝐛 VA B nH2O2 = 𝟓𝟓.
𝟐𝟐
= 9. 10−5 mol ; CH2O2 = .
𝟐𝟐 10,0 × 10−3
= 8,90. 10−3 mol /L
-
MnO4
-
L’ors d’un titrage colorimétrique, un changement de L’ors du titrage colorimétrique, l’espèce H2O2, les ions MnO4 est le seul
couleur du mélange réactionnel (solution dans coloré (magenta). A l’équivalence, le mélange réactionnel (solution dans
l’erlenmeyer) permet de repérer l’équivalence. VE V l’erlenmeyer) passe de l’incolore au magenta. VE V
Sciences physiques 1er spécialité
Vous aimerez peut-être aussi
- 50 Exercices de PNL LivreDocument300 pages50 Exercices de PNL LivreYoucef Kasmi100% (9)
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- 1 5057939326709531169Document35 pages1 5057939326709531169Aboby emmanuel0% (1)
- S7 Chapitre 03 Reaction Acide Base DosageDocument16 pagesS7 Chapitre 03 Reaction Acide Base DosageRADWAN100% (2)
- Dosage Acido BasiqueDocument33 pagesDosage Acido Basiquemed100% (1)
- TP Dosage Redox Potentiometrique CorrectionDocument5 pagesTP Dosage Redox Potentiometrique Correctiondina 05100% (1)
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 pagesTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - Monobaseel hazbi fadilaPas encore d'évaluation
- Livre Vers Le Bacc T2Document27 pagesLivre Vers Le Bacc T2Hanine Hmida50% (2)
- Fascicule de TP de Chimie 1Document28 pagesFascicule de TP de Chimie 1Karim Kisserli100% (1)
- TP00 H2O2corr PDFDocument2 pagesTP00 H2O2corr PDFEl Ouahabi SoufyanePas encore d'évaluation
- CSPlas 2Document16 pagesCSPlas 2KangamaPas encore d'évaluation
- TP Chimie AnalytiqueDocument13 pagesTP Chimie AnalytiqueFedoua Benamer100% (1)
- CHP 2 TD - Chimie - SolutionDocument8 pagesCHP 2 TD - Chimie - SolutionSimplice Assemien100% (2)
- NFP 18-459 - V - 2010Document11 pagesNFP 18-459 - V - 2010Abdelghafour LAAMARTIPas encore d'évaluation
- TP1 Chimie Rappels CorrectionDocument6 pagesTP1 Chimie Rappels Correctionأمال بلقاسمPas encore d'évaluation
- C6Chim - Titrages - Exos - Ph&conduct&color PDFDocument9 pagesC6Chim - Titrages - Exos - Ph&conduct&color PDFAzizElheniPas encore d'évaluation
- 8 - DosageDocument4 pages8 - DosageWay to futurePas encore d'évaluation
- 3-TP Solution TitréesDocument14 pages3-TP Solution TitréesMeriem BenPas encore d'évaluation
- TleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsDocument21 pagesTleD - CH - L10 - Réactions Acidobasiques. Solutions TamponsHamadi DialloPas encore d'évaluation
- Mission N°3 PH Acide& Base FortsDocument2 pagesMission N°3 PH Acide& Base FortsAmélie D.Pas encore d'évaluation
- Réaction Acido-Basique Solution Tampon-1Document10 pagesRéaction Acido-Basique Solution Tampon-1juniorkoffi681Pas encore d'évaluation
- Chimie B Chap8 Titrage - Acidobasique PDFDocument6 pagesChimie B Chap8 Titrage - Acidobasique PDFMouloud IssaadPas encore d'évaluation
- TP-PH-métrie ElectrochimieDocument14 pagesTP-PH-métrie ElectrochimieAya DgmPas encore d'évaluation
- 1 STPC 8Document3 pages1 STPC 8talebi jamalPas encore d'évaluation
- TD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseDocument5 pagesTD: Réactions Acido-Basiques: Exercice N°1: Diagramme de Distribution Pour Un Couple Monoacide - MonobaseLOUkmen Bel100% (1)
- tp11 Evolution Spontanee D Un Systeme Chimique EleveDocument4 pagestp11 Evolution Spontanee D Un Systeme Chimique Elevemohamed laghribPas encore d'évaluation
- Chapitre XIV: Les Techniques de La Chimie: A KXCDocument8 pagesChapitre XIV: Les Techniques de La Chimie: A KXCOuaazizPas encore d'évaluation
- TD 3ème CEGDocument25 pagesTD 3ème CEGAlain DEMBIPas encore d'évaluation
- Site TS C 06 Titrages Acido-BasiquesDocument8 pagesSite TS C 06 Titrages Acido-BasiquesPecorella100% (1)
- La Reaction Chimique Exercices Non CorrigesDocument1 pageLa Reaction Chimique Exercices Non CorrigesSara EcheradiPas encore d'évaluation
- Ptsi - I1 TD.C4 Réactions Acido-Basiques Et de Précipitation I-Réactions Acido-BasiquesDocument2 pagesPtsi - I1 TD.C4 Réactions Acido-Basiques Et de Précipitation I-Réactions Acido-Basiquesnoamassin78Pas encore d'évaluation
- TD Acide Faible-2024-Lsll - WahabdiopDocument4 pagesTD Acide Faible-2024-Lsll - WahabdiopAmadou Oury DialloPas encore d'évaluation
- Controle de La Qualité Par DosageDocument53 pagesControle de La Qualité Par DosageNada MarhfourPas encore d'évaluation
- TD Eq2Document5 pagesTD Eq2Lÿnçrë Mërss DoriPas encore d'évaluation
- Exercice Chimie 3Document8 pagesExercice Chimie 3Idris HammouchePas encore d'évaluation
- 08 TS Chimie Cours - Reactions Acido-Basiques-2Document4 pages08 TS Chimie Cours - Reactions Acido-Basiques-2foufoudoudouPas encore d'évaluation
- Serie CoronaDocument15 pagesSerie CoronaJoséphine NancassePas encore d'évaluation
- Acido Basiques Cours Et Exercices CorrigésDocument11 pagesAcido Basiques Cours Et Exercices CorrigésAnass Benahmed100% (1)
- Micro MDocument28 pagesMicro Ml3bsectionbPas encore d'évaluation
- CHAPITRE 2 Partie 1Document33 pagesCHAPITRE 2 Partie 1hamid ibbakhPas encore d'évaluation
- TD tc7 DosagesDocument11 pagesTD tc7 Dosagescours importantPas encore d'évaluation
- Cours PCT A TIRERDocument60 pagesCours PCT A TIRERJoy TowendoPas encore d'évaluation
- Chap09 ExercicesDocument3 pagesChap09 ExercicesR VMPas encore d'évaluation
- Calcul Du PH Des Solutions AqueusesDocument5 pagesCalcul Du PH Des Solutions AqueusesHassen JinyorPas encore d'évaluation
- TP2 - Détermination D'un Coefficient de PartageDocument7 pagesTP2 - Détermination D'un Coefficient de PartageOmairPas encore d'évaluation
- Physique Chimie CDocument4 pagesPhysique Chimie CLa Sereine Duvolant100% (1)
- Analyse 2024 01 30 19 - 51 - 51Document8 pagesAnalyse 2024 01 30 19 - 51 - 51kamelbd36Pas encore d'évaluation
- Chimie TP7 Prof PDFDocument3 pagesChimie TP7 Prof PDFمنير علي هباطي100% (1)
- Fiche Des 5 TP Chimie MPDocument8 pagesFiche Des 5 TP Chimie MPLandry Yoboue100% (1)
- Cours Chimie 02Document3 pagesCours Chimie 02imen dimessiPas encore d'évaluation
- Série 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseDocument6 pagesSérie 5 Transformations Associées À Des Réactions Acido-Basiques en Solution AqueuseFATIMA fatiii100% (1)
- Chimie en Ligne TD 8 Acides BasesDocument5 pagesChimie en Ligne TD 8 Acides BasesMed BriniPas encore d'évaluation
- C13 - Correction D'exercicesDocument5 pagesC13 - Correction D'exercicesSans SnoqPas encore d'évaluation
- ACIDE BASE Equilibre D'un Systeme Janvier 2004Document3 pagesACIDE BASE Equilibre D'un Systeme Janvier 2004David BéliardPas encore d'évaluation
- Acides Et Bases PCDocument15 pagesAcides Et Bases PCrkibi.khadija2006Pas encore d'évaluation
- 01devoir 1 Rev 2 Trimestre Bac Math Et SC 2023Document4 pages01devoir 1 Rev 2 Trimestre Bac Math Et SC 2023yasmine.akremi123Pas encore d'évaluation
- TPC4Document2 pagesTPC4hhedfiPas encore d'évaluation
- Cours TitragesDocument6 pagesCours TitragesKira BeatboxPas encore d'évaluation
- TD Réactions Acido-Basiques: L Mol HCO CDocument3 pagesTD Réactions Acido-Basiques: L Mol HCO ChassouiooPas encore d'évaluation
- ch5 1esterification Cours PDFDocument2 pagesch5 1esterification Cours PDFAmen RouissiPas encore d'évaluation
- 6129e58d84154reactions Acide Base Solutions Tampons Chimie TermDocument7 pages6129e58d84154reactions Acide Base Solutions Tampons Chimie TermPrince Informaticien GamesPas encore d'évaluation
- Dosage Acido Basique PCDocument3 pagesDosage Acido Basique PCKhalid AwtmPas encore d'évaluation
- Exo Chimie 2008 SNDocument1 pageExo Chimie 2008 SNlina elouadihPas encore d'évaluation
- Réaction AB Indicateur DosageDocument5 pagesRéaction AB Indicateur DosageSk CissePas encore d'évaluation
- Savon Synthèse Correction 2024Document2 pagesSavon Synthèse Correction 2024erlingx722Pas encore d'évaluation
- Savon Synthèse 2024Document2 pagesSavon Synthèse 2024erlingx722Pas encore d'évaluation
- Cours Cahpitre 8 Synthèse MoiDocument2 pagesCours Cahpitre 8 Synthèse Moierlingx722Pas encore d'évaluation
- Résumé Chapitre 16 MoiDocument1 pageRésumé Chapitre 16 Moierlingx722Pas encore d'évaluation
- Résumé Chapitre 13 L Energie Des Systèmes ÉlectriquesDocument2 pagesRésumé Chapitre 13 L Energie Des Systèmes Électriqueserlingx722Pas encore d'évaluation
- 12.2 Porteurs de ChargesDocument1 page12.2 Porteurs de Chargeserlingx722Pas encore d'évaluation
- Contrat Type de Maintenance Climatiseur - Résidence de La BaieDocument5 pagesContrat Type de Maintenance Climatiseur - Résidence de La BaiePatou Patrice100% (1)
- Revue de La Litterature EmpiriqueDocument41 pagesRevue de La Litterature EmpiriqueK.arsene DjekaPas encore d'évaluation
- TP Hydraulique AppDocument7 pagesTP Hydraulique AppAMALI BlaisePas encore d'évaluation
- Ultrastructure de La Cellule AnimaleDocument4 pagesUltrastructure de La Cellule AnimaleWiem HabbassiPas encore d'évaluation
- Stats Seance 03 DocDocument16 pagesStats Seance 03 DocJean-Baptiste GAUTIER-FABIANIPas encore d'évaluation
- Le Transducteur 1Document2 pagesLe Transducteur 1Elysee Mukanya mwanabutePas encore d'évaluation
- Curriculum Vitae. King Ima Supzonale PDFDocument5 pagesCurriculum Vitae. King Ima Supzonale PDFKingamboPas encore d'évaluation
- Le TP Se Déroule en 4 Étapes. Documents FournisDocument9 pagesLe TP Se Déroule en 4 Étapes. Documents FournisAnacleto AlfredoPas encore d'évaluation
- Cv. Fabrice Thierry Amba (1) CompressedDocument2 pagesCv. Fabrice Thierry Amba (1) CompressedambadiangPas encore d'évaluation
- Compte Rendu de L'atelier DEADocument8 pagesCompte Rendu de L'atelier DEADibé BATADIWAPas encore d'évaluation
- Ingenieur FR PDFDocument2 pagesIngenieur FR PDFAlseni SoumahPas encore d'évaluation
- Discussion WhatsApp Avec Anta BarryDocument115 pagesDiscussion WhatsApp Avec Anta Barrysow67% (3)
- M 3650 DocDocument1 pageM 3650 Docimen mehriPas encore d'évaluation
- Qu'est-Ce Qu'une Analyse Syntaxique ?: La Nature D'un Mot Ne Change Donc Jamais: C'est Sa Nature Justement !Document4 pagesQu'est-Ce Qu'une Analyse Syntaxique ?: La Nature D'un Mot Ne Change Donc Jamais: C'est Sa Nature Justement !cacaftPas encore d'évaluation
- Serie 7 - Corrigees - Probabilite de RuineDocument4 pagesSerie 7 - Corrigees - Probabilite de RuineStéphanie Sablon100% (1)
- Psaume 72Document4 pagesPsaume 72John PoloPas encore d'évaluation
- Propulseur Electromagnétique - CoilGun3 PDFDocument1 pagePropulseur Electromagnétique - CoilGun3 PDFMAD-BONDOPas encore d'évaluation
- 030884664Document130 pages030884664Papilo NaaPas encore d'évaluation
- Partie1 Chapitre 2Document60 pagesPartie1 Chapitre 2oussama.lahlimiPas encore d'évaluation
- Article Cerveau Droit PDFDocument6 pagesArticle Cerveau Droit PDFA.nassPas encore d'évaluation
- Power Point Gaba E. Credo - Mp2-Genie - ElectriqueDocument34 pagesPower Point Gaba E. Credo - Mp2-Genie - ElectriquecredoPas encore d'évaluation
- TD N°4 Travail Et Puissance MecaniqueDocument3 pagesTD N°4 Travail Et Puissance MecaniqueBado Sall67% (3)
- Chapitre 04 Concept FMDDocument10 pagesChapitre 04 Concept FMDTaha IdrissiPas encore d'évaluation
- Droit de La Responsabilité S4Document35 pagesDroit de La Responsabilité S4Marjane LnaPas encore d'évaluation
- Rapport: Séance3Document4 pagesRapport: Séance3Sara RimasPas encore d'évaluation
- Les Registres UsthbDocument45 pagesLes Registres Usthbzgaren aminePas encore d'évaluation