100% ont trouvé ce document utile (1 vote)
2K vues20 pagesCondensation Aldolique
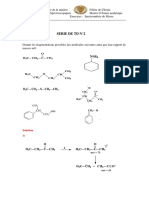
Ce document décrit les réactions d'aldolisation et apparentées impliquant des composés carbonylés. Il explique la tautomérie céto-énolique et la formation d'énolates qui sont des espèces nucléophiles réactives. Différents types de réactions comme l'halogénation et l'alkylation sont également abordés.
Transféré par
Zorgani TarekCopyright
© © All Rights Reserved
Nous prenons très au sérieux les droits relatifs au contenu. Si vous pensez qu’il s’agit de votre contenu, signalez une atteinte au droit d’auteur ici.
Formats disponibles
Téléchargez aux formats PDF, TXT ou lisez en ligne sur Scribd
100% ont trouvé ce document utile (1 vote)
2K vues20 pagesCondensation Aldolique
Ce document décrit les réactions d'aldolisation et apparentées impliquant des composés carbonylés. Il explique la tautomérie céto-énolique et la formation d'énolates qui sont des espèces nucléophiles réactives. Différents types de réactions comme l'halogénation et l'alkylation sont également abordés.
Transféré par
Zorgani TarekCopyright
© © All Rights Reserved
Nous prenons très au sérieux les droits relatifs au contenu. Si vous pensez qu’il s’agit de votre contenu, signalez une atteinte au droit d’auteur ici.
Formats disponibles
Téléchargez aux formats PDF, TXT ou lisez en ligne sur Scribd