Académique Documents
Professionnel Documents
Culture Documents
Sujet CC1 2014
Transféré par
samuelCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Sujet CC1 2014
Transféré par
samuelDroits d'auteur :
Formats disponibles
Réaction chimiques
Combustion du benzène C6H6
L’hydrogénation du propène C3H6 en propane C3H8
Neutralisation de la soude NaOH par l’acide chlorhydrique HCl
Neutralisation de l’acide acétique CH3COOH par la soude
Exercice :
Soit la réaction suivante :
C2H2 (g) + H2O (l) CH3CHO (l)
On étudie cette réaction en introduisant 3,6g d’eau et de l’ethène C 2H2 dans une enceinte
préalablement vide de volume V=10L.
On mesure une pression initiale de 1bar et une température de 300°K.
1) Justifier numériquement le fait que le volume d’eau est négligeable devant celui du gaz.
2) Calculer la quantité initiale de gaz dans l’enceinte.
3) Dresser un tableau d’avancement des quantités de matières
4) Quel est le réactif en défaut.
5) Quel seront les quantités de matière dans l’enceinte si la réaction est totale.
6) Calculer les pressions partielles et la pression totale dans l’enceinte à l’issue de la réaction.
Masse volumique de l’eau : 1g/cm3
Exercice : Volatilité de l’acétone
On renverse sur le sol d’une salle de chimie de volume V=100m 3 une bouteille contenant
1500g d’acétone C3H6O. La température de la pièce est de 25°C
1) Calculer la pression partielle théorique en acétone dans la pièce si on fait l’hypothèse que la
totalité du liquide s’évapore.
2) Compte tenu de la pression de vapeur de ce solvant, la quantité d’acétone renversée pourra-
t-elle entièrement s’évaporer ?
3) Quelle masse maximum d’acétone est capable de s’évaporer dans la pièce pour atteindre
l’équilibre liquide-gaz pour ce composé.
4) On cherche à calculer la quantité d’acétone correspondant au mélange stœchiométrique
avec l’oxygène de la pièce, pour une combustion complète.
Pour cela, vous calculerez la quantité d’oxygène initialement présent dans la pièce. Puis vous
estimerez, à partir de l’équation de combustion de l’acétone, la quantité d’acétone que l’on
peut faire réagir de façon stœchiométrique, en consommant la totalité de l’oxygène.
A quelle pression partielle d’acétone cela correspond-il ? En déduire le rapport d’explosivité.
(le rapport d’explosivité correspond au rapport de cette pression partielle sur la pression
atmosphérique)
Données : pression de vapeur de l’acétone à 25°C : PVS= 0,228bar
M(acetone)=58 g.mol-1 ; 1bar=105 Pa ; % molaire d’O2 dans l’air = 20% ; R=8,314J.K-
1
.mol-1
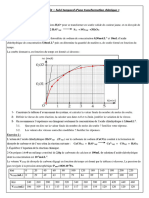
Exercice : Diagramme de phase
3
2.5
2
ace-
Pression (atm)
tone
1.5
0.5
0
250 260 270 280 290 300 310 320 330 340 350 360 370 380 390 400
température (°K)
1) Dessiner sur le diagramme d’équilibre liquide-vapeur le point permettant de déterminer la
température d’ébullition de ces composés.
2) On enferme 1mole de chacun de ces deux composés dans une enceinte de volume V=20L, à la
température T=350°K. Représenter sur le diagramme la pression théorique correspondante.
3) En déduire graphiquement l’état physique de chacun de ces composés et leur pression partielle
dans l’enceinte.
4) En déduire la pression totale dans l’enceinte.
Vous aimerez peut-être aussi
- Exo T6liqvapDocument8 pagesExo T6liqvapجعدبندرهمPas encore d'évaluation
- Série5 Liqvap Janv2023 PC2Document4 pagesSérie5 Liqvap Janv2023 PC2alicherifbouzaidaPas encore d'évaluation
- TD Chimie Physique Appliquée 2022Document8 pagesTD Chimie Physique Appliquée 2022Ivan YamdjeuPas encore d'évaluation
- Série N°2 Chimie Equilibre Chimique Technique 2011 2012 (Alibi Anouar)Document4 pagesSérie N°2 Chimie Equilibre Chimique Technique 2011 2012 (Alibi Anouar)Hiba JendoubiPas encore d'évaluation
- Fiche TD Opu N 1 l3 Gp2020 2021Document4 pagesFiche TD Opu N 1 l3 Gp2020 2021Mohamed Berber100% (1)
- Reactivite Chimie 1 TDDocument48 pagesReactivite Chimie 1 TDOlaya ELPas encore d'évaluation
- TD2Document2 pagesTD2Aabed omairPas encore d'évaluation
- °smc4 TD Thermodynamique Chimique Fsdm-Fes 19-20Document23 pages°smc4 TD Thermodynamique Chimique Fsdm-Fes 19-20Ayoub OuangliPas encore d'évaluation
- Série5 Liqvap 2022 PC2Document4 pagesSérie5 Liqvap 2022 PC2Aymen GharbiPas encore d'évaluation
- 1ère SérieDocument3 pages1ère SérieAbdallah abdellaoui100% (1)
- 1ère SérieDocument3 pages1ère SérieAbdallah abdellaouiPas encore d'évaluation
- Exo Cinetique Corrige AmmadoucheDocument82 pagesExo Cinetique Corrige AmmadouchetalebPas encore d'évaluation
- L1BCGS - Série N°4 - 22-23Document2 pagesL1BCGS - Série N°4 - 22-23nbineta261Pas encore d'évaluation
- C 02 Ab 1 eDocument5 pagesC 02 Ab 1 eMihnea GamanPas encore d'évaluation
- Tdtsen 15 (Physique-Chimie) : Academie D'Enseignement de San Lycee Public de SanDocument5 pagesTdtsen 15 (Physique-Chimie) : Academie D'Enseignement de San Lycee Public de SanAlassane TraorePas encore d'évaluation
- Série #1 S2 PIC8 19-20Document6 pagesSérie #1 S2 PIC8 19-20SALIMA BOULAIDPas encore d'évaluation
- TD Equilibre Chimique 2016Document4 pagesTD Equilibre Chimique 2016Oumar TraoréPas encore d'évaluation
- Série D'exercices - Chimie Série Loi de Modération Et Loi D'action de Masse - Bac Math (2013-2014) MR Afdal AliDocument6 pagesSérie D'exercices - Chimie Série Loi de Modération Et Loi D'action de Masse - Bac Math (2013-2014) MR Afdal AliOussémaM'solli0% (1)
- Ex 1Document2 pagesEx 1soulaimaneelaouni220Pas encore d'évaluation
- Fiche TD Opu 2023 2024 GPDocument4 pagesFiche TD Opu 2023 2024 GPClash of Clans Bilal DzPas encore d'évaluation
- Série D'exos Sur Equilibre ChimiqueDocument2 pagesSérie D'exos Sur Equilibre Chimiquedt456145Pas encore d'évaluation
- Binaire PiDocument9 pagesBinaire PiBasmã Alileche100% (1)
- TD1 DistillationDocument2 pagesTD1 DistillationTakwaPas encore d'évaluation
- Binaires 2Document8 pagesBinaires 2محمد الفاتح100% (1)
- DEVOIR IC1 PETROLE - Thermodynamique ChimiqueDocument2 pagesDEVOIR IC1 PETROLE - Thermodynamique ChimiqueYannick Ange Karmel THIEROPas encore d'évaluation
- Contrôle #1 SMI-SMA Thermo-Phy1 - 2010-2011Document3 pagesContrôle #1 SMI-SMA Thermo-Phy1 - 2010-2011ToufikJalalEddinePas encore d'évaluation
- Devoir FinalDocument5 pagesDevoir FinalKawthar MezennerPas encore d'évaluation
- Devoir ThermochimieDocument6 pagesDevoir Thermochimieeloijonathan0Pas encore d'évaluation
- Examen CB21 31 Mai 2012+corrigeDocument3 pagesExamen CB21 31 Mai 2012+corrigeOumaima El ImraniPas encore d'évaluation
- Fiche de TD N°1Thermodynamique Version Finale 2019-2020Document2 pagesFiche de TD N°1Thermodynamique Version Finale 2019-2020Ñar ĎjesPas encore d'évaluation
- Devoir de Contrôle N°1 Lycée Pilote - Physique - Bac Mathématiques (2011-2012) MR FekiriDocument5 pagesDevoir de Contrôle N°1 Lycée Pilote - Physique - Bac Mathématiques (2011-2012) MR FekiriDeadly TokyoPas encore d'évaluation
- Soutien Pcsi 3 Vitesse Et Loi de VitesseDocument5 pagesSoutien Pcsi 3 Vitesse Et Loi de VitesseHarakat ElhoucinePas encore d'évaluation
- TD TransfMat01-1Document4 pagesTD TransfMat01-1Chaymae OuahmanePas encore d'évaluation
- DM 1 Potentiel Chimique Diagrammes BinairesDocument3 pagesDM 1 Potentiel Chimique Diagrammes BinairesDonguiPas encore d'évaluation
- 6 TDPCSIcinetique 2015Document8 pages6 TDPCSIcinetique 2015Nguissaly SonkoPas encore d'évaluation
- Equilibre ChimiqueDocument5 pagesEquilibre ChimiqueJabri ImenePas encore d'évaluation
- Mc389langes Et Corps PursDocument3 pagesMc389langes Et Corps PursLiza mezariPas encore d'évaluation
- Série No1 de DistillationDocument1 pageSérie No1 de DistillationAyoub ArrarPas encore d'évaluation
- Series Thermodynamique 2011 Zradba Avec CorrectionDocument26 pagesSeries Thermodynamique 2011 Zradba Avec CorrectionTaha Blr100% (1)
- TD Te l3gpDocument7 pagesTD Te l3gpInas DrPas encore d'évaluation
- Série 2 Liquide Vapeur (Chimie)Document9 pagesSérie 2 Liquide Vapeur (Chimie)Chedly TrimechPas encore d'évaluation
- Série D'exercices de Révision Corrigées de Chimie Suivi Temporel d'1 Transformation Vitesse de La Réaction p.SBIRO Abdelkrim (WWW - Pc1.ma)Document19 pagesSérie D'exercices de Révision Corrigées de Chimie Suivi Temporel d'1 Transformation Vitesse de La Réaction p.SBIRO Abdelkrim (WWW - Pc1.ma)Yacine Ait El Houss100% (15)
- TP Distillation Courbe de RoséeDocument9 pagesTP Distillation Courbe de RoséeKeryl Crawford100% (1)
- DM 6. Thermo Second PCP Et OptimisationDocument10 pagesDM 6. Thermo Second PCP Et Optimisationhabet.houria63Pas encore d'évaluation
- TDcinét Chim.17-18Document3 pagesTDcinét Chim.17-18Joseph AmondPas encore d'évaluation
- ch9 ds1 09 2013 Cinetique CatalyseDocument2 pagesch9 ds1 09 2013 Cinetique CatalysemohamedPas encore d'évaluation
- TD Thermo Série N 1Document2 pagesTD Thermo Série N 1sa raPas encore d'évaluation
- 0607DM2 PDFDocument3 pages0607DM2 PDFFoudil Laouici100% (1)
- Série D'exercices - Sciences Physiques Préparation Bac 2011 - Bac Mathématiques (2010-2011) MR BenaichDocument21 pagesSérie D'exercices - Sciences Physiques Préparation Bac 2011 - Bac Mathématiques (2010-2011) MR BenaichTawfiq Weld EL ArbiPas encore d'évaluation
- Série D'exercices 1, Transformations Rapides Et Transformations Lentes, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument1 pageSérie D'exercices 1, Transformations Rapides Et Transformations Lentes, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDالغزيزال الحسن EL GHZIZAL Hassane100% (1)
- Série #3 - S4 2021 PDFDocument3 pagesSérie #3 - S4 2021 PDFYounesPas encore d'évaluation
- Fiche 2 OpuDocument9 pagesFiche 2 Opusaid laibPas encore d'évaluation
- Série Loi Daction de MasseDocument2 pagesSérie Loi Daction de MasseimedPas encore d'évaluation
- Série Loi Daction de MasseDocument2 pagesSérie Loi Daction de Masseimed100% (1)
- Série 1Document4 pagesSérie 1Lamia ALACHAHER100% (1)
- 2019-2020 TD Total.Document7 pages2019-2020 TD Total.asics tigerPas encore d'évaluation
- Texte Chimie Travaux DirigéeDocument1 pageTexte Chimie Travaux DirigéeJaynito EtinnePas encore d'évaluation
- Examen Chimie en Sol CE1-Ratt Juillet 2021Document1 pageExamen Chimie en Sol CE1-Ratt Juillet 2021Wi Em ChPas encore d'évaluation
- PRAL Des Aliments Alcalinisants Et Acidifiants - InternetDocument10 pagesPRAL Des Aliments Alcalinisants Et Acidifiants - InternetsauvagePas encore d'évaluation
- The Very Hungry CaterpillarDocument3 pagesThe Very Hungry Caterpillarkinito kPas encore d'évaluation
- Vicia Faba (La Féve)Document85 pagesVicia Faba (La Féve)Martine FatouPas encore d'évaluation
- Cours 2 - Principales Caractéristiques Des VégétauxDocument29 pagesCours 2 - Principales Caractéristiques Des VégétauxMouhamadou DiopPas encore d'évaluation
- Lenovo-Pc20200624145014 PDFDocument3 pagesLenovo-Pc20200624145014 PDFMOUMOUPas encore d'évaluation
- Are 2Document28 pagesAre 2Ndoumbe BaPas encore d'évaluation
- KOUMENDocument73 pagesKOUMENSerigne WadePas encore d'évaluation
- Conception de Moule-2Document3 pagesConception de Moule-2elking gingstarsPas encore d'évaluation
- TP JarDocument4 pagesTP JarAY YàPas encore d'évaluation
- Alphabetically: InstructionsDocument3 pagesAlphabetically: InstructionsquentinfollinaPas encore d'évaluation
- Disjoncteur C60H-DC - A9N61522Document2 pagesDisjoncteur C60H-DC - A9N61522Paul DayPas encore d'évaluation
- Esquema ElectricoDocument67 pagesEsquema ElectricoGonçalo Filipe SousaPas encore d'évaluation
- Carte Tiers Payant Thomas MoulignerDocument2 pagesCarte Tiers Payant Thomas MoulignerGUIARDEPas encore d'évaluation
- 3 As - Projet 2 - Le Débat DidéesDocument37 pages3 As - Projet 2 - Le Débat Didéesryad133192% (171)
- Contentieux Du TravailDocument37 pagesContentieux Du Travailmarc soubeigaPas encore d'évaluation
- ProcrastinationDocument2 pagesProcrastinationBRAKNESSPas encore d'évaluation
- Physiopathologie NeuroscienceDocument46 pagesPhysiopathologie NeuroscienceYas MiiinaaPas encore d'évaluation
- 3g Chimie TousDocument6 pages3g Chimie Tousapi-502752268Pas encore d'évaluation
- Camera Infrarouge PDFDocument11 pagesCamera Infrarouge PDFsensaadPas encore d'évaluation
- PEF Zizou Corriger - GENERAL - Khouloud Nchalla NejhaDocument56 pagesPEF Zizou Corriger - GENERAL - Khouloud Nchalla Nejhakhouloud rouissiPas encore d'évaluation
- Whirlpool ADG 676 NBDocument12 pagesWhirlpool ADG 676 NBChristian AlbertiniPas encore d'évaluation
- Ca 203 FR 1501 - LRDocument4 pagesCa 203 FR 1501 - LRjlopezPas encore d'évaluation
- Préparation MentaleDocument19 pagesPréparation Mentaleardis murejPas encore d'évaluation
- Appareil LocomoteurDocument2 pagesAppareil LocomoteurTASMINE HAMZAPas encore d'évaluation
- Sujets de Théorie 1Document7 pagesSujets de Théorie 1titounanoPas encore d'évaluation
- Animaux ExercicesDocument5 pagesAnimaux Exercicesmansouri100% (1)
- Genie Civil Questions WatermarkDocument11 pagesGenie Civil Questions WatermarkBenhmaida HananPas encore d'évaluation