Académique Documents
Professionnel Documents
Culture Documents
Série5 Liqvap 2022 PC2
Transféré par
Aymen GharbiTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Série5 Liqvap 2022 PC2
Transféré par
Aymen GharbiDroits d'auteur :
Formats disponibles
FACULTE DES SCIENCES DE MONASTIR A.U.
2022-2021
Département de Chimie PC2
Enseignant : Moneim ZANNEN
Chimie Inorganique
SERIE N°5
Exercice N°1 :
On refroidit l’air sous la pression atmosphérique. L’air est un mélange binaire de dioxygène et
de diazote tel que yO2 = 0,21.
a) Quelle sera la température de liquéfaction commençante de l’air ?
b) Quelle sera la fraction molaire en dioxygène de la première goutte de liquide ?
c) A quelle température l’air est totalement liquéfié ? quelles sont alors les compositions
du liquide et de la vapeur ?
d) On part de 1000 moles d’air. Quelle est la composition du système à 80 K ?
Exercice N°2 :
Le benzène (noté A) et le toluène (noté B) forment des solutions idéales à l’état liquide de
gazeux. Les tensions de vapeur saturantes du benzène et du toluène liquides suivent les
relations suivantes
PA* 4077
Pour le benzène : Ln( ) 11,55
P T
PB* 4570, 6
Pour le toluène : Ln( ) 11,93
P T
« T » exprimé en Kelvin et les pressions en bar.
Partie -A-
1) Déterminer la température d’ébullition normale de chaque composé.
2) Calculer les enthalpies molaires de vaporisation de A et de B. (on suppose qu’elles sont
indépendantes de la température).
Partie -B-
On se propose de tracer le diagramme binaire isobare liquide-vapeur du système A-B,
T = f(XB) et T = f(YB) avec XB la fraction molaire de B dans la phase liquide et YB la fraction
molaire de B dans la phase vapeur.
Les résultats de quelques expériences effectuées sous un bar, sont regroupés dans le tableau
suivant :
T (K) 360 365 370 375 380
YB 0,15 ? 0,44 ? 0,84
XB 0,32 ? 0,67 0,81 0,94
1) Compléter ce tableau en calculant les valeurs manquantes.
2) Tracer et indexer le diagramme correspondant. (On prendra comme échelle 1 cm pour
X = 0,1 et 4 cm pour ∆T = 10 K) et l’origine des températures sera prise à T = 350 K.
3) On chauffe progressivement un mélange liquide formé de 55,2 g de toluène et de 31,2 g de
benzène jusqu’à la température T = 370 K.
a- Déterminer la composition des phases présentes.
b- Calculer la quantité (en moles) de chacune des phases.
c- En déduire la masse du toluène et du benzène dans chacune de ces phases.
Données :
Constante des gaz parfaits R = 8,32 J.K-1.mol-1 ; masses molaires en (g.mol-1) : A = 78 et
B = 92.
Exercice N°3 :
Les pressions de vapeur de chloroforme pur (symbolisé par A) et du méthanol pur
(symbolisé par B) sont données par les deux relations suivantes :
1170,97
Pour le chloroforme CHCl3 : log10 ( PA ) 7, 77
90, 76
1582, 27
Pour le méthanol CH3OH : log10 ( PB ) 8, 212
128,32
Où la température ϴ est exprimée en °C et les pressions de vapeur en bar.
1) Calculer les températures d’ébullition du chloroforme et du méthanol sous la pression de 1
bar.
Le diagramme liquide-vapeur méthanol-chloroforme présente un point azéotropique à la
température ϴ = 52,5°C. La fraction molaire de l’azéotrope est égale à 0,35 en méthanol.
2) Donner l’allure de ce diagramme sous la pression de 1 bar.
3) On procède à une distillation fractionnée d’un mélange méthanol-chloroforme à 70 %
molaire de méthanol. Qu’obtient-on comme résidu et comme distillat ?
4) Comment peut-on différencier un mélange azéotropique d’un corps pur ?
5) Représenter sur le même schéma que celui de la question (2), l’allure qu’aurait le
diagramme si l’étude est faite sous la pression de 0,5 bar.
Exercice N°4 :
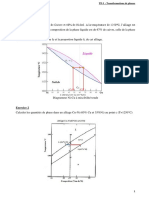
On se propose d’étudier l’équilibre liquide-vapeur du mélange eau(H2O)-peroxyde de
dihydrogène(H2O2) appelé aussi eau oxygénée. Les diagrammes isobare et isotherme sont
donnés ci-dessous. Les deux diagrammes sont donnés en fonction de fraction molaire de
(H2O2).
1) Indexer les domaines de (I) à (VI). Nommer les courbes (1), (2), (3) et (4).
2) Quelles sont les températures d’ébullition standard des deux corps purs ?
3) Quel est le liquide le plus volatil ? Justifier votre réponse.
4) Le mélange H2O-H2O2 est-il idéal ? justifier votre réponse.
5) A pression constante (P = 1 bar), on chauffe 10-3 moles d’un mélange (H2O et H2O2)
liquide noté L1 ; de fraction initiale (XH2O2)init. Lorsqu’on atteint la température de début
d’ébullition, le liquide L1, émet de la vapeur de composition (YH2O2)émis. Le liquide noté L2 de
même composition que cette vapeur a une température d’ébullition standard égale à 117 °C.
a- Quelle est la composition du liquide L2 ?
b- En déduire la composition du liquide L1 : (XH2O2)init
6) A température égale à 25 °C, on fait diminuer la pression d’un mélange liquide
(H2O et H2O2) de composition XH2O2 = 0,8.
a- A quelle pression P1 observe-t-on l’apparition de la première bulle de vapeur ?
b- Quelle est la composition de cette phase vapeur en H2O2 ?
c- Déterminer la fraction molaire globale (XH2O2)glob du système diphasé maintenu à la
température de 25 °C et sous P1, sachant que la quantité de matière (nombre de mole) totale
est égale à 10-3 moles et celle de la vapeur est égale à 2,5.10-4 moles.
7) Représenter la courbe de refroidissement d’un mélange de composition XH2O2 = 0,5 de
T1 = 150 °C à T2 = 100 °C. Indexer toutes les branches de cette courbe.
Vous aimerez peut-être aussi
- Aide Memoire Tuyauterie - CompletDocument62 pagesAide Memoire Tuyauterie - CompletMars7695% (121)
- Physique StatistiqueDocument369 pagesPhysique StatistiqueAnas Hasni86% (7)
- Exercices d'intégrales et d'équations intégro-différentiellesD'EverandExercices d'intégrales et d'équations intégro-différentiellesPas encore d'évaluation
- Theme 1 Le Corps HumainDocument65 pagesTheme 1 Le Corps Humainmagali2m100% (1)
- Examen de EntrepreneuriatDocument14 pagesExamen de EntrepreneuriatMamadou Gueye100% (1)
- SolfegeDocument24 pagesSolfegeDodaPas encore d'évaluation
- Brochure SOBANE Incendie - FRDocument144 pagesBrochure SOBANE Incendie - FRLarmes de SangPas encore d'évaluation
- Programmation Didactique - Concours 10Document55 pagesProgrammation Didactique - Concours 10Miguel92% (13)
- Exercices Liaison ChimiqueDocument0 pageExercices Liaison ChimiquehhedfiPas encore d'évaluation
- Les Obstacles A La CommunicationDocument3 pagesLes Obstacles A La CommunicationSissou Bello100% (2)
- Correction BAC ST2S PC 2013Document2 pagesCorrection BAC ST2S PC 2013BrunoPCBC100% (1)
- Il Faut Que Je Sois ParfaitDocument111 pagesIl Faut Que Je Sois ParfaitlynxnetPas encore d'évaluation
- Les Modes de Transferts Thermique Dons Les BatimentDocument6 pagesLes Modes de Transferts Thermique Dons Les Batimentfatiha100% (1)
- TD3 de Chapitre Iii de L3Document11 pagesTD3 de Chapitre Iii de L3ZougmoréPas encore d'évaluation
- Atome 1Document5 pagesAtome 1Hakimi Abderrahmane100% (1)
- Olymp 19862007Document487 pagesOlymp 19862007mohsat0% (1)
- Serie TDDocument4 pagesSerie TDTaoufik Ez100% (1)
- AE6 Titrage Destop Conductimétrique-ProfDocument4 pagesAE6 Titrage Destop Conductimétrique-Profbabouche fesdaPas encore d'évaluation
- SMC 3Document113 pagesSMC 3kurts010100% (1)
- Exoo7 RDocument20 pagesExoo7 RAYOUBelhamdaniPas encore d'évaluation
- Cours Chimie Organique SMP S3Document68 pagesCours Chimie Organique SMP S3MOHAMMED ZAKARIA BAALI100% (1)
- NomenclatureDocument10 pagesNomenclatureKallel JihenePas encore d'évaluation
- Enonces Des Exercices de Chimie TheoriqueDocument34 pagesEnonces Des Exercices de Chimie TheoriqueAbdelhakim Bailal0% (1)
- Isom Conformation AliphatiqueDocument3 pagesIsom Conformation AliphatiqueSamba BarhamPas encore d'évaluation
- Mecanique Serie 3Document2 pagesMecanique Serie 3maryem sousitaPas encore d'évaluation
- Ouvrir SA Chap1 ConductimétrieDocument44 pagesOuvrir SA Chap1 ConductimétrieLo Ana100% (1)
- Expansion de La Chimie Organique Cours 2Document5 pagesExpansion de La Chimie Organique Cours 2zakaria zakiPas encore d'évaluation
- Exercices Equilibres de Phases Liquide Solide Des Melanges BinairesDocument7 pagesExercices Equilibres de Phases Liquide Solide Des Melanges BinairesYvan Kayo KamdemPas encore d'évaluation
- Corrigé Énergie Électrique - PhysiqueDocument14 pagesCorrigé Énergie Électrique - PhysiqueXXX XXXPas encore d'évaluation
- CHM 103 Equilibres en Solution Aqueuse Parcouurs Chimie Physique PDFDocument76 pagesCHM 103 Equilibres en Solution Aqueuse Parcouurs Chimie Physique PDFonuci100% (1)
- TD Chapitre 6 Cinetique MacroscopiqueDocument12 pagesTD Chapitre 6 Cinetique MacroscopiqueNabil holmesPas encore d'évaluation
- Examen Finaux Et Corrigé - 230516 - 232706Document37 pagesExamen Finaux Et Corrigé - 230516 - 232706bensalimyoussef94Pas encore d'évaluation
- 0 TD Fso Liaison Chimique 15 16Document20 pages0 TD Fso Liaison Chimique 15 16Ursule YaméogoPas encore d'évaluation
- TD Chimie QuantiqueDocument3 pagesTD Chimie Quantiqueibrahima100% (1)
- Biophysique Des Solutions 2023Document26 pagesBiophysique Des Solutions 2023zaki taleb100% (1)
- tp5 - Transfert D EnergieDocument4 pagestp5 - Transfert D Energieahmed benhammaPas encore d'évaluation
- TD - Chapitre 1Document6 pagesTD - Chapitre 1CharlesPas encore d'évaluation
- Nouha Ramadan Hamou Mouna Exercices 1 Decroissance RadioactiveDocument1 pageNouha Ramadan Hamou Mouna Exercices 1 Decroissance Radioactiverihab0% (1)
- TP Chimie #10C, Synhtèse D'esters, Correction, Terminale S, tstp10chcDocument10 pagesTP Chimie #10C, Synhtèse D'esters, Correction, Terminale S, tstp10chcZakaria ElhammoumiPas encore d'évaluation
- Lois PhysiquesDocument1 pageLois PhysiquesMartin SossouPas encore d'évaluation
- Chimie Organique Exercices Corr 01 - CompressedDocument11 pagesChimie Organique Exercices Corr 01 - CompressedAdilsonPas encore d'évaluation
- 1S2-TD Alcanes 2013 LSLL 2-Wahab DiopDocument1 page1S2-TD Alcanes 2013 LSLL 2-Wahab DiopMohamed Amine Gharbi100% (1)
- TP de Cinetique Chimique L2 Polytech - 080923Document4 pagesTP de Cinetique Chimique L2 Polytech - 080923Alain Ditend100% (1)
- Exercice 4 Réactions Destérification Et Dhydrolyse LAHLALI PDFDocument5 pagesExercice 4 Réactions Destérification Et Dhydrolyse LAHLALI PDFBouba KhedherPas encore d'évaluation
- c2 1bac Biof - Les Grandeurs Liées À La Quantité de Matière Prof - Sbiro (WWW - Pc1.ma) PDFDocument2 pagesc2 1bac Biof - Les Grandeurs Liées À La Quantité de Matière Prof - Sbiro (WWW - Pc1.ma) PDFHAMADA1972100% (2)
- Chimie Théorique TD1Document2 pagesChimie Théorique TD1thegthed0% (1)
- Approche Par CompétenceDocument1 pageApproche Par CompétenceOumar TraoréPas encore d'évaluation
- Collection Top Education SP 3e Octobre 2022Document38 pagesCollection Top Education SP 3e Octobre 2022sokhnaamygadiaga074Pas encore d'évaluation
- Travaux Dirigés CHM101 - Série N°1Document5 pagesTravaux Dirigés CHM101 - Série N°1RV EtsePas encore d'évaluation
- Electrochimie ChafouDocument12 pagesElectrochimie ChafouSamah SoltanePas encore d'évaluation
- 6129d738f008el Amplificateur Operationnel Physiques 1ere C Et DDocument8 pages6129d738f008el Amplificateur Operationnel Physiques 1ere C Et DTCHEREGNIMIN SEYDOU TUO100% (1)
- Bac Blanc 2 ts2 1Document5 pagesBac Blanc 2 ts2 1Amadou Makhtar SeckPas encore d'évaluation
- $RFCGXUMDocument2 pages$RFCGXUMChikov ÆminePas encore d'évaluation
- Correction Epreuve de Chimie Des Electrolytes 2014 2015Document5 pagesCorrection Epreuve de Chimie Des Electrolytes 2014 2015Imene GhmrPas encore d'évaluation
- Exem1 0910Document15 pagesExem1 0910kurts010Pas encore d'évaluation
- TdchigenDocument21 pagesTdchigenIlhame Alâbouch100% (1)
- CO1 TS2 2016 LSLL WahabdiopDocument4 pagesCO1 TS2 2016 LSLL WahabdiopMed BriniPas encore d'évaluation
- Corrigé Bac D 1996Document3 pagesCorrigé Bac D 1996AMADOU TYOUPas encore d'évaluation
- Fiche Defibac Reaction D EsterificationDocument2 pagesFiche Defibac Reaction D Esterificationali100% (1)
- SMPC s2 CHP 2Document31 pagesSMPC s2 CHP 2Abdelhakim BailalPas encore d'évaluation
- CHIM105BS1DS20405Document2 pagesCHIM105BS1DS20405tv tvPas encore d'évaluation
- Travaux Diriges - Atomes Et Molecules - Cours de Thierry BriereDocument46 pagesTravaux Diriges - Atomes Et Molecules - Cours de Thierry BriereHarakat ElhoucinePas encore d'évaluation
- Cours Diagrammes Binaires Liquide-Vapeur-1Document71 pagesCours Diagrammes Binaires Liquide-Vapeur-1MOHAMED MAZOUARIPas encore d'évaluation
- Introduction A La Science PolitiqueDocument8 pagesIntroduction A La Science PolitiqueAs NordinePas encore d'évaluation
- TD 3Document7 pagesTD 3Abdou HajjajiPas encore d'évaluation
- Serie TD Chimie Corrige l2Document14 pagesSerie TD Chimie Corrige l2bouaddouanisPas encore d'évaluation
- Tp11 Deshydratation Methylbutan 2 OlDocument3 pagesTp11 Deshydratation Methylbutan 2 Olالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Alcool Tres ImportantDocument19 pagesAlcool Tres ImportantOumar TraoréPas encore d'évaluation
- Cinématique Des Solides Indéformables: IPEIB 2020Document56 pagesCinématique Des Solides Indéformables: IPEIB 2020Aymen Gharbi100% (1)
- Rappel de 1ère Année InformatiqueDocument9 pagesRappel de 1ère Année InformatiqueAymen GharbiPas encore d'évaluation
- Révision Gestion de FichiersDocument5 pagesRévision Gestion de FichiersAymen GharbiPas encore d'évaluation
- Chapitre VIII Diagrammes Potentiel-Ph (Diagrammes de Pourbaix)Document10 pagesChapitre VIII Diagrammes Potentiel-Ph (Diagrammes de Pourbaix)Aymen GharbiPas encore d'évaluation
- LeadershipDocument6 pagesLeadershipEvodie WestPas encore d'évaluation
- Mobiscript 3Document77 pagesMobiscript 3wukzPas encore d'évaluation
- Certificat Informatique & Internet - Guide de L'apprenantDocument6 pagesCertificat Informatique & Internet - Guide de L'apprenantKhadidiatou DialloPas encore d'évaluation
- Devoir de Controle +Liaisons+MécaniquesN2 1AS 2021Document4 pagesDevoir de Controle +Liaisons+MécaniquesN2 1AS 2021Razan KhPas encore d'évaluation
- Ifu - Lettre DgiDocument9 pagesIfu - Lettre Dgicomptabilité financière approfondiePas encore d'évaluation
- CV Afiatou ToeDocument1 pageCV Afiatou ToeFranck AbPas encore d'évaluation
- Partie II La Théorie Du Comportement de ConsommateurDocument77 pagesPartie II La Théorie Du Comportement de ConsommateuressalkagarmounePas encore d'évaluation
- (CFT) Memento PDFDocument6 pages(CFT) Memento PDFlacoste123Pas encore d'évaluation
- rapport_cc_MILKADocument21 pagesrapport_cc_MILKAfefeelbouzidiPas encore d'évaluation
- MTTH 4Document1 pageMTTH 4Anas MenoirPas encore d'évaluation
- Bertrand Russell Théorie de La Connaissance - Le Manuscrit de 1913Document3 pagesBertrand Russell Théorie de La Connaissance - Le Manuscrit de 1913Ahmed KabilPas encore d'évaluation
- Guide Des Associations 2020 21Document88 pagesGuide Des Associations 2020 21David Avishaï CohenPas encore d'évaluation
- Evangile Apocryphe de ThomasDocument10 pagesEvangile Apocryphe de ThomasYves MinougouPas encore d'évaluation
- Atd BasketballDocument20 pagesAtd BasketballelhanyPas encore d'évaluation
- PompageDocument14 pagesPompagewithe animalsPas encore d'évaluation
- LM Linear Range 12774 FRDocument248 pagesLM Linear Range 12774 FRAhmed MezniPas encore d'évaluation
- Cours HDD ASSASNETDocument91 pagesCours HDD ASSASNETAlyssa PeixotoPas encore d'évaluation
- Étude de La Poussée AxialeDocument5 pagesÉtude de La Poussée Axialechahrazed bngPas encore d'évaluation
- Itinerary Email v2 20160620193500903Document3 pagesItinerary Email v2 20160620193500903Shaimae ChatouiPas encore d'évaluation
- Jeu de L'oie Épisode 3Document5 pagesJeu de L'oie Épisode 3Mery MeryPas encore d'évaluation