Académique Documents
Professionnel Documents
Culture Documents
Sommeil
Transféré par
Stéphane MaliyamunguTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Sommeil
Transféré par
Stéphane MaliyamunguDroits d'auteur :
Formats disponibles
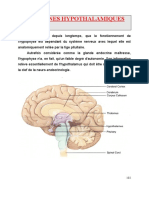
Les mécanismes de régulation du sommeil
Le sommeil est un état dans lequel nous passons environ le tiers de notre vie. Il fait partie des fonctions
vitales de l'organisme comme la respiration, la digestion ou l'immunité. Les progrès de
l’électrophysiologie (enregistrement de l’activité musculaire et des mouvements oculaires) et
notamment de l’électroencéphalogramme ont permis de donner une définition de plus en plus précise
du sommeil et de décrire ses différents états. Le sommeil est décrit classiquement comme une
alternance de trois principaux états, le sommeil léger, le sommeil profond à ondes longues (SL) et le
sommeil paradoxal (SP). L'EEG permet de distinguer quatre stades (1 à 4) selon la profondeur du sommeil
jugée sur la présence plus ou moins importante d'ondes lentes (0,5-4 Hz) de grande amplitude (300 µV).
Les modèles actuels de régulation du sommeil et de la vigilance découlent presque tous du modèle de
régulation du sommeil proposé par Borbély en 1982, qui suggère que le sommeil est régi par 2 processus
principaux : le processus circadien et le processus homéostasique1,6.
Le processus circadien est responsable de l’aspect rythmique du cycle éveil-sommeil. Il commande les
moments de faible et de forte propension à l’éveil au cours de 24 heures. Le processus homéostatique,
homéostatique,
quant à lui, augmente exponentiellement au cours de l’éveil et diminue de la même façon durant le
sommeil : il reflète l’accumulation au cours de la période d’éveil d’un besoin de sommeil3. Cette
accumulation de sommeil ne cesse qu’avec l’apparition du sommeil lui-même7.
Ces 2 processus interagissent pour générer des épisodes de sommeil ininterrompus d’environ 8 heures et
maintenir l’éveil durant environ 16 heures, malgré l’accumulation de fatigue6. Ainsi, l’accumulation du
besoin de sommeil au cours de la période d’éveil est compensée par l’augmentation de la tendance
circadienne à l’éveil qui atteint son maximum quelques heures avant l’heure habituelle du coucher.
Inversement, au cours de la période de sommeil, la diminution du besoin sommeil est contrecarrée par la
diminution graduelle de la tendance circadienne à l’éveil. Finalement, le sommeil sera induit quand le
moment où l’accumulation du besoin de sommeil atteint un seuil coïncide avec le moment où la
propension circadienne au sommeil est favorable (voir représentation schématique à la figure ci-après).
IEDM Association loi 1901 – déclaration à la Préfecture de Paris sous le n° 00129779P
20, rue Emeriau – 75015 Paris – Tél : 01 53 86 00 81 – Fax : 01 53 86 00 82
Institut Européen de Diététique et Micronutrition Mail : contact@iedm.asso.fr – Site : www.iedm.asso.fr
Chez les mammifères, le rythme circadien est généré par l’horloge biologique interne localisée au
niveau des
de s noyaux suprachiasmatiques de l’hypothalamus qui déterminent une période endogène
d’une longueur d’environ 24 heures. La capacité rythmique des noyaux suprachiasmatiques s’exprime au
niveau de chaque neurone. En l’absence de toute information extérieure, les noyaux suprachiasmatiques
délivrent de façon répétitive l’ensemble de leurs informations selon un programme préétabli sur une
durée de 24,8 heures. Les mécanismes moléculaires impliquent le principe de rétroaction : lorsque les
gènes de l’horloge sont exprimés, ils engendrent des produits qui régulent leur propre fonctionnement,
ce qui forme ainsi des cycles d’expression de gènes et d’abondance de protéines5. Les rythmes
biologiques sont également entraînés par des facteurs externes nommés synchronisateurs comme la
lumière. La synchronisation des neurones des noyaux suprachiasmatiques engendre la coordination de
leurs signaux circadiens, ce qui finalement régule les rythmes physiologiques et comportementaux via
des projections dans plusieurs zones principalement hypothalamiques (dont les noyaux
paraventriculaires et l’hypothalamus dorsomédian) et thalamiques. L’activité des noyaux
suprachiasmatiques est plus grande le jour que la nuit; de plus, certaines cellules réagissent à la lumière
principalement via la voie rétino-hypothalamique et permettent aux rythmes circadiens de se maintenir
en phase avec le cycle lumière-obscurité de l’environnement. Pour ce faire, avant de parvenir aux noyaux
supra chiasmatiques, la lumière est convertie en signal électrique par les photorécepteurs de la rétine.
Les informations lumineuses sont ensuite transmises au ganglion cervical supérieur puis à la glande
pinéale par les fibres noradrénergiques sympathiques post-ganglionnaires. La glande pinéale (épiphyse)
IEDM Association loi 1901 – déclaration à la Préfecture de Paris sous le n° 00129779P
20, rue Emeriau – 75015 Paris – Tél : 01 53 86 00 81 – Fax : 01 53 86 00 82
Institut Européen de Diététique et Micronutrition Mail : contact@iedm.asso.fr – Site : www.iedm.asso.fr
ainsi appelée à cause de sa forme en pine de pin, se trouve au centre du cerveau, entre le diencéphale et
le 3e ventricule. Elle est considérée comme un « transducteur neuroendocrinien », c’est à dire qu’elle
convertit l’information en un signal hormonal : la mélatonine. La mélatonine a donc comme rôle
essentiel d’être un médiateur de l’information qui apporte à l’organisme la notion de photopériode
(durée des phases d’obscurité et de lumière). Elle permet à l’organisme de vivre en harmonie avec son
environnement en renforçant certaines fonctions physiologiques.
Contrairement à l’horloge biologique, qui est clairement localisée au niveau des noyaux
suprachismatiques, la région anatomique qui régie les processus homéostasiques
homéostasiques de régulation du
sommeil n’est pas claire et serait très probablement diffuse6. L’induction homéostasique du sommeil
a souvent été apparentée à une sorte de fatigue cellulaire ou métabolique : plus un réseau neuronal est
utilisé, plus la pression homéostatique s’accumule. De nombreuses hypothèses concernant le fondement
neurochimique du processus homéostasique ont été émises 1,2,6,6. L’accumulation ou la déplétion d’une ou
plusieurs molécules dans les cellules pourraient être à l’origine de l’accumulation du besoin de dormir
c'est-à-dire de la pression homéostasique. Plusieurs molécules candidates potentielles ont été ainsi
proposées, comme des interleukines et l’hormone de croissance, dans la théorie humorale de la
régulation du sommeil. En fait, à l’heure d’aujourd’hui, la molécule candidate dont les effets sont les
mieux documentés reste l’adénosine, produit de dégradation de l’ATP libérée par les neurones et la glie
du système nerveux central pendant les périodes de haute activité métabolique. Dans le prosencéphal
basal, le niveau d’adénosine augmente pendant l’éveil et une administration d’adénosine dans cette
région engendre le sommeil. Aussi, il a été démontré récemment que l’adénosine active des neurones
promouvant le sommeil dans le noyau préoptique ventrolatéral de l’hypothalamus4. C’est ainsi que la
caféine, antagoniste de l’adénosine, est connue pour atténuer le besoin de sommeil.
La façon dont les processus de régulation du sommeil et de la vigilance interagissent est encore mal
comprise. Certains modèles contemporains dérivés de celui de Borbély postulent que les 2 processus sont
indépendants et donc que leurs effets sont additifs. L’indépendance de ces 2 processus a été appuyée par
des études de privation de sommeil chez les animaux où la réponse homéostatique demeure intacte lors
de la lésion des noyaux suprachiasmatiques et donc de l’abolition de la rythmicité circadienne.
Néanmoins, plusieurs résultats s’expliquant mal par l’indépendance des deux processus de régulation du
sommeil et de la vigilance, de plus en plus de scientifiques remettent en question l’indépendance
structurale et/ou moléculaire de ces processus.
Marqueurs circadiens et homéostatiques
Marqueurs circadiens
Chez l’humain, l’oscillation circadienne de l’horloge biologique ne peut malheureusement pas être
mesurée directement. Il faut donc utiliser des indices indirects de la rythmicité circadienne pour l’étude
IEDM Association loi 1901 – déclaration à la Préfecture de Paris sous le n° 00129779P
20, rue Emeriau – 75015 Paris – Tél : 01 53 86 00 81 – Fax : 01 53 86 00 82
Institut Européen de Diététique et Micronutrition Mail : contact@iedm.asso.fr – Site : www.iedm.asso.fr
de la régulation du sommeil. Les marqueurs du processus circadiens sont des paramètres physiologiques
dont la rythmicité d’environ 24 heures persiste en conditions constantes. À ce jour, trois marqueurs
circadiens sont couramment utilisés comme indicateurs de l’horloge biologique chez l’humain : la
sécrétion de mélatonine, la température corporelle et la sécrétion de cortisol.
Le rythme de la sécrétion de mélatonine est considéré comme le meilleur marqueur circadien, surtout en
raison de sa grande stabilité et de la robustesse de son rythme. La mélatonine est sécrétée pendant la
nuit par la glande pinéale, sous le contrôle direct des noyaux suprachiasmatiques. L’épisode de sécrétion
de mélatonine reflète le moment au cours duquel l’organisme perçoit la nuit. La sécrétion de la
mélatonine peut être mesurée dans le plasma, dans la salive ou encore via son métabolite dans l’urine.
Un des marqueurs du rythme de sécrétion de la mélatonine couramment utilisé est l’heure du début de
la sécrétion en soirée qui peut être évaluée à l’aide d’un seuil fixe ou d’une valeur relative à l’amplitude
totale de la sécrétion. Les patrons de sécrétion de mélatonine sont hautement reproductibles chez un
même individu. Cependant, les échantillons biologiques doivent être recueillis en lumière tamisée
puisque l’exposition à la lumière supprime la sécrétion de mélatonine. De plus, la concentration de
mélatonine peut être affectée par les changements de posture. Lorsque les conditions expérimentales
sont bien contrôlées, la mélatonine s’avère particulièrement utile pour l’étude de la phase circadienne
chez les chronotypes.
Pour sa part, le rythme de la température corporelle est sans doute le marqueur circadien le plus ancien
en chronobiologie humaine. La température corporelle est élevée pendant la journée et basse pendant la
nuit. Au départ, l’acrophase (l’heure du maximum) du rythme de température était utilisée comme
marqueur; cependant, depuis environ 20 ans, l’heure du minimum circadien de la température est
favorisée. Le rythme de la température corporelle est une mesure particulièrement utile car elle suit de
très près le rythme circadien de la propension à l’éveil. De plus, le minimum de la température pendant la
nuit marque le point pivot de la courbe de réponse de phase à la lumière. Un problème notoire perdure
néanmoins avec la température car elle est modifiée par l’activité, le sommeil et la prise alimentaire. Bien
qu’il soit possible de corriger l’influence du sommeil sur la mesure de la phase de la température, il
semble que le rythme de température soit une mesure circadienne moins précise que celui de la
sécrétion de mélatonine.
Le rythme de sécrétion du cortisol est un marqueur circadien relativement nouveau. La sécrétion de
cortisol augmente pendant la nuit, atteint un maximum au lever, puis diminue par la suite au cours de la
journée pour atteindre un minimum peu après le coucher. Bien que le rythme de sécrétion du cortisol soit
un marqueur robuste en conditions constantes, son utilisation est limitée du fait de son association à la
réponse au stress. Effectivement, une étude combinant mesures circadiennes et tâche de performance,
IEDM Association loi 1901 – déclaration à la Préfecture de Paris sous le n° 00129779P
20, rue Emeriau – 75015 Paris – Tél : 01 53 86 00 81 – Fax : 01 53 86 00 82
Institut Européen de Diététique et Micronutrition Mail : contact@iedm.asso.fr – Site : www.iedm.asso.fr
par exemple, risque de voir son marqueur circadien de cortisol affecté par le stress provenant de la
nécessité de bien performer.
Bien qu’étant peu utilisés comme marqueurs circadiens, plusieurs paramètres mesurés au cours du
sommeil et de l’éveil subissent une forte influence circadienne. Pour le sommeil, la latence à
l’endormissement, la latence au sommeil paradoxal, la quantité de sommeil paradoxal et le temps total
de sommeil montrent une influence circadienne prépondérante. Pendant l’éveil, plusieurs mesures de la
vigilance sont également affectées par le processus circadien. Cependant, la qualité globale de l’éveil
semble dépendre grandement de la combinaison des influences circadiennes et homéostatiques.
Marqueurs homéostatiques
Depuis l’élaboration du modèle de régulation du sommeil à deux processus, les modèles qui en
découlent ont presque toujours utilisé les stades de sommeil lent profond (SLP, stades 3 et 4 de sommeil)
et l’activité à ondes lentes (AOL; entre 0.5-5 Hz) durant le sommeil lent comme index du processus
homéostasique. Puisque ce processus contrôle l’intensité du sommeil en fonction de la durée de l’éveil, il
va de soi que la quantité de SLP et d’AOL, indices de la profondeur du sommeil, constituent les piliers du
modèle. En effet, les données de la littérature montrent bien que l’augmentation de la durée de l’éveil
engendre une augmentation proportionnelle de la quantité de SLP et d’AOL mais aussi que, le SLP et l’AOL
se dissipent au cours de la période de sommeil.
NB : ce texte a été adapté à partir d’un extrait de l’introduction d’une thèse (Rythmes circadiens et
mécanismes homéostasiques de récupération chez des personnes de types matinal ou vespéral)
particulièrement exhaustive sur le sujet6
IEDM Association loi 1901 – déclaration à la Préfecture de Paris sous le n° 00129779P
20, rue Emeriau – 75015 Paris – Tél : 01 53 86 00 81 – Fax : 01 53 86 00 82
Institut Européen de Diététique et Micronutrition Mail : contact@iedm.asso.fr – Site : www.iedm.asso.fr
Reference List
1
A. A. Borbely and P. Achermann, "Concepts and models of sleep regulation: an overview," J. Sleep
Res. 1(2), 63 (1992).
Ref Type: Journal
2
C. Cirelli, "The genetic and molecular regulation of sleep: from fruit flies to humans," Nat. Rev.
Neurosci. 10(8),
10 549 (2009).
Ref Type: Journal
3
S. Daan, D. G. Beersma, and A. A. Borbely, "Timing of human sleep: recovery process gated by a
circadian pacemaker," Am. J. Physiol 246(2
246 Pt 2), R161-R183 (1984).
Ref Type: Journal
4
T. Gallopin, et al., "The endogenous somnogen adenosine excites a subset of sleep-promoting
neurons via A2A receptors in the ventrolateral preoptic nucleus," Neuroscience 134(4),
134 1377
(2005).
Ref Type: Journal
5
P. L. Lowrey and J. S. Takahashi, "Mammalian circadian biology: elucidating genome-wide levels of
temporal organization," Annu. Rev. Genomics Hum. Genet. 5, 407 (2004).
Ref Type: Journal
6
V Mongrain, Université de Montréal, 2006.
7
J. Paquereau, "[Physiology of normal sleep]," Rev. Prat. 57(14),
57 1529 (2007).
Ref Type: Journa
IEDM Association loi 1901 – déclaration à la Préfecture de Paris sous le n° 00129779P
20, rue Emeriau – 75015 Paris – Tél : 01 53 86 00 81 – Fax : 01 53 86 00 82
Institut Européen de Diététique et Micronutrition Mail : contact@iedm.asso.fr – Site : www.iedm.asso.fr
Vous aimerez peut-être aussi
- Sommeil: Les Grands Articles d'UniversalisD'EverandSommeil: Les Grands Articles d'UniversalisPas encore d'évaluation
- Chronobiologie - Inserm - La Science Pour La SantéDocument7 pagesChronobiologie - Inserm - La Science Pour La SantélebeaultPas encore d'évaluation
- Physiologie de L'eveil Et Du SommeilDocument12 pagesPhysiologie de L'eveil Et Du SommeilDima HorPas encore d'évaluation
- Les Rythmes Biologiques 2021-2022Document6 pagesLes Rythmes Biologiques 2021-2022HoussemPas encore d'évaluation
- D.legeR - Horloge BiologiqueDocument37 pagesD.legeR - Horloge BiologiqueMihaela-Alexandra PopPas encore d'évaluation
- Cours de Psychophysiologie N°8Document13 pagesCours de Psychophysiologie N°8Mezian BelkacemiPas encore d'évaluation
- Théorie polyvagale: Découvrir le pouvoir de guérison du nerf vague pour vaincre l'anxiété, les traumatismes, la dépression et le stress émotionnelD'EverandThéorie polyvagale: Découvrir le pouvoir de guérison du nerf vague pour vaincre l'anxiété, les traumatismes, la dépression et le stress émotionnelÉvaluation : 5 sur 5 étoiles5/5 (4)
- 3-Cours Endocrinologie Et Régulation Des Systèmes Chapitre 2 M1 TOXICOLOGIE 2020-2021 BOUBEKRIDocument32 pages3-Cours Endocrinologie Et Régulation Des Systèmes Chapitre 2 M1 TOXICOLOGIE 2020-2021 BOUBEKRIBERDJOUH YoucefPas encore d'évaluation
- Cours - 3 Les Régulation Hormonale de La MétabolismeDocument9 pagesCours - 3 Les Régulation Hormonale de La Métabolismemiss anthropocenePas encore d'évaluation
- Mieux dormir pour mieux vivre: Adieu fatigue, somnolence, irritabilité !D'EverandMieux dormir pour mieux vivre: Adieu fatigue, somnolence, irritabilité !Pas encore d'évaluation
- PHYSIOLOGE DE L'AXE HYPOTHALAMO HYPOPHYSAIRE PolyDocument4 pagesPHYSIOLOGE DE L'AXE HYPOTHALAMO HYPOPHYSAIRE PolyFatima zahra NaciriPas encore d'évaluation
- 7 Le Sommeil Et Le RêveDocument6 pages7 Le Sommeil Et Le RêveAziza AskriPas encore d'évaluation
- Comprendre Et Choisir Son Sommeil, Par Quentin ChabertDocument20 pagesComprendre Et Choisir Son Sommeil, Par Quentin ChabertTelecomParisTechPas encore d'évaluation
- Support de Cours HOMEOSTASIE DU MILIEU INTERIEUR ABED NousseibaDocument42 pagesSupport de Cours HOMEOSTASIE DU MILIEU INTERIEUR ABED Nousseibabalnanaime6Pas encore d'évaluation
- Cours Endocrinologie de La ReproductionDocument49 pagesCours Endocrinologie de La ReproductionLukusa MauricePas encore d'évaluation
- Poly S1 PCEM2 2020Document113 pagesPoly S1 PCEM2 2020pvfbszf9mtPas encore d'évaluation
- CM1 L3GBI 2023-24 Endocrino-ReproDocument16 pagesCM1 L3GBI 2023-24 Endocrino-Reprodiop2802antaPas encore d'évaluation
- Bien Dormir MicronutritionDocument8 pagesBien Dormir MicronutritionTIPPIPas encore d'évaluation
- Régulation Physiologique Du Complexe Hypothalamo - HypophysaireDocument15 pagesRégulation Physiologique Du Complexe Hypothalamo - HypophysaireRyanPas encore d'évaluation
- Système Endocrinien DR BouraimaDocument34 pagesSystème Endocrinien DR Bouraimaaba djibaPas encore d'évaluation
- UE2 Tome 4 Sur 4Document145 pagesUE2 Tome 4 Sur 4mathieu.lanier.2004Pas encore d'évaluation
- Troubles Du Sommeil Chez L'enfantDocument15 pagesTroubles Du Sommeil Chez L'enfanthadjar.djebbour.psyPas encore d'évaluation
- 3 Choses À Savoir Sur Notre Horloge BiologiqueDocument3 pages3 Choses À Savoir Sur Notre Horloge BiologiqueFrancky0001Pas encore d'évaluation
- SEPI 8 Et 9Document17 pagesSEPI 8 Et 9leybadaraccoPas encore d'évaluation
- Cours Homeostasie Pour Residents Premiere AnneeDocument8 pagesCours Homeostasie Pour Residents Premiere AnneeKhaoula SahtouriPas encore d'évaluation
- Physiologie Du SommeilDocument18 pagesPhysiologie Du SommeilsafemindPas encore d'évaluation
- Neuroendocrinologie Des Comportaments FondamentauxDocument35 pagesNeuroendocrinologie Des Comportaments FondamentauxmicheleiovinoPas encore d'évaluation
- MNE CM3bis Physiologie Axe Hypothalamo HypophysaireDocument13 pagesMNE CM3bis Physiologie Axe Hypothalamo HypophysaireSoheib RahrahPas encore d'évaluation
- 2-Physiologie Hypothalamo-HypophysaireDocument11 pages2-Physiologie Hypothalamo-HypophysaireNateche NassiraPas encore d'évaluation
- Le SommeilDocument10 pagesLe SommeilMichael GuillienPas encore d'évaluation
- Physio Endocrino23-01glandes EndocrinesDocument4 pagesPhysio Endocrino23-01glandes EndocrinesVictorin FANDREBOPas encore d'évaluation
- Veille SommeilDocument8 pagesVeille Sommeilkhouloud djebabraPas encore d'évaluation
- Les Glandes EndocrinesDocument44 pagesLes Glandes EndocrinescepPas encore d'évaluation
- UE8 TC Physio Cours 2 - Régulation Endocrinienne Tutorat 2013-2014Document10 pagesUE8 TC Physio Cours 2 - Régulation Endocrinienne Tutorat 2013-2014Ali EL Kihel100% (1)
- Ronéo N°3Document16 pagesRonéo N°3Djallal HassaniPas encore d'évaluation
- 02-PHYSIOLOGE DE L'AXE HYPOTHALAMO HYPOPHYSAIRE Poly-1Document3 pages02-PHYSIOLOGE DE L'AXE HYPOTHALAMO HYPOPHYSAIRE Poly-1alimkettouchePas encore d'évaluation
- Antidote PhysioDocument47 pagesAntidote PhysioIkapiklevice15Pas encore d'évaluation
- Sommeil Un Carnet Pour Mieux ComprendreDocument28 pagesSommeil Un Carnet Pour Mieux Comprendrelepresse Damien100% (1)
- 1 s2.0 S176944931930528X MainDocument15 pages1 s2.0 S176944931930528X Mainmarlene castanPas encore d'évaluation
- Ahh M2decineDocument22 pagesAhh M2decinemalakzerizer2005Pas encore d'évaluation
- Le Système EndocrinienDocument23 pagesLe Système Endocrinienchadi ouechtatiPas encore d'évaluation
- Horloge Biologique Et Rythme Veille/Sommeil : Médecine Et NutritionDocument4 pagesHorloge Biologique Et Rythme Veille/Sommeil : Médecine Et Nutritionyousra ben othmanePas encore d'évaluation
- Physiologie Du Complexe Hypothalamo-HypophysaireDocument5 pagesPhysiologie Du Complexe Hypothalamo-HypophysaireZied Bouabene100% (1)
- Concepts Fond en Psycho Chap1 Part A À CDocument9 pagesConcepts Fond en Psycho Chap1 Part A À CmuchostroPas encore d'évaluation
- 2 Cours ChronobiologieDocument3 pages2 Cours Chronobiologiecamille-puechPas encore d'évaluation
- Les Neurohormones Chez HommeDocument17 pagesLes Neurohormones Chez HommeNisrine 2112Pas encore d'évaluation
- Sommeil Et Memoires - Notes de CoursDocument3 pagesSommeil Et Memoires - Notes de Coursnassim lrrrPas encore d'évaluation
- Principes Des Systemes de Controle HormonalDocument2 pagesPrincipes Des Systemes de Controle Hormonalfafoufa133Pas encore d'évaluation
- Cours Axe Hypothalamo HypophysaireDocument51 pagesCours Axe Hypothalamo HypophysaireSamar OmraniPas encore d'évaluation
- Fichier Produit 2426Document8 pagesFichier Produit 2426Schizo FraisePas encore d'évaluation
- Hormones HypothalamiquesDocument14 pagesHormones Hypothalamiquesdjamila benaissaPas encore d'évaluation
- Séance 1 VigilanceDocument4 pagesSéance 1 VigilancePOLY DavidPas encore d'évaluation
- 01-Principes Des Systemes de Controle HormonalDocument2 pages01-Principes Des Systemes de Controle HormonalLem AhPas encore d'évaluation
- P Fonctions Du Système Endocrinien - (L. Bayer) - 23.04.21Document8 pagesP Fonctions Du Système Endocrinien - (L. Bayer) - 23.04.21nasten16fhPas encore d'évaluation
- La Physiologie de La MictionDocument4 pagesLa Physiologie de La MictionMohammed GartitPas encore d'évaluation
- État de Vigilance Cycle Veille Sommeil PDFDocument58 pagesÉtat de Vigilance Cycle Veille Sommeil PDFBMA-medecinePas encore d'évaluation
- L'axe Hypothalamo-HypophysaireDocument11 pagesL'axe Hypothalamo-Hypophysairegeorge.guergourPas encore d'évaluation
- 2021 06 29 Aic - AmegDocument6 pages2021 06 29 Aic - AmegStéphane MaliyamunguPas encore d'évaluation
- F OIE List Antimicrobials Mai2015Document9 pagesF OIE List Antimicrobials Mai2015rezaPas encore d'évaluation
- FichesCerveau SommeilDocument4 pagesFichesCerveau SommeilStéphane MaliyamunguPas encore d'évaluation
- Les 7 Blessures de L AmeDocument3 pagesLes 7 Blessures de L AmeStéphane Maliyamungu50% (2)
- Capture D'écran . 2023-07-18 À 22.04.49Document1 pageCapture D'écran . 2023-07-18 À 22.04.49Young Baru95Pas encore d'évaluation
- Comparaison Entre L'huile Synthétique Et L'huile Minérale Conventionnelle - Mobil 1™ FrancaisDocument3 pagesComparaison Entre L'huile Synthétique Et L'huile Minérale Conventionnelle - Mobil 1™ FrancaiskarijosephPas encore d'évaluation
- Origo Mig c250 3phDocument21 pagesOrigo Mig c250 3phsimoriPas encore d'évaluation
- Lavage Des MainsDocument4 pagesLavage Des MainsIn EsPas encore d'évaluation
- Devoir 2024 1asDocument2 pagesDevoir 2024 1asratiba kherroubPas encore d'évaluation
- SLT Cours Recap2aDocument22 pagesSLT Cours Recap2aYassine AguelmamePas encore d'évaluation
- Alcatel C250 Voice Wireless PhoneDocument2 pagesAlcatel C250 Voice Wireless PhoneMichael LoupisPas encore d'évaluation
- TRAMEATELIERTMDocument14 pagesTRAMEATELIERTMAbdelmajid JayalPas encore d'évaluation
- PUG Extrait A Propos B1 Cahier ExercicesDocument24 pagesPUG Extrait A Propos B1 Cahier Exercicescorina_lulariu1861100% (1)
- Projet de Fin DétudesDocument89 pagesProjet de Fin DétudesAlia ZekriPas encore d'évaluation
- Ecologie Generale IDocument32 pagesEcologie Generale Isaad abaniPas encore d'évaluation
- Cour Hablitation ElectriqueDocument27 pagesCour Hablitation Electriquehicham-223Pas encore d'évaluation
- Bayard Et Gourdon (2010) - Traitement Bio Des Déchets. TIDocument22 pagesBayard Et Gourdon (2010) - Traitement Bio Des Déchets. TIMery WyssPas encore d'évaluation
- Dossier Technique Mars 65 V FDocument2 pagesDossier Technique Mars 65 V FismailPas encore d'évaluation
- TheseHERNANDEZFinal MVLLDocument163 pagesTheseHERNANDEZFinal MVLLnasma2008Pas encore d'évaluation
- Dalle en VerreDocument4 pagesDalle en VerreablayetinePas encore d'évaluation
- Les OuverturesDocument5 pagesLes OuverturesSafia SafiPas encore d'évaluation
- DS 2015 Et DS 2017 - UnlockedDocument9 pagesDS 2015 Et DS 2017 - UnlockedWael MaatougPas encore d'évaluation
- Le Systeme Nerveux ResumeDocument2 pagesLe Systeme Nerveux Resumekenza boucetta100% (2)
- noticeTU5Me (L) - RF3 AlarmeMenace PPMS PSEDocument5 pagesnoticeTU5Me (L) - RF3 AlarmeMenace PPMS PSEMbgardPas encore d'évaluation
- Medapoxy AlDocument3 pagesMedapoxy Albader_rachedPas encore d'évaluation
- 2 ParasympatholytiquesDocument16 pages2 ParasympatholytiquesDemba Tahirou DIOPPas encore d'évaluation
- Acide UriqueDocument4 pagesAcide UriqueLilou Ṧṹpeř MaboullPas encore d'évaluation
- DéparaffinageDocument6 pagesDéparaffinageChui Spr Vedette100% (1)
- RM35Document4 pagesRM35zarun1Pas encore d'évaluation
- David Icke 7 - 04 - 2020Document46 pagesDavid Icke 7 - 04 - 2020panasonic92Pas encore d'évaluation
- DS 6 964 2020-2021 17Document2 pagesDS 6 964 2020-2021 17hyacinthe charles hlannonPas encore d'évaluation
- Le Politique Par Jean OuryDocument17 pagesLe Politique Par Jean OuryEleni KarafylliPas encore d'évaluation
- These27 08Document91 pagesThese27 08samih.khorchafPas encore d'évaluation