Académique Documents
Professionnel Documents
Culture Documents
Examen - Final - 2012-2013.docx Filename - UTF-8''Examen Final 2012-2013-1
Transféré par
sidi mohamed el amine nekkal0 évaluation0% ont trouvé ce document utile (0 vote)
74 vues2 pagesTitre original
Examen_final_2012-2013.docx;filename_= UTF-8''Examen final 2012-2013-1.docx
Copyright
© © All Rights Reserved
Formats disponibles
DOCX, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
74 vues2 pagesExamen - Final - 2012-2013.docx Filename - UTF-8''Examen Final 2012-2013-1
Transféré par
sidi mohamed el amine nekkalDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
Université des Sciences et de la Technologie d’Oran « MB »
Faculté des Sciences Option GPE : L3
2011-2012
Département de Chimie Module : MPCA
Examen final
Durée 1h.40min
Questions de cours (05 points)
1- Définir brièvement les vocables suivants : (2,5)
- Groupement chromophore - Groupement auxochrome.
- Isotherme de type C - Facteur de séparation - Temps de rétention.
2- -
- Expliquer le principe de fonctionnement d’un catharomètre ? (1)
- Sur un spectre infrarouge, la bande de la liaison C-H apparait avant celle de la
liaison C-O, pourquoi ? (1,5)
Exercice 1: (05 points)
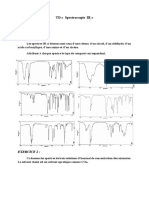
On donne ci-dessous le spectre infrarouge d’un composé inconnu.
1- donner les différents groupes fonctionnels présents en précisant leur nombre
d’onde. (1)
2- le produit peut-il être un aldéhyde ou un acide carboxylique? Si non pourquoi ?
(1,5)
3- Peut-on déterminer exactement la fonction du composé ? (1)
4- Une analyse complémentaire a permis de déterminer la formule brute du composé
inconnu qui est C4H8O2. Cette formule est-elle compatible avec le spectre IR
précédent ? (0,5)
5- Donner les formules semi développées du produit. (1)
Exercice 2: (05 points)
I- Un composé polycristallin de structure cubique est analysé à l’aide d’un
diffractogramme à poudre fonctionnant à la longueur d’onde λ = 1.54Å. Dans le
spectre obtenu, on constate l’absence des pics (220), (221) et (321).
1- calculer le paramètre de maille « a » de ce composé sachant que le pic situé juste
avant le pic (220) se trouve à 68.74°. (1,5)
2- Déterminer, sans calcul, les indices de Miller du dernier pic du spectre sachant
que le diffractogramme est constitué de 13 pics. (1)
II- Un catalyseur de structure quadratique de paramètres de maille a = 1 Ả et c = 2 Ả est
infecté par une phase impureté contenant trois pics.
1- Donner les indices de Miller du deuxième pic du catalyseur. (1,5)
2- Quel est le nombre total de pics sur le diffractogramme. (1)
Exercice 3: (05 points)
1- Quelles sont les transitions possibles dans la caféine. (1)
Sur l’étiquette du flacon de ce produit deux informations sont
mentionnées : masse molaire 193 g/mol et densité 1,15.
Un volume de 15 ml est prélevé de la solution mère (flacon) puis dilué dans une fiole de
50 ml (la solution diluée est nommée solution A). L’analyse UV de la solution A
donne une absorbance de 0,45.
2- Calculer la concentration de la solution A. (1)
3- Discuter la fiabilité du résultat d’analyse UV. (1)
4- Sachant que ε = 0,12 l.mol-1.mm-1 ; donner la longueur de la trajectoire optique
(cm). (1)
5- On procède à une deuxième dilution à partir de la solution A : 1 ml dans 25 ml.
Que devient la transmittance avec la même longueur du trajet optique. (1)
Vous aimerez peut-être aussi
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Fiche TD 2 IR PDFDocument2 pagesFiche TD 2 IR PDFIk RamPas encore d'évaluation
- Fiche TD 2 MPCA 2023 2024Document4 pagesFiche TD 2 MPCA 2023 2024Clash of Clans Bilal DzPas encore d'évaluation
- TD° 5 C433 - CopieDocument3 pagesTD° 5 C433 - CopieRayene BARPas encore d'évaluation
- Examen Final L3 GP 2016-2017Document2 pagesExamen Final L3 GP 2016-2017AnesPas encore d'évaluation
- Fiche de TD N 5 - 2Document4 pagesFiche de TD N 5 - 2ANes ツ100% (1)
- RMN 02Document87 pagesRMN 02Abderrahim BelmJouJPas encore d'évaluation
- Correction Série D'exercices 1 RMNDocument4 pagesCorrection Série D'exercices 1 RMNToulmoutine ManelPas encore d'évaluation
- TD Ir 2019Document39 pagesTD Ir 2019khouloud bensalemPas encore d'évaluation
- Theme Realise Par Encadre Par CHROMATOGRDocument11 pagesTheme Realise Par Encadre Par CHROMATOGRJimmy Hend KhratPas encore d'évaluation
- Spectres RMN Du Proton: I. Présentation D'un Spectre de RMNDocument4 pagesSpectres RMN Du Proton: I. Présentation D'un Spectre de RMNKaouther JouiniPas encore d'évaluation
- Chrono Potent I Om Ét RieDocument33 pagesChrono Potent I Om Ét RieIsmail HisashiPas encore d'évaluation
- LPVPT - TD N°1 - TD N°2Document30 pagesLPVPT - TD N°1 - TD N°2Mimi BCGPas encore d'évaluation
- Série de TD #01 Corrigé - TextMarkDocument6 pagesSérie de TD #01 Corrigé - TextMarknadjet polyPas encore d'évaluation
- LPro ElectroDocument23 pagesLPro ElectroYoussef Akr100% (1)
- Ue CHM 441 ElectrochimieDocument46 pagesUe CHM 441 ElectrochimieAxel AzanguimPas encore d'évaluation
- LPro Spectro Picquet PDFDocument173 pagesLPro Spectro Picquet PDFJunior MbatepPas encore d'évaluation
- Boulika Bourkane Derrouich Groupe 3 PDFDocument5 pagesBoulika Bourkane Derrouich Groupe 3 PDFHamza BoulikaPas encore d'évaluation
- 5351 Entrainement TSDocument6 pages5351 Entrainement TSmohammed laadili100% (1)
- Exercices Bac de ChimieDocument3 pagesExercices Bac de ChimieFatima BenPas encore d'évaluation
- M14 - TD N°2: Spectrométrie Infra Rouge: Master (PACQ)Document2 pagesM14 - TD N°2: Spectrométrie Infra Rouge: Master (PACQ)Imane MouamrPas encore d'évaluation
- CHM224 2022 2023Document102 pagesCHM224 2022 2023Franel YolandaPas encore d'évaluation
- TD Chromatographie en Phase Gazeuse de L3Document6 pagesTD Chromatographie en Phase Gazeuse de L3Kharoubi NassimaPas encore d'évaluation
- Exercice 1:: TD Spectroscopie IRDocument8 pagesExercice 1:: TD Spectroscopie IRGenie des procede Promotion 2022100% (1)
- Controle 3 - 1 S2 TC 19 - 20Document4 pagesControle 3 - 1 S2 TC 19 - 20Chaoui YoussefPas encore d'évaluation
- TD 2-Cristallo 2019Document1 pageTD 2-Cristallo 2019héma tologiePas encore d'évaluation
- SpectrophotometrieDocument16 pagesSpectrophotometriedohaPas encore d'évaluation
- TD RMN LSTDocument10 pagesTD RMN LSTHajar AMENAOUPas encore d'évaluation
- 15209cours Orga M1 CMS Reactions PericycliquesDocument33 pages15209cours Orga M1 CMS Reactions PericycliquesLaura DijouxPas encore d'évaluation
- Molécule FuraneDocument11 pagesMolécule FuraneHamza BoulikaPas encore d'évaluation
- Série Dexercices 2 - Spectrométrie Infra RougeDocument3 pagesSérie Dexercices 2 - Spectrométrie Infra RougeSamar ZedamPas encore d'évaluation
- Chapitre 1Document26 pagesChapitre 1HindPas encore d'évaluation
- Polycopié Exercices PDFDocument6 pagesPolycopié Exercices PDFTaouil MohamedPas encore d'évaluation
- Corrigé de La Série 1 de CorrosionDocument8 pagesCorrigé de La Série 1 de CorrosionRabeh BenzadaPas encore d'évaluation
- Wa0006Document5 pagesWa0006Taouil MohamedPas encore d'évaluation
- Exam-Corrige Chimie PDFDocument4 pagesExam-Corrige Chimie PDFNassimaPas encore d'évaluation
- Série 1Document2 pagesSérie 1héma tologiePas encore d'évaluation
- LICENCE PROFESSIONNELLE INDUSTRIES CHIMIQUES ET PHARMACEUTIQUES Option DM PDFDocument9 pagesLICENCE PROFESSIONNELLE INDUSTRIES CHIMIQUES ET PHARMACEUTIQUES Option DM PDFTaouil MohamedPas encore d'évaluation
- TP - Catalyse Hétérogène Appliquée À La Dépollution AutomobileDocument13 pagesTP - Catalyse Hétérogène Appliquée À La Dépollution AutomobileHaniDjekrif100% (1)
- RMNCours TDOct 2016Document2 pagesRMNCours TDOct 2016Cafe EstudiantinPas encore d'évaluation
- Cours Et TD Propriètés OptiquesDocument62 pagesCours Et TD Propriètés Optiquesmohamed HanouniPas encore d'évaluation
- Poly D'Exercices (RMN Sv2)Document13 pagesPoly D'Exercices (RMN Sv2)Hiba ZEROUALPas encore d'évaluation
- FlammeDocument13 pagesFlammeilyesPas encore d'évaluation
- Examen Smc3 - 2016-17 Rattrapage CorrigeDocument4 pagesExamen Smc3 - 2016-17 Rattrapage Corrigeayyoub dhbPas encore d'évaluation
- TD SMC S5 Cinétique Chimique 2020-2021 - TD4Document1 pageTD SMC S5 Cinétique Chimique 2020-2021 - TD4Simo BoumahrachiPas encore d'évaluation
- Theorie CorrigeDocument10 pagesTheorie CorrigeMonta del CapoPas encore d'évaluation
- UV VisibleDocument80 pagesUV VisibleReda RamiPas encore d'évaluation
- Correction Serie5 ATOMISTIQUE 2015Document3 pagesCorrection Serie5 ATOMISTIQUE 2015Reda AchoukhanePas encore d'évaluation
- Exercices de Chimie OrganométalliqueDocument5 pagesExercices de Chimie OrganométalliqueEddouks FatimazahraePas encore d'évaluation
- ChemDocument5 pagesChemAnonymous svBEhGhEIPas encore d'évaluation
- Correction Epreuve de Chimie Des Electrolytes 2014 2015Document5 pagesCorrection Epreuve de Chimie Des Electrolytes 2014 2015Imene GhmrPas encore d'évaluation
- TD Polymère 3Document4 pagesTD Polymère 3mostafa bounabPas encore d'évaluation
- Ato ExercicesDocument11 pagesAto ExerciceshhedfiPas encore d'évaluation
- Null 9Document12 pagesNull 9Fati FleurPas encore d'évaluation
- Cours Résumés Avec CorrectionDocument434 pagesCours Résumés Avec CorrectionMaheu MaheuPas encore d'évaluation
- App Elect FinalDocument6 pagesApp Elect FinalAmine HamaouiPas encore d'évaluation
- UV Et UV VISDocument32 pagesUV Et UV VISMuhammed AddalaPas encore d'évaluation
- Rattrapage 2013-2014Document2 pagesRattrapage 2013-2014Anis BouhousPas encore d'évaluation
- Examen - Final - 2011.docx Filename - UTF-8''Examen Final 2011Document2 pagesExamen - Final - 2011.docx Filename - UTF-8''Examen Final 2011sidi mohamed el amine nekkalPas encore d'évaluation
- AI Bap B Analyse Chi 227Document5 pagesAI Bap B Analyse Chi 227mariem outahmiditPas encore d'évaluation
- Allouch RapportDocument67 pagesAllouch Rapportkhaser2011Pas encore d'évaluation
- Serie Dex 4 Alg 1Document3 pagesSerie Dex 4 Alg 1sidi mohamed el amine nekkalPas encore d'évaluation
- Serie1 05Document5 pagesSerie1 05Massyl BensaidPas encore d'évaluation
- TD1 Structure - 12 - 13Document2 pagesTD1 Structure - 12 - 13sidi mohamed el amine nekkalPas encore d'évaluation
- 2nde TP TableauDocument3 pages2nde TP Tableausidi mohamed el amine nekkalPas encore d'évaluation
- Chaleur de Dissolution GC 2010 - CopieDocument7 pagesChaleur de Dissolution GC 2010 - Copiesidi mohamed el amine nekkalPas encore d'évaluation
- Chute LibreDocument4 pagesChute Libresidi mohamed el amine nekkalPas encore d'évaluation
- TP42Document7 pagesTP42sidi mohamed el amine nekkal80% (5)
- Chaleur de Dissolution GC 2010 - CopieDocument7 pagesChaleur de Dissolution GC 2010 - Copiesidi mohamed el amine nekkalPas encore d'évaluation
- TD3 Structure - 12 - 13Document7 pagesTD3 Structure - 12 - 13sidi mohamed el amine nekkal100% (1)
- TP GC DistilaDocument9 pagesTP GC Distilasidi mohamed el amine nekkalPas encore d'évaluation
- TP DismutationDocument4 pagesTP Dismutationsidi mohamed el amine nekkalPas encore d'évaluation
- Coeffiicient de PartageDocument3 pagesCoeffiicient de PartagesuperdoperPas encore d'évaluation
- Dosage DDocument3 pagesDosage DAzzouze HalaouetPas encore d'évaluation
- Titrage Conductim TriquegDocument4 pagesTitrage Conductim Triquegsidi mohamed el amine nekkalPas encore d'évaluation
- TP N°3: Titrage D'un Acide Faible: PrésentationDocument5 pagesTP N°3: Titrage D'un Acide Faible: Présentationsidi mohamed el amine nekkal100% (4)
- TP 15 CF 2009Document10 pagesTP 15 CF 2009sidi mohamed el amine nekkalPas encore d'évaluation
- TP 2 Pétro ChimieDocument2 pagesTP 2 Pétro Chimiesidi mohamed el amine nekkalPas encore d'évaluation
- TP 1 BDocument3 pagesTP 1 Bsidi mohamed el amine nekkalPas encore d'évaluation
- Des Définitions: TP N1: Préparation D'une Solution D'acide Faible, L'acide OxaliqueDocument3 pagesDes Définitions: TP N1: Préparation D'une Solution D'acide Faible, L'acide Oxaliquesidi mohamed el amine nekkalPas encore d'évaluation
- 6 PDFDocument44 pages6 PDFsidi mohamed el amine nekkal0% (1)
- Os Chimie Corrige Ch6Document82 pagesOs Chimie Corrige Ch6Mourad RabahPas encore d'évaluation
- Img030 PDFDocument1 pageImg030 PDFsidi mohamed el amine nekkalPas encore d'évaluation
- 1-1 Généralités Sur Les Acides Et Les BasesDocument8 pages1-1 Généralités Sur Les Acides Et Les Basessidi mohamed el amine nekkalPas encore d'évaluation
- Corriges Chimie 05Document3 pagesCorriges Chimie 05Ĥä MžãPas encore d'évaluation
- MCHI29Document84 pagesMCHI29sidi mohamed el amine nekkalPas encore d'évaluation
- Img 025Document1 pageImg 025sidi mohamed el amine nekkalPas encore d'évaluation
- Img 031Document1 pageImg 031sidi mohamed el amine nekkalPas encore d'évaluation
- CinetiqueDocument50 pagesCinetiquesidi mohamed el amine nekkalPas encore d'évaluation
- Img025 PDFDocument1 pageImg025 PDFsidi mohamed el amine nekkalPas encore d'évaluation