Académique Documents
Professionnel Documents
Culture Documents
Chp24 Bts
Transféré par
ahlemmTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Chp24 Bts
Transféré par
ahlemmDroits d'auteur :
Formats disponibles
Chapitre 24 Sciences Physiques - BTS
Thermodynamique des gaz parfaits
1 Le modèle du gaz parfait
1.1 Définition
On appelle gaz parfait un ensemble de molécules sans interaction entre elles en dehors des chocs
élastiques. Les molécules ne s’attirent ou ne se repoussent pas, elles ne font que se cogner les unes
aux autres.
Les gaz parfaits ne constituent en fait qu’un modèle qui constitue bien souvent une approximation
acceptable. D’autres modèles sont possibles dont le plus connu est celui de Van der Waals.
1.2 Equation d’état des gaz parfaits
: pression du gaz [Pa]
: volume du gaz [m3]
: quantité de matière du gaz [mol]
: constante des gaz parfaits [J.mol.K-1]
: température absolue [K]
La constante des gaz parfaits a pour valeur :
1.3 Masse volumique et densité des gaz parfaits
: masse volumique [kg.m3]
: masse molaire [kg.mol-1]
: pression du gaz [Pa]
: constante des gaz parfaits [J.mol.K-1]
: température absolue [K]
Enveloppe du Bâtiment Page 1
La masse molaire moyenne de l’air vaut 29 g.mol-1
On en déduit la formule :
2 Mélanges de gaz parfaits
2.1 Définition d’un mélange idéal
Un mélange de gaz parfait est dit idéal quand toutes les particules (qu’elles soient identiques ou non)
ne subissent que des chocs élastiques et aucune autre interaction. La pression totale d’un mélange
ne dépend alors pas de la nature des gaz présents, mais uniquement de la quantité totale de matière.
2.2 Fraction molaire du constituant d’un mélange
Quantité de matière totale dans le mélange :
Fraction molaire de chaque constituant :
2.3 Pression partielle d’un constituant
2.4 Masse molaire moyenne d’un mélange
La masse molaire moyenne d’un mélange est définie par :
2.5 Masse volumique et densité d’un mélange
Enveloppe du Bâtiment Page 2
3 Propriétés thermoélastiques des gaz parfaits
3.1 Transformation isochore : loi de Charles
L’échauffement (ou refroidissement) à volume constant d’une quantité de matière fixe d’un gaz
parfait permet d’écrire :
Une autre formulation de cette loi peut être utile :
3.2 Transformation isobare : loi de Gay-Lussac
L’échauffement (ou refroidissement) à pression constante d’une quantité fixe d’un gaz parfait
permet d’écrire :
Une autre formulation de cette loi peut être utile :
3.3 Transformation isotherme : loi de Mariotte
Une autre formulation de cette loi peut être utile :
3.4 Transformation adiabatique : loi de Laplace
Lorsqu’une transformation est adiabatique et réversible, il existe une relation entre deux
paramètres :
Enveloppe du Bâtiment Page 3
3.5 Coefficient de dilatation des gaz
3.6 Coordonnées de Clapeyron
Les coordonnées de Clapeyron permettent de représenter les transformations réversibles. Cette
transformation utilise le volume en abscisse et la pression en ordonnée
3.6.1 Transformations isothermes réversibles
3.6.2 Transformations isochores réversibles
Enveloppe du Bâtiment Page 4
3.6.3 Transformations isobares réversibles
3.6.4 Transformations adiabatiques réversible
Le tracé de quelques isotherme superposées à la courbe précédente montre que les adiabatiques
décroissent plus rapidement que les isothermes.
Enveloppe du Bâtiment Page 5
4 1er Principe de la thermodynamique pour les gaz parfaits
4.1 Energie interne
: variation d’énergie interne *J+
: capacité thermique molaire à volume
constant [J.mol-1.K-1]
: capacité thermique massique à volume
constant [J.mol-1.K-1]
Remarque : La variation d’énergie interne pour un gaz parfait ne dépend que de la
quantité de matière et de l’écart de température entre l’état initial et final.
Rappel : L’énergie interne est un terme « forfaitaire » comptabilisant l’ensemble des
énergies microscopiques
4.2 Relation de Mayer
On peut démontrer les relations suivantes :
4.3 Enthalpie
Rappel : La fonction enthalpie permet de simplifier le calcul des échanges d’énergie
pour les transformations isobares. Cette fonction ne comptabilise pas les échanges d’énergie
dus au travail des forces de pression (conséquence de la variation de volume)
Enveloppe du Bâtiment Page 6
5 Expression du travail des forces de pression
5.1 Représentation en coordonnées de Clapeyron
5.2 Transformation isochore
Expression générale du travail des forces de pression
Dans le cas d’une transformation isochore : dV =0 donc W = 0
W désigne l’énergie reçue par l’extérieur sous forme de travail des forces de pression *J+
5.3 Transformation isobare
: énergie reçue par l’extérieur sous forme de
travail des forces de pression [J]
: variation de volume [m3]
: pression constante à laquelle se réalise la
transformation [Pa]
Enveloppe du Bâtiment Page 7
5.4 Transformation isotherme réversible
Ainsi :
5.5 Transformation adiabatique réversible
On peut démontrer que :
6 Energie échangée par transfert thermique
Enveloppe du Bâtiment Page 8
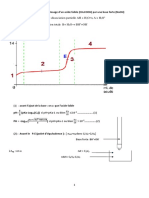
7 Exemple de machine à cycle : la pompe à chaleur
Une pompe à chaleur est une machine thermique dans laquelle le fluide qui subit une transformation
cyclique est du fréon R12 (CF2Cl2)
Description du cycle :
Le fluide caloporteur sort à l’état gazeux du serpentin de l’évaporateur E situé à l’extérieur.
(Pression PF et température TF de la source froide) – étape notée 6. Il a reçu de l’énergie
thermique QF.
Il passe dans le compresseur qui le comprime à la pression PC . Cette compression rapide est
isentropique (adiabatique) : le fréon s’échauffe – étape notée 2. Le compresseur a amené un
travail W.
Le fréon arrive dans le serpentin du condenseur C situé à l’intérieur de l’habitation. Le gaz se
refroidit jusqu’à la température TC de la source chaude et se liquéfie sous la pression PC. –
étape notée 3.
Il passe dans une vanne de détente qui le ramène à la pression PD. La détente est
adiabatique.
A l’arrivée dans le serpentin de l’évaporateur E, le fluide se vaporise sous la pression PD et à
la température TF de la source froide.
Bilan énergétique :
Le fluide reçoit le travail W du compresseur
Le fluide cède à la source chaude la chaleur QC dans le condenseur où il se liquéfie
Le fluide reçoit de la source froide la chaleur QF dans l’évaporateur pour se vaporiser
Rendement :
Enveloppe du Bâtiment Page 9
Chapitre 23 Sciences Physiques - BTS
Exercices
Exercice 1
Enveloppe du Bâtiment Page 10
Exercice 2 Etude d’une machine frigorifique
Enveloppe du Bâtiment Page 11
Exercice 3 : Détente isotherme d’un gaz parfait
1 m3 d’air (supposé gaz parfait), à la pression p1 = 10 atmosphères, subit une détente, à température
constante ; la pression finale est p2 = 1 atmosphère.
Déterminer le travail échangé par le gaz avec le milieu extérieur, au cours de cette détente, ainsi que
la quantité de chaleur échangée avec le milieu extérieur. On rappelle que 1atm = 105 N/m²
Exercice 4 : Compression adiabatique d’un gaz parfait
Un récipient, fermé par un piston mobile, renferme 2g d’hélium (gaz parfait, monoatomique) dans
les conditions (p1, v1). On amène le gaz dans les conditions (p2, v2). On donne p1 = 1 atm, v1 = 10L et
p2 = 3 atm.
1. Déterminer :
2. Le volume final v2 ;
3. Le travail reçu par le gaz ;
4. La variation d’énergie interne du gaz ;
5. En déduire l’élévation de température du gaz, sans calculer la température initiale T1.
Exercice 5 : Equation de la statique des fluides
Deux vases A1 et A2 de sections S1 = 50 cm² et S2 = 10 cm², dont les bases sont dans un même plan
horizontal, communiquent par un tube fin de volume négligeable, muni d’un robinet R initialement
fermé. On verse un litre de mercure dans A1 et 0.5 litre de mercure dans A2.
Déterminer les déplacements x1 et x2 des deux niveaux de mercure lorsqu’on ouvre le robinet.
Enveloppe du Bâtiment Page 12
Vous aimerez peut-être aussi
- TD ThermodynamiqueDocument4 pagesTD ThermodynamiqueamenmhedhbiiPas encore d'évaluation
- TD Serie 1 PDFDocument4 pagesTD Serie 1 PDFmohamed saadiPas encore d'évaluation
- TD Premier Deuxieme PrincipesDocument5 pagesTD Premier Deuxieme Principessamim1971Pas encore d'évaluation
- TD Thermo en LigneDocument16 pagesTD Thermo en LigneDavi Nordel NgondzaPas encore d'évaluation
- Thermodynamique II TD 15 - CompressedDocument2 pagesThermodynamique II TD 15 - CompressedhassegoutePas encore d'évaluation
- TD N°3 de PHYSIQUE IIIDocument3 pagesTD N°3 de PHYSIQUE IIIfjosephfabricePas encore d'évaluation
- TD Thermo ERSE 2eAN 21 22Document1 pageTD Thermo ERSE 2eAN 21 22ezmabelloPas encore d'évaluation
- TD t2 1er-PpeDocument12 pagesTD t2 1er-PpeKld MntPas encore d'évaluation
- ZZZ Suppexos Th3 Th4 Premier Et Second PrincipesDocument12 pagesZZZ Suppexos Th3 Th4 Premier Et Second PrincipesOussama El BouadiPas encore d'évaluation
- Cours Exercices Thermo4Document9 pagesCours Exercices Thermo4Fatou SECKPas encore d'évaluation
- TD Thermodynamique-2Document48 pagesTD Thermodynamique-2kawtar azzouziPas encore d'évaluation
- Gaz 1Document18 pagesGaz 1Amal FatouhPas encore d'évaluation
- Gaz 1Document18 pagesGaz 1imade zidanePas encore d'évaluation
- Examen BTS Thermo Gaz1Document18 pagesExamen BTS Thermo Gaz1Ronaldo soallaPas encore d'évaluation
- Chapitre 3 - Le Premier Principe de La ThermodynamiqueDocument10 pagesChapitre 3 - Le Premier Principe de La ThermodynamiqueMalick DiopPas encore d'évaluation
- Chapitre 3 - Le Premier Principe de La ThermodynamiqueDocument12 pagesChapitre 3 - Le Premier Principe de La ThermodynamiquePapa Mbaye BaPas encore d'évaluation
- S Rie 2 ThermodynamiqueDocument3 pagesS Rie 2 Thermodynamiquechakib abPas encore d'évaluation
- Exercices Corriges Thermo PDFDocument34 pagesExercices Corriges Thermo PDFLoubna MentarPas encore d'évaluation
- 1er PrincipeDocument3 pages1er PrincipemohamedPas encore d'évaluation
- TD 03 Thermodynamique - 2024Document2 pagesTD 03 Thermodynamique - 2024mouslim.badrPas encore d'évaluation
- TD ThermodynamiqueDocument5 pagesTD ThermodynamiqueEmmanuel KingPas encore d'évaluation
- TD 1 ThermoDocument2 pagesTD 1 Thermomoney makerPas encore d'évaluation
- S Rie 2 ThermodynamiquenDocument3 pagesS Rie 2 Thermodynamiquenabdo issaouiPas encore d'évaluation
- Introduction Generale de ThermosDocument2 pagesIntroduction Generale de ThermoskakeraPas encore d'évaluation
- Ecole Supérieure de Technologie Fkih Ben Saleh: Filière: DUT Génie Minier (GM) /DUT Génie Civil (GC)Document1 pageEcole Supérieure de Technologie Fkih Ben Saleh: Filière: DUT Génie Minier (GM) /DUT Génie Civil (GC)koooooabdoojoPas encore d'évaluation
- SérieN3 2020-2021Document2 pagesSérieN3 2020-2021MounirPas encore d'évaluation
- TD Thermo L1chi 23 24 022637Document6 pagesTD Thermo L1chi 23 24 022637milandcalebPas encore d'évaluation
- TD N°1 2020Document2 pagesTD N°1 2020Ismahane BenPas encore d'évaluation
- Travaux Dirigés ThermodynamiqueDocument4 pagesTravaux Dirigés ThermodynamiqueRodolphe Sounou100% (2)
- Ch3 Gaz ParfaitsDocument16 pagesCh3 Gaz ParfaitsAymen AdjissiPas encore d'évaluation
- Thermodynamique TD, Tests, Exam CorrigeeDocument55 pagesThermodynamique TD, Tests, Exam CorrigeeAwatif BePas encore d'évaluation
- Second Principe: EX 1 - Création D'entropie Dans Une Expérience de CalorimétrieDocument2 pagesSecond Principe: EX 1 - Création D'entropie Dans Une Expérience de Calorimétriezakaria amirPas encore d'évaluation
- T5 TD PDFDocument2 pagesT5 TD PDFMario StiflerPas encore d'évaluation
- Thermique 1Document39 pagesThermique 1Zakia ZikerPas encore d'évaluation
- Exercices Gaz Parfaits 3Document3 pagesExercices Gaz Parfaits 3Hocine BylkaPas encore d'évaluation
- TD4 Sol PDFDocument15 pagesTD4 Sol PDFyoussefPas encore d'évaluation
- Thermo TD2 2024Document4 pagesThermo TD2 2024Lodvert T. POATYPas encore d'évaluation
- Exercices D'application - CopieDocument3 pagesExercices D'application - CopieAbbé Marc LESSAMBA100% (3)
- TD Thermody. Serie3 2019-20 - S1Document2 pagesTD Thermody. Serie3 2019-20 - S1Fatifleur AssemarPas encore d'évaluation
- TD1 VF10 Thermo II - Rappels Th1. 2019Document9 pagesTD1 VF10 Thermo II - Rappels Th1. 2019AbouZakariaPas encore d'évaluation
- Partie I ThermodynamiqueDocument11 pagesPartie I ThermodynamiqueCheikh BenaniPas encore d'évaluation
- Exercice N1Document3 pagesExercice N1Harry Mongo100% (2)
- Thermo C7 TD 3Document3 pagesThermo C7 TD 3PLK 225Pas encore d'évaluation
- TD4 ThermoDocument3 pagesTD4 ThermoYoussef BensaidPas encore d'évaluation
- Examen Thermo L2 ERSE 22Document1 pageExamen Thermo L2 ERSE 22ezmabelloPas encore d'évaluation
- TD Thermo Série N 1Document2 pagesTD Thermo Série N 1sa raPas encore d'évaluation
- 3chimie Générale PR - El MrabetDocument53 pages3chimie Générale PR - El MrabetFouad BenallalPas encore d'évaluation
- Thermodynamique TD 4:: Premier Principe de La ThermodynamiqueDocument6 pagesThermodynamique TD 4:: Premier Principe de La ThermodynamiqueHoussam BenkerroumPas encore d'évaluation
- Ch9 Le Modèle Des Gaz ParfaitsDocument2 pagesCh9 Le Modèle Des Gaz ParfaitsOmar ErrajiPas encore d'évaluation
- Ex Thermo 1Document10 pagesEx Thermo 1ArthurpetitPas encore d'évaluation
- MACHTHERMQDocument125 pagesMACHTHERMQravonantenaina rakotonindrainyPas encore d'évaluation
- TD 2 Mip - Mipc 2020Document2 pagesTD 2 Mip - Mipc 2020HEBATONPas encore d'évaluation
- TD T4: Second Principe de La Thermodynamique: But Du ChapitreDocument4 pagesTD T4: Second Principe de La Thermodynamique: But Du ChapitreMOCTAR HASSANEPas encore d'évaluation
- Série #8 Et 9 de Chimie Générale Pharmaceutique 2024Document6 pagesSérie #8 Et 9 de Chimie Générale Pharmaceutique 2024hamzamt2023Pas encore d'évaluation
- Exercices de ThermodynamiqueDocument18 pagesExercices de ThermodynamiqueBadre-ezzamen KaddourPas encore d'évaluation
- ThermoDocument3 pagesThermoOumixa BenPas encore d'évaluation
- 1-2 - Grippes Et Viroses (Covid)Document10 pages1-2 - Grippes Et Viroses (Covid)ahlemmPas encore d'évaluation
- 5 - Régulation de RespirationDocument29 pages5 - Régulation de RespirationahlemmPas encore d'évaluation
- 5 - SD MédiastinauxDocument39 pages5 - SD MédiastinauxahlemmPas encore d'évaluation
- 1 - ÉlectrocardiogrammeDocument28 pages1 - ÉlectrocardiogrammeahlemmPas encore d'évaluation
- 3 - Le Cycle CardiaqueDocument30 pages3 - Le Cycle CardiaqueahlemmPas encore d'évaluation
- Examen de Révision Med 1Document6 pagesExamen de Révision Med 1ahlemm100% (1)
- 1 - Introduction À La Physiologie RespiratoireDocument29 pages1 - Introduction À La Physiologie RespiratoireahlemmPas encore d'évaluation
- Bioch1an16-Enzymologie GhoualiDocument67 pagesBioch1an16-Enzymologie Ghoualiahlemm100% (1)
- F-Le Système Nerveux VégétatifDocument2 pagesF-Le Système Nerveux Végétatifahlemm100% (1)
- 550 QCM Génétique 2020Document45 pages550 QCM Génétique 2020ahlemmPas encore d'évaluation
- Exercices N 5 Et 6Document7 pagesExercices N 5 Et 6ahlemmPas encore d'évaluation
- 100 Réponses Réanimation Et UrgencesDocument6 pages100 Réponses Réanimation Et UrgencesahlemmPas encore d'évaluation
- Myologie Supérieur !Document12 pagesMyologie Supérieur !ahlemmPas encore d'évaluation
- Le Noyau Interphasique CoursDocument76 pagesLe Noyau Interphasique CoursahlemmPas encore d'évaluation
- Support de Cours Thermodynamique 2020Document59 pagesSupport de Cours Thermodynamique 2020ahlemmPas encore d'évaluation
- Cours - Chimie Des Solutions, 2019Document81 pagesCours - Chimie Des Solutions, 2019ahlemmPas encore d'évaluation
- 3 La SpermatogenèseDocument2 pages3 La SpermatogenèseahlemmPas encore d'évaluation
- La Membrane PlasmiqueDocument53 pagesLa Membrane PlasmiqueahlemmPas encore d'évaluation
- Chimie 4Document12 pagesChimie 4riadhPas encore d'évaluation
- Formulaire de Physique ExtraitDocument17 pagesFormulaire de Physique Extraitousseynou dialloPas encore d'évaluation
- Liquefaction D'un Gaz PDFDocument15 pagesLiquefaction D'un Gaz PDFKHALEDFEKAIRPas encore d'évaluation
- Ch6 (TSTI2D) - Changements Détat Et Transferts Thermique (Prof)Document1 pageCh6 (TSTI2D) - Changements Détat Et Transferts Thermique (Prof)unsheatedsword55Pas encore d'évaluation
- Pertes de ChargeDocument17 pagesPertes de ChargeAbderrahmen MakhebiPas encore d'évaluation
- Distillation Flash PDFDocument14 pagesDistillation Flash PDFSarah sarahPas encore d'évaluation
- DS 14 15 2 rtp1Document2 pagesDS 14 15 2 rtp1Mohammed MarzougPas encore d'évaluation
- Compte Rendu TP MachineDocument14 pagesCompte Rendu TP MachineYousfi WahidPas encore d'évaluation
- Procédé CryogeniqueDocument18 pagesProcédé CryogeniqueManel 123Pas encore d'évaluation
- Chimie 2 Chap 5Document8 pagesChimie 2 Chap 5ajb4duPas encore d'évaluation
- Résumé ThermochimieDocument9 pagesRésumé ThermochimiejeanPas encore d'évaluation
- Comment Gonfler La Vessie D Un Reservoir Pompe A EauDocument3 pagesComment Gonfler La Vessie D Un Reservoir Pompe A EauLobna CHEBBIPas encore d'évaluation
- Chapitre 4 MDF1Document12 pagesChapitre 4 MDF1Mohamed Amine BelkemitiPas encore d'évaluation
- Changement de Phase 1Document34 pagesChangement de Phase 1laila123azzPas encore d'évaluation
- Mini Projet CryogénieDocument17 pagesMini Projet Cryogéniefeed me upPas encore d'évaluation
- Cours Procédés de Dépollution S6Document40 pagesCours Procédés de Dépollution S6CHAIMAEPas encore d'évaluation
- tp01 tp02Document12 pagestp01 tp02Belmabedi MarouanePas encore d'évaluation
- ThermodynamiqueDocument20 pagesThermodynamiqueNesrine NasriPas encore d'évaluation
- Diagramme Enthalpique EcodimeDocument15 pagesDiagramme Enthalpique EcodimeAbdelillah feghoulPas encore d'évaluation
- Mécanique de Fluide TDDocument7 pagesMécanique de Fluide TDNaifar OnsPas encore d'évaluation
- Solution Série N1 MDF1Document3 pagesSolution Série N1 MDF1Hamid BrzPas encore d'évaluation
- td15 Thermodynamique1Document2 pagestd15 Thermodynamique1Adri LebPas encore d'évaluation
- TP VenturiDocument7 pagesTP VenturiM Naim100% (1)
- Note de Calcul Alimentation en Eau Potable BâtimentDocument17 pagesNote de Calcul Alimentation en Eau Potable BâtimentDera RalamboPas encore d'évaluation
- Série TD HydrodinamiqueDocument4 pagesSérie TD HydrodinamiqueCHAHID MOHAMMEDPas encore d'évaluation
- UNB MPI TD Thermodynamique 2023Document4 pagesUNB MPI TD Thermodynamique 2023Traoré InoussaPas encore d'évaluation
- Sist en Iso 6974 6 2005Document10 pagesSist en Iso 6974 6 2005Ajay SharmaPas encore d'évaluation
- ST2 Thermodynamique GourariDocument38 pagesST2 Thermodynamique GouraritthPas encore d'évaluation
- Revue des incompris revue d'histoire des oubliettes: Le Réveil de l'Horloge de Célestin Louis Maxime Dubuisson aliéniste et poèteD'EverandRevue des incompris revue d'histoire des oubliettes: Le Réveil de l'Horloge de Célestin Louis Maxime Dubuisson aliéniste et poèteÉvaluation : 3 sur 5 étoiles3/5 (3)
- Le livre de la mémoire libérée : Apprenez plus vite, retenez tout avec des techniques de mémorisation simples et puissantesD'EverandLe livre de la mémoire libérée : Apprenez plus vite, retenez tout avec des techniques de mémorisation simples et puissantesÉvaluation : 4 sur 5 étoiles4/5 (6)
- Hypnotisme et Magnétisme, Somnambulisme, Suggestion et Télépathie, Influence personnelle: Cours Pratique completD'EverandHypnotisme et Magnétisme, Somnambulisme, Suggestion et Télépathie, Influence personnelle: Cours Pratique completÉvaluation : 4.5 sur 5 étoiles4.5/5 (8)
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Neuropsychologie: Les bases théoriques et pratiques du domaine d'étude (psychologie pour tous)D'EverandNeuropsychologie: Les bases théoriques et pratiques du domaine d'étude (psychologie pour tous)Pas encore d'évaluation
- Harmonisation Energétique des Personnes: Manuel de Curothérapie 2020D'EverandHarmonisation Energétique des Personnes: Manuel de Curothérapie 2020Évaluation : 4 sur 5 étoiles4/5 (8)
- Force Mentale et Maîtrise de la Discipline: Renforcez votre Confiance en vous pour Débloquer votre Courage et votre Résilience ! (Comprend un Manuel Pratique en 10 Étapes et 15 Puissants Exercices)D'EverandForce Mentale et Maîtrise de la Discipline: Renforcez votre Confiance en vous pour Débloquer votre Courage et votre Résilience ! (Comprend un Manuel Pratique en 10 Étapes et 15 Puissants Exercices)Évaluation : 4.5 sur 5 étoiles4.5/5 (28)
- Entretien clinique: Outils et techniques de diagnostic en santé mentaleD'EverandEntretien clinique: Outils et techniques de diagnostic en santé mentalePas encore d'évaluation
- Le B.A.-Ba de la communication: Comment convaincre, informer, séduire ?D'EverandLe B.A.-Ba de la communication: Comment convaincre, informer, séduire ?Évaluation : 3 sur 5 étoiles3/5 (1)
- Comment développer l’autodiscipline: Résiste aux tentations et atteins tes objectifs à long termeD'EverandComment développer l’autodiscipline: Résiste aux tentations et atteins tes objectifs à long termeÉvaluation : 4.5 sur 5 étoiles4.5/5 (7)
- Technologie automobile: Les Grands Articles d'UniversalisD'EverandTechnologie automobile: Les Grands Articles d'UniversalisPas encore d'évaluation
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- Anatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursD'EverandAnatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursPas encore d'évaluation
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Aimez-Vous en 12 Étapes Pratiques: Un Manuel pour Améliorer l'Estime de Soi, Prendre Conscience de sa Valeur, se Débarrasser du Doute et Trouver un Bonheur VéritableD'EverandAimez-Vous en 12 Étapes Pratiques: Un Manuel pour Améliorer l'Estime de Soi, Prendre Conscience de sa Valeur, se Débarrasser du Doute et Trouver un Bonheur VéritableÉvaluation : 5 sur 5 étoiles5/5 (4)
- Géobiologie de l'habitat et Géobiologie sacrée: Pour un lieu sainD'EverandGéobiologie de l'habitat et Géobiologie sacrée: Pour un lieu sainÉvaluation : 4.5 sur 5 étoiles4.5/5 (2)
- Manuel pour les débutants Fabriquez des savons naturelsD'EverandManuel pour les débutants Fabriquez des savons naturelsÉvaluation : 3 sur 5 étoiles3/5 (2)
- Production et propagation des sons: Les Grands Articles d'UniversalisD'EverandProduction et propagation des sons: Les Grands Articles d'UniversalisPas encore d'évaluation
- Anatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsD'EverandAnatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsPas encore d'évaluation
- Le TDA/H chez l'adulte: Apprendre à vivre sereinement avec son trouble de l'attentionD'EverandLe TDA/H chez l'adulte: Apprendre à vivre sereinement avec son trouble de l'attentionPas encore d'évaluation