Académique Documents
Professionnel Documents
Culture Documents
Procédés Chimiques
Transféré par
Kahil Laib0 évaluation0% ont trouvé ce document utile (0 vote)
6 vues2 pagesCopyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
6 vues2 pagesProcédés Chimiques
Transféré par
Kahil LaibDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
Procédés Chimiques
1. Equilibres chimiques
Enthalpie libre de réaction
𝑁
𝛿𝑈 𝛿𝐻 𝛿𝐺
Δ𝑟 𝐺 = = = = ∑ 𝝊𝑖 ∙ 𝜇𝑖
𝛿𝜉 𝛿𝜉 𝛿𝜉
𝑖=1
𝛿𝑛𝑖
𝝊𝑖 =
𝛿𝜉
Potentiel chimique
𝜇𝑖 = 𝜇𝑖 °(𝑇) + 𝑅 ∙ 𝑇 ∙ ln(𝑎𝑖 )
Enthalpie libre standard de réaction
𝑁
Δ𝑟 𝐺° = ∑ 𝝊𝑖 ∙ 𝜇𝑖 °
𝑖=1
Constante d’équilibre standard
Δ𝑟 𝐺° Δ𝑟 𝐺°
ln 𝐾° = − ⇔ 𝐾° = 𝑒 − 𝑅 𝑇
𝑅𝑇
Loi de Van’t Hoff
𝑑 ln 𝐾° Δ𝑟 𝐻°
=
𝑑𝑇 𝑅 𝑇2
Gibbs – Helmholtz
𝑑 Δ𝑟 𝐺° Δ𝑟 𝐻°
( )=− 2
𝑑𝑇 𝑇 𝑇
Relations entre les Δ𝑟 𝑌°
𝑑Δ𝑟 𝐺°
Δ𝑟 𝑆° = −
𝑑𝑇
Δ𝑟 𝐺° = Δ𝑟 𝐻° − 𝑇 ∙ Δ𝑟 𝑆°
Δ𝑟 𝐻° = Δ𝑟 𝑈° + 𝑝° ∙ Δ𝑟 𝑉°
Capacités thermiques standards de réaction
𝑑Δ𝑟 𝐻°
Δ𝑟 𝐶𝑝 ° =
𝑑𝑇
Δ𝑟 𝑆° Δ𝑟 𝐶𝑝 °
=
𝑑𝑇 𝑇
L’essentiel de SPE // Chimie // Procédés Chimiques
2. Optimisation des procédés chimiques
Influence de T
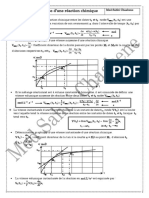
𝛥𝑟 𝐻° > 0 ⇒ 𝑒𝑛𝑑𝑜𝑡ℎ𝑒𝑟𝑚𝑖𝑞𝑢𝑒 (𝐾° 𝑐𝑟𝑜î𝑡 𝑎𝑣𝑒𝑐 𝑇)
𝛥𝑟 𝐻° < 0 ⇒ 𝑒𝑥𝑜𝑡ℎ𝑒𝑟𝑚𝑖𝑞𝑢𝑒 (𝐾° 𝑑é𝑐𝑟𝑜î𝑡 𝑎𝑣𝑒𝑐 𝑇)
Influence de Δ𝑟 𝐺
𝑄 > 𝐾° , Δ𝑟 𝐺 > 0 ⇒ 𝐿𝑎 𝑟é𝑎𝑐𝑡𝑖𝑜𝑛 é𝑣𝑜𝑙𝑢𝑒 𝑣𝑒𝑟𝑠 𝑙𝑎 𝑔𝑎𝑢𝑐ℎ𝑒 (𝜉 𝑑é𝑐𝑟𝑜𝑖𝑠𝑠𝑎𝑛𝑡𝑠)
𝑄 < 𝐾° , Δ𝑟 𝐺 < 0 ⇒ 𝐿𝑎 𝑟é𝑎𝑐𝑡𝑖𝑜𝑛 é𝑣𝑜𝑙𝑢𝑒 𝑣𝑒𝑟𝑠 𝑙𝑎 𝑑𝑟𝑜𝑖𝑡𝑒 (𝜉 𝑐𝑟𝑜𝑖𝑠𝑠𝑎𝑛𝑡𝑠)
L’essentiel de SPE // Chimie // Procédés Chimiques
Vous aimerez peut-être aussi
- Cours Genie ChimiqueDocument14 pagesCours Genie ChimiquealiciaPas encore d'évaluation
- Cours Et TDDocument29 pagesCours Et TDA100% (1)
- 209 Ponceuse CorrigeDocument3 pages209 Ponceuse CorrigeKahil Laib0% (1)
- Potentiel - PHDocument3 pagesPotentiel - PHKahil LaibPas encore d'évaluation
- ThermochimieDocument3 pagesThermochimieKahil LaibPas encore d'évaluation
- Equilibre D'un Système ChimiqueDocument8 pagesEquilibre D'un Système ChimiqueNouhad KaisPas encore d'évaluation
- Chapitre 1 Réacteurs HomogènesDocument8 pagesChapitre 1 Réacteurs HomogènesGp GpPas encore d'évaluation
- Equilibre Et Loi D Action de MasseDocument1 pageEquilibre Et Loi D Action de Masseaziz bensaid2Pas encore d'évaluation
- 2018-Chap6-Enthalpie LibreDocument19 pages2018-Chap6-Enthalpie LibreOthMane TaPas encore d'évaluation
- Cours Stage Thermochimie 2021 FinalDocument11 pagesCours Stage Thermochimie 2021 Finalsafae ziyatiPas encore d'évaluation
- 06 Evolution Spontanee D Un Systeme ChimiqueDocument7 pages06 Evolution Spontanee D Un Systeme ChimiqueElec FoPas encore d'évaluation
- Chapitre IV Les Potentiels ThermodynamiqueDocument4 pagesChapitre IV Les Potentiels ThermodynamiqueDoudou AminePas encore d'évaluation
- Chapitre 1 - Proprités Colligatives - Master Chim PharmDocument38 pagesChapitre 1 - Proprités Colligatives - Master Chim PharmChoukri SBPas encore d'évaluation
- 6 Réactions Acido-BasiqueDocument6 pages6 Réactions Acido-Basiqueateich simohamedPas encore d'évaluation
- 1 Bac Les Reactions Acido Basiques Cours 1Document6 pages1 Bac Les Reactions Acido Basiques Cours 1rihabPas encore d'évaluation
- Chapitre IDocument7 pagesChapitre IKhaled BouchaourPas encore d'évaluation
- Cours Réacteurs Homogènes 1ère Partie-1Document11 pagesCours Réacteurs Homogènes 1ère Partie-1Faiza RahmouniPas encore d'évaluation
- Cours - Physique Loi de Moderation Et Loi Daction de Masse - Bac Math (2013-2014) MR Afdal AliDocument3 pagesCours - Physique Loi de Moderation Et Loi Daction de Masse - Bac Math (2013-2014) MR Afdal AliceddmefPas encore d'évaluation
- CM CHI 201 - 2022 Royal Partie 1Document53 pagesCM CHI 201 - 2022 Royal Partie 1Vera Legba-MonyPas encore d'évaluation
- Cinétique 1Document21 pagesCinétique 1Closed WayPas encore d'évaluation
- Révision N°1 Correction (MR KH Bessem) (Lycée Maknassy) PDFDocument2 pagesRévision N°1 Correction (MR KH Bessem) (Lycée Maknassy) PDFFakhri KlaiPas encore d'évaluation
- 9 - État D'équilibre D'un Système 2Document8 pages9 - État D'équilibre D'un Système 2pro alixPas encore d'évaluation
- Cinetique ChimiqueDocument7 pagesCinetique ChimiqueSoufiane SarhiPas encore d'évaluation
- Cours DosageDocument5 pagesCours DosageTEST - TESTPas encore d'évaluation
- Chimie 5Document11 pagesChimie 5LAILA ASLOUZIPas encore d'évaluation
- Reacteurs Chapitre-1Document14 pagesReacteurs Chapitre-1Ahmed BelkacemPas encore d'évaluation
- Cours Thermo - Chapitre 7. Solutions Réelles - 2019Document27 pagesCours Thermo - Chapitre 7. Solutions Réelles - 2019ait hssainPas encore d'évaluation
- CoursExercices 01Document65 pagesCoursExercices 01phytanja100% (4)
- Chapitre 5A Complété Quotient de Réaction Et Constante d' ÉquilibreDocument3 pagesChapitre 5A Complété Quotient de Réaction Et Constante d' Équilibreairfann67Pas encore d'évaluation
- AIDE MÉMOIRE - BM BE Intra1 2022Document3 pagesAIDE MÉMOIRE - BM BE Intra1 2022Edwin RodriguezPas encore d'évaluation
- Transformation Chimiquebilan de MatièreDocument3 pagesTransformation Chimiquebilan de MatièreKamal LaourdaniPas encore d'évaluation
- Chapitre 2Document4 pagesChapitre 2Moustapha Bassirou NianePas encore d'évaluation
- 1 Equilibres ChimiquesDocument6 pages1 Equilibres ChimiquesMira MslPas encore d'évaluation
- Chap. 12-Évolution SpontanéeDocument1 pageChap. 12-Évolution SpontanéeBénédicte & Christophe MULLERPas encore d'évaluation
- Fiche Sur Loi Daction de Masse Conditions Dévolution Spontanée 1Document4 pagesFiche Sur Loi Daction de Masse Conditions Dévolution Spontanée 1chadaPas encore d'évaluation
- 2 - Bilan D'énergie D'un Système Réactif - 1Document14 pages2 - Bilan D'énergie D'un Système Réactif - 1Chikhi AyoubPas encore d'évaluation
- Rappels Cinetique ChimiqueDocument22 pagesRappels Cinetique ChimiqueSaid Soilihi ZayadPas encore d'évaluation
- 40-103 Vitesse RéactionDocument14 pages40-103 Vitesse RéactionKhalil LasferPas encore d'évaluation
- Transformations Chimiques S Effectuant Dans Les 2 Sens Cours 1Document5 pagesTransformations Chimiques S Effectuant Dans Les 2 Sens Cours 1Ahmed Yassine NaciriPas encore d'évaluation
- Cours Thermochimie Mardi 04 Mai 2021Document41 pagesCours Thermochimie Mardi 04 Mai 2021Aissa AoufPas encore d'évaluation
- Chapitre 4Document6 pagesChapitre 4Oussema MzoughiPas encore d'évaluation
- 6.equilibre ChimiqueDocument3 pages6.equilibre ChimiqueDan GrigorePas encore d'évaluation
- Vitesse Dune Réaction Chimique 2Document2 pagesVitesse Dune Réaction Chimique 2Alae MghirbiPas encore d'évaluation
- Thermodynamique ChimiqueDocument31 pagesThermodynamique Chimiquebanzanzadrelvan4Pas encore d'évaluation
- Résumé .CHP 3.transformations Associées À Des Réactions Acido-Basique ..Document3 pagesRésumé .CHP 3.transformations Associées À Des Réactions Acido-Basique ..ayamazouz962Pas encore d'évaluation
- Les Reactions Acido Basiques Cours 1Document6 pagesLes Reactions Acido Basiques Cours 1منةيصةبصسكبةPas encore d'évaluation
- CM Thermo Générale L3 U-ManDocument176 pagesCM Thermo Générale L3 U-ManHarvey SpecterPas encore d'évaluation
- Chapitre 5. Solutions IdéalesDocument19 pagesChapitre 5. Solutions Idéaleshayat LOUKILIPas encore d'évaluation
- 2022 Examen 1 Chimie Solutions Corrigé LDDocument10 pages2022 Examen 1 Chimie Solutions Corrigé LDLaurent KeletaonaPas encore d'évaluation
- Cours Chimie PhysiqueDocument33 pagesCours Chimie PhysiqueBoudardaraPas encore d'évaluation
- Cours 1 - Suivi Temporel D'une TransformationDocument7 pagesCours 1 - Suivi Temporel D'une TransformationsalhiPas encore d'évaluation
- Cours 5 Enthalpie LibreDocument4 pagesCours 5 Enthalpie LibreHimer IlyesPas encore d'évaluation
- Reactions Equilibrees 2022Document33 pagesReactions Equilibrees 2022Mira MslPas encore d'évaluation
- Chapitre III - Equilibres ChimiquesDocument15 pagesChapitre III - Equilibres ChimiquesSoro AchillePas encore d'évaluation
- Cours de ChimieDocument13 pagesCours de Chimiekawaiialways9Pas encore d'évaluation
- Description D'un Système Chimique en Réaction (1029)Document6 pagesDescription D'un Système Chimique en Réaction (1029)AxellePas encore d'évaluation
- Correction DC Nov 2023Document4 pagesCorrection DC Nov 2023tamersamira80Pas encore d'évaluation
- Mines Ponts 01 MP Tharmo BaO2 c01mm1w en CorrDocument3 pagesMines Ponts 01 MP Tharmo BaO2 c01mm1w en Corrhamzedd77tankiPas encore d'évaluation
- DM1 20Document4 pagesDM1 20Kahil LaibPas encore d'évaluation
- 06 C02 PDFDocument34 pages06 C02 PDFKahil LaibPas encore d'évaluation
- 1-1 - TD - Applications Du Cours - Correction PDFDocument1 page1-1 - TD - Applications Du Cours - Correction PDFKahil LaibPas encore d'évaluation
- SUJET - OP - PHYSIQUE-Part2Document3 pagesSUJET - OP - PHYSIQUE-Part2Kahil LaibPas encore d'évaluation
- 2 - Dictionnaires Et Programmation Dynamique - Résumé PDFDocument4 pages2 - Dictionnaires Et Programmation Dynamique - Résumé PDFKahil LaibPas encore d'évaluation
- Option: Physique: Samedi 9 Avril 2022Document4 pagesOption: Physique: Samedi 9 Avril 2022Kahil LaibPas encore d'évaluation
- Mer. 5 Avr. 2023 À 2137Document1 pageMer. 5 Avr. 2023 À 2137Kahil LaibPas encore d'évaluation
- Option: Sciences Industrielles: Samedi 04 Avril 2020Document4 pagesOption: Sciences Industrielles: Samedi 04 Avril 2020Kahil LaibPas encore d'évaluation
- Option: Physique: Samedi 17 Avril 2021Document4 pagesOption: Physique: Samedi 17 Avril 2021Kahil LaibPas encore d'évaluation
- Polynomes LagrangeDocument1 pagePolynomes LagrangeKahil LaibPas encore d'évaluation