Académique Documents
Professionnel Documents
Culture Documents
Chapitre 1 Réacteurs Homogènes
Transféré par
Gp GpTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Chapitre 1 Réacteurs Homogènes
Transféré par
Gp GpDroits d'auteur :
Formats disponibles
CHAPITRE I Lois Cinétiques
Lois Cinétiques
I.1 Nature de réactions chimiques
Diverses caractéristiques des réactions chimiques sont utilisées pour leur classement. On
distingue les réactions:
Elémentaires : elles se produisent en une seule étape.
Complexes : nécessitent plusieurs étapes.
Réversibles : sont possibles dans les deux sens (direct et inverse)
Irréversibles : dans ce cas, les conditions opératoires sont choisies de manière à ce que
l’équilibre soit totalement déplacé vers la formation des produits désirés.
A stœchiométrie unique : la transformation chimique peut être décrite par une seule
équation de bilan indiquant le nombre de moles consommées et produites.
A stœchiométrie multiple : plusieurs équations sont nécessaires pour décrire la
transformation chimique en question.
La réaction chimique peut s’effectuer en présence d’une seule phase (on parle alors de
réaction homogène) ou en présence de deux ou plusieurs phases (réaction hétérogène).
I.2 Vitesse de réaction
La vitesse d’une réaction chimique est la quantité de matière transformée (ou formée) par
unité de temps et par unité d’une extensité donnée (volume, masse, surface, …). La vitesse
mesure donc un débit spécifique de transformation(ou de formation) chimique.
Pour une réaction simple :
𝑎𝐴 + 𝑏𝐵 → 𝑝𝑃 𝐼. 1
Dans le cas général, l’équation stœchiométrique peut s’écrire :
𝑁
∑ 𝛾𝑗 𝐴𝑗 = 0 𝐼. 2
𝑗=1
Avec :
N : nombre de constituants actifs du mélange.
Aj : espèce active j du mélange.
𝜈𝑗: est le coefficient stœchiométrique de l’espèce Aj.
On note la vitesse volumique globale de la réaction par « r » [mole ou masse]/[(unité de
volume)×(unité de temps)].
Dr HAMAIDI Nassima Née MAOUCHE Université A.MIRA Bejaia 2
CHAPITRE I Lois Cinétiques
𝑟𝑗 , est la vitesse du constituant Aj si :
𝑟𝑗 >0 , il s’agit alors de l’apparition (production) du constituant Aj.
𝑟𝑗 <0 , il s’agit de la disparition du constituant Aj.
Pour une réaction homogène :
1 𝑑𝑛𝑗
𝑟𝑗 = 𝐼. 3
𝑉 𝑑𝑡
V : volume du mélange (c'est-à-dire le volume de matière en cours de réaction)
𝒏𝒋 : nombre de moles du constituant Aj.
Pour l’exemple précédent, on peut donc écrire pour chaque constituant actif :
1 𝑑𝑛𝐴
𝑟𝐴 = 𝐼. 4
𝑉 𝑑𝑡
1 𝑑𝑛𝐵
𝑟𝐵 = 𝐼. 5
𝑉 𝑑𝑡
1 𝑑𝑛𝑃
𝑟𝑝 = 𝐼. 6
𝑉 𝑑𝑡
En tenant compte de la stœchiométrie on a :
1 𝑑𝑛𝑃 𝑝 1 𝑑𝑛𝐴 𝑃 1 𝑑𝑛𝐵
= = 𝐼. 7
𝑉 𝑑𝑡 −𝑎 𝑉 𝑑𝑡 −𝑏 𝑉 𝑑𝑡
On a alors
𝑝 𝑝
𝑟𝑃 = 𝑟𝐴 = 𝑟 𝐼. 8
−𝑎 −𝑏 𝐵
Et encore :
𝑟𝑃 𝑟𝐴 𝑟𝐵
= = =𝑟 𝐼. 9
𝑝 −𝑎 −𝑏
Ou
𝑟𝑖 = 𝜈𝑖 𝑟 𝐼. 10
De façon générale, la vitesse de la réaction s’écrit :
1 𝑑𝑛𝑗
𝑟= 𝐼. 11
𝜈𝑗 𝑉 𝑑𝑡
si :
ν𝑗 > 0 : l’espèce Aj est un produit.
Dr HAMAIDI Nassima Née MAOUCHE Université A.MIRA Bejaia 3
CHAPITRE I Lois Cinétiques
ν𝑗 = 0 : l’espèce Aj est un inerte.
ν𝑗 < 0 : l’espèce Aj est un réactif.
I.3 Ordre de la réaction
I.3.1 Réaction élémentaire
Une réaction admet un ordre si l’expérience montre qu’à température constante, la vitesse
volumique de celle-ci peut se mettre sous la forme (on prend pour exemple
la réaction : aA + bB → pP).
𝛽
𝑟 = 𝑘𝐶𝐴𝛼 𝐶𝐵 𝐼. 12
𝑘 : constante de vitesse (son unité dépend de α et β).
α: ordre partiel par rapport au réactif A.
β : ordre partiel par rapport au réactif B.
α + β : ordre global (ou total).
CA et CB : étant les concentrations molaires volumiques respectivement pour le réactif A et B.
Seules les concentrations des réactifs qui interviennent et non celles des produits.
I.3.2 Réaction réversible
Une réaction réversible survient lorsque, au même moment et au même endroit, les
réactifs se transforment en produits et les produits en réactifs.
𝑘1
→
𝑎𝐴 + 𝑏𝐵 ← 𝑐𝐶 + 𝑑𝐷
𝑘2
La vitesse de disparition des réactifs de gauche à droite (sens 1) s’écrit :
𝑟1 = 𝑘1 𝐶𝐴𝑎 𝐶𝐵𝑏 𝐼. 13
Celle de formation des réactifs (droite vers la gauche) selon le sens 2 est :
𝑟2 = 𝑘2 𝐶𝐶𝑐 𝐶𝐷𝑑 𝐼. 14
A l’équilibre :
𝑘1 𝐶𝐶𝑐 𝐶𝐷𝑑
𝑟1 = 𝑟2 𝑑𝑜𝑛𝑐 𝑘1 𝐶𝐴𝑎 𝐶𝐵𝑏 = 𝑘2 𝐶𝐶𝑐 𝐶𝐷𝑑 ⇒ = 𝑎 𝑏=𝑘 𝐼. 15
𝑘2 𝐶𝐴 𝐶𝐵
Dr HAMAIDI Nassima Née MAOUCHE Université A.MIRA Bejaia 4
CHAPITRE I Lois Cinétiques
I.3.3 Réaction autocatalytique
Une réaction est dite autocatalytique si l’un des produits de la réaction catalyse cette
réaction. Généralement, au début de la réaction il faut au moins avoir une quantité de
catalyseur sinon, la réaction sera très lente.
𝑘
𝐴 + 𝐵 → 2𝐵
L’expression de la vitesse de cette réaction autocatalytique s’écrit :
𝑟 = 𝑘𝐶𝐴 𝐶𝐵 𝐼. 16
I.4 Facteurs influents sur la cinétique de la réaction chimique
I.4.1 Influence de la température sur la vitesse de réaction : énergie d’activation
Une observation faite par Arrhenius est que la plupart des réactions ont des constantes de
vitesse k qui augmentent exponentiellement avec la température :
−𝐸𝑎⁄
𝑘 = 𝐴𝑒 𝑅𝑇 𝐼. 17
Ou encore :
𝐸𝑎
𝑙𝑛𝑘 = 𝑙𝑛𝐴 − 𝐼. 18
𝑅𝑇
Avec :
A : facteur pré-exponentiel de la loi d’Arrhenius (dit aussi facteur de fréquence).
Ea : énergie d’activation (J/mol).
R : constante des gaz parfaits (8,314J/mol. K).
T : température absolue (K).
L’équation I.18 prend la forme d’une droite (y= ax +b), pour laquelle (lnA) est l’ordonnée à
l’origine, et (-Ea/R) est la pente, dans un graphique de (lnk) en fonction de (1/T).
lnk
Lnk=lnA-Ea/RT
lnA
Pente =-Ea/R
1
𝑇
Figure I.1 : Linéarisation de la loi d’Arrhenius
Dr HAMAIDI Nassima Née MAOUCHE Université A.MIRA Bejaia 5
CHAPITRE I Lois Cinétiques
I.4.2 Influence de la pression sur la cinétique de la réaction
Soit une réaction en phase gazeuse homogène de type : aA→ Produits
Si cette réaction admet un ordre n, on peut écrire :
𝑟 = 𝑘𝐶𝐴𝑛 𝐼. 19
On a donc en supposant que les gaz sont parfaits (PAV = nART donc PA=CART):
𝑃𝐴 𝑛
𝑟 = 𝑘𝐶𝐴𝑛 = 𝑘( ) = 𝑘 ′ 𝑃𝐴𝑛 𝐼. 20
𝑅𝑇
𝑘
𝑘′ = 𝐼. 21
(𝑅𝑇)𝑛
PA : est la pression partielle du réactif gazeux A.
La pression est donc un facteur cinétique. Si la pression partielle du gaz A augmente, la
vitesse augmente.
I.5 Temps de demi- réaction (demi-vie)
Le temps de demi-réaction est, pour une réaction donnée, le temps au bout duquel
l’avancement vaut la moitié de sa valeur finale. Et pour une réaction totale donnée c’est le
temps au bout duquel la moitié du réactif limitant a réagi.
Ce temps de demi-réaction sera noté par la suite : 𝒕𝟏⁄𝟐 .
Soit la réaction qu’on suppose d’ordre1 :
𝑘
𝑎𝐴 → 𝑝𝑟𝑜𝑑𝑢𝑖𝑡𝑠
La vitesse rA est définie par :
𝑑𝐶𝐴
𝑟𝐴 = −𝑎. 𝑟 = 𝐼. 22
𝑑𝑡
Apres intégration entre CA0 et CA0/2 pour la concentration et entre zéro et 𝑡1⁄2 pour le temps
on obtient (CA0 étant la concentration initiale (à t = 0) du réactif A) :
𝑙𝑛2
𝑡1⁄2 = 𝐼. 23
𝑎𝑘
Dr HAMAIDI Nassima Née MAOUCHE Université A.MIRA Bejaia 6
CHAPITRE I Lois Cinétiques
Tableau I.1 : Expression de 𝑡1⁄2 pour différents ordres de réaction.
Ordre de la Loi de vitesse Loi de vitesse Graphique d’une Expression de
Unité de k 𝒕𝟏⁄𝟐
réaction du réactif A intégrée droite
0 𝐶𝐴 = 𝑓(𝑡) 𝐶𝐴0
−𝑎𝑘 𝐶𝐴= 𝐶𝐴0 − 𝑎𝑘𝑡 mol/L.s
2𝑎𝑘
𝐶𝐴
𝑙𝑛 = −𝑎𝑘𝑡
𝐶𝐴0
1 −𝑎𝑘𝐶𝐴 𝑙𝑛2
𝑙𝑛𝐶𝐴 = 𝑓(𝑡) s-1
𝑎𝑘
1 1
= + 𝑎𝑘𝑡 1 1
2 −𝑎𝑘𝐶𝐴2 𝐶𝐴 𝐶𝐴0 = 𝑓(𝑡) L /mol.s
𝐶𝐴 𝑎𝑘𝐶𝐴0
I.6 Détermination de l’ordre de la réaction
Si on nous propose une série de valeurs expérimentales, pour en déterminer l’ordre et la loi de
vitesse de la réaction :
- On trace d’abord le graphique de la concentration du réactif en fonction du temps
CA=f(t), s’il en résulte une droite, la réaction est d’ordre zéro.
- Si c’est une courbe, on construit le graphique lnCA=f(t), s’il en résulte une droite, la
réaction est d’ordre 1.
- Si ce n’est pas une droite, on trace le graphique 1/CA= f(t), s’il en résulte une droite, la
réaction est d’ordre 2.
I.6.1 Méthode du temps de demi-réaction
A étant le réactif limitant, la manière dont 𝒕𝟏⁄𝟐 dépend de CA0 est caractéristique de
l’ordre de la réaction par rapport à A.
- Ordre zéro : 𝑡1⁄2 proportionnel à CA0.
- Ordre 1 : 𝑡1⁄2 indépendant de CA0.
1
- Ordre 2 : 𝑡1⁄2 proportionnel à .
𝐶𝐴0
Plus généralement, on peut montrer que le temps de demi-réaction pour une réaction d’ordre n
1−𝑛
est proportionnel à 𝐶𝐴0 .
Dr HAMAIDI Nassima Née MAOUCHE Université A.MIRA Bejaia 7
CHAPITRE I Lois Cinétiques
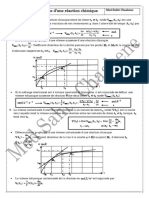
I.6.2 Méthode basée sur la vitesse initiale
On réalise une série d’expériences à une même température. On étudie l’évolution de CA
en fonction du temps pour une concentration CA0 connue. On en déduit la valeur de la vitesse
initiale : pente de la tangente à l’origine de la courbe CA= f(t).
Pour différentes valeurs de CAO, on obtient différentes valeurs de r(0).
𝑛
Or r(0) = k 𝐶𝐴𝑂 . On trace ln(r(0)) = f (LnCAO) et on obtient une droite de pente n et
d’ordonnée à l’origine ln k.
CA
C A0 Pente = r0
0 t
Figure I.2 : Détermination de l’ordre de la réaction avec la méthode de la vitesse initiale
I.6.3 Méthode intégrale
On fait une hypothèse de n (0,1 ou 2), on intègre l’équation différentielle :
𝑑𝐶𝐴
= −𝑎𝑟 = −𝑎𝑘𝐶𝐴𝑛 𝐼. 24
𝑑𝑡
Puis on cherche la représentation de CA= f(t) qui est linéaire.
Tableau I.2 : Equations représentatives de la concentration en fonction du temps pour
différents ordres de réaction
Ordre n 0 1 2
𝐶𝐴 = 𝐶𝐴0 − 𝑎𝑘𝑡 1 1
Représentation linéarisée 𝑙𝑛𝐶𝐴 = 𝑙𝑛𝐶𝐴0 − 𝑎𝑘𝑡 = + 𝑎𝑘𝑡
𝐶𝐴 𝐶𝐴0
I.6.4 Méthode différentielle
Si on connait CA =f(t) (l’évolution de la concentration CA en fonction du temps), on trace la
courbe et on détermine la vitesse de disparition de A à différents instants.
Si la réaction admet un ordre, la vitesse de disparition du réactif A s’écrira :
Dr HAMAIDI Nassima Née MAOUCHE Université A.MIRA Bejaia 8
CHAPITRE I Lois Cinétiques
𝑟𝐴 = −𝑎𝑘𝐶𝐴𝑛 𝐼. 25
Sous forme linéaire, on écrira :
𝑙𝑛(−𝑟𝐴 ) = 𝑙𝑛(𝑎𝑘) + 𝑛𝑙𝑛𝐶𝐴 𝐼. 26
si la réaction admet un ordre n, la courbe représentant ln(-rA) en fonction de lnCA est une
droite de pente n .
Dr HAMAIDI Nassima Née MAOUCHE Université A.MIRA Bejaia 9
Vous aimerez peut-être aussi
- Equilibre D'un Système ChimiqueDocument8 pagesEquilibre D'un Système ChimiqueNouhad KaisPas encore d'évaluation
- Fiche Sur Loi Daction de Masse Conditions Dévolution Spontanée 1Document4 pagesFiche Sur Loi Daction de Masse Conditions Dévolution Spontanée 1chadaPas encore d'évaluation
- Chapitre IDocument7 pagesChapitre IKhaled BouchaourPas encore d'évaluation
- 06 Evolution Spontanee D Un Systeme ChimiqueDocument7 pages06 Evolution Spontanee D Un Systeme ChimiqueElec FoPas encore d'évaluation
- Chimie CinetiqueDocument4 pagesChimie Cinetiqued5kz77jhzzPas encore d'évaluation
- CoursExercices 01Document65 pagesCoursExercices 01phytanja100% (4)
- Reacteurs Chapitre-1Document14 pagesReacteurs Chapitre-1Ahmed BelkacemPas encore d'évaluation
- Cours Réacteurs Homogènes 1ère Partie-1Document11 pagesCours Réacteurs Homogènes 1ère Partie-1Faiza RahmouniPas encore d'évaluation
- Cours Genie ChimiqueDocument14 pagesCours Genie ChimiquealiciaPas encore d'évaluation
- Les Réacteurs Idéaux Homogènes (Partie 2)Document16 pagesLes Réacteurs Idéaux Homogènes (Partie 2)OùSsàmà EL MàsmoùdiPas encore d'évaluation
- Chapitre 3 RHDocument8 pagesChapitre 3 RHGp GpPas encore d'évaluation
- Chimie 5Document11 pagesChimie 5LAILA ASLOUZIPas encore d'évaluation
- Cours CinetiqueDocument27 pagesCours CinetiquebrahkolmPas encore d'évaluation
- CINETIQUE CHIMIQUEDocument7 pagesCINETIQUE CHIMIQUESoufiane SarhiPas encore d'évaluation
- CR Equilibre ChimiqueDocument3 pagesCR Equilibre Chimiquemohamed mohPas encore d'évaluation
- Chimie 3Document5 pagesChimie 3LAILA ASLOUZIPas encore d'évaluation
- Cour Cinetique Ello PC - 1 UfhbDocument85 pagesCour Cinetique Ello PC - 1 UfhbJudicaël SekaPas encore d'évaluation
- Vitesse Dune Réaction Chimique 2Document2 pagesVitesse Dune Réaction Chimique 2Alae MghirbiPas encore d'évaluation
- Examen National Physique Chimie 2 Bac SVT 2017 Normale CorrigeDocument10 pagesExamen National Physique Chimie 2 Bac SVT 2017 Normale CorrigeMohamed SaidiPas encore d'évaluation
- Correction Examen 2016-2020Document68 pagesCorrection Examen 2016-2020Mohamed SaidiPas encore d'évaluation
- Transformation ChimiqueDocument2 pagesTransformation ChimiquekhabbahsPas encore d'évaluation
- Rappels Cinetique ChimiqueDocument22 pagesRappels Cinetique ChimiqueSaid Soilihi ZayadPas encore d'évaluation
- Cours DosageDocument5 pagesCours DosageTEST - TESTPas encore d'évaluation
- Fiche Sur Notion Déquilibre ChimiqueDocument3 pagesFiche Sur Notion Déquilibre ChimiquechadaPas encore d'évaluation
- Suivi Temporel Et Vitesse de Reaction Cours Corrige Et CompleteDocument7 pagesSuivi Temporel Et Vitesse de Reaction Cours Corrige Et CompleteYassine RabikPas encore d'évaluation
- CM CHI 201 - 2022 Royal Partie 1Document53 pagesCM CHI 201 - 2022 Royal Partie 1Vera Legba-MonyPas encore d'évaluation
- Cours Et TDDocument29 pagesCours Et TDA100% (1)
- Chapitre I Thermochimie Grandeurs de RéactionDocument13 pagesChapitre I Thermochimie Grandeurs de RéactionyounessPas encore d'évaluation
- Chapitre 2Document4 pagesChapitre 2Moustapha Bassirou NianePas encore d'évaluation
- Transformation Chimiquebilan de MatièreDocument3 pagesTransformation Chimiquebilan de MatièreKamal LaourdaniPas encore d'évaluation
- Dosage Acidobasique 4eme ST1Document6 pagesDosage Acidobasique 4eme ST1Mouhamed Ali Sahbani100% (1)
- Cours Reacteur Homogene AdDocument33 pagesCours Reacteur Homogene AdBichou DerresPas encore d'évaluation
- 6 Réactions Acido-BasiqueDocument6 pages6 Réactions Acido-Basiqueateich simohamedPas encore d'évaluation
- Cinetique Chimique-1Document6 pagesCinetique Chimique-1EspoirPas encore d'évaluation
- Procédés ChimiquesDocument2 pagesProcédés ChimiquesKahil LaibPas encore d'évaluation
- Chapitre 9Document17 pagesChapitre 9Belinda DancheuPas encore d'évaluation
- CinetiqueDocument10 pagesCinetiqueVghjhPas encore d'évaluation
- 1 Bac Les Reactions Acido Basiques Cours 1Document6 pages1 Bac Les Reactions Acido Basiques Cours 1rihabPas encore d'évaluation
- Chimie CinetiqueDocument33 pagesChimie CinetiqueomraamPas encore d'évaluation
- Transformations Chimiques S Effectuant Dans Les 2 Sens Cours 1Document5 pagesTransformations Chimiques S Effectuant Dans Les 2 Sens Cours 1Ahmed Yassine NaciriPas encore d'évaluation
- CH2Document4 pagesCH2drissboum1bacPas encore d'évaluation
- Chap. 12-Évolution SpontanéeDocument1 pageChap. 12-Évolution SpontanéeBénédicte & Christophe MULLERPas encore d'évaluation
- C_3_4_Dyamiq_pt mat MBH.Document23 pagesC_3_4_Dyamiq_pt mat MBH.brendanhounsouPas encore d'évaluation
- Reactions de ComplexationDocument2 pagesReactions de ComplexationVghjhPas encore d'évaluation
- Cours Cinetique Chimique RMDocument11 pagesCours Cinetique Chimique RMUchiha SaadPas encore d'évaluation
- Cours Opérations UnitairesDocument28 pagesCours Opérations UnitairesCherif LaifaPas encore d'évaluation
- Complexes CDocument2 pagesComplexes CZikas NmirichPas encore d'évaluation
- Reactions Equilibrees 2022Document33 pagesReactions Equilibrees 2022Mira MslPas encore d'évaluation
- Chapitre IV Les Potentiels ThermodynamiqueDocument4 pagesChapitre IV Les Potentiels ThermodynamiqueDoudou AminePas encore d'évaluation
- Chapitre I Rappels Partie IDocument8 pagesChapitre I Rappels Partie IJojo BoubPas encore d'évaluation
- Description D'un Système Chimique en Réaction (1029)Document6 pagesDescription D'un Système Chimique en Réaction (1029)AxellePas encore d'évaluation
- Résumé Équilibre ChimiqueDocument4 pagesRésumé Équilibre ChimiqueMehdi BnmssdPas encore d'évaluation
- 3 Chimie Chap5 Cours de Cinetique ChimiqueDocument9 pages3 Chimie Chap5 Cours de Cinetique ChimiqueanaPas encore d'évaluation
- Cinétique 1Document21 pagesCinétique 1Closed WayPas encore d'évaluation
- Correction DC Nov 2023Document4 pagesCorrection DC Nov 2023tamersamira80Pas encore d'évaluation
- Cours Thermodynamique-ConvertiDocument45 pagesCours Thermodynamique-ConvertiRedOne DerrouazinPas encore d'évaluation
- 6.equilibre ChimiqueDocument3 pages6.equilibre ChimiqueDan GrigorePas encore d'évaluation
- Chapitre 3 RHDocument8 pagesChapitre 3 RHGp GpPas encore d'évaluation
- CristallinitéDocument295 pagesCristallinitéGp GpPas encore d'évaluation
- Chapitre 4 RHDocument16 pagesChapitre 4 RHGp GpPas encore d'évaluation
- Chapitre 2 RH CORRIGéDocument10 pagesChapitre 2 RH CORRIGéGp GpPas encore d'évaluation
- Chapitre II HYGIENE Et ERGONOMIE DU TRAVAILDocument7 pagesChapitre II HYGIENE Et ERGONOMIE DU TRAVAILGp GpPas encore d'évaluation
- Cours RisquechimiqueDocument10 pagesCours RisquechimiqueGp GpPas encore d'évaluation
- Cours RisquechimiqueDocument10 pagesCours RisquechimiqueGp GpPas encore d'évaluation
- Cours RisquechimiqueDocument10 pagesCours RisquechimiqueGp GpPas encore d'évaluation
- Extrude UseDocument3 pagesExtrude UseArt Mohamed IdrissiPas encore d'évaluation
- Solutions Polyéthylène À Différentes MassesDocument18 pagesSolutions Polyéthylène À Différentes MassesGp GpPas encore d'évaluation
- Devoir de MaisonDocument8 pagesDevoir de MaisonGp GpPas encore d'évaluation
- Cours Ethique DeonthologieDocument21 pagesCours Ethique DeonthologieSalah SparrowPas encore d'évaluation
- Cours Ethique DeonthologieDocument21 pagesCours Ethique DeonthologieSalah SparrowPas encore d'évaluation
- Technologie Des BoissonsDocument29 pagesTechnologie Des BoissonsGp Gp100% (3)
- PolymersDocument1 pagePolymersGp GpPas encore d'évaluation
- MinouDocument15 pagesMinouGp GpPas encore d'évaluation
- PolyDocument1 pagePolyGp GpPas encore d'évaluation
- Osmose Inerse 10000000000Document29 pagesOsmose Inerse 10000000000Gp GpPas encore d'évaluation
- OsmosDocument1 pageOsmosGp GpPas encore d'évaluation
- OsmosDocument1 pageOsmosGp GpPas encore d'évaluation
- Catalogo Reductor Serie TA PDFDocument33 pagesCatalogo Reductor Serie TA PDFFabian Ariza ArizaPas encore d'évaluation
- Fascicule de Cours Chimie TL2 PDFDocument45 pagesFascicule de Cours Chimie TL2 PDFkountiyou100% (1)
- Diagramme de Lair Humide CosticDocument4 pagesDiagramme de Lair Humide CosticSissy carburePas encore d'évaluation
- Champ ElectrostatiqueDocument4 pagesChamp ElectrostatiqueDavePas encore d'évaluation
- TP N 3 Chimie Sem1 2022 Compte RenduDocument2 pagesTP N 3 Chimie Sem1 2022 Compte RenduHîş TörîăPas encore d'évaluation
- Cours Transfert de Chaleur - 1Document20 pagesCours Transfert de Chaleur - 1CHaima GHzayelPas encore d'évaluation
- La DensitéDocument5 pagesLa Densité213020 213020Pas encore d'évaluation
- Lecon 4 de 4eme Air Qui Nous EntoureDocument17 pagesLecon 4 de 4eme Air Qui Nous EntouredocittoPas encore d'évaluation
- CorrosionDocument81 pagesCorrosionzay yassinePas encore d'évaluation
- Cinétique Chimique App PDFDocument6 pagesCinétique Chimique App PDFAzizElheni100% (1)
- Introduction À La Biophysique de La Circulation Sanguine-OkDocument13 pagesIntroduction À La Biophysique de La Circulation Sanguine-OkMohamedBahmed0% (1)
- LocatorDocument8 pagesLocatorChokri SahbaniPas encore d'évaluation
- TD A11 04 Adaptation ImpedanceDocument2 pagesTD A11 04 Adaptation ImpedanceMariam Zouhair100% (1)
- PI F GLUC - GOD - 5 9Document2 pagesPI F GLUC - GOD - 5 9Khouloud GhribiPas encore d'évaluation
- Chp3 de L'atome À L'élément Chimique TD Structure de L'atomeDocument1 pageChp3 de L'atome À L'élément Chimique TD Structure de L'atomelmarin1607Pas encore d'évaluation
- S SVT Specialite 2013 Metropole Remplacement SujetDocument4 pagesS SVT Specialite 2013 Metropole Remplacement SujetSpøtííFÿ MødPrēmīūmPas encore d'évaluation
- ThermodynamiqueDocument10 pagesThermodynamiqueMira MiellaPas encore d'évaluation
- Cours L1 DynamiqueDocument76 pagesCours L1 DynamiqueLē JøkērPas encore d'évaluation
- DS 5 SM 2018Document5 pagesDS 5 SM 2018Med Brini100% (1)
- Lixiviation CardeDocument2 pagesLixiviation CardeBenharzallah KrobbaPas encore d'évaluation
- Structure de La MatièreDocument115 pagesStructure de La MatièreYoussef NajihPas encore d'évaluation
- TP1°°°2Document7 pagesTP1°°°2Ilyes Bzn100% (1)
- Constante PhysiqueDocument3 pagesConstante PhysiqueTheo WanPas encore d'évaluation
- Inj Benbia Leila PDFDocument66 pagesInj Benbia Leila PDFHassani MohamedPas encore d'évaluation
- COR 306 - Plan de Cours - Hiver 2011Document4 pagesCOR 306 - Plan de Cours - Hiver 2011hhedfiPas encore d'évaluation
- CNC 2022 Mécanique de FluidesDocument6 pagesCNC 2022 Mécanique de Fluidesomarboulakhrif7Pas encore d'évaluation
- Traitement Et Conditionnement Des Eaux de Process - 111438Document33 pagesTraitement Et Conditionnement Des Eaux de Process - 111438Aisaoua BuobouPas encore d'évaluation
- Memoire de Magister - Amini Ali-Genie Civil-17-06-2010 PDFDocument126 pagesMemoire de Magister - Amini Ali-Genie Civil-17-06-2010 PDFBRAHIMI AbdelmalekPas encore d'évaluation
- AMDEC OriginalDocument6 pagesAMDEC Originalabdoulaye sane100% (1)
- Projet: Les Chaussées Rigides: Module: Infrastructure Des TransportDocument25 pagesProjet: Les Chaussées Rigides: Module: Infrastructure Des TransportZina Rayene BOUDIBPas encore d'évaluation
- Harmonisation Energétique des Personnes: Manuel de Curothérapie 2020D'EverandHarmonisation Energétique des Personnes: Manuel de Curothérapie 2020Évaluation : 4 sur 5 étoiles4/5 (8)
- Le profilage au service du football: Démarche scientifique pour un recrutement et entraînements optimisésD'EverandLe profilage au service du football: Démarche scientifique pour un recrutement et entraînements optimisésPas encore d'évaluation
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Force Mentale et Maîtrise de la Discipline: Renforcez votre Confiance en vous pour Débloquer votre Courage et votre Résilience ! (Comprend un Manuel Pratique en 10 Étapes et 15 Puissants Exercices)D'EverandForce Mentale et Maîtrise de la Discipline: Renforcez votre Confiance en vous pour Débloquer votre Courage et votre Résilience ! (Comprend un Manuel Pratique en 10 Étapes et 15 Puissants Exercices)Évaluation : 4.5 sur 5 étoiles4.5/5 (28)
- Essai sur le libre arbitre: Premium EbookD'EverandEssai sur le libre arbitre: Premium EbookÉvaluation : 4 sur 5 étoiles4/5 (1)
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Le livre de la mémoire libérée : Apprenez plus vite, retenez tout avec des techniques de mémorisation simples et puissantesD'EverandLe livre de la mémoire libérée : Apprenez plus vite, retenez tout avec des techniques de mémorisation simples et puissantesÉvaluation : 4 sur 5 étoiles4/5 (6)
- Manuel de fabrication du savon: Je fabrique mes savons facilementD'EverandManuel de fabrication du savon: Je fabrique mes savons facilementÉvaluation : 5 sur 5 étoiles5/5 (4)
- La Pensée Positive en 30 Jours: Manuel Pratique pour Penser Positivement, Former votre Critique Intérieur, Arrêter la Réflexion Excessive et Changer votre État d'Esprit: Devenir une Personne Consciente et PositiveD'EverandLa Pensée Positive en 30 Jours: Manuel Pratique pour Penser Positivement, Former votre Critique Intérieur, Arrêter la Réflexion Excessive et Changer votre État d'Esprit: Devenir une Personne Consciente et PositiveÉvaluation : 4.5 sur 5 étoiles4.5/5 (12)
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- 160 ressources pour se lancer dans la vidéo quand on n’y connait rienD'Everand160 ressources pour se lancer dans la vidéo quand on n’y connait rienPas encore d'évaluation
- Hypnotisme et Magnétisme, Somnambulisme, Suggestion et Télépathie, Influence personnelle: Cours Pratique completD'EverandHypnotisme et Magnétisme, Somnambulisme, Suggestion et Télépathie, Influence personnelle: Cours Pratique completÉvaluation : 4.5 sur 5 étoiles4.5/5 (8)
- Enseigner une Langue Etrangère Par l’Apprentissage HybrideD'EverandEnseigner une Langue Etrangère Par l’Apprentissage HybridePas encore d'évaluation
- Anatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursD'EverandAnatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursPas encore d'évaluation
- Le rêve et son interprétation: un essai de Sigmund Freud sur l'interprétation des rêvesD'EverandLe rêve et son interprétation: un essai de Sigmund Freud sur l'interprétation des rêvesPas encore d'évaluation
- L'Interprétation des rêves de Sigmund Freud: Les Fiches de lecture d'UniversalisD'EverandL'Interprétation des rêves de Sigmund Freud: Les Fiches de lecture d'UniversalisPas encore d'évaluation
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- Cancer - Leucémie: Et autres maladies apparemment incurables, mais guérissables avec des moyens naturelsD'EverandCancer - Leucémie: Et autres maladies apparemment incurables, mais guérissables avec des moyens naturelsPas encore d'évaluation