Académique Documents
Professionnel Documents
Culture Documents
TP Mesure de L'absorbance
Transféré par
Oum AmnaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
TP Mesure de L'absorbance
Transféré par
Oum AmnaDroits d'auteur :
Formats disponibles
TP Absorbance d’une solution - Dosage d’une solution colorée
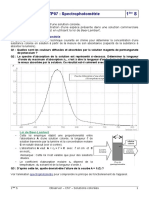
I. Spectre d’absorption d’une solution colorée
Spectre d’absorption d’une solution de bleu de méthylène
λ (nm)
Nous allons ensemble obtenir le spectre d’absorption d’une solution de bleu de méthylène de
concentration massique to = 10 mg/L.
La longueur d’onde au maximum d’absorption λm= ………….
Cette longueur d’onde sera choisie comme longueur d’onde de travail.
II. Dosage d’une solution inconnue de bleue de méthylène par étalonnage
1. Préparation d’une échelle de teinte
A partir de la solution mère de bleu de méthylène de concentration massique t = 10 mg/L, on souhaite
réaliser une échelle de teinte constituée de 6 tubes à essai de volume 10mL :
a. Retrouver la relation entre la concentration massique t (g/L), la concentration molaire C (mol/L) et la
masse molaire M (g/mol)
b. Calculer la masse molaire M du bleu de méthylène de formule brute C16H18ClN3S
données :
M(C)=12,0 g.mol-1
M(H)=1,0 g.mol-1
M(Cl)=35,5 g.mol-1
M(N)=14,0 g.mol-1
M(S)=32,1 g.mol-1
TP Absorbance d’une solution – Dosage d’une solution colorée page 1 sur 4
c. Compléter le tableau suivant (sauf la dernière ligne) :
Numéro de la solution 0 1 2 3 4 5 6
Volume de la solution
0 1 2 4 6 8 10
mère prélevé (mL)
Volume d’eau ajoutée
10 9 8 6 4 2 0
(mL)
Volume de la solution
10 10 10 10 10 10 10
diluée (mL)
Facteur de dilution F
(sans unité)
Concentration molaire
C (mol/L)
Absorbance A 0 0,149 0,317 0,668 0,935 1,248 1,481
d. Préparer les 7 solutions dans 7 tubes à essai.
e. Mesurer l’absorbance de chaque solution à la longueur d’onde de travail et complétez la dernière
ligne du tableau. (elles sont déjà dans le tableau)
2. Tracé d’une courbe d’étalonnage
a. Tracer sur papier millimétré la courbe d’étalonnage A = f(C)
3. Dosage d’une solution inconnue de bleu de méthylène
a. Mesurer l’absorbance de la solution inconnue à la longueur d’onde de travail. A = 460
b. Graphiquement déduisez-en la concentration C de la solution inconnue.
4. Question supplémentaires
a. Calculez d’après la courbe le coefficient de proportionnalité entre l’absorbance A et la concentration
molaire C.
b. Déduisez des questions 3.a et 4.a la valeur de la concentration molaire C de la solution inconnue.
TP Absorbance d’une solution – Dosage d’une solution colorée page 2 sur 4
Annexe
Principe de la mesure de l’absorbance A d’une solution colorée
On utilise comme matériel un spectrophotomètre.
Le spectrophotomètre sélectionne une radiation monochromatique
(une seule longueur d’onde λ) à travers une cuve de longueur l
de solution et mesure l'absorbance A de la solution.
lumière blanche réseau par réflexion (dispersion)
fente
IO I détecteur
miroir (réflexion)
cuve de longueur l
L'absorbance Aλ dépend de la couleur de la radiation, de sa longueur d’onde λ.
Soit Io l'intensité de la lumière incidente et I l'intensité de la lumière transmise à la longueur d’onde λ.
Le spectrophotomètre compare I et Io et calcule l’absorbance A = - log . (formule à ne pas connaître)
Il faut régler le zéro en plaçant le solvant (eau) dans la cuve. L'absorbance A doit être nulle.
L’absorbance ne peut prendre que des valeurs allant de 0 à 2.
Dilution
Au cours d’une dilution, le volume de solvant augmente, la concentration de l’espèce dissoute diminue et
la quantité de matière de l’espèce dissoute reste constante n = no.
On dilue une solution mère de concentration molaire Co de volume Vo pour obtenir une solution fille de
concentration molaire C de volume V.
La relation entre C, V Co et Vo est Co × Vo = C × V
Facteur de dilution
On définit le facteur de dilution F (sans unité) (exemple F=5 solution diluée 5 fois) comme le quotient de
Co par C.
Co
On en déduit que = =
C o
TP Absorbance d’une solution – Dosage d’une solution colorée page 3 sur 4
Graphique
TP Absorbance d’une solution – Dosage d’une solution colorée page 4 sur 4
Vous aimerez peut-être aussi
- Les Prodigieuses Victoires de La Psychologie - Pierre DacoDocument510 pagesLes Prodigieuses Victoires de La Psychologie - Pierre DacoMohammed Mankour100% (11)
- Spectrophotometrie MnO4Document4 pagesSpectrophotometrie MnO4Anaëlle Avril88% (8)
- TP - Spectroscopie UV-VisibleDocument4 pagesTP - Spectroscopie UV-Visibleelhidhab201488% (8)
- TP Chimie 1 ExercicesDocument33 pagesTP Chimie 1 ExercicesNidal Hellal100% (1)
- TP1 Chimie 2 (2022-2023)Document3 pagesTP1 Chimie 2 (2022-2023)Native Emerick Kokea TielaPas encore d'évaluation
- Dosage Spectrophotomètrique (Méthyle Orange) TP Chimie 2Document2 pagesDosage Spectrophotomètrique (Méthyle Orange) TP Chimie 2Ł'azălée S'ň0% (1)
- Annalee 214Document16 pagesAnnalee 214Zineb KhadranePas encore d'évaluation
- Annale Chimie 1Document16 pagesAnnale Chimie 1Sinem SinemPas encore d'évaluation
- Chapitre 4 Les Dosages Spectrophotométriques - ProfDocument5 pagesChapitre 4 Les Dosages Spectrophotométriques - Profdorcaslisa15Pas encore d'évaluation
- Cellule Mixte 3emDocument1 pageCellule Mixte 3emabdoulayewatt726Pas encore d'évaluation
- Chapitre 2 Dosage Sprectrophotom Trique PROFDocument4 pagesChapitre 2 Dosage Sprectrophotom Trique PROFzabsi533Pas encore d'évaluation
- DS 3 B - CorrigéDocument11 pagesDS 3 B - Corrigéhedidbz38Pas encore d'évaluation
- 2021 09 Metro Sujet1 ExoA Correction Encre BeerCinetique 5ptsDocument4 pages2021 09 Metro Sujet1 ExoA Correction Encre BeerCinetique 5ptsClémentine TakumiPas encore d'évaluation
- Chimie Seances 1234Document148 pagesChimie Seances 1234HIBA BOUKELLOUCHEPas encore d'évaluation
- DS1spe 1Document2 pagesDS1spe 1zaydscameurPas encore d'évaluation
- Université Batna 2 Département D'électroniqueDocument4 pagesUniversité Batna 2 Département D'électroniqueAbdealaziz BouhoreiraPas encore d'évaluation
- Tdserie1m1baequi - Hydro .ElectDocument12 pagesTdserie1m1baequi - Hydro .ElectLinda KoundziPas encore d'évaluation
- TP Dosage Dakin CorrectionDocument3 pagesTP Dosage Dakin CorrectionŚà Ĺãh ĎķłPas encore d'évaluation
- TP 2 Tda L3 GDPDocument3 pagesTP 2 Tda L3 GDPLina alikh100% (2)
- TP 2 Tda l3 Gdp-1Document3 pagesTP 2 Tda l3 Gdp-1Mål ÆkPas encore d'évaluation
- TP 2 Tda L3 GDPDocument3 pagesTP 2 Tda L3 GDPMål ÆkPas encore d'évaluation
- 95p3w td1Document4 pages95p3w td1abdellah elghebouli100% (1)
- Exercices Solutions Dilutionscor PDFDocument4 pagesExercices Solutions Dilutionscor PDFans1390Pas encore d'évaluation
- Fiches de TP Chimie 1ère Année (Toute L'année)Document12 pagesFiches de TP Chimie 1ère Année (Toute L'année)Riadh Marouani100% (2)
- Spectro Kmno4Document1 pageSpectro Kmno4sihem ayadiPas encore d'évaluation
- 2021 09 Metro Sujet2 Exo1 Encre BeerCinetique 5ptsDocument3 pages2021 09 Metro Sujet2 Exo1 Encre BeerCinetique 5ptsYassinePas encore d'évaluation
- Docs Remed CHDocument10 pagesDocs Remed CHhoucem addinePas encore d'évaluation
- CHAP 11 Les SolutionsDocument4 pagesCHAP 11 Les Solutionshepived840Pas encore d'évaluation
- Chapitre SolutionDocument7 pagesChapitre SolutionDenisco NkemgnePas encore d'évaluation
- ch1 Qtite de MatDocument3 pagesch1 Qtite de MatYounes MAZOUAR0% (1)
- Les Dosages Ou Titrages Directs Exercices Non Corriges 1Document5 pagesLes Dosages Ou Titrages Directs Exercices Non Corriges 1Zeineb BiadPas encore d'évaluation
- TD Chimie Ana Lomé L2 2021Document12 pagesTD Chimie Ana Lomé L2 2021Bamon100% (2)
- SMPC S2 CHP 1 Chimie Des Solutions 21Document15 pagesSMPC S2 CHP 1 Chimie Des Solutions 21Abdelhakim BailalPas encore d'évaluation
- Présentation de Cours de Chimie de L'eau PDFDocument67 pagesPrésentation de Cours de Chimie de L'eau PDFMed Bidjel RamdhanePas encore d'évaluation
- TPC04 Dissolution-DilutionDocument1 pageTPC04 Dissolution-DilutionsimpledialoquePas encore d'évaluation
- Cours La MoleDocument27 pagesCours La Molevucamtu100% (3)
- Chapitre c1 La Mole Xbqi7xdwdpcDocument6 pagesChapitre c1 La Mole Xbqi7xdwdpcLouna Balotte FrugierPas encore d'évaluation
- Especes Chimiques en Solution AqueuseDocument7 pagesEspeces Chimiques en Solution AqueuseValéry Epee EbonguePas encore d'évaluation
- Notion de Concentration Et de Quantite de MatiereDocument8 pagesNotion de Concentration Et de Quantite de MatiereSimier NoéPas encore d'évaluation
- Chapitre IDocument12 pagesChapitre INak awadPas encore d'évaluation
- Fiche RevisionDocument4 pagesFiche Revisionmv9zrfr85xPas encore d'évaluation
- DIONE PC Fascicule de Sciences Physiques 3èmeDocument40 pagesDIONE PC Fascicule de Sciences Physiques 3èmesoda loPas encore d'évaluation
- Corrigé+sDocument7 pagesCorrigé+sMOHAMMEDMEJDOUBI100% (2)
- Biophysique2an ConcentrationsDocument62 pagesBiophysique2an Concentrationsapi-248201264Pas encore d'évaluation
- Chapitre I Expressions de Concentrations-1Document5 pagesChapitre I Expressions de Concentrations-1El HadiPas encore d'évaluation
- NYB Chap1Document19 pagesNYB Chap1LarusanPas encore d'évaluation
- Chap 2 Cours Complet EleveDocument3 pagesChap 2 Cours Complet EleveRblhPas encore d'évaluation
- 2008 National Exo1 Sujet BBT 6 5ptsDocument4 pages2008 National Exo1 Sujet BBT 6 5ptsmoezbouchnak80Pas encore d'évaluation
- AL7SP02TDPA0212 Sequence 05 PDFDocument110 pagesAL7SP02TDPA0212 Sequence 05 PDFjulyimadiPas encore d'évaluation
- 04TP Dosages EtalonnageDocument2 pages04TP Dosages EtalonnageAhmed 69Pas encore d'évaluation
- Chimie Des SolutionsDocument48 pagesChimie Des Solutionsabdelaziz malkiPas encore d'évaluation
- Bentalia Bilal TP Chimie AnDocument5 pagesBentalia Bilal TP Chimie AnNadji FenichiPas encore d'évaluation
- Serie TD Chimie Corrige l2Document14 pagesSerie TD Chimie Corrige l2bouaddouanisPas encore d'évaluation
- 2012 Pondichery Exo2 Sujet Spectrophotometrie 5 5ptsDocument4 pages2012 Pondichery Exo2 Sujet Spectrophotometrie 5 5ptsRafael CastilloPas encore d'évaluation
- Le Titrage VolumetriqueDocument4 pagesLe Titrage Volumetriquebira7965Pas encore d'évaluation
- Cours Chimie SolutionDocument47 pagesCours Chimie Solutionمحمد ريزقيPas encore d'évaluation
- La Concentration MolaireDocument2 pagesLa Concentration Molairecpm fessaisPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Conditionnement Et Conservation Des Produits AlimentairesDocument5 pagesConditionnement Et Conservation Des Produits AlimentairesOum AmnaPas encore d'évaluation
- Technologie Et QualitéDocument63 pagesTechnologie Et QualitéTCHEKPE MaximePas encore d'évaluation
- Cours Procédés de Conservation Des Produits AlimentairesDocument28 pagesCours Procédés de Conservation Des Produits AlimentairesOum AmnaPas encore d'évaluation
- Cours Statistique Descriptive L1SADocument73 pagesCours Statistique Descriptive L1SAOum AmnaPas encore d'évaluation
- Guide de Bonnes Pratiques Orientations Pour Une Meilleure Conservation Des DattesDocument37 pagesGuide de Bonnes Pratiques Orientations Pour Une Meilleure Conservation Des DattesOum AmnaPas encore d'évaluation
- Cours - Faradji-Hamma Samia - Techniques de Contrôle Microbiologique Des AlimentsDocument107 pagesCours - Faradji-Hamma Samia - Techniques de Contrôle Microbiologique Des AlimentsMusta AkromaPas encore d'évaluation
- Cours Isaet Conservation Denrées AnimalesDocument60 pagesCours Isaet Conservation Denrées AnimalesOum AmnaPas encore d'évaluation
- Guide de Planification Du Cours de Mécanique Appliquée en Première E, F1, MA, MEMDocument33 pagesGuide de Planification Du Cours de Mécanique Appliquée en Première E, F1, MA, MEMESSOME ESSOME OLIVIER STEPHANEPas encore d'évaluation
- Construire Des Tableaux de Bord Vraiment UtilesDocument149 pagesConstruire Des Tableaux de Bord Vraiment UtilesSébastien Amet100% (2)
- Initiation À La Prospection Aut2019Document4 pagesInitiation À La Prospection Aut2019Ali GuelmamiPas encore d'évaluation
- Questionnaire 2017Document85 pagesQuestionnaire 2017toto TOTOROTOPas encore d'évaluation
- Plan Detaille ReseauDocument1 pagePlan Detaille ReseaulaomatteoPas encore d'évaluation
- CRM en B To BDocument41 pagesCRM en B To BechnagesecrPas encore d'évaluation
- Analyse D'une Séquence de Les Glaneurs Et La GlaneuseDocument10 pagesAnalyse D'une Séquence de Les Glaneurs Et La GlaneuseMarina Calvo BritoPas encore d'évaluation
- TP HydropulseurDocument4 pagesTP HydropulseurcliorlPas encore d'évaluation
- Presentation Entree en RelationDocument36 pagesPresentation Entree en RelationIsmael NguetsopPas encore d'évaluation
- POO en PHP5Document3 pagesPOO en PHP5Bash SumerPas encore d'évaluation
- Chasse ShotshellsDocument12 pagesChasse Shotshells873258Pas encore d'évaluation
- BenchmarkingDocument47 pagesBenchmarkingJean-Paul LEGERPas encore d'évaluation
- GeomDocument28 pagesGeomIlyasse LemezaliPas encore d'évaluation
- La Liste Complète Des Verbes Irréguliers Anglais (+ Fiche PDF) - Lea-EnglishDocument21 pagesLa Liste Complète Des Verbes Irréguliers Anglais (+ Fiche PDF) - Lea-EnglishFreshPas encore d'évaluation
- Cours Réseaux MobilesDocument94 pagesCours Réseaux MobilesTig IkrPas encore d'évaluation
- Les 10 Cles Du Developpement Personnel 1Document28 pagesLes 10 Cles Du Developpement Personnel 1TAKAMPas encore d'évaluation
- Prob3-Ondes EM Plasma1 CorrigéDocument15 pagesProb3-Ondes EM Plasma1 CorrigéAymane ESSALIMPas encore d'évaluation
- R2AM - PDF Version 1 PDFDocument5 pagesR2AM - PDF Version 1 PDFÉlia BylkaPas encore d'évaluation
- CT1 CHAPITRE 1 Le MATERIAU TERREDocument15 pagesCT1 CHAPITRE 1 Le MATERIAU TERREGiser TakoustPas encore d'évaluation
- CredibilitéDocument132 pagesCredibilitéAssia BelhouchetPas encore d'évaluation
- Gaine Technique GazDocument8 pagesGaine Technique GazmohabentrPas encore d'évaluation
- Hyphotheses de La RDMDocument6 pagesHyphotheses de La RDMallaouiPas encore d'évaluation
- M'Hamed IssiakhemDocument257 pagesM'Hamed IssiakhemAdel BenzemaPas encore d'évaluation
- Le Monde Forestier: La Foresterie Urbaine Et La Santé HumaineDocument3 pagesLe Monde Forestier: La Foresterie Urbaine Et La Santé Humainekenfack sergePas encore d'évaluation
- 1-Terre Dans Le Système SolaireDocument35 pages1-Terre Dans Le Système SolaireSohaib SfPas encore d'évaluation
- MedjourDocument16 pagesMedjournadaPas encore d'évaluation
- Contribution À L'étude de La Gestion Des Ressources Humaines Et de L'intégration de La FormationDocument194 pagesContribution À L'étude de La Gestion Des Ressources Humaines Et de L'intégration de La FormationAmal Ben TaherPas encore d'évaluation
- BENJILALIDocument77 pagesBENJILALIelhagePas encore d'évaluation
- Fiche D'exercices N°2 - Notion de Fonction DérivéeDocument1 pageFiche D'exercices N°2 - Notion de Fonction Dérivéezelda wegrzyniakPas encore d'évaluation