Académique Documents
Professionnel Documents
Culture Documents
00 2183
Transféré par
hizballah27Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
00 2183
Transféré par
hizballah27Droits d'auteur :
Formats disponibles
Immunologie
B 320
Cellules T et immunité cellulaire
Récepteur T (structure, diversité, répertoire)
Antigènes de différenciation (CD4, CD8)
Activation
Cellules T auxiliaires et immunorégulation
Lymphokines (interférons,TNF, IL1, IL2, IL4)
et cytotoxicité
Concept de déficit de l’immunité cellulaire
PR Jean-François MOREAU, DR Julie DECHANET-MERVILLE, DR Jean-Luc TAUPIN
CNRS-UMR, 5540, groupe cytokines et transplantation, université Bordeaux 2, 33076 Bordeaux Cedex.
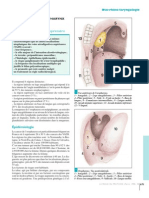
Points Forts à comprendre est en fait complexe et composée de plusieurs chaînes
protéiques transmembranaires dont les chaînes du CD3.
Les molécules du complexe TCR/CD3 à la
• L’immunité cellulaire désigne la réponse surface du lymphocyte T sont les éléments clés de la
immunitaire transférable par les seules cellules reconnaissance spécifique de l’antigène, de l’activation
de l’immunité et dans notre cas par les seuls et des fonctions lymphocytaires. Cependant, à côté de ce
lymphocytes T. complexe, il existe d’autres molécules jouant un rôle
• Elle n’est que la traduction des diverses dans la réponse fonctionnelle succédant à la reconnais-
fonctions des lymphocytes T, ce qui inclut sance antigénique, ce sont les molécules accessoires. La
par une action indirecte sur les lymphocytes B découverte progressive de ces différentes molécules pré-
le développement de l’immunité humorale sentes à la surface du lymphocyte T s’est faite grâce aux
désignant la part de la réponse immunitaire anticorps monoclonaux. Par leur propriété anticorps, ces
due aux immunoglobulines. outils servent à identifier les molécules à la surface des
cellules, mais aussi peuvent servir de sondes pour l’étu-
de du rôle de ces molécules. Initialement, les
molécules de surface étaient appelées par le nom de
Cellules T et immunité cellulaire l’anticorps la reconnaissant. Cependant, plusieurs labo-
ratoires pouvaient parler de la même molécule, mais
Le lymphocyte T reconnaît à la fois le peptide anti- avoir isolé des anticorps différents et leur avoir donné
génique et la molécule HLA (pour human leucocyte des noms différents. Cela rendait les échanges difficiles.
antigen) dans laquelle le peptide est enchâssé. Cette En 1980, une conférence internationale a homogénéisé
reconnaissance est rendue possible par la présence à sa la nomenclature en créant les CD, en français classe de
surface d’une molécule particulière appelée TCR (pour différenciation ou, en anglais, les clusters of differentiation.
T cell receptor) ou récepteur à l’antigène. Le TCR est Ils portent un numéro chronologique correspondant
une molécule variable à l’intérieur d’un même individu, grossièrement à l’ordre de leur découverte. Un même
mais tous les TCR d’un même lymphocyte sont identiques. numéro regroupe tous les anticorps reconnaissant une
La spécificité du système immunitaire repose entièrement même structure moléculaire, quand bien même l’épitope
sur la spécificité moléculaire du TCR vis-à-vis du com- reconnu est différent. Par extension, le nom de la molécule
plexe HLA + peptide présent à la surface de la cellule est le numéro de la classe de différenciation, précédé du
présentatrice de l’antigène (APC). Ainsi, à la variabilité sigle CD. C’est ainsi que l’on compte maintenant à peu
des antigènes parmi lesquels nous évoluons correspond près 200 classes de différenciation, débordant d’ailleurs
une variabilité du TCR. Cette molécule n’est présente le champ de l’immunologie. Les anciennes terminologies
qu’à la surface du lymphocyte T, à l’exclusion de toute doivent être abandonnées, mais l’on retrouve encore
autre cellule de l’organisme. Cette entité membranaire parfois T3, T4 ou T8 pour CD3, CD4 ou CD8.
LA REVUE DU PRATICIEN 2000, 50 2183
CELLULES T ET IMMUNITÉ CELLULAIRE
Récepteur T Diversité du TCR et répertoire
Pour simplifier le problème nous laisserons de côté les
Structure du récepteur T à l’antigène (TCR) gènes codant les chaînes du TCR γ/δ qui sont organisés
Tout a commencé par la production au début des de façon similaire à ceux codant les chaînes α/β. Les
années 1980 d’anticorps capables de reconnaître des gènes codant pour les chaînes α et β du TCR sont orga-
molécules présentes à la surface de certains lympho- nisés comme ceux codant les immunoglobulines. Si l’on
cytes T et qui pouvaient répondre à la définition de définit le lymphocyte T comme la cellule capable de
molécules spécifiques d’un clone cellulaire. Ces anti- reconnaître le peptide antigénique, il exprime donc, par
corps dénommés clonotypiques reconnaissaient une définition, un TCR/CD3 fonctionnel en surface. Or ce
molécule hétérodimérique glycosylée dénommée alors TCR, par essence, est variable puisque telle la clé dans
chaînes α et β. Après digestion protéique et analyse des la serrure, un TCR doit être spécifique d’un antigène par-
fragments obtenus, les molécules isolées de clones ticulier. Il existe donc des caractéristiques uniques des
lymphocytaires T ayant des spécificités différentes se gènes codant ces molécules afin de créer cette diversité
montrèrent particulièrement polymorphes, suggérant moléculaire au niveau du génome des chordés. En effet,
une nature proche de celles des immunoglobulines. Puis c’est le génome cellulaire lui-même qui est altéré dans
des approches de biologie moléculaire isolèrent les le sens de la diversité, faisant presque de chaque lym-
gènes codant ces polypeptides démontrant leur nature phocyte T un lymphocyte T unique au niveau de son
hétérogène. On connaît maintenant 4 chaînes qui TCR (tous les TCR d’une même cellule étant parfaite-
s’associent 2 à 2. Sur la majorité des lymphocytes T ment identiques). Comme les capacités du système sont
(95 %) il s’agit de l’hétérodimère α/β, et sur moins de très importantes pour générer cette diversité, il en résulte
5 % d’entre eux de l’hétérodimère γ/δ. La preuve défini- que statistiquement presque tous les lymphocytes expri-
tive qu’il s’agit bien là de la structure moléculaire ment en surface des TCR différents.
dictant la spécificité immunologique des lymphocytes T
est apportée par les expériences de transfection d’acide 1. Diversité combinatoire
désoxyribonucléique (ADN) codant ces protéines qui À quelques différences près l’organisation des gènes
confèrent à la cellule transfectée la spécificité anti- codant les chaînes α et β du TCR est similaire et com-
génique. posite. Elle suit en cela l’organisation en domaines que
Toutes les chaînes du TCR ont une structure primaire nous avons déjà décrite au niveau de la protéine. Ainsi
similaire avec un segment V, éventuellement un segment D chaque domaine est codé par un gène propre qui chacun,
dans le cas des chaînes β et δ seulement, un segment J et mis les uns à côté des autres lors d’un processus géné-
un segment constant C, ce qui les rend très similaires tique appelé réarrangement, va donner le gène définitif
aux immunoglobulines dans leur architecture. Le poids codant une des chaînes du TCR. L’ensemble des gènes
moléculaire est d’environ 40 000 pour chaque chaîne. V, J et C codant pour la chaîne α sont sur le chromosome
Au niveau protéique, la région constante pour les 14, alors que ceux codant pour les segments V, D, J, et C
chaînes α est unique et il en existe aussi une unique mais de la chaîne β sont sur le chromosome 7.
différente pour les chaînes β. Elle comporte une région Le gène codant la région constante est soit unique
charnière avec une cystéine permettant un pont disulfure (chaînes α) soit double (chaînes β) et il code la portion
entre les 2 chaînes. Puis vient ensuite une région trans- constante extracytoplasmique de la molécule, une
membranaire hydrophobe contenant des acides aminés région charnière présentant le pont disulfure permettant
chargés positivement permettant une interaction électro- l’hétérodimérisation des 2 chaînes, la région intramem-
statique avec les portions intramembranaires des molé- branaire, et la région intracytoplasmique.
cules composant le CD3 qui sont chargées négativement Il existe aussi des gènes J au nombre d’une cinquantaine
(voir : Pour approfondir). Le segment intracytoplas- de gènes différents codant la région J α et une douzaine
mique est très court et ne permet pas en lui-même la pour la région J β. Ils sont en général situés en amont
transduction du signal. des gènes C. Puis il existe des gènes D. Ils codent pour
Dans la structure repliée telle qu’elle se présente dans quelques acides aminés entre le domaine V et le
l’espace, 4 régions en boucle sont importantes à domaine J. Il en existe 2 et seulement pour la chaîne β.
considérer et se retrouvent voisines les unes des autres Cependant ils peuvent être répétés et mis à l’envers lors
spatialement. Trois représentent les CDR (1, 2 et 3) ou du processus de réarrangement, ce qui augmente
complementary determining regions. Ce sont ces 6 considérablement la possibilité de diversification de la
boucles, 3 pour la chaîne α et 3 pour la chaîne β qui protéine β finale. Les gènes V sont en général situés en
entrent en contact avec le peptide antigénique et les amont des gènes J ou D quand ils existent, et sont au
berges du sillon de la molécule du complexe majeur nombre d’une cinquantaine pour le locus β et pour le
d’histocompatibilité (CMH). La 4e boucle située à l’ex- locus α. Un point important à considérer est le fait que
térieur des 3 autres représente la zone d’interaction avec le locus δ est entièrement compris entre les gènes J et les
les superantigènes. La portion variable de l’hétérodimère gènes V codant la chaîne α, ce qui fait que, comme nous
se comporte donc dans l’espace en gros comme un allons le voir, lorsque le locus α se réarrange, il y a obli-
fragment F(ab) d’immunoglobuline. gatoirement excision et perte définitive du locus δ, ce qui
2184 LA REVUE DU PRATICIEN 2000, 50
Immunologie
fait que les lymphocytes T ayant réarrangé les gènes α, au hasard un certain nombre de nucléotides de chaque
ne peuvent exprimer l’hétérodimère γ/δ. extrémité en présence (V et J), puis en rajouter de nou-
Les mécanismes de réarrangement du TCR sont iden- veaux dans des proportions différentes. Ce qui fait que
tiques à ceux qui se produisent dans le lymphocyte B la jonction entre les segments V et J est particulièrement
pour la production des immunoglobulines. Ils sont sous diverse et due au seul hasard. C’est la diversité jonction-
le contrôle de l’accessibilité des régions à réarranger nelle.
(acétylation et désacétylation des histones des nucléo- L’ensemble des lymphocytes T d’un individu peut ainsi
somes) et sous le contrôle transcriptionnel et la production être considéré comme une collection de lymphocytes
des enzymes de recombinaison (recombinases RAG-1 presque tous différents au niveau du TCR, et ayant
et 2) permettant le réarrangement ordonné. La génération chacun une capacité unique à reconnaître un antigène
des lymphocytes T est particulièrement complexe et ne donné, ce qui constitue le « répertoire » d’un individu.
sera pas abordée ici. Elle a lieu uniquement dans Il faut bien réaliser que c’est le génome même de la
l’environnement thymique T. Nous prendrons pour cellule qu’il s’agit de modifier de façon aléatoire mais
exemple le réarrangement du locus β. définitive (ce qui est unique parmi les cellules soma-
Un élément Vβ et un Jβ vont être choisis au hasard et mis tiques), la régulation de ces mécanismes étant heureu-
l’un à côté de l’autre grâce à des séquences nucléoti- sement puissante mais très complexe. Cela n’empêche
diques cibles et aux recombinases RAG-1 et 2 qui recon- pas que des « ratées » se produisent amenant des
naissent ces sites spécifiques sur l’ADN. La séquence translocations anormales et variées à l’origine de
d’ADN comprise entre ces 2 sites maintenant à proximi- tumeurs du système immunitaire. De la même façon,
té forme une boucle qui est alors excisée. Ce qui donne lorsqu’il existe des altérations intrinsèques de ces méca-
d’une part un morceau d’ADN circulaire qui est ensuite nismes comme dans certaines maladies congénitales,
perdu, et le reste du génome avec les 2 gènes Vβ et Jβ il y a un retentissement important de type déficits sur le
l’un à côté de l’autre. système immunitaire avec des retombées carcinologiques.
Puis un gène C va être rattaché au tout, pour donner un
gène fonctionnel β. Tout l’ADN qui existe entre les
gènes qui sont choisis est définitivement perdu. Antigène de différenciation
Cependant le lymphocyte peut réarranger plusieurs fois, CD4 et CD8
tant qu’il y a des gènes V disponibles en amont et des
gènes J disponibles en aval. En fait, jusqu’à obtenir une Ce sont des glycoprotéines exprimées en général de
protéine fonctionnelle, sans quoi, faute de recevoir des façon mutuellement exclusives sur 2 sous-populations
signaux de la part de ce récepteur, il meurt dans le thymus. de lymphocytes T matures fonctionnellement diffé-
La présence d’un TCR fonctionnel à la membrane du rentes. Ces molécules facilitent l’interaction du lympho-
lymphocyte commande donc la génération de ces cel- cyte T avec la cellule présentative de l’antigène ou dans
lules. Un réarrangement fonctionnel d’un chromosome le cas de lymphocytes T cytotoxiques avec la cible lors
entraîne l’inactivation du réarrangement de l’autre, sauf d’un contact secondaire. En se liant aux ligands inva-
pour le locus α. C’est l’exclusion allélique qui existe riables que représentent les domaines invariants des
aussi avec la recombinaison des gènes des immuno- molécules du complexe majeur d’histocompatibilité sur
globulines et qui permet qu’une cellule n’exprime les cellules présentatives de l’antigène, elles augmentent
qu’une chaîne β, mais éventuellement 2 chaînes α, ce l’avidité du lymphocyte T vis-à-vis des cellules présen-
qui fait 2 TCR au plus à la surface, avec 2 possibilités de tatives de l’antigène en complémentant l’affinité du TCR
reconnaissance différente potentielle. La loterie combi- pour le CMH + peptide. CD4 et CD8 sont des molécules
natoire qui consiste à « choisir » parmi un très grand différentes, mais qui ont des fonctions similaires. Le
nombre de possibilités les différents segments requis rapport entre les cellules CD4+/CD8+ est de 2 chez un
pour aboutir au gène fonctionnel constitue la variabilité individu normal, mais les variations peuvent être assez
combinatoire. larges.
2. Diversité jonctionnelle
CD4
Comme nous l’avons mentionné au chapitre structure,
les boucle protéiques CDR1, 2 et 3 sont importantes car C’est une glycoprotéine transmembranaire, monomé-
ce sont elles qui contactent soit les bords du sillon pour rique, exprimée par les lymphocytes T périphériques et
les CDR1 et 2, soit le peptide antigénique pour le les thymocytes. Chez l’homme, elle est faiblement
CDR3. Si dans l’espace ces 3 boucles sont les unes à exprimée sur d’autres cellules de l’organisme dont les
côté des autres, au niveau du gène et donc de la structure monocytes/macrophages et les cellules dendritiques.
primaire de la protéine, il en va différemment. Ainsi, Elle est composée de 4 domaines de type immuno-
c’est le segment J et éventuellement D qui codent le globuline pour la partie extracellulaire, une portion
CDR3, alors que les CDR1 et 2 sont codés sur la transmembranaire, et une queue intracytoplasmique.
portion V. Or au moment de la mise côte à côte des Cette protéine est codée sur le chromosome 12.
segments Jα et Vα ou Dβ-Jβ et Vβ et de leur « soudure », Cette molécule reconnaît et se lie par ses 2 domaines
il existe des mécanismes enzymatiques qui vont exciser distaux avec la portion invariante proche de la membrane
LA REVUE DU PRATICIEN 2000, 50 2185
CELLULES T ET IMMUNITÉ CELLULAIRE
des molécules du CMH de classe II, et spécifiquement Molécules de costimulation ou coactivation
avec le domaine β 2 de la chaîne β. Elle stabilise ainsi
l’interaction cellulaire entre lymphocyte T et cellules Ce sont des molécules fondamentales pour une pleine et
présentatrices de l’antigène lors de l’activation. Cette complète activation du lymphocyte T par le TCR, et
interaction qui est indépendante du peptide est donc donc l’antigène. Elles vont : abaisser le seuil de stimula-
particulièrement importante lorsque l’affinité du TCR tion de la cellule par le peptide antigénique, permettre la
pour le complexe MHC de classe II + peptide est natu- prolifération clonale, inhiber des phénomènes de régulation
rellement faible. Dans ces cas, si l’on rajoute aux négative, permettre la différenciation du lymphocyte T.
cellules un anti-CD4, on abroge l’activation du lympho- Leur présence et leurs fonctions permettent d’expliquer
cyte T car l’interaction CD4/CMH est annulée faute la tolérance périphérique. En effet, si pour une quelconque
d’atteindre le seuil d’affinité nécessaire. raison, suite à une mise en jeu du TCR, les signaux de
L’activation du lymphocyte T repose sur l’activation de costimulation ne l’accompagnent pas, le lymphocyte T,
kinases intracytoplasmiques en cascade, ce qui aboutit à au lieu de s’activer, est paralysé, il devient inactif. On
l’activation de facteurs de transcription régulant l’ex- parle alors d’anergie. Le lymphocyte T se doit donc
pression de certains gènes ou à la régulation du cycle d’interagir avec les « bonnes cellules » présentatrices de
cellulaire permettant ainsi à la cellule, par exemple, soit l’antigène, c’est-à-dire les cellules exprimant les ligands
de sécréter des médiateurs, soit d’exprimer de nouvelles des récepteurs des signaux de costimulation présents sur
molécules à sa surface ou bien encore de se multiplier sa membrane, pour l’initiation d’une réponse immunitaire
pour réaliser l’amplification clonale nécessaire à la réac- active. En pratique, ce sont les cellules dendritiques
tion immunitaire. Le CD4 est associé par son segment et leurs dérivés, les monocytes/macrophages et leurs
intracytoplasmique à l’une de ces kinases qui, lors- dérivés, les lymphocytes B, qui vont remplir ce rôle.
qu’elles sont activées, permettent l’activation cellulaire Le nombre de ces molécules coactivatrices est grand,
(p56lck). Lors du rapprochement entre le lymphocyte T mais quelques-unes sont essentielles à connaître (voir :
et la cellule présentatrice de l’antigène, le complexe Pour approfondir 2).
TCR/CD3 se retrouve géographiquement associé au
CD4 ou au CD8 sur la surface cellulaire, si bien que
sous la membrane les kinases sont, elles aussi, regrou- Activation
pées dans un même lieu et peuvent donc interagir pour
initier les premières phases de l’activation cellulaire. L’affinité avec laquelle le TCR α/β peut reconnaître un
Enfin le CD4 est la molécule sur laquelle se fixe la peptide antigénique lié à un MHC est faible, de l’ordre
gp120 du virus de l’immunodéficience humaine, permet- de 100 à 1 000 fois plus faible que celle d’un anticorps
tant ainsi la pénétration de la capside virale à l’intérieur pour un antigène. D’autre part le CMH + peptide ne se
des cellules CD4+ après fusion de l’enveloppe et de la comporte pas comme un aimant vis-à-vis du TCR. Mais
membrane de la cellule cible. cette interaction est la dernière phase moléculaire d’un
enchaînement d’étapes complexes comprenant le rap-
CD8 prochement du lymphocyte T de la cellule présentatrice
de l’antigène via les molécules d’adhésion, la création
Il s’agit toujours d’un dimère, mais qui peut être d’une interface membranaire entre les 2 cellules
variable dans sa composition car il existe 2 chaînes impliquant une réorganisation moléculaire importante
protéiques distinctes, α et β. Sur les lymphocytes T péri- des 2 membranes en contact aboutissant à ce que
phériques portant un TCR de type α/β, c’est l’hétérodimère l’on appelle maintenant la « synapse immunologique »
CD8 α/β qui est présent. Les 2 chaînes sont liées par un par analogie au système nerveux. Au cours de ces
pont disulfure. Par contre sur les lymphocytes T portant processus, les TCR d’une cellule vont migrer et se
un TCR γ/δ, c’est un homodimère CD8 α/α qui est concentrer au site de contact entre les 2 cellules, permet-
retrouvé. C’est aussi le cas pour les thymocytes et les tant ainsi, en dépit de l’affinité intrinsèque faible et
cellules natural killer CD8+. La chaîne β n’est jamais grâce à la loi d’action de masse, une interaction possible
exprimée seule. Lors d’un phénotypage des lymphocytes T, avec les CMH + peptides qui en font de même sur la
on emploie généralement un anticorps reconnaissant cellule présentatrice de l’antigène. Cette interaction est
exclusivement la chaîne α. En pratique donc, la notion labile avec des caractéristiques d’association et de
de CD8 équivaut à la chaîne α. dissociation variables d’un TCR à l’autre aboutissant,
À l’exception du virus de l’immunodéficience humaine tant que la synapse existe, à une sorte de palpation du
(VIH), ce sont exactement les mêmes fonctions que pour sillon du CMH et du peptide antigénique par les 2 CDR 1,
le CD4, sauf que dans ce cas, la chaîne CD8 α se lie à la les 2 CDR2, et les 2 CDR3 du TCR. Ce sont les caracté-
portion invariante de la chaîne lourde des MHC de classe I, ristiques subtiles de cette interaction qui permettent
c’est-à-dire au domaine α 3 proximal à la membrane. Il est l’initiation de la cascade d’événements biochimiques à
bien clair que, comme dans le cas du CD4, le complexe l’origine de l’activation cellulaire. Les caractéristiques
TCR + CD3 et le CD8 se lient au même complexe MHC + d’interaction ne sont pas que le résultat du TCR inter-
peptide. En ce qui concerne l’activation cellulaire, agissant avec le CMH + peptide. D’autres molécules par-
l’hétérodimère CD8 est plus efficace que l’homodimère. ticipent à cette synapse dont le CD4 ou le CD8 comme
2186 LA REVUE DU PRATICIEN 2000, 50
Immunologie
nous allons le voir et ainsi se crée un système amplifica- branaires ou de flux calciques intracellulaires ou de
teur des faibles différences d’affinité intrinsèques du l’extérieur vers l’intérieur du cytoplasme à travers des
TCR vis-à-vis du CMH + peptide. La subtilité de cette canaux calciques membranaires. Des composés chimiques
interaction explique aussi les multiples possibilités qui sont capables de mimer ces effets et aboutissent aussi à
existent pour sa modulation, que ce soit avec des pep- l’activation cellulaire en court-circuitant la phase de
tides antagonistes ou en empêchant la constitution de la reconnaissance antigénique. Ces composés ont été et
synapse en agissant sur les molécules d’adhésion. restent très utiles pour disséquer les événements biochi-
Certaines molécules, appelées super antigènes, généra- miques à l’origine de l’activation. Ce sont, par exemple,
lement des protéines bactériennes ou virales (toxines de les ionophores calciques qui provoquent une augmenta-
streptocoques ou staphylocoques) ont la propriété de tion de la concentration intracellulaire de calcium (voir :
reconnaître à la fois un segment Vβ particulier (indépen- Pour approfondir 3, 4).
damment du CDR1, 2 ou 3) et des molécules HLA de
classe II réalisant ainsi un pont antigène-indépendant
entre les lymphocytes T présentant ce Vβ particulier et Différenciation lymphocytaire T
les cellules présentatrices de l’antigène. Il en résulte
qu’un nombre important de lymphocytes T (tous ceux Jusqu’à présent nous avons considéré l’activation de
utilisant le même segment V) vont être activés de façon lymphocytes T matures, mais la naissance de cette cellule
simultanée pour aboutir entre autres à la libération mas- passe aussi par de nombreuses étapes où les phéno-
sive de cytokines à l’origine de l’état de choc observé mènes d’activation cellulaire ou bien leur absence sont
chez le patient. déterminants.
L’activation est le corollaire du contact antigénique, Les cellules précurseurs du lymphocyte T sont encore
mais in vitro le peptide antigénique et la molécule CMH mystérieuses, mais on sait qu’elles prennent naissance
le portant ne sont pas toujours disponibles. Même si cela comme les autres cellules lymphoïdes dans le foie fœtal
était, cela ne concernerait qu’un nombre infime de puis la moelle osseuse. Ces cellules n’expriment pas de
lymphocytes T pris dans le sang périphérique, ce qui TCR et les gènes les codant sont dans un état vierge
rend de toute façon l’étude impossible. C’est pourquoi, comme on peut le constater dans n’importe quelle autre
les modèles d’activation in vitro reposent sur l’activa- cellule de l’organisme. On appelle cet état l’état germinal.
tion massive des lymphocytes T, indépendamment de Elles sont donc au sens immunologique non fonction-
l’antigène. Ils doivent donc concerner au minimum le nelles. Produites dans la moelle osseuse, elles vont
TCR ou le CD3. migrer dans le thymus soit pour la première fois au
Les lectines sont une classe de protéines qui ont la pro- cours de la vie fœtale, soit ensuite lors de l’enfance puis
priété de reconnaître relativement spécifiquement des de la vie adulte. L’activité thymique diminue progres-
sucres et de les lier. Comme la majorité des protéines sivement au cours de la vie sans jamais vraiment
membranaires sont glycosylées, elles vont pouvoir être s’éteindre. Sous l’influence de cytokines produites dans
reconnues par ces lectines. C’est le cas de la phytohéma- l’environnement thymique comme l’interleukine 7 (IL7),
glutinine ou PHA extraite d’un haricot, Phaseolus vul- ces cellules, dont les gènes codant le TCR sont à l’état
garis. C’est la lectine la plus employée pour étudier germinal, vont proliférer. À ce stade, elles ne sont pas
l’activation des lymphocytes T humains. Elle peut se fixer encore commises dans le lignage T, et peuvent engen-
sur le TCR, les protéines du CD3, et d’autres molécules. drer des cellules NK, des lymphocytes B ou des lym-
Comme la PHA est tétravalente, elle va pouvoir ponter phocytes T. Puis dans une étape ultérieure, les réarran-
les molécules reconnues à la surface du lymphocyte, gements des gènes codant les chaînes β, γ, et δ du TCR
ainsi activer les lymphocytes T indépendamment de commencent à être détectés. De même détecte-t-on la
l’antigène et donc remplacer la cellule présentatrice présence de certaines sous-unités du CD3. C’est le point
de l’antigène. Il existe toute une liste de lectines de non-retour pour la différenciation lymphocytaire T et
d’origine végétale capables d’activer les lymphocytes l’arrêt de leur prolifération. Certaines de ces cellules
par ce mécanisme. vont pouvoir réarranger correctement leurs locus γ et δ
Les anticorps monoclonaux, spécifiques soit du TCR ou pour produire un TCR γ/δ fonctionnel, tandis que
des chaînes du CD3, peuvent aussi activer les lympho- d’autres ne vont réarranger correctement qu’un gène β
cytes T indépendamment de l’antigène. Par contre, et donc exprimer à leur membrane la chaîne β du TCR
comme il s’agit le plus souvent d’IgG, ils ne seront que qui, associée avec une chaîne non variable de type α
divalents, ce qui limite leur pouvoir de mobilisation appelée pré-TCR α ou pTα ainsi qu’à certaines sous-
d’un grand nombre de molécules membranaires et ainsi unités du CD3, va constituer un pré-TCR αβ. La majorité
leur effet activateur. C’est pourquoi ils sont peu efficaces des cellules ne vont pas pouvoir réarranger correctement
en solution mais beaucoup plus lorsqu’ils sont fixés soit leurs gènes codant le TCR et vont mourir au cours de ce
sur une cellule, soit sur une phase solide comme des processus. Pour les survivantes γ/δ leur maturation est
billes de polystyrène par exemple. terminée. Pour les survivantes présentant un pré-TCR de
L’activation du lymphocyte T s’accompagne de modifi- type α/β, les réarrangements sur le locus β sont terminés
cations biochimiques du contenu cellulaire, dont l’appa- et tandis qu’elles se mettent à exprimer le CD4 et le
rition de produits de clivage des phospholipides mem- CD8 (doubles positives), le locus α commence ses réar-
LA REVUE DU PRATICIEN 2000, 50 2187
CELLULES T ET IMMUNITÉ CELLULAIRE
rangements. Cela s’accompagne à nouveau d’une proli- produites que par les seuls lymphocytes T, et représentent
fération. Puis ces thymocytes du stade doubles positifs un système général de régulation des différentes cellules
vont successivement : réarranger leur locus α jusqu’à la constitutives d’un groupe cellulaire ou de plusieurs
mort ou exprimer un dimère α/β fonctionnel, puis subir groupes cellulaires entre eux, comme le font les hor-
la sélection positive consistant à ne sélectionner que les mones dans le système endocrinien. Le nombre des
cellules ayant une certaine affinité pour le CMH, puis cytokines connues est de plusieurs centaines à l’heure
choisir leur destin en devenant soit CD4 soit CD8, pour actuelle et ne cesse de grandir. Ces modulateurs repré-
enfin subir la sélection négative qui ne garde que les cel- sentent des cibles thérapeutiques de choix en santé
lules portant un TCR incapable de s’activer au contact humaine, et les équivalents recombinants de certaines
d’un CMH autologue, avant de sortir du thymus par les (interféron par exemple) sont déjà utilisés en thérapeu-
vaisseaux sanguins qui irriguent la jonction cortico-médul- tique.
laire. En ce qui concerne le lymphocyte T, il a été montré,
La stringence importante de ce processus complexe fait d’abord chez la souris, que cette production de cyto-
que plus de 95 % des cellules du départ sont détruites kines pouvait être un système d’identification phénoty-
avant d’être libérées dans la circulation. C’est un processus pique. Ainsi, il a été identifié au moins 2 classes de
long de l’ordre d’un mois, incomplètement connu et lymphocytes T sur leurs capacités à produire certaines
géographiquement organisé. Les thymocytes doubles cytokines et pas d’autres et ainsi influencer de façon
positifs sont localisés dans le cortex thymique en étroit différentielle la réponse immune. C’est la dichotomie T
contact avec les cellules épithéliales thymiques. La helper 1 (Th1)/T helper 2 (Th2). C’est l’équilibre entre
médullaire thymique ne contient que des cellules CD4 ces 2 pôles de la réaction immunitaire qui va finalement
ou CD8. On voit ainsi que : faire basculer la réponse du côté cellulaire ou plutôt
– les mécanismes du réarrangement qui génèrent les humoral (tableau).
TCR dans le thymus ne sont le fait que du hasard et
sont identiques chez tout un chacun quel que soit son
CMH ; TABLEAU
– mais ce répertoire est ensuite affiné en fonction de
2 critères fondamentaux, qui sont : la nécessité absolue Équilibre Th1/Th2
pour le TCR de reconnaître à la fois le peptide anti-
génique et les berges du sillon de la molécule de CMH Cytokines Lymphocytes Lymphocytes
qui le porte, c’est le but de la sélection positive, la CD4+ Th1 CD4+ Th2
nécessité absolue d’éliminer les TCR très autoréactifs
pouvant causer la destruction de l’hôte qui le porte, Interleukine 2 ++ 0
c’est le but de la sélection négative. (IL2)
Il faut alors noter que c’est le CMH propre à chaque
individu qui modèle le répertoire primitif, ce répertoire Interféron γ ++ 0
est en cela propre à chaque individu comme le sont ses (IFNγ)
haplotypes CMH. C’est le répertoire passé au crible de
ces filtres qui va rester et constituer le système immuni- Interleukine 4 0 ++
(IL4)
taire de l’individu.
Après activation, les lymphocytes T vont subir des pro-
cessus divers de différenciation consistant en la trans-
cription de certains gènes pour aboutir à exercer leurs
fonctions cellulaires qui peuvent se subdiviser schémati- Interleukine 2 (IL2)
quement en 2 grandes catégories recoupant exactement
les anciennes dénominations de la réponse immunitaire C’est une glycoprotéine de 20 000 de poids moléculaire
à médiation cellulaire que sont l’hypersensibilité retardée environ qui est produite par les lymphocytes T activés
et la réponse cytolytique. seulement. C’est le facteur de prolifération de ces
mêmes lymphocytes T activés (para- et autocrinie).
C’est un facteur à action locale, il n’est pas présent dans
Lymphocytes T auxiliaires la circulation ou de toute façon sa demi-vie est très
brève (lorsqu’on l’injecte à des fins thérapeutiques par
Ils concernent principalement les lymphocytes T portant exemple). L’activation lymphocytaire T induit aussi
le marqueur CD4 et sont responsables de l’hypersensibilité l’expression du récepteur de haute affinité pour cette
retardée. Ces lymphocytes auxiliaires (helper) exercent molécule, ce qui permet après fixation de l’IL2 sur
leurs fonctions régulatrices de la réponse immunitaire celui-ci la prolifération et donc l’amplification des
cellulaire et humorale par le biais de molécules de surface clones réactifs sans laquelle il n’y a pas de réponse pos-
comme le CD40-ligand ou le Fas-ligand mais aussi et sible. Or, l’expression de ce récepteur est transitoire à la
surtout par des médiateurs solubles de nature glycopro- surface du lymphocyte permettant une régulation fine de
téiques appelés cytokines. Les cytokines ne sont pas l’amplification clonale. L’IL2 apparaît donc comme un
2188 LA REVUE DU PRATICIEN 2000, 50
Immunologie
important paramètre de la réponse T dépendante. Ce viral et antiprolifératif, mais il possède un récepteur tota-
système IL2-IL2 récepteur permet une modulation thé- lement différent des autres IFN et des actions spécifiques
rapeutique de la réponse immune, soit en plus dans le d’immunorégulation. Ainsi, c’est un activateur puissant
cas des tumeurs (lymphokine activated killers ou tumor des monocytes/macrophages leur permettant par exemple
infiltrating lymphocytes), soit en moins dans le cas des de détruire les bactéries endocytées. Il augmente l’ex-
greffes d’organes allogéniques (anticorps anti-récepteur pression des HLA de classe I et de classe II, augmentant
IL2 pour contrôler la réponse immune et donc prévenir ainsi les capacités de présentation antigénique au lym-
les rejets). Le récepteur est un complexe multimoléculaire. phocyte T et donc l’efficacité de la réaction immune. Il
L’élément le plus inductible par l’antigène est la chaîne α permet la différenciation des lymphocytes cytolytiques.
ou p55 (55 000 de PM) encore appelé CD25. Ce CD25 Enfin, il permet la commutation isotypique vers certaines
est quasi absent des cellules au repos et isolé ne présente sous-classes d’IgG. Il inhibe la production d’IL4, et la
qu’une faible affinité pour l’IL2, en revanche une fois la différenciation des lymphocytes T en Th2, influençant
cellule activée par l’antigène son expression est considé- ainsi le cours de la réponse immune vers une réponse de
rablement augmentée. Une seconde molécule, la type cellulaire. La résultante de ces actions est une pro-
chaîne β ou p75 est, elle, exprimée en quantité plus motion de la réponse cellulaire et inflammatoire ainsi
importante que le CD25 par les lymphocytes T au repos qu’une suppression des réactions allergiques (switch des
et son expression est augmentée après activation. Isolée, Ig vers les IgG plutôt que vers les IgE).
elle présente une affinité moyenne pour l’IL2. Un
3e composant, appelé chaîne γ est incapable de lier seul Interleukine 4 (IL4)
l’IL2 et n’a donc aucune affinité intrinsèque pour ce
ligand. Comme la chaîne β, son expression membranaire C’est la cytokine de régulation des réactions allergiques.
est légèrement augmentée après activation. Il participe à Elle est nécessaire à la production des IgE et permet le
la structure du récepteur en complémentant les 2 autres switch des chaînes lourdes d’Ig vers cet isotype. Un
pour donner un récepteur de très haute affinité capable déséquilibre de production en faveur de cette cytokine,
de transduire un signal à l’intérieur de la cellule. Il rend au cours d’une réponse immune, serait responsable du
les cellules sensibles à de très faibles quantités d’IL2. La développement des allergies. Elle inhibe l’activation des
présence de ce récepteur de haute affinité à la surface du macrophages en interférant avec l’IL1 qui est une cyto-
lymphocyte T activé est donc régulée par l’intense sur- kine sécrétée par les cellules de l’immunité naturelle
expression temporaire de la chaîne α. L’induction de la qui, elle, est activatrice de l’inflammation. C’est donc
chaîne α se fait en quelques heures, mais diminue déjà 48 h une cytokine anti-inflammatoire. C’est un facteur de
après la stimulation. Ce système permet l’amplification croissance pour les mastocytes. Elle est nécessaire à la
rapide des cellules T spécifiques de l’antigène et le retour réponse antiparasitaire. Elle agit positivement sur le
au repos de ces mêmes cellules après disparition de l’anti- développement des cellules Th2 et bloque l’éclosion
gène puisque l’induction de la chaîne α est consécutive d’une réponse de type TH1.
à la liaison du ligand antigénique. Certains déficits
immunitaires combinés sévères affectant les lympho- TNF α ou facteur de nécrose tumorale
cytes T et B et liés au chromosome X, sont dus à l’absence (tumor necrosis factor)
totale ou fonctionnelle de la chaîne γ du récepteur à
l’IL2 qui est commune à d’autres récepteurs pour Il est produit par les cellules de l’immunité naturelle
d’autres cytokines (IL4, IL13, IL7 et IL9) et dont le gène comme les macrophages mais aussi par le lymphocyte T
se trouve sur le chromosome X. après activation. C’est le principal médiateur de la
réponse de l’hôte aux bactéries gram-négatives. Les
Interféron γ (IFN γ) lipopolysaccharides (LPS) présents à la surface de la
paroi des bactéries gram-négatives stimulent les fonc-
Il existe 2 types d’interférons sur la base de leurs effets tions des phagocytes mononucléés, et il est reconnu que
biologiques. Le 1er type comporte 2 groupes différents : la sécrétion de TNF est l’un des principaux médiateurs
l’un, α, comprend une vingtaine de gènes différents, de cet effet. La source majeure de TNF sera donc les
l’autre, β, n’est codé que par un gène. L’IFN α et l’IFN β phagocytes mononucléés activées. C’est un lien impor-
ont des effets biologiques similaires, ce qui s’explique tant entre les réponses immunitaires spécifiques et les
par le fait qu’ils interagissent avec le même récepteur à réactions inflammatoires. Il présente des actions anti-
la surface des cellules. Ils sont produits par n’importe tumorale, antivirale et antiparasitaire. Il agit par l’inter-
quelle cellule de l’organisme et l’inducteur le plus puis- médiaire d’un récepteur dont les effets sur la cellule sont
sant en est l’infection virale d’une cellule. Cette propriété aussi l’induction de l’apoptose. Le résultat de son action
les fait utiliser en thérapeutique anti-infectieuse. Le est un effet pro-inflammatoire important dont les effets
second type est représenté par l’IFN γ, qui nous retiendra délétères in vivo peuvent être combattus soit par les
ici. Comme l’IL2, c’est un produit des cellules T CD4+ corticoïdes, soit par des moyens spécifiques comme le
activées, mais aussi des CD8+ et des cellules non-T récepteur soluble recombinant qui, en captant le TNF
natural killer. Comme son nom l’indique, il a des actions soluble, empêche sa liaison avec les récepteurs membra-
similaires à celles des IFNα et β, comme le pouvoir anti- naires et l’activation cellulaire qui s’ensuit.
LA REVUE DU PRATICIEN 2000, 50 2189
CELLULES T ET IMMUNITÉ CELLULAIRE
Interleukine1 (IL1) ciation dont nous venons de parler est la période de mise
en place de la machinerie nécessaire pour accomplir
Comme pour le TNF, la source majeure en est le macro- cette fonction. Ainsi, il apparaît dans le cytoplasme, près
phage activé, mais il est aussi produit par les cellules de la membrane, des granules contenant des protéines
endothéliales, les astrocytes, et les kératinocytes. Il est capables de perforer la membrane des cellules cibles
synthétisé sous forme d’un précurseur inactif dans la (perforine), des enzymes de type sérine estérases, des
cellule. Une protéase spécifique clive la molécule en protéoglycanes. La lyse est antigène spécifique et est
2 fragments dans le cytoplasme dont l’un seulement sera restreinte par le complexe majeur d’histocompatibilité.
sécrété et actif. Il existe 2 formes (α et β) se fixant sur Seules les cibles exprimant le même HLA de classe I et
un même récepteur. Il joue un rôle essentiel dans la le même peptide antigénique associé que les cellules qui
réaction inflammatoire et dans l’induction des réponses ont permis la différenciation des pré-CTL peuvent être
immunitaires spécifiques. Quand il est produit en grande reconnues. Un contact entre les 2 cellules (tueuse et
quantité, il passe dans le sang et agit à distance. C’est cible) est indispensable pour obtenir une lyse. Les CTL
ainsi qu’il augmente la température centrale par action eux-mêmes sont résistants à ce type de lyse et ne s’auto-
directe sur l’hypothalamus, qu’il augmente la produc- détruisent pas. Un CTL peut tuer séquentiellement plu-
tion des protéines de la phase aiguë de l’inflammation sieurs cibles.
par action sur les hépatocytes, ce qui se traduit par une Il existe 4 étapes distinctes menant à la mort d’une
augmentation de la vitesse de sédimentation sanguine, cellule cible. La première consiste en la reconnaissance
qu’il induit une cachexie. Comme le TNF, c’est un puis- et la formation d’un conjugué entre les 2 cellules. Le
sant inducteur inflammatoire notamment en induisant la CTL se lie à la cellule cible par son récepteur à l’antigène
sécrétion d’autres cytokines par les cellules de l’immunité. (TCR) spécifique de celui-ci, mais aussi par d’autres
molécules via une liaison non spécifique (CD2/LFA3,
Cytotoxicité à médiation cellulaire CD8/HLA classe I, LFA-1/ICAM-1). Ces systèmes de
type fermeture à glissière, bien que non spécifiques, sont
Elle concerne principalement les lymphocytes T portant importants à considérer car ils permettent le rapproche-
le marqueur CD8 qui sont responsables de l’immunité à ment transitoire et non spécifique de 2 cellules.
médiation cellulaire antivirale. Ces cellules sont en effet Puis la liaison de plusieurs TCR sur le lymphocyte avec
capables de lyser des cellules infectées par un virus. plusieurs HLA + peptide viral sur la cellule cible permet
Mais ces lymphocytes tueurs sont impliqués dans le une activation du CTL qui ne peut être qu’antigène
rejet de greffe, les maladies auto-immunes et peuvent spécifique. Ce phénomène est donc exactement super-
présenter une activité antitumorale. Ils reconnaissent des posable à l’activation des CD4 + helper qui mène à la
peptides étrangers dérivés de protéines intracellulaires production de cytokines. Ici il va mener à la délivrance
et associés aux molécules HLA de classe I. La du « message lytique » à la cellule cible constituant la
préférence qu’ont les cellules CD8+ à reconnaître des 3e étape. Deux types de mécanismes lytiques existent.
peptides présentés par les antigènes de classe I repose Premièrement, les CTL sécrètent dans l’espace intercel-
sur la liaison directe que la molécule CD8 peut avoir lulaire le contenu de leurs granules dont nous avons déjà
avec ces classes I. parlé plus haut. La perforine, monomérique et inoffensive
Les lymphocytes T CD8+ qui sortent du thymus ne sont en tant que telle, va se polymériser au contact de la haute
pas doués de ce pouvoir cytolytique, même s’ils expri- concentration extracellulaire de calcium dans la mem-
ment un TCR fonctionnel et peuvent reconnaître un anti- brane de la cellule cible et y créer un canal perméable
gène. Par exemple dans le cas d’une greffe, très peu de aux ions. Lorsqu’un nombre suffisant de ces pores exis-
lymphocytes T cytoxiques (CTL) spécifiques de l’allo- te, la cellule ne peut plus réguler ses échanges ioniques,
greffe sont détectés dans le sang du receveur avant la elle gonfle et se lyse. C’est la nécrose cellulaire. Ce
greffe. En revanche, si les lymphocytes T sont préalable- mécanisme de mort cellulaire est analogue à celui infli-
ment cultivés pendant 7 à 10 jours, avec les leucocytes gé par le complément. Les autres composants des gra-
du donneur (culture mixte lymphocytaire), des CTL spé- nules ou bien protègent la cellule tueuse d’une lyse (pro-
cifiques du donneur sont facilement mis en téoglycanes) ou bien sont aussi délétères pour la cellule
évidence dans ces cultures. Il en va de même pour des cible (sérine estérases = granzymes). Dans le deuxième
cellules infectées par des virus. Ces cellules ont subi un type, le mécanisme fait intervenir une fragmentation de
processus de différenciation lors de la phase de culture. l’ADN de la cellule cible. Il y a activation des enzymes
Cette différenciation nécessite 2 types de signaux pour intracellulaires responsables de ce phénomène par la
se réaliser. L’un est la reconnaissance spécifique de mise en jeu de récepteurs membranaires particuliers
l’antigène, l’autre est la présence de cytokines ; bien que comme l’antigène FAS ou CD95 présents à la surface de
l’on ne connaisse pas exactement les cytokines indis- la cellule cible ou bien du système TNF/TNF récepteur.
pensables, l’IL2, l’IFN γ sont connus pour influencer ce Ce mécanisme est totalement
phénomène au moins in vitro. Elles sont produites par indépendant de l’exocytose des granules. Lorsque
les CD4+ ou bien par ces mêmes CD8+ (autocrinie). l’ADN est fragmenté le noyau se fragmente aussi, la
La fonction essentielle des lymphocytes T cytotoxiques membrane bourgeonne, et la cellule entière se réduit
est de lyser une cellule cible. En fait l’étape de différen- à quelques globules. C’est l’apoptose.
2190 LA REVUE DU PRATICIEN 2000, 50
Immunologie
Ces 2 mécanismes peuvent coexister et sont complémen- virus de l’immunodéficience humaine de type 1 est la
taires. En ce qui concerne l’immunité à médiation cellu- plus connue. Les phénotypes des déficits immunitaires
laire antivirale, ils n’ont pas les mêmes implications. On sont assez polymorphes reflétant la complexité des phé-
comprend aisément que le second mécanisme est mieux nomènes moléculaires en cause et leur évolution selon
adapté à la défense antivirale, car dans ce cas l’ADN l’âge. Les mécanismes déficients ne sont pas toujours
viral est lui aussi détruit et il y a un confinement des proprement « immunologiques », mais peuvent être plus
produits viraux assez long, évitant leur dissémination généraux comme par exemple certaines maladies méta-
dans l’environnement extracellulaire. Par le même tru- boliques congénitales s’accompagnant de manifestations
chement, le premier est inflammatoire car il y a libération immunologiques. Cependant, quelle qu’en soit la cause,
assez rapide d’enzymes dans le milieu extracellulaire, la symptomatologie tourne toujours autour des manifes-
donc destruction locale. Enfin dans une ultime étape, tations infectieuses inhabituelles par leur ampleur, leur
une fois le mécanisme lytique commencé, le CTL se répétition ou leur persistance, alors que l’on constate
sépare physiquement de sa cible, qui va lentement mourir habituellement une absence de ganglions lymphatiques
(1 à 2 h), alors qu’il est capable de recommencer plusieurs ou de splénomégalie. Des états d’auto-immunité, des
autres cycles lytiques de ce type qui durent à peu près entéropathies, des anomalies hépatiques, des retards de
une dizaine de minutes. Dans l’immunité à médiation croissance peuvent aussi être présents ou donner l’alerte.
cellulaire antivirale les CTL agissent à 2 niveaux. D’autres malformations peuvent aussi être présentes et
Premièrement par destruction des cellules infectées, ce évocatrices tout en étant plus évidentes à l’examen cli-
qui réduit la diffusion du virus, et deuxièmement par la nique direct. À un âge plus avancé ce sont des états
sécrétion d’interféron notamment γ qui active les macro- tumoraux qui peuvent se manifester. La numération for-
phages, stimule la production d’anticorps neutralisants mule montrera les altérations numériques commandant
(IgG) l’infectivité du virus, et rend les cellules résistantes l’analyse des marqueurs membranaires lymphocytaires,
à l’infection virale. le dosage des immunoglobulines sériques. Un diagnostic
précoce est essentiel et permet de diriger le patient vers
Concept de déficit de l’immunité les centres spécialisés pour une greffe de moelle osseuse ou
le traitement de la cause infectieuse. Ce sont des maladies
cellulaire extrêmement graves mettant rapidement le pronostic vital
De toutes les notions évoquées précédemment, il résulte en jeu, d’autant que les vaccinations avec des virus atténués
que l’immunité à médiation cellulaire repose sur un ou le BCG (bacille bilié de Calmette et Guérin) peuvent
édifice moléculaire particulièrement complexe et être des modes de révélation de ces états. ■
finement régulé. Il va de soi que si l’un des maillons de
la chaîne des signaux générés au cours de la mise en Points Forts à retenir
place de la réaction est soit absent, soit incapable de
remplir sa fonction, c’est l’ensemble du processus
• Après activation, les lymphocytes T vont
auquel il participe qui est en péril, nous parlerons alors
subir des processus divers de différenciation
de déficit immunitaire et dans le cas qui nous occupe de consistant en la transcription de certains gènes
déficit de l’immunité cellulaire. Ces processus et leurs pour aboutir à exercer leurs fonctions cellulaires
voies de régulation sont en général très redondants, ce régulatrices de la réponse immunitaire cellulaire
qui fait que l’altération de l’un n’a pas nécessairement de et humorale par le biais non seulement
répercussion tangible. Cette constatation amène à conclure de molécules de surface, mais aussi de médiateurs
que d’une certaine façon les situations de déficits immuni- solubles de nature glycoprotéiques appelés
taires sont un continuum pouvant se situer à n’importe cytokines : IL2, IFNγ, IL4, TNF α, IL1.
quel point entre la normalité objective (existe-t-elle ?) et • La cytotoxicité à médiation cellulaire est l’une
la déficience totale et évidente, ce qui fait souvent parler de ces fonctions et concerne plutôt les lymphocytes
de susceptibilité. Dans un certain nombre de cas une T portant le marqueur CD8. Ces cellules sont
susceptibilité exacerbée d’un individu à un type d’infec- capables de lyser des cellules infectées par un
tion par exemple n’est peut-être que la traduction de la virus soit par apoptose, soit par nécrose de la
présence d’un gène légèrement altéré dont le produit cellule cible. Mais ces lymphocytes tueurs sont
présente quand même un reliquat fonctionnel. impliqués dans le rejet de greffe, les maladies
Compte tenu des liens étroits qui existent entre les auto-immunes et peuvent présenter une activité
immunités humorale et cellulaire, un déficit massif de la antitumorale. Ils reconnaissent des peptides
seconde entraîne indirectement le déficit sévère de la étrangers dérivés de protéines intracellulaires
première. Nous parlerons alors de déficits combinés. Le et associés aux molécules HLA de classe I.
nombre de cibles moléculaires possibles pouvant être • Les cytokines quant à elles sont plutôt
altérées étant très important, seuls un certain nombre de produites par les lymphocytes T portant
déficits sont aujourd’hui caractérisés au niveau molécu- le marqueur CD4 que l’on appelle aussi
laire. Mais il ne faut pas penser uniquement aux déficits auxiliaires. Ils reconnaissent plutôt des peptides
immunitaires cellulaires comme le résultat d’anomalies antigéniques dérivés de protéines exogènes
génétiques congénitales. Il existe aussi des causes et présentés par les molécules HLA de classe II.
acquises notamment infectieuses dont l’infection par le
LA REVUE DU PRATICIEN 2000, 50 2191
CELLULES T ET IMMUNITÉ CELLULAIRE
POUR APPROFONDIR
1 / Structure du CD3 est conservée des oiseaux à l’homme, témoignant de son importance
fonctionnelle. Son expression à la surface des cellules varie avec le
L’addition d’un anti-TCR à une solution de protéines membranaires niveau d’engagement avec ses ligands CD80 et CD86 qui sont des
du lymphocyte T permet de purifier non seulement les 2 chaînes du molécules membranaires présentes sur les cellules présentatrices de
TCR, mais aussi 4 autres chaînes différentes qui leurs sont associées l’antigène comme les lymphocytes B.
et qui représentent le complexe CD3. Il y a la chaîne γ (PM = 20 000),
la chaîne δ (PM = 25 000), la chaîne ε (PM = 20 000) et la chaîne ζ L’engagement du CD28 par ses ligands permet : l’augmentation très
(PM = 16 000). Ces chaînes sont elles-mêmes associées en dimères. importante de la production de cytokines (IL2, IL4, GM-CSF, TNF, IFN
Ainsi au sein du complexe, la chaîne δ est-elle associée par un pont γ par exemple), l’augmentation de l’expression des chaînes du récep-
disulfure à la chaîne ε, tandis que la chaîne γ se retrouve associée teur à l’IL2, de diminuer le seuil d’activation du lymphocyte T, de pré-
aussi avec la chaîne ε. La chaîne ζ est quant à elle homodimérique là venir la mort cellulaire programmée qui suit l’activation, la différen-
aussi par l’existence d’un pont disulfure interchaîne. ciation des Th1, la différenciation des lymphocytes T cytolytiques.
L’inhibition de cette interaction va donc sévèrement altérer la réponse
L’arrangement combinatoire de ces dimères est complexe et peut
immunitaire et de façon durable ce que l’on désigne sous le nom
varier d’une cellule à l’autre, mais en général on s’accorde à penser
d’anergie.
que le supercomplexe TCR/CD3 à la surface du lymphocyte T est de
la nature suivante : [αβ]2 [γ/δε]2 [ζζ]4. Il existe une seconde molécule, homologue du CD28, qui est le
CD152 (CTLA-4) exprimée à la surface du lymphocyte T activé seu-
Les chaînes constitutives du CD3 ne présentent pas de variabilité
lement. Il est exprimé environ 10 fois moins que le CD28, mais la
génétique et lors d’un phénotypage lymphocytaire on utilise, en géné-
chose intéressante, c’est qu’il a la possibilité de lier les mêmes ligands
ral, un anticorps spécifique de la chaîne ε pour identifier le CD3, et
(CD80 et 86) quoique avec une affinité 20 à 50 fois moindre, créant
donc le complexe TCR/CD3 et ainsi numérer les lymphocytes T
ainsi une compétition pour les ligands entre les 2 récepteurs.
puisque ces structures moléculaires ne se retrouvent qu’à la surface
Simultanément à l’activation par le TCR, la liaison du CD28 avec ses
des lymphocytes T à l’exclusion de toutes les autres cellules de l’or-
ligands entraîne l’expression membranaire de CD152 dont l’essentiel
ganisme.
est normalement intracellulaire. Le rôle du CD152 est inverse de
À la surface du lymphocyte T mature, le complexe TCR/CD3 est en celui du CD28 et il régule négativement l’activation cellulaire.
principe indissociable, et lorsqu’une des chaînes est présente à la L’inhibition de sa mise en jeu augmente la prolifération cellulaire,
membrane, elles le sont toutes. L’expression à la membrane de ce d’ailleurs les souris chez lesquelles les gènes codant CD152 sont inac-
complexe est coordonnée. Ainsi, la chaîne α du TCR s’associe avec le tivés, présentent une
dimère CD3 δ et ε, tandis que la chaîne TCR β s’associe au dimère prolifération majeure et un syndrome auto-immun grave.
CD3 γ et ε. Les dimères ζ semblent quant à eux ne rejoindre le com-
De la même façon le CD28 a un rôle important dans la maturation
plexe qu’aux dernières étapes de sa maturation avant sa migration à la
des thymocytes.
membrane. Comme c’est la chaîne ζ qui est limitante (à peu près
exprimée à 10 % du niveau des autres), les protéines produites en Enfin, l’inhibition de cette voie de costimulation permet d’envisager
excès sont rapidement détruites à l’intérieur de la cellule et jamais des applications thérapeutiques dans le domaine des transplantations
exportées en surface. Toutes les chaînes du CD3 présentent dans la pour prévenir le rejet. Inversement dans le cancer où l’on cherche à
portion intramembranaire un acide aminé chargé négativement com- promouvoir une réponse immunitaire antitumorale, l’expression des
plémentaire de la charge positive présente dans la portion intramem- ligands de CD28 à la surface des cellules tumorales favoriserait
branaire des chaînes du TCR, ce qui stabilise leur agrégation. l’installation d’une immunité antitumorale.
La portion intracytoplasmique de ces protéines comporte au moins
Système CD40/CD40-ligand
1 motif d’une vingtaine d’acides aminés particuliers comprenant tou-
jours 2 tyrosines et des leucines capables de médier la transduction du Ce système moléculaire est surtout impliqué dans la génération de la
signal par le jeu de phosphorylation de tyrosines (ITAM pour immu- réponse primaire et secondaire humorale.
noreceptor tyrosine based activation motif). Ces motifs sont indispen-
Le CD40-ligand (CD154) est exprimé par les lymphocytes T activés.
sables à l’activation cellulaire, et leur altération entraîne des modifica-
Sa structure est voisine de celle du TNF, du CD95-ligand (Fas-ligand)
tions profondes de la fonction du lymphocyte T et des déficits
qui sont d’importantes molécules régulatrices.
immunitaires congénitaux sévères.
Quant au CD40 qui est le récepteur au CD154, il est assez voisin du
récepteur au TNF, du CD95 (Fas). Il est exprimé sur les cellules pré-
2 / Molécules co-activatrices sentatrices de l’antigène que sont les cellules dendritiques, les mono-
cytes/macrophages activés et les lymphocytes B. Il permet lorsqu’il a lié
son ligand à la surface du lymphocyte T activé : la commutation iso-
Système CD28
typique des Ig chez les lymphocytes B activé, une augmentation de l’ex-
Il s’agit d’un dimère d’une glycoprotéine transmembranaire exprimée pression des ligands CD80 et 86 du CD28, la prolifération lympho-
par presque tous les lymphocytes T matures CD4, et 50 % des lym- cytaire B, la sécrétion de cytokines par les monocytes/macrophages
phocytes T CD8 matures. La structure primaire de cette molécule activés et les cellules dendritiques (IL 12, IL 1).
2192 LA REVUE DU PRATICIEN 2000, 50
Immunologie
POUR APPROFONDIR (SUITE)
Les 2 systèmes sont donc interconnectés et cette interconnexion est hautement ordonnée dans le plan membranaire et constitue la
permet de saisir leur importance dans le développement d’une synapse immunologique. Cette activation va avoir pour résultat
réponse immunitaire dans sa globalité. d’induire la transcription d’une centaine de gènes jusqu’alors
quiescents ou peu actifs. Mais entre l’accomplissement d’un program-
CD2 me de différenciation (par exemple en cellules cytolytiques capables
de détruire des cellules infectées par un virus) ou la mise en route de
La molécule CD2 est connue depuis très longtemps, puisque avant les la prolifération cellulaire, des intermédiaires moléculaires intracellu-
anticorps monoclonaux, les lymphocytes T étaient identifiés grâce à laires nombreux sont nécessaires.
leur faculté à s’associer à des hématies de mouton. Le lymphocyte T
était ainsi entouré de globules rouges, et cette image bien visible au Quelques secondes après l’engagement du TCR et pendant les
microscope était appelée rosette. Les cellules rosette de mouton quelques heures qui suivent, on observe : des phosphorylations de
positives étaient des lymphocytes T. Le CD2 est exprimé par les lym- protéines, une augmentation du calcium intracellulaire, une augmentation
phocytes T et une partie des lymphocytes NK. C’est une molécule de du pH intracellulaire, une perturbation de la concentration des
coactivation qui possède plusieurs ligands assez ubiquitaires dont le nucléotides cycliques.
CD58 ou LFA3 présents sur la cellule présentatrice de l’antigène. Comme les portions intracytoplasmiques des protéines membranaires
concernées par l’interaction avec la cellule présentatrice de l’antigène
ne présentent aucune activité enzymatique, c’est par l’intermédiaire
3 / Marqueurs membranaires de l’activation des séquences ITAM que va s’effectuer le couplage avec les kinases
lymphocytaire T cellulaires et leur subséquente activation. Au cours de l’interaction
TCR/CD3/CD4 ou CD8 avec leurs ligands présents sur la cellule
Il s’agit de molécules dont l’expression membranaire est liée à l’acti- présentatrice de l’antigène, la mobilisation du CD4 ou du CD8 aux-
vation, c’est-à-dire au contact antigénique. quels est liée une tyrosine kinase appelée p56lck amène celle-ci à
pouvoir phosphoryler les motifs ITAM portés par les portions intra-
Molécules HLA de classe II cytoplasmiques des différentes chaînes du CD3. Une fois ces tyro-
sines phosphorylées, d’autres kinases en les reconnaissant vont pou-
Au repos, le lymphocyte T n’exprime que les molécules de classe I,
voir être activées de proche en proche. C’est l’état de
comme toutes les cellules nucléées de l’organisme. Après activation il
phosphorylation sur des tyrosines, des sérines ou des thréonines par-
exprime les molécules de classe II dont les molécules D. Comme
ticulières de tous ces acteurs qui régule leur activité et leurs interac-
nous disposons d’anticorps monoclonaux spécifiques des portions
tions. Cette cascade, très complexe, permet finalement la mise en jeu
invariables de ces molécules, nous pouvons mettre en évidence ces
de facteurs de transcription régulant l’activité d’un ensemble de gènes
cellules et ainsi avoir une idée de l’état d’activation du système
et de protéines régulatrices permettant la différenciation et la prolifé-
immunitaire. L’expression de classe II persiste plusieurs jours après
ration.
l’activation.
L’activité kinase au cours de ce processus est elle-même régulée
CD69 négativement par des phosphorylations sur certaines de leurs
propres tyrosines, et c’est précisément là que les phosphatases
C’est une molécule de coactivation dont l’expression est décelée comme le CD45, qui est recruté au lieu de la synapse, vont
2 ou 3 heures après activation. Cependant, elle ne persiste pas et paradoxalement pouvoir permettre la poursuite de l’activation et
disparaît rapidement. donc sa régulation, qui autrement s’éteindrait.
L’augmentation du calcium intracellulaire n’est pas totalement com-
CD25 prise mais elle provient non seulement du flux d’ions calciques de
C’est la chaîne α du récepteur à l’interleukine 2 qui permet l’extérieur vers l’intérieur cellulaire permis par un brusque changement
la formation du récepteur de haute affinité sur lequel vient se de perméabilité membranaire mais aussi de l’ouverture de stocks
lier l’IL2, permettant la prolifération des lymphocytes T. Son intracellulaires de calcium. Cette augmentation du calcium intracellulaire
expression nécessite une forte activation, et persiste pendant va modifier un certain nombre de protéines à activité enzymatique
plusieurs jours. calcium dépendante comme la calcineurine cible d’un immunosup-
presseur très employé, qui est la ciclosporine A.
Les changements de pH en modifiant le milieu vont affecter l’efficacité
4 / Transduction du signal des enzymes intracellulaires. L’augmentation du pH intracellulaire est
provoquée par une augmentation de l’activité du canal membranaire
Comme nous avons déjà eu l’occasion de le dire, le TCR pour ce
Na+/H+ due au clivage de certains phospholipides de la membrane
qui concerne la spécificité de la reconnaissance, les différentes
par des phospholipases activées par la mobilisation du complexe
chaînes du CD3, les corécepteurs et les molécules de coactivation
TCR/CD3.
sont
mobilisés dans le plan membranaire, lors du contact entre le En faisant varier la concentration intracellulaire en nucléotides
lymphocyte T et la cellule présentatrice de l’antigène. Cette mobilisation cycliques, notamment celle de l’AMPc, la cellule module certaines
LA REVUE DU PRATICIEN 2000, 50 2193
Vous aimerez peut-être aussi
- 98 991Document7 pages98 991hizballah27Pas encore d'évaluation
- 98 1003Document7 pages98 1003hizballah27Pas encore d'évaluation
- 98 1011Document7 pages98 1011hizballah27100% (1)
- 98 999Document4 pages98 999hizballah27Pas encore d'évaluation
- 98 919Document5 pages98 919hizballah27Pas encore d'évaluation
- 98 913Document6 pages98 913hizballah27Pas encore d'évaluation
- 98 987Document3 pages98 987hizballah27Pas encore d'évaluation
- 98 875Document5 pages98 875hizballah27Pas encore d'évaluation
- 98 765Document5 pages98 765hizballah27Pas encore d'évaluation
- 98 905Document4 pages98 905hizballah27Pas encore d'évaluation
- Antagonistes Des Récepteurs H Et Inhibiteurs de La Pompe À ProtonsDocument6 pagesAntagonistes Des Récepteurs H Et Inhibiteurs de La Pompe À Protonshizballah27Pas encore d'évaluation
- 98 899Document6 pages98 899hizballah27Pas encore d'évaluation
- 98 909Document3 pages98 909hizballah27Pas encore d'évaluation
- 98 881Document5 pages98 881hizballah27Pas encore d'évaluation
- 98 887Document5 pages98 887hizballah27100% (1)
- 98 802Document3 pages98 802hizballah27Pas encore d'évaluation
- 98 805Document5 pages98 805hizballah27Pas encore d'évaluation
- 98 781Document5 pages98 781hizballah27Pas encore d'évaluation
- 98 797Document5 pages98 797hizballah27Pas encore d'évaluation
- 98 685Document3 pages98 685hizballah27Pas encore d'évaluation
- 98 771Document6 pages98 771hizballah27100% (1)
- 98 787Document10 pages98 787hizballah27Pas encore d'évaluation
- 98 689Document5 pages98 689hizballah27Pas encore d'évaluation
- 98 661Document6 pages98 661hizballah27Pas encore d'évaluation
- 98 657Document3 pages98 657hizballah27Pas encore d'évaluation
- Lipothymie, Syncope Et Perte de Connaissance Brève: Orientation DiagnostiqueDocument4 pagesLipothymie, Syncope Et Perte de Connaissance Brève: Orientation Diagnostiquehizballah27100% (1)
- 98 679Document6 pages98 679hizballah27Pas encore d'évaluation
- 98 671Document4 pages98 671hizballah27Pas encore d'évaluation
- 98 667Document4 pages98 667hizballah27Pas encore d'évaluation
- 98 653Document4 pages98 653hizballah27Pas encore d'évaluation
- Certificat Medical D'Aptitude Au Sport: Le MédecinDocument3 pagesCertificat Medical D'Aptitude Au Sport: Le MédecinMomo SchmidtPas encore d'évaluation
- DÉONTOLOGIEDocument3 pagesDÉONTOLOGIEklenza.kitokoPas encore d'évaluation
- ISOLEMENTDocument5 pagesISOLEMENTNar Mh78% (9)
- Fiche Renseignements InscriptionDocument2 pagesFiche Renseignements InscriptionNawel MougariPas encore d'évaluation
- Epreuves de L - Examen 2008 PDFDocument4 pagesEpreuves de L - Examen 2008 PDFKhalid TadiliPas encore d'évaluation
- Rapport de Stage Assistant MidécalDocument4 pagesRapport de Stage Assistant MidécalAnonymous ivQbJJh5gE89% (9)
- AppelMaster Cohorte8Document1 pageAppelMaster Cohorte8Léon PaulinePas encore d'évaluation
- TP 1 MucoviscidoseDocument3 pagesTP 1 MucoviscidoseRania BenyaminaPas encore d'évaluation
- Urgences ChirurgicalesDocument62 pagesUrgences ChirurgicalesalmnaouarPas encore d'évaluation
- GardeDocument17 pagesGardekamalPas encore d'évaluation
- N6431972 PDF 1 - 1DM PDFDocument244 pagesN6431972 PDF 1 - 1DM PDFanon_736742916Pas encore d'évaluation
- 5 RER Et Spectre LynchDocument11 pages5 RER Et Spectre Lynchfati imadPas encore d'évaluation
- Fiche de Poste PHDocument1 pageFiche de Poste PHARMVOPPas encore d'évaluation
- Les UterotoniquesDocument1 pageLes UterotoniquesSimohamed KadiriPas encore d'évaluation
- 3a III Act1 Gene AlleleDocument1 page3a III Act1 Gene Alleleapi-263330162Pas encore d'évaluation
- FMT TunisDocument65 pagesFMT TunisThème DigestionPas encore d'évaluation
- CV Pr. Farid ISMAEL PDFDocument2 pagesCV Pr. Farid ISMAEL PDFMouna BouhlalPas encore d'évaluation
- Résolution Projet de Transformation Clinique CH La SarreDocument2 pagesRésolution Projet de Transformation Clinique CH La SarreRadio-CanadaPas encore d'évaluation