Académique Documents
Professionnel Documents
Culture Documents
Correction de La Fiche 2 PDF
Transféré par
LARIBI0 évaluation0% ont trouvé ce document utile (0 vote)
173 vues2 pagesTitre original
correction de la fiche 2.pdf
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
173 vues2 pagesCorrection de La Fiche 2 PDF
Transféré par
LARIBIDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 2
COLORANT EXERCICE COLORANT ALIMENTAIRE
3. Le colorant E120 :rouge de cochenille
3.1. On réalise une dilution.
Solution mère : Solution fille :
V ? à prélever V6 = 50,0 mL
C = 6,7×10–4 mol.L-1 C6 = 6,7×10–5 mol.L-1
Au cours d’une dilution la quantité de matière de soluté ne change pas : n = n6
C.V = C6.V6
C .V
V= 6 6
C
6,7 10 5 50,0
V= = 5,0 mL
6,7 10 4
3.2. Déterminons la masse de colorant contenue dans un chewing-gum.
Il faut d’abord déterminer la concentration molaire de la solution S.
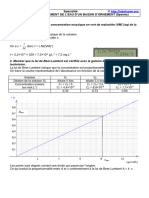
Comme il n’y a pas de feuille de papier millimétré fournie avec le sujet, on ne trace pas la courbe
représentative de l’absorbance en fonction de la concentration.
D’après la loi de Beer-Lambert, l’absorbance est proportionnelle à la concentration A = k .c.
Déterminons k le coefficient de proportionnalité.
Solution Si S1 S2 S3 S4 S5 S6
Ci
6,7 × 10–6 1,3 × 10–5 2,0 × 10–5 2,6 × 10–5 3,4 × 10–5 6,7 × 10–5
(mol.L-1)
Absorbance 0,058 0,118 0,172 0,253 0,299 0,592
A
k= k1 = k2 = k3 = k4 = k5 = k6 =
c 8,7×10 3
9,1×10 3
8,6×10 3
9,7×10 3
8,8×10 3
8,8×10 3
-1
(L.mol )
k = (k1 + k2 + k3 + k4 + k5 + k6)/6
k = 8,9×103 L.mol-1
Pour la solution S, on a A = 0,213
A
La loi de Beer-Lambert donne c = ,
k
0,213
c= = 2,4×10–5 mol.L-1 dans la solution S.
8,9 10 3
On peut alors calculer la masse d’acide carminique contenue dans un chewing-gum dissout dans
V = 50,0 mL = 0,0500 L
m
n donc m = n.M
M
Et comme n = c.V alors m = c.V.M
m = 2,4×10–5 × 0,0500 × 492 = 5,9×10–4 g = 0,59 mg par chewing-gum
La boite de 17 chewing-gums contient donc 17 × 0,59 = 10 mg d’acide carminique.
Nombre de cochenilles nécessaires pour une boite :
15
L’énoncé indique 15 000 insectes 100 g × d’acide carminique
100
donc 15 000 insectes 15 g d’acide carminique
N insectes 10×10–3 g d’acide
15000 10 103
Par proportionnalité, N = = 10 insectes pour obtenir assez de colorant pour
15
une boite de chewing-gums.
Vous aimerez peut-être aussi
- Chapitre 2-0-Pliage Des TolesDocument32 pagesChapitre 2-0-Pliage Des TolesHamza Liberados80% (5)
- Textile HabillementDocument4 pagesTextile HabillementElmehdi TalbiPas encore d'évaluation
- Ria 1 PDFDocument28 pagesRia 1 PDFamal118Pas encore d'évaluation
- Rapport BroyageDocument59 pagesRapport BroyageIhsan Afriad75% (4)
- Amelioration de La Disponibili - Safae JTITE - 4630Document151 pagesAmelioration de La Disponibili - Safae JTITE - 4630Zineddine El Mehdi MustaphaPas encore d'évaluation
- Mod4 Corrige ch8 Partie2Document8 pagesMod4 Corrige ch8 Partie2api-278378684100% (1)
- Biology Paper 1 TZ1 HLDocument16 pagesBiology Paper 1 TZ1 HLyara hazemPas encore d'évaluation
- TPDocument5 pagesTPمحمد ضياء الحقPas encore d'évaluation
- CG TP 08 PDFDocument15 pagesCG TP 08 PDFMag ManPas encore d'évaluation
- TP L2 2022 BouraadaDocument9 pagesTP L2 2022 BouraadaHanae HanaPas encore d'évaluation
- Cinétique de Dismutation de L'eau Oxygénée - Loi D'arrhenius Concours Capes Externe 2008 PDFDocument4 pagesCinétique de Dismutation de L'eau Oxygénée - Loi D'arrhenius Concours Capes Externe 2008 PDFmostafa90raouf100% (1)
- Polycopie Travaux Pratique Chimie Organique III L3Document30 pagesPolycopie Travaux Pratique Chimie Organique III L3rayanezianimalakPas encore d'évaluation
- Acide TransDocument3 pagesAcide Transouijdane marocPas encore d'évaluation
- tp17 Synthese Savon PDFDocument5 pagestp17 Synthese Savon PDFDelano TseffPas encore d'évaluation
- TP Reacteur DiscontinuDocument20 pagesTP Reacteur DiscontinuThouraya BohliPas encore d'évaluation
- TP SulfonationDocument5 pagesTP Sulfonationiphone53131100% (1)
- Fiche TD1 L3 2020Document2 pagesFiche TD1 L3 2020lamiae el moustafi100% (1)
- TP Cinétique Version FinaleDocument28 pagesTP Cinétique Version FinaleRaniaPas encore d'évaluation
- La DensitéDocument5 pagesLa Densité213020 213020Pas encore d'évaluation
- TP Macromol 2022-2023Document14 pagesTP Macromol 2022-2023IlyassPas encore d'évaluation
- Rapport de Stage (Réparé)Document17 pagesRapport de Stage (Réparé)Adda BENDJEBBOURPas encore d'évaluation
- Compte Rendu 2Document10 pagesCompte Rendu 2Houssam moussaPas encore d'évaluation
- Travaux Pratiques Coordinance S6Document21 pagesTravaux Pratiques Coordinance S6Mohamed TaouilPas encore d'évaluation
- TP ThermoDocument7 pagesTP Thermosofia safaaPas encore d'évaluation
- Extraction Liq Liq25Document6 pagesExtraction Liq Liq25fahedbou751Pas encore d'évaluation
- TP 1 Extraction Et Identification Des Piguements D'une Feuille VerteDocument7 pagesTP 1 Extraction Et Identification Des Piguements D'une Feuille VerteSoudani MoustafaPas encore d'évaluation
- Chimie B Chap8 Titrage - Acidobasique PDFDocument6 pagesChimie B Chap8 Titrage - Acidobasique PDFMouloud IssaadPas encore d'évaluation
- TP 2 FrancaisDocument4 pagesTP 2 Francaissidi mohamed el amine nekkalPas encore d'évaluation
- Première Phase:: A. en Utilisant Le DiethyletherDocument7 pagesPremière Phase:: A. en Utilisant Le Diethyletherufuq matarPas encore d'évaluation
- BUT DE TP Determination de Lordre Dune RDocument7 pagesBUT DE TP Determination de Lordre Dune RÃßdø SãñføürPas encore d'évaluation
- TP 4 - Dosage Du Vinaigre-CorrectionDocument1 pageTP 4 - Dosage Du Vinaigre-Correctionthierryleprofesseurdephysique bristolPas encore d'évaluation
- Rapport de TP ExempleDocument10 pagesRapport de TP Exemplealexandre FRANKEPas encore d'évaluation
- TD 1 Opu Skikda 2019-20Document8 pagesTD 1 Opu Skikda 2019-20mahi mahiPas encore d'évaluation
- Compte Rendu TP2 Cinétique ChimiqueDocument12 pagesCompte Rendu TP2 Cinétique ChimiquePONDIKPA KondiPas encore d'évaluation
- Compte Rendu 1Document4 pagesCompte Rendu 1Fatima Aidara100% (1)
- TP2 PH Métrie 2022-2023Document6 pagesTP2 PH Métrie 2022-2023abderrahmane lalaouiPas encore d'évaluation
- TP 3 Estimation de La Concentration en Ions Nitrate de L'eau Du Robinet.Document3 pagesTP 3 Estimation de La Concentration en Ions Nitrate de L'eau Du Robinet.Nøûr SínëPas encore d'évaluation
- Etude Cinetique D'Une Reaction Du 2 Ordre TP N°1Document2 pagesEtude Cinetique D'Une Reaction Du 2 Ordre TP N°1Ikram GrPas encore d'évaluation
- Compte Rendu Cinetique Ch4 Ismail Et InesDocument5 pagesCompte Rendu Cinetique Ch4 Ismail Et InesIsmail ZitouniPas encore d'évaluation
- P2016 CM11 TP FasciculeDocument44 pagesP2016 CM11 TP FasciculeRochdi BAATIPas encore d'évaluation
- TP de Chimie MinéraleDocument22 pagesTP de Chimie MinéraleSouhila BETCHPas encore d'évaluation
- Correction To CinetiqueDocument5 pagesCorrection To CinetiquejaywalkPas encore d'évaluation
- Des Définitions: TP N1: Préparation D'une Solution D'acide Faible, L'acide OxaliqueDocument3 pagesDes Définitions: TP N1: Préparation D'une Solution D'acide Faible, L'acide Oxaliquesidi mohamed el amine nekkalPas encore d'évaluation
- TP 3: Séparation Et Purification Par Distillation Fractionnée Cas D'une Estérification II) Manipulation: A. SécuritéDocument3 pagesTP 3: Séparation Et Purification Par Distillation Fractionnée Cas D'une Estérification II) Manipulation: A. SécuritéBøũdįāf KhäwlåPas encore d'évaluation
- Distillation Fractionnée D'un Mélange Binaire (Eau - Acétone)Document4 pagesDistillation Fractionnée D'un Mélange Binaire (Eau - Acétone)achhamoudaPas encore d'évaluation
- TP Chromato Colonne Colorants AlimentaireDocument4 pagesTP Chromato Colonne Colorants AlimentaireJulien SanseverinoPas encore d'évaluation
- TP de Chimie Organique II - 22-23Document9 pagesTP de Chimie Organique II - 22-23Ayoub Ichfi0% (1)
- TD 2 Bio IhnibiteursDocument1 pageTD 2 Bio IhnibiteursMohamed EL AminePas encore d'évaluation
- VolumetrieDocument9 pagesVolumetriebounegabPas encore d'évaluation
- Thermo-1 DjaberDocument6 pagesThermo-1 DjaberSara BenPas encore d'évaluation
- Compte Rendu de TP ModeleDocument1 pageCompte Rendu de TP ModeleIOana BorcaPas encore d'évaluation
- Manuel de TP CHM 332 2023-2024Document20 pagesManuel de TP CHM 332 2023-2024michelakon1Pas encore d'évaluation
- Exercices Suppl CinetiqueDocument2 pagesExercices Suppl CinetiqueJoulia Fezzani0% (1)
- 1 Synthese D Une Base de SchiffDocument3 pages1 Synthese D Une Base de SchiffbiohanaPas encore d'évaluation
- ExempleDocument3 pagesExempleangelinamorenaPas encore d'évaluation
- L'adsorption de Méthylène PDFDocument12 pagesL'adsorption de Méthylène PDFAymene Salah BendrihemPas encore d'évaluation
- Bilan TPO - 02Document12 pagesBilan TPO - 02Simona StefanPas encore d'évaluation
- DistillationDocument5 pagesDistillationadelPas encore d'évaluation
- 2005 AmSud Correction Exo3 Cinetique Sapo 6 5ptsDocument3 pages2005 AmSud Correction Exo3 Cinetique Sapo 6 5ptsFoudil LaouiciPas encore d'évaluation
- TP SMC S3 EstérificationDocument4 pagesTP SMC S3 EstérificationIstabraq AzPas encore d'évaluation
- PS CMM b3 TP Dosage Du Diiode Dans La BetadineDocument7 pagesPS CMM b3 TP Dosage Du Diiode Dans La BetadinemranonimosPas encore d'évaluation
- Binaires 2Document8 pagesBinaires 2محمد الفاتح100% (1)
- TP AbidiDocument11 pagesTP AbidiLara sennaouiPas encore d'évaluation
- Catalyse Suivi Cinetique2Document2 pagesCatalyse Suivi Cinetique2Fatima YahiaPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- 2017 Metropole Exo3 Spe Correction 5ptsDocument2 pages2017 Metropole Exo3 Spe Correction 5ptsantoineheude78Pas encore d'évaluation
- 2021 09 Metro Sujet1 ExoA Correction Encre BeerCinetique 5ptsDocument4 pages2021 09 Metro Sujet1 ExoA Correction Encre BeerCinetique 5ptsClémentine TakumiPas encore d'évaluation
- EFFICACITE ENERGETIQUE - Processus de Fabrication de Sucre (La Cosumar)Document21 pagesEFFICACITE ENERGETIQUE - Processus de Fabrication de Sucre (La Cosumar)Abdellah Samadi100% (3)
- Analyse TGADocument20 pagesAnalyse TGAzhor El hallaoui100% (1)
- PDR Pour Analyseur Chimiques Et SondesDocument19 pagesPDR Pour Analyseur Chimiques Et SondesSODEX FRANCEPas encore d'évaluation
- Application Des Méthodes Expérimentales Dans Des Structures en B.ADocument25 pagesApplication Des Méthodes Expérimentales Dans Des Structures en B.ANazim KASSABPas encore d'évaluation
- MANSOURI Fatima-Converti - 3Document97 pagesMANSOURI Fatima-Converti - 3Ouail guePas encore d'évaluation
- Mémo Thermochimie Chap 1 MP 22Document3 pagesMémo Thermochimie Chap 1 MP 22emilian ghaniPas encore d'évaluation
- Adet 0251 Fraisage Usinage Matériaux MétalliquesDocument22 pagesAdet 0251 Fraisage Usinage Matériaux MétalliquesOkbaPas encore d'évaluation
- Aniosyme Pla IiDocument8 pagesAniosyme Pla IiAbdelPas encore d'évaluation
- Leçon N6 Reactions Les Solutions Avec Les MetauxDocument3 pagesLeçon N6 Reactions Les Solutions Avec Les MetauxAgnaou MohamedPas encore d'évaluation
- Exp RaffinageDocument15 pagesExp RaffinageNøü ĐaPas encore d'évaluation
- TD 3 Et CorrectionDocument10 pagesTD 3 Et CorrectionCǿêûr Ðê PîirâtêPas encore d'évaluation
- BP Chap2 PDFDocument15 pagesBP Chap2 PDFHamedGamaounPas encore d'évaluation
- N2016SM PDFDocument8 pagesN2016SM PDFmjidooooPas encore d'évaluation
- Fup FRDocument16 pagesFup FRMohamed ChelfatPas encore d'évaluation
- T1 C1A2 COURS Evolution AtmosphèreDocument1 pageT1 C1A2 COURS Evolution AtmosphèresimousseePas encore d'évaluation
- Criteres D'acceptation API 1104Document1 pageCriteres D'acceptation API 1104Had Rayane100% (2)
- 32examen National Physique Chimie Sciences Maths 2018 Rattrapage CorrigeDocument4 pages32examen National Physique Chimie Sciences Maths 2018 Rattrapage CorrigeAssia OunkhirPas encore d'évaluation
- La Gaine de Câble À Fibre Optique ++++Document1 pageLa Gaine de Câble À Fibre Optique ++++Abdelhamid SammoudiPas encore d'évaluation
- Les Structures PoreusesDocument9 pagesLes Structures PoreusesSeddik hPas encore d'évaluation
- TDPermDocument4 pagesTDPermAmine HeddoubPas encore d'évaluation
- Norme Européenne: NF EN 10028-5Document13 pagesNorme Européenne: NF EN 10028-5Noureddine SemaraPas encore d'évaluation
- Contribution À L'optimisation D'une Chaine de Conversion D'énergie PhotovoltaïqueDocument141 pagesContribution À L'optimisation D'une Chaine de Conversion D'énergie PhotovoltaïqueMoez YoussefPas encore d'évaluation
- 10 SD FRDocument4 pages10 SD FRabbes ben hemanaPas encore d'évaluation