Académique Documents
Professionnel Documents
Culture Documents
Synthèse de L'ammoniac
Transféré par
Saoud Hadjer0 évaluation0% ont trouvé ce document utile (0 vote)
58 vues9 pagesTitre original
synthèse de l'ammoniac
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
58 vues9 pagesSynthèse de L'ammoniac
Transféré par
Saoud HadjerDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 9
Synthèse industrielle de l’ammoniac
L’ammoniac est un élément essentiel à l’industrie des engrais, d’explosifs, de carburants et de
polymères.
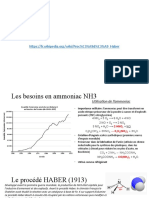
Sa production mondiale a connu une très forte hausse et dépasse les 140 Mt, c’est un produit
d’intérêt majeur pour l’industrie chimique
Sa synthèse se fait aujourd’hui essentiellement selon le procédé dit « Haber-Bosch » à partir de
la réaction d’équation :
Le diazote est fourni par l’air qui contient environ 80 % de diazote gazeux N2 et le dihydrogène
par vaporeformage du méthane CH4. Les conditions opératoires sont particulièrement sévères,
car le diazote est chimiquement peu réactif à cause de sa liaison covalente triple :
Le développement du procédé Haber-Bosch fut réalisé par une équipe de la société BASF en
Allemagne en 1913 et contribua à récompenser les chimistes Haber et Bosch d’un prix Nobel de
Chimie 1.
Pour parvenir à synthétiser l’ammoniac de façon industriellement rentable, les étapes sont les
suivantes :
1. Amont du réacteur chimique :
(a) Production de H2 par vapoformage de CH4,
(b) Purification du H2.
2. Dans le réacteur chimique :
(a) Synthèse catalytique de NH3(g) par mélange de H2(g) et N2(g) selon N2 + 3H2 = 2NH3.
3. Aval du réacteur chimique :
(a) Séparation des produits et réactifs par liquéfaction,
(b) Recyclage des molécules restantes
4. Recyclage de l’énergie thermique libérée.
Le schéma ci-dessous décrit les différentes parties d’un site
industriel :
Schéma simplifié du procédé Haber-Bosch pour la synthèse
industrielle d’ammoniac
Étude des différentes étapes
Bloc 1 préparation du gaz de synthèse par une désulfuration et reformage du méthane
en deux étapes :
· Le reformage primaire où se déroulent principalement les réactions
Le reformage secondaire
Bloc 2 réalise la purification du mélange par :
· Conversion du CO en CO2 selon la réaction de shift.
· Élimination du dioxyde de carbone (décarbonatation) par absorption en solution aqueuse.
Le (CO et CO2) résiduels sont transformés en méthane (CH4) en passant par la
Méthanisation catalytique avec H2,
Le bloc 3 réalise la synthèse d’ammoniac
• Compression du gaz de synthèse purifié (à partir d’une pression approximativement
(25bar,38°C) jusqu'à environ (est comprimé jusqu’à (63 bars et 187°C),110 à140 bar)) et envoyé
vers la boucle de synthèse
• Synthèse(Dans un convertisseur catalytique approximativement à 137 bar et 440º C, on
obtient du gaz ammoniac)
Le réacteur de synthèse est formé d’une enveloppe à haute pression qui contient une section
catalytique et un échangeur de chaleur
Le gaz de synthèse à une température de 144°C et à une pression de 148 bars
Où se déroule la réaction de synthèse :N2 + 3H2 ------- 2NH3 ( – 26,74 kcal/mole)
• Réfrigération (qui par réfrigération, condensation et séparation, en envoyant à l'unité de
stockage cryogénique)
• Stockage de NH3 sous forme de liquide -33°C (il est distribué aux consommateurs
internes et à l'expédition)
Vous aimerez peut-être aussi
- CG GC 2007Document3 pagesCG GC 2007Kacem MokdedPas encore d'évaluation
- Chapitre II - CMI-2021Document6 pagesChapitre II - CMI-2021amaniPas encore d'évaluation
- Chapitre C2: Thermodynamique de La Transformation Chimique: Application Du Deuxieme Principe A La Transformation CHIMIQUE: Approche DocumentaireDocument6 pagesChapitre C2: Thermodynamique de La Transformation Chimique: Application Du Deuxieme Principe A La Transformation CHIMIQUE: Approche DocumentaireZakariae BennacerPas encore d'évaluation
- 3 Procédés Pétrochimiques Gaz de SyntheseDocument19 pages3 Procédés Pétrochimiques Gaz de SyntheseKadi MiragePas encore d'évaluation
- Cours Découverte Fabrication de L'ammoniac: CH SH +H CH + H SDocument6 pagesCours Découverte Fabrication de L'ammoniac: CH SH +H CH + H SYahia ChouderPas encore d'évaluation
- Synthése de L'ammoniac (Procédé Haber)Document5 pagesSynthése de L'ammoniac (Procédé Haber)Amine100% (2)
- 2.2. Synthèse Et Stockage de L'ammoniacDocument8 pages2.2. Synthèse Et Stockage de L'ammoniacVeron djonkepPas encore d'évaluation
- Synth NH3 EDocDocument5 pagesSynth NH3 EDoclilia Bennaceur FarahPas encore d'évaluation
- Stami CarbonDocument8 pagesStami CarbonAminaPas encore d'évaluation
- Production Du MéthanolDocument14 pagesProduction Du MéthanolSnøw WhītePas encore d'évaluation
- MethanoleDocument21 pagesMethanoleWįs SāmPas encore d'évaluation
- Cours 04 PDFDocument7 pagesCours 04 PDFHam ZaPas encore d'évaluation
- AmmoniacDocument6 pagesAmmoniacKreirate Sid Ahmed50% (2)
- Cours L2 2021 6Document3 pagesCours L2 2021 6Nedjm EddinePas encore d'évaluation
- Bts Cira U31-SujetDocument6 pagesBts Cira U31-SujetVeron djonkepPas encore d'évaluation
- TD 1Document4 pagesTD 1Jonas lumbuPas encore d'évaluation
- Production Des Gaz Par Vaporeformage PDFDocument20 pagesProduction Des Gaz Par Vaporeformage PDFAyoub L'voy0% (1)
- Production Des Gaz Par VaporeformageDocument20 pagesProduction Des Gaz Par VaporeformageAyoub L'voy100% (2)
- Petrochimie Correct2 (3)Document41 pagesPetrochimie Correct2 (3)Franck EinsteinPas encore d'évaluation
- Chapitre 5 Les Grandes Synthèses MinéralesDocument6 pagesChapitre 5 Les Grandes Synthèses Minéralesrefran daliaPas encore d'évaluation
- Production de Matières Premières-ConvertiDocument25 pagesProduction de Matières Premières-ConvertiMŏhặ MdnPas encore d'évaluation
- Synthése de Méthanol Aomine Ski2019Document11 pagesSynthése de Méthanol Aomine Ski2019Hadia DjeltiPas encore d'évaluation
- Examen de Génie ChimiqueDocument4 pagesExamen de Génie ChimiqueAnis Bouhous100% (2)
- Wa0017.Document1 pageWa0017.Bentama FatimaPas encore d'évaluation
- Rapport de Stage Sur La Production Du MéthanolDocument16 pagesRapport de Stage Sur La Production Du Méthanolbouzisb-boyPas encore d'évaluation
- CoursDocument24 pagesCoursTaim Khouri100% (2)
- Cours de Pétrochimie-ULTDocument23 pagesCours de Pétrochimie-ULTSana100% (12)
- 4.obtention Du Gaz de SynthèseDocument4 pages4.obtention Du Gaz de Synthèsebest musicPas encore d'évaluation
- Craquage À La Vapeur-Converti-SignéDocument8 pagesCraquage À La Vapeur-Converti-SignéMŏhặ MdnPas encore d'évaluation
- Obtention de L'ammoniac Procédé HABER-BOSCH: N + 3H 2NHDocument3 pagesObtention de L'ammoniac Procédé HABER-BOSCH: N + 3H 2NHMa LiaPas encore d'évaluation
- TD1 Genie Des Procedes L3MGPDocument3 pagesTD1 Genie Des Procedes L3MGPEnoc LataPas encore d'évaluation
- Projet UreeDocument15 pagesProjet UreeMoncef SgPas encore d'évaluation
- Ac NitriqueDocument13 pagesAc NitriquenoamanPas encore d'évaluation
- Chapitre 2Document48 pagesChapitre 2Amine FeraounPas encore d'évaluation
- Reformage Catalytique-ConvertiDocument7 pagesReformage Catalytique-ConvertiMarwa BzgPas encore d'évaluation
- 1.matières Premières PétrochimieDocument23 pages1.matières Premières Pétrochimiebest musicPas encore d'évaluation
- Expose PetrochimieDocument13 pagesExpose Petrochimiehalidou N'samboPas encore d'évaluation
- Serie1 3eme RaffinageDocument2 pagesSerie1 3eme RaffinageRaid ChenikherPas encore d'évaluation
- Oxydation Des ParaffinesDocument11 pagesOxydation Des ParaffinesHadjer zit100% (1)
- CHAPITRE 01-1liquifactionDocument14 pagesCHAPITRE 01-1liquifactionSavana BellaPas encore d'évaluation
- 1dead0f4c1e26b1ac0a477dd32b08b4cDocument5 pages1dead0f4c1e26b1ac0a477dd32b08b4cabderrahimnPas encore d'évaluation
- 4eme Cours 2019 Tizi ReformzgrDocument5 pages4eme Cours 2019 Tizi ReformzgrophePas encore d'évaluation
- Reformage CatalytiqueDocument17 pagesReformage CatalytiqueAhmad TlilaniPas encore d'évaluation
- Le ReformageDocument4 pagesLe ReformageAbabacar Mbaye DIAGNEPas encore d'évaluation
- RendementchaudDocument6 pagesRendementchaudnoorkr19Pas encore d'évaluation
- 2 Procédés Pétrochimiques VapocraquageDocument7 pages2 Procédés Pétrochimiques VapocraquageKadi MiragePas encore d'évaluation
- Exposé Stage D'embocheDocument46 pagesExposé Stage D'embochelopir120100% (2)
- 3eme Cours 2019Document10 pages3eme Cours 2019anon_509931202Pas encore d'évaluation
- Simulation Production de MéthanolDocument10 pagesSimulation Production de MéthanolMjaied Sawsen100% (2)
- Ac NitriqueDocument26 pagesAc NitriqueMame Thierno Sene100% (1)
- Chapitre 2Document11 pagesChapitre 2infor. andPas encore d'évaluation
- EXPOSES - VapocraquageDocument15 pagesEXPOSES - VapocraquageLAHCIENE TAHAR100% (2)
- Présentation 2Document36 pagesPrésentation 2wissal1111 blmPas encore d'évaluation
- IsomerisationDocument6 pagesIsomerisationyahiPas encore d'évaluation
- Bac de StoquageDocument8 pagesBac de StoquageproPas encore d'évaluation
- Generalité Sur LammoniacDocument5 pagesGeneralité Sur Lammoniacdridermoussa4Pas encore d'évaluation
- Fabrication Du Gaz de Synthèse: 2 CondDocument6 pagesFabrication Du Gaz de Synthèse: 2 CondMa LiaPas encore d'évaluation
- NH 3Document14 pagesNH 3amina ennoualPas encore d'évaluation
- Fiche Méthode - Distillation Fractionnée PDFDocument1 pageFiche Méthode - Distillation Fractionnée PDFSaoud Hadjer100% (1)
- TD1 Hydrodynamique - Bernoulli (Parfait) Correction PDFDocument31 pagesTD1 Hydrodynamique - Bernoulli (Parfait) Correction PDFSaoud HadjerPas encore d'évaluation
- TD Ndeg7 - Spectro Uv-Visible To PDFDocument2 pagesTD Ndeg7 - Spectro Uv-Visible To PDFSaoud HadjerPas encore d'évaluation
- Courrs PétrochimieDocument20 pagesCourrs PétrochimieSaoud HadjerPas encore d'évaluation
- Bilan Énergétique Sur La ColonneDocument4 pagesBilan Énergétique Sur La ColonneSaoud HadjerPas encore d'évaluation
- Chapitre 2 Organique Classification Des Fonctions OrganiquesDocument13 pagesChapitre 2 Organique Classification Des Fonctions OrganiquesSaoud HadjerPas encore d'évaluation
- AAASession 13 - CamerounDocument32 pagesAAASession 13 - CamerounDaniel Ndob boum100% (1)
- m14 Systeme ThermiqueDocument3 pagesm14 Systeme ThermiqueMohamed LaribiPas encore d'évaluation
- Correction de Lexercice 3 de La Série 1Document10 pagesCorrection de Lexercice 3 de La Série 1medmm200430Pas encore d'évaluation
- Corrosion Des Metaux M1Document18 pagesCorrosion Des Metaux M1Lkl HadjerPas encore d'évaluation
- 3 HakkouDocument8 pages3 HakkouMahaPas encore d'évaluation
- Human GeographyDocument2 pagesHuman GeographySimple IdeaPas encore d'évaluation
- Historique de EddDocument17 pagesHistorique de EddChaima MarzoukPas encore d'évaluation
- Rockwool Catalogue Solutions Isolation Bâtiment 2011Document200 pagesRockwool Catalogue Solutions Isolation Bâtiment 2011Hervé AngPas encore d'évaluation
- .Equipements Electriques - 1646142137000Document38 pages.Equipements Electriques - 1646142137000JoPas encore d'évaluation
- THERMODYNAMIQUE II Chapitres FondamentauxDocument262 pagesTHERMODYNAMIQUE II Chapitres FondamentauxDavi Nordel NgondzaPas encore d'évaluation
- Compensation de L'énergie RéactiveDocument1 pageCompensation de L'énergie RéactiveSarahSaidiPas encore d'évaluation
- ST GermainDocument6 pagesST GermainJean-Loïc BauchetPas encore d'évaluation
- ParasismiqueDocument120 pagesParasismiqueJalal KePas encore d'évaluation
- These Nouacer Sana PDFDocument143 pagesThese Nouacer Sana PDFSoussou PerlaPas encore d'évaluation
- Universite Kasdi MerbahDocument5 pagesUniversite Kasdi MerbahKaouachi Ahmed LouayPas encore d'évaluation
- HOUSSAMATOU - DOUDOUA Ligne PDFDocument93 pagesHOUSSAMATOU - DOUDOUA Ligne PDFAlassane KeitaPas encore d'évaluation
- Rapporte 1 Ayoub BakhtiDocument24 pagesRapporte 1 Ayoub BakhtiAyoub BakhtiPas encore d'évaluation
- Pollution Du Sol Assia YamounDocument92 pagesPollution Du Sol Assia YamounYamounAssia100% (4)
- TD #01 Limites de La Théorie ClassiqueDocument2 pagesTD #01 Limites de La Théorie Classiquemahfoud1254Pas encore d'évaluation
- GEI Physique 2021Document8 pagesGEI Physique 2021qzc4sstkgxPas encore d'évaluation
- Rapport Finale Boubaker 2020Document38 pagesRapport Finale Boubaker 2020Mohamed LamraniPas encore d'évaluation
- GeoradarDocument41 pagesGeoradargeonourePas encore d'évaluation
- Programmes FASA Avec Descriptifs Final Final XXXDocument185 pagesProgrammes FASA Avec Descriptifs Final Final XXXN LislaurePas encore d'évaluation
- Article Carbone Jatropha 2014Document21 pagesArticle Carbone Jatropha 2014Gouhoungou RogatienPas encore d'évaluation
- Fiche Smart Grids PDFDocument5 pagesFiche Smart Grids PDFthe.diable.tristrePas encore d'évaluation
- BLANC - PUGHE - CHARTHIER - Littérature Et Écologie - Vers Une Écopoétique PDFDocument12 pagesBLANC - PUGHE - CHARTHIER - Littérature Et Écologie - Vers Une Écopoétique PDFMarcelo SpitznerPas encore d'évaluation
- 2023A - GCH2525 - Thermodynamique II - Chapitre 04 - Equilibre Thermo (Partie I)Document23 pages2023A - GCH2525 - Thermodynamique II - Chapitre 04 - Equilibre Thermo (Partie I)Rim Ben othmanPas encore d'évaluation
- Chapitre 1 Géologie Minière (L3 Valo)Document6 pagesChapitre 1 Géologie Minière (L3 Valo)Blanckoo BlanckooPas encore d'évaluation
- ZZZ Suppexos Me3 Me4 Energetique-3Document10 pagesZZZ Suppexos Me3 Me4 Energetique-3Maryam MaryamPas encore d'évaluation