Académique Documents
Professionnel Documents
Culture Documents
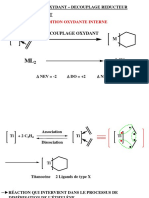
Organometalliques
Transféré par
abdelouahed.rhaouiTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Organometalliques
Transféré par
abdelouahed.rhaouiDroits d'auteur :
Formats disponibles
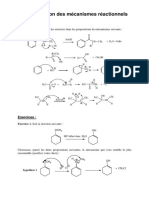
ORGANOMETALLIQUES
Exercice n°1
Donner le mécanisme et le produit final lors de l’action du chlorure de méthylmagnésium
sur les composés suivants :
O C2H5 O
H C2 H5 H C C2 H5 C N
C O
O C2H5
O C2H5
H3C O
C=N
O CO2 , - 40°C
H3C C2 H5
CH3
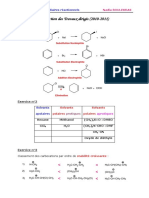
Exercice n°2
Quel organométallique, symbolisé ici par R-M, doit-on utiliser pour effectuer les
transformations suivantes ?
R
O
éther
R-M + C OH à 100%
CH
+
puis H3O
H
O O
R-M + C éther
C à 100%
H +
puis H3O
H
R
Exercice n°3
Indiquer comment, par synthèse magnésienne avec CH3-MgBr, on peut passer de l’acide 4-
hydroxypentanoïque au 2-méthylhexane-2,5-diol, sachant que l’acide initial est d’abord
transformé par chauffage en un composé dont la masse molaire est 100 g.mol-1.
Exercice n°4
Donner le produit final (après hydrolyse) de l’action du bromure de méthylmagnésium sur :
a- l’acide éthanoïque b- le propyne
c- le 1,2-époxypropane d- le propanenitrile
Cl. Viel – RNChimie 1
Exercice n°5
Donner le produit formé par les réactions ci-dessous suivies d’une hydrolyse acide :
CH3-MgBr + HCHO 2-méthylhept-2-èn-6-one + BrZn-CH 2-COOEt
Φ-MgBr + Φ-COOEt
MgBr + CO2
+ CH3COCl
O
MgBr 1- CH3-Li
+
2- (CH3)2CuLi
+ CdCl2 puis CH3COCl
MgBr CH3(CH2)4-MgBr + H-C(OEt)3
Exercice n°6
Identifier E et F ; mécanisme et réactifs des différentes étapes :
(1) OH HBr
A Br
B C
O
1-(2) HBr (3)
2-A
E F
D OH
OH
(4)
F
Exercice n°7
Donner le produit final (après hydrolyse) de l’action du bromure de phénylmagnésium en
excès sur :
a- le benzoate de méthyle b- l’éthanoate de phényle
c- le carbonate de diméthyle d- une lactone
H3C-O-C-O-CH3
O
O O
Cl. Viel – RNChimie 2
Exercice n°8
Compléter les réactions suivantes :
hν Mg CO2 H3O+
a- (CH3)4C + Br2 A1 B1 C1 D1
éther -40°C
propanone H3O+
b- CH3-C CH + C2H5MgBr A2 B2 C2
Mg propanone H3O
+
c- CH3CH2CH2OH + PBr3 A3 B3 C3 D3
éther
d- +
CH CH CHO + CH3MgBr A4 + A5 H3O B4 + B5
B5 H2SO4 H2O + C5
Δ
C N
H3O
+
e- Br + Mg éther A6 B6 C6
Exercice n°9
14
Synthèses d’isotopoméres à l’aide de dioxyde de carbone marqué au carbone 14 : CO2.
Compléter les réactions :
14 +
CO2,-40°C H3O
a- MgBr A B
éther
14 1-CH3MgX,éther,-40°C C2H5OH
b- CO2 C D
2-H3O
+ H+ cat
BrMg MgBr
1- , éther
D H+ Se
E F G
2-H3O
+ Δ,-H2O Δ
-
1-MnO4 ,Δ
G H
+
2- H
Exercice n°10
Proposer, à partir de l’éthène comme seul réactif organique, et de tout réactif minéral
nécessaire, une synthèse de :
a- acide propanoïque
b- butan-1-ol
c- pentan-3-one
Cl. Viel – RNChimie 3
Exercice n°11
Comment préparer, en une ou plusieurs étapes, à partir du bromure de phénylmagnésium et
de réactifs organiques ou minéraux courants de :
a- 1-phénylpropan-2-one b- acide 2-phényléthanoïque
c- 1,1-diphényléthanol d- 1,2-diphényléthanol
Exercice n°12
a- le 1-chlorocyclohexane, traité par la soude, donne deux produits organiques C et D,
dont l’un d’entre eux, D, est un hydrocarbure qui peut réagir sur le dibrome.
b- le 1-chlorocyclohexane réagit avec le magnésium dans l’éther ; la solution
résultante est traitée, soit par C, soit par D, soit par du diiode.
Écrire les réactions éventuelles et les produits obtenus.
c- le composé E obtenu par réaction avec le diiode est traité par le cyanure de
potassium pour donner un composé F qui est traité ensuite par la solution magnésienne
précédente pour conduire, après hydrolyse acide, au composé G. Écrire les réactions en
donnant les formules de E , F et G.
Exercice n°13
Le traitement de la 6-méthylhept-5-én-2-one par l’acide chlorhydrique conduit au composé A
1- Quelle est la formule développée de A ?
On transforme totalement A en un organomagnésien B, en utilisant une quantité
stoechiométrique de Mg. Par chauffage à reflux, on provoque diverses réactions.
Après hydrolyse et extraction on isole par distillation fractionnée trois composés C, D et E.
2- C présente une bande d’absorption intense en infra-rouge à 1715 cm-1. Sa masse molaire
est 128 g.mol-1. Indiquer sa structure et son mode de formation.
3- D, chauffé en milieu acide, conduit au 1,5,5-triméythyl cyclopentène. Quelle est la
structure de D ? Justifier sa formation.
4- E, chauffé en milieu acide, forme F dont l’ozonolyse réductrice conduit à la 3,3-
diméthyloctane-2,7-dione et au 4-méthylpentanal. Expliquer ces réactions et donner la
structure de E.
Donner les formules développées de C, D et E et expliquer leur formation.
Exercice n°14
Identifier R, R’, R1, R2 , R3 et R4 dans les réactions suivantes :
O
R-MgBr + C 2-méthylhexan-2-ol
R1 R2
O
R'-MgBr + C 2-méthylhexan-2-ol
R3 R4
Cl. Viel – RNChimie 4
Exercice n°15
On réalise une solution magnésienne à partir du 1-idopentane. On utilise 15,0 mL de 1-
iodopentane et du magnésium en léger excès. Le solvant est l’éther. Le volume final de la
solution est 112 mL.
Données : ρ(1-iodopentane)=1,52g.mL-1 ; M(I)=127 g.mol-1
1- Quelle serait la concentration en organomagnésien, en mol.L-1, si la réaction de
l’iodopentane et du magnésium était totale?
2- On prélève 10,0 mL de la solution magnésienne que l’on hydrolyse par 100,0
mL d’une solution aqueuse à 0,20 mol.L-1 d’acide chlorhydrique. Il faut 11,3
mL d’une solution aqueuse d’hydroxyde de sodium à 1 mol.L-1 pour titrer
l’acide n’ayant pas réagit.
a- Donner les réactions qui interviennent dans ce titrage.
b- Calculer la concentration de l’organomagnésien et le rendement de la
préparation.
3- On fait réagir 10,0 mL de la solution magnésienne du 1- avec 10,0 mL de
solution de diiode à 1 mol.L-1 dans le toluène. Le diiode qui n’a pas réagit est
dosé par une solution de thiosulfate de sodium : il en faut 25,7 mL à 0,20
mol.L-1 pour atteindre l’équivalence.
a- Écrire les équations des réactions qui interviennent dans ce titrage.
b- Pourquoi n’a t-on pas pris une solution aqueuse d’iode ?
c- Calculer la concentration en organomagnésien et le rendement de la
préparation ; justifier la différence avec les résultats du 2- .
Exercice n°16
Dans les réactions suivantes donner la nature du réactif qui permettra d’obtenir le produit final
après hydrolyse :
a- Et-MgBr → pentan-3-ol d- Pr-MgBr → pentan-1-ol
b- Ph-MgBr → 1-phénylpropan-1-one e- CO2 → acide 2-phényléthanoïque
c- Me-MgBr → 2-méthylbutan-2-ol + f- Me-MgBr →
méthanol diméthyltertiobutylamine
Cl. Viel – RNChimie 5
Exercice n°17
Compléter la suite de réactions :
1- 2 éthanal,éther HI excès 2 Mg
2 Mg
1,4-dibromobutane A B C D
éther éther
2- H3O
1- éther
D + méthanoate de méthyle F : C9H18O
2- H3O
Exercice n°18
Une cétone R1-CO-R2, a pour masse molaire 100 g.mol-1. L’analyse élémentaire pondérale
donne les résultats suivants : 72% de carbone et 12% d’hydrogène.
Traitée par l’iodure de méthylmagnésium dans l’éther anhydre, puis par hydrolyse acide, cette
cétone fournit un alcool dédoublable en énantiomères.
Quelle est la formule de cette cétone ?
Exercice n°19
Indiquer comment on peut préparer, à partir du bromure de phénylmagnésium, en une ou
plusieurs étapes, les composés suivants :
a- d- CH CH2
H
O O
b- e-
OH CH3
OH
c- CH3 f- CH2 CH2 Br
CH3
Cl. Viel – RNChimie 6
Exercice n°20
Donner le détail de l’action de CH3MgCl suivie d’hydrolyse sur les composés suivants :
O
N
O N
Exercice n°21
1- Une mole d’un composé A est traitée par une mole de bromure d’éthylmagnésium.
Après hydrolyse acide on obtient 25% d’un produit B1 et 75% d’un produit B2.
1-1- B1 se déshydrate facilement en milieu acide et peut conduire à un mélange C de
trois composés C1, C2 et C3.
1-2- C1 et C2 sont des produits normalement attendus, dont un mélange équimolaire
donne par ozonolyse réductrice les composés suivants : méthanal, éthanal, 2-
oxopropanal, 2-oxobutanal.
1-3- B2 réagit sur un excès de bromure d’éthylmagnésium et conduit après hydrolyse à
un composé E qui se déshydrate facilement en milieu acide pour donner un
mélange F dont l’hydrogénation catalytique en présence de Ni de Raney conduit à
un carbure G, symétrique, possédant deux carbones asymétriques et de formule
C9H20.
2- On demande de déterminer les composés A, B1, B2, C1, C2, E, F et G et d’expliquer les
réactions (nomenclature systématique).
3- De C1 et C2, quel est le produit prédominant ? Pourquoi ?
4- C3 est obtenu après réarrangement interne lors de la déshydratation. Expliquer sa
formation.
Cl. Viel – RNChimie 7
Exercice n°22
1- On désire transformer totalement la 4-bromobutan-2-one en un composé
organomagnésien en utilisant une quantité stoechiométrique de magnésium. Par
chauffage à reflux de l’éther jusqu'à disparition du métal, on provoque diverses
réactions.
Après hydrolyse et extraction, on isole trois composés B , C et de la butanone D.
B est un composé bifonctionnel, C et D sont isomères.
Après déshydratation du composé B, on réalise une ozonolyse réductrice qui
conduit au 3-oxo butanal ainsi qu’à la butanone.
Préciser les conditions opératoires de l’ozonolyse réductrice.
Donner les formules des composés B, C et D.
Exercice n°23
2- On réalise une hydrogénation partielle sur l’éthyne puis on ajoute du bromure
d’hydrogène sur le produit obtenu. On isole E. Donner la structure de E.
3- L’action de la butènone sur le magnésien issu de E conduit, après hydrolyse, à une
cétone F et à un autre produit organique G.
Donner les formules de F et G ainsi que les mécanismes conduisant à leur
formation.
4- L’action de l’acide bromhydrique sur G conduit à deux isomères de position H et
H’ de formule brute C6H11Br.
Quels sont les sites de la molécule qui peuvent être, à priori, attaqués ?
Quel est le site le plus réactif ? (justifier)
Proposer alors un mécanisme rendant compte de l’obtention de H et H’.
Exercice n°24
Compléter le schéma réactionnel suivant :
Br2 Mg ZnCl2
A B C
AlCl3 éther
O
C+ éther LiAlH4
C D E
Cl
Cl. Viel – RNChimie 8
Exercice n°25
Compléter les réactions suivantes :
O O
1-éther HO , Δ
+ A B
H Br-Zn O C2H5 2- H3O
H3O 1 mol SOCl2 AlCl3 H,Δ
B C D K bicyclique L
- H2O
1- (CH3)2CuLi
L M
2- H3O
Exercice n°26
Compléter les réactions suivantes :
Br
1-éther MnO4
+ Mg éther A ; A + CuI + O B C
CH3
2-hydrolyse
HO
H3O SOCl2 HO
C D E F composé tricyclique, β-dicétone
- Cl
Cl. Viel – RNChimie 9
Exercice n°27
Compléter les réactions suivantes :
O O
1- éther H3O ,Δ
+ A B
CH3 - H2O
CH Br-Zn O Et 2- H3O
CH3
H2, Ni Raney 1- LiAlH4,éther PBr3 CN
B C D E F
25°C,1 bar DMSO
2- H3O
1- CH3MgBr
éther
F G
2- H3O
Exercice n°28
Un composé de formule brute C4H7ON est traité par une quantité stoechiométrique de
bromure de méthylmagnésium. Aucun dégagement de méthane n’a lieu et, après hydrolyse
totale en présence d’un excès d’acide chlorhydrique, on isole un composé C5H10O2 (A).
Ce dernier, traité à nouveau mole à mole par le bromure de méthylmagnésium, conduit, après
hydrolyse acide, à B (C6H14O2). B est déshydraté en C et celui-ci est hydrogéné
catalytiquement en D.
Par ailleurs D peut être obtenu de la façon suivante :
Mg ,éther éthanal H3O Na I-CH3
2-bromopropane E F G H D
éther - H2
Donner la structure de tous les composés rencontrés ci-dessus.
Cl. Viel – RNChimie 10
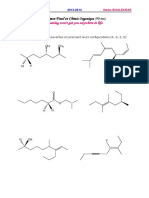
Exercice n°29
Les phéromones des insectes sont des substances servant à la communication entre individus
d’une même espèce. L’une d’elles, la phéromone de marquage de piste du termite de
Saintonge (composé I de formule C12H20O) a été synthétisée par les réactions suivantes, puis
séparée de l’un de ses isomères, I’, par chromatographie en phase gazeuse.
Le composé de départ, J, de formule moléculaire C3H3Br, a pour spectres I.R. et RMN du
proton :
Cl. Viel – RNChimie 11
Déterminer la formule développée de J.
éther butanal SOCl2 KOH Δ
J+ Mg A B C D , D'
puis H3O pyridine éthanol
1-O3
D , D' butanal + propanal + autres produits à déterminer
2- Zn,CH3COOH
C2H5MgBr
D , D' E , E' + composés gazeux
J
E , E' F , F' + 2 MgBr2
C2H5MgBr
F , F' G , G' + composés gazeux
O H2
G , G' H , H' I , I'
Pd,BaSO4
puis H
Donner les formules de A à I et I’. Nommer I et I’.
Exercice n°30
Quel est le résultat de l’action du chlorure de méthylmagnésium suivie d’hydrolyse acide sur
les composés suivants :
• C2H5SH ;
• S=C=S ;
• SCl2 .
Cl. Viel – RNChimie 12
Table des exercices
1 : réactions diverses avec des organomagnésiens
2 : lithiens et cuprates
3 : synthèse magnésienne
4 : synthèses magnésienne
5 : réactions avec des organométalliques divers
6 : synthèse avec des organométalliques
7 : réactions diverses avec des organomagnésiens
8 : réactions diverses avec des organomagnésiens
9 : synthèse d’isotopomères avec des organomagnésiens
10 : synthèses magnésienne
11 : synthèses magnésienne
12 : synthèse avec organomagnésien
13 : réactions inter et intra moléculaires avec organomagnésien
14 : identification de molécules
15 : dosages d’un organomagnésien
16 : synthèses magnésienne
17 : organomagnésien bifonctionnel
18 : identification d’une cétone
19 : synthèses magnésienne
20 : réactions diverses avec des organomagnésiens
21 : organomagnésien et cétone conjuguée
22 : réactions inter et intra moléculaires avec organomagnésien
23 : réaction d’un organomagnésien avec une cétone conjuguée
24 : synthèse avec un organozincique
25 : synthèse avec un organozincique (Reformatsky) et un cuprate
26 : synthèse avec un cuprate
27 : synthèse avec un organozincique (Reformatsky) et un organomagnésien
28 : synthèse avec un organomagnésien
29 : synthèse avec un organomagnésien
30 : réactions avec des dérivés soufrés
Cl. Viel – RNChimie 13
Vous aimerez peut-être aussi
- Plan Du Cours, TD Retrosynthese Et Synthese AsymetriqueDocument11 pagesPlan Du Cours, TD Retrosynthese Et Synthese AsymetriqueLaura DijouxPas encore d'évaluation
- Aldéhydes Et CétonesDocument34 pagesAldéhydes Et Cétonesatika benslimanePas encore d'évaluation
- 2009 Lyon Walchshofer Radix StrucMolOrgaCours PDFDocument19 pages2009 Lyon Walchshofer Radix StrucMolOrgaCours PDFAbdessamed GherbaouiPas encore d'évaluation
- Serie 3 PDFDocument2 pagesSerie 3 PDFElbahi Djaalab0% (2)
- SMC4 Examen Juin 2013Document5 pagesSMC4 Examen Juin 2013Yc YacinePas encore d'évaluation
- Polycopié TP Chimie DecriptiveDocument15 pagesPolycopié TP Chimie DecriptivebilalPas encore d'évaluation
- 1S2016 20 - 20DS3 20 - 20c04avancementDocument4 pages1S2016 20 - 20DS3 20 - 20c04avancementSurbroPas encore d'évaluation
- Fiche TD 2 MPCA 2023 2024Document4 pagesFiche TD 2 MPCA 2023 2024Clash of Clans Bilal DzPas encore d'évaluation
- Tests D'identificationDocument2 pagesTests D'identificationAgnaou MohamedPas encore d'évaluation
- Al CoolsDocument13 pagesAl Coolsbmm2Pas encore d'évaluation
- TP 1 CphysiDocument3 pagesTP 1 Cphysiazou korbaPas encore d'évaluation
- TD Spectrometrie de Masse de L3Document4 pagesTD Spectrometrie de Masse de L3Hk EhPas encore d'évaluation
- Corrigé Exam Norm 21 (SMC5)Document4 pagesCorrigé Exam Norm 21 (SMC5)ZAGGAZ MERYPas encore d'évaluation
- Mecanismes Reactionnels PDFDocument6 pagesMecanismes Reactionnels PDFJérémie NimpagaritsePas encore d'évaluation
- P39oxbenzoine PersaDocument8 pagesP39oxbenzoine Persaayoub dahbi0% (1)
- Examen Corrigé Hydro Smc4 by - Chimist ChimistDocument5 pagesExamen Corrigé Hydro Smc4 by - Chimist ChimistYc YacinePas encore d'évaluation
- TD Chap 1-2Document8 pagesTD Chap 1-2Aris MpomePas encore d'évaluation
- Bilan TPO - 02Document12 pagesBilan TPO - 02Simona StefanPas encore d'évaluation
- Examen 20141 SDocument7 pagesExamen 20141 SElbachaPas encore d'évaluation
- TD Intermediaires Reactionnels 2 SolutionDocument2 pagesTD Intermediaires Reactionnels 2 SolutionIssa SINDEPas encore d'évaluation
- L SMC S4 M43 113 1 PDFDocument19 pagesL SMC S4 M43 113 1 PDFŘachida LkPas encore d'évaluation
- raw:/storage/emulated/0/Download/Browser/COURS-TD CATALYSE Partie IIDocument15 pagesraw:/storage/emulated/0/Download/Browser/COURS-TD CATALYSE Partie IISalah LáálámPas encore d'évaluation
- Ch06 SolutionsDocument46 pagesCh06 SolutionsMateus SantosPas encore d'évaluation
- Polyc SMC s5 2021-22Document17 pagesPolyc SMC s5 2021-22Lamsaaf MohamedPas encore d'évaluation
- Série-3-Corrigée Chimie4Document15 pagesSérie-3-Corrigée Chimie4poly educationPas encore d'évaluation
- Structure ReO3 Et Per SpinelleDocument10 pagesStructure ReO3 Et Per Spinelleismail amnihPas encore d'évaluation
- Exsm14 02rDocument1 pageExsm14 02rbadre50% (2)
- Cnc-Chimie-Mp-19999 DOSAGEDocument5 pagesCnc-Chimie-Mp-19999 DOSAGEAz-eddine KaibaPas encore d'évaluation
- Loi de NerstDocument6 pagesLoi de Nerstamany brPas encore d'évaluation
- Chapitre II-2-hydantoines Et Dérivés PDFDocument11 pagesChapitre II-2-hydantoines Et Dérivés PDFcamelaPas encore d'évaluation
- Exam I 7Document3 pagesExam I 7Dlimi MohamedPas encore d'évaluation
- Master PhosphoreDocument34 pagesMaster PhosphoreMohamed EL FAGHLOUMIPas encore d'évaluation
- Boumendjel Ahcene p08Document16 pagesBoumendjel Ahcene p08جعدبندرهمPas encore d'évaluation
- TP Catalyse Par Transfert de Phase PDFDocument12 pagesTP Catalyse Par Transfert de Phase PDFFifiMisaPas encore d'évaluation
- TD Nomenclature Corrigé12goodprepa PDFDocument3 pagesTD Nomenclature Corrigé12goodprepa PDFNour EddinePas encore d'évaluation
- Chimie SolutionDocument31 pagesChimie SolutionNabil holmesPas encore d'évaluation
- Substitutions EliminationsDocument65 pagesSubstitutions EliminationsYounes MAZOUARPas encore d'évaluation
- Composés Carbonylés ExercicesDocument11 pagesComposés Carbonylés ExercicesClara VincePas encore d'évaluation
- LPVPT - TD N°1 - TD N°2Document30 pagesLPVPT - TD N°1 - TD N°2Mimi BCGPas encore d'évaluation
- Chapitre-Intermédiaires RéactionnelsDocument9 pagesChapitre-Intermédiaires RéactionnelsIsmail ZitouniPas encore d'évaluation
- Rapport TP CinétiqueDocument44 pagesRapport TP CinétiqueNour-Eddin LaaouajPas encore d'évaluation
- Acides AminésDocument14 pagesAcides AminésA100% (1)
- Tables IrDocument5 pagesTables IrMahmoud AyadPas encore d'évaluation
- Cours Licence - FONCTION CARBONYLEDocument82 pagesCours Licence - FONCTION CARBONYLEFatima Ben100% (1)
- Activité 4 IbuprofèneDocument4 pagesActivité 4 IbuprofèneDiego Alves SilvaPas encore d'évaluation
- Travail Pratique Chimie Des PolymèresDocument13 pagesTravail Pratique Chimie Des PolymèresEddouks Fatimazahrae100% (1)
- 5 1a Correction ConformationDocument4 pages5 1a Correction ConformationKenson DEROSANPas encore d'évaluation
- Chimie Organique Fonctionnelle TD Corr 01Document2 pagesChimie Organique Fonctionnelle TD Corr 01123456789Pas encore d'évaluation
- Chimie TP3 ProfDocument7 pagesChimie TP3 ProfAdel LaimechePas encore d'évaluation
- Chim 306 - Notes de CoursDocument43 pagesChim 306 - Notes de Coursnatural recipePas encore d'évaluation
- Substitution ElectrophileDocument36 pagesSubstitution Electrophileadelino13Pas encore d'évaluation
- PARTIE 1. Biochimie Métabolique (Enregistré Automatiquement) - 1Document42 pagesPARTIE 1. Biochimie Métabolique (Enregistré Automatiquement) - 1beauty queensPas encore d'évaluation
- Séance 1-CH1 Gravimétrie p1Document23 pagesSéance 1-CH1 Gravimétrie p1Mohsine DriowyaPas encore d'évaluation
- 15209cours Orga M1 CMS Reactions PericycliquesDocument33 pages15209cours Orga M1 CMS Reactions PericycliquesLaura DijouxPas encore d'évaluation
- Cinetique Catalyse BIs CorDocument2 pagesCinetique Catalyse BIs CorFatima YahiaPas encore d'évaluation
- TD n3 - La CorrectionDocument2 pagesTD n3 - La CorrectionFatima Ezahra RochdiPas encore d'évaluation
- Chapitre3 Caracterisation de Quelques IonsDocument7 pagesChapitre3 Caracterisation de Quelques IonsAlhou Inabigue HarounaPas encore d'évaluation
- Applications de la spectrophotomérie en phytochimie: sciencesD'EverandApplications de la spectrophotomérie en phytochimie: sciencesPas encore d'évaluation
- Corrige Type TD 11 2020Document3 pagesCorrige Type TD 11 2020diakitemadogoniaminataPas encore d'évaluation
- TD4 Et Solution - S4 - Word-1Document9 pagesTD4 Et Solution - S4 - Word-1MohamedPas encore d'évaluation
- Acide and BaseDocument80 pagesAcide and BaseMBOTAKE LawsonPas encore d'évaluation
- Devoir Surveillé #2 Semestre II, 2BAC BIOF, PC - SM Et SVT, 2020-2021, PR JENKAL RACHIDDocument3 pagesDevoir Surveillé #2 Semestre II, 2BAC BIOF, PC - SM Et SVT, 2020-2021, PR JENKAL RACHIDHiba NajiPas encore d'évaluation
- Orga 15Document3 pagesOrga 15Ishak NkttPas encore d'évaluation
- Devoir de Contrôle N°2 - Physique - 2ème Sciences Exp (2006-2007)Document8 pagesDevoir de Contrôle N°2 - Physique - 2ème Sciences Exp (2006-2007)Boubaker ChaabaniPas encore d'évaluation
- Formation Formulation Des Produits Detergents Et D EntretienDocument5 pagesFormation Formulation Des Produits Detergents Et D EntretienOuchrif Mohammed100% (1)
- 2NDE Chap 4 Exercices d' Application-ÉlèveDocument3 pages2NDE Chap 4 Exercices d' Application-Élèvesarah dpsPas encore d'évaluation
- Simulation RapideDocument20 pagesSimulation Rapidejoakim KamgaPas encore d'évaluation
- Cours Acides Carboxyliques Et DerivesDocument46 pagesCours Acides Carboxyliques Et Deriveswissal1111 blmPas encore d'évaluation
- Corrigé Type (1) (6837)Document3 pagesCorrigé Type (1) (6837)Dina DerichePas encore d'évaluation
- TDN°2 - 2API - Diagramme Des PhasesDocument2 pagesTDN°2 - 2API - Diagramme Des PhasesKhamlichi SoukainaPas encore d'évaluation
- Analyse Et Interprétation D'étude PVT Intégrée Dans L'évaluation Des Propriétés de Fluide de RéservoirDocument74 pagesAnalyse Et Interprétation D'étude PVT Intégrée Dans L'évaluation Des Propriétés de Fluide de Réservoirinstructor drilling100% (1)
- Catalogue Parcours de Formations Longues Durées IAP 2021Document59 pagesCatalogue Parcours de Formations Longues Durées IAP 2021YounesNacerPas encore d'évaluation
- Art19-1 9Document19 pagesArt19-1 9Bakhta ChPas encore d'évaluation
- TP BetonDocument5 pagesTP Betonjebari medaminePas encore d'évaluation
- 06-Cinétique Enzymatique à Deux SubstratsDocument8 pages06-Cinétique Enzymatique à Deux SubstratsSlimkhane DzPas encore d'évaluation
- Norme Marocaine: Qualité de L'eauDocument17 pagesNorme Marocaine: Qualité de L'eauYousri OfficePas encore d'évaluation
- Chapitre 1Document6 pagesChapitre 1KhaLed BenKaPas encore d'évaluation
- 000586658 (1)Document88 pages000586658 (1)Imene ImenePas encore d'évaluation
- cلDocument8 pagescلkhaledPas encore d'évaluation
- Méthode Des ColiformesDocument21 pagesMéthode Des Coliformeskhaldi malikaPas encore d'évaluation
- Pathologies Et Durabilité Des BétonsDocument30 pagesPathologies Et Durabilité Des BétonsMaxime AmiraultPas encore d'évaluation
- Fragilisation Par Hydrogene For - b4 Lfor2Document2 pagesFragilisation Par Hydrogene For - b4 Lfor2pedro66Pas encore d'évaluation
- Sulfate D'ammonium Et de Fer (III)Document4 pagesSulfate D'ammonium Et de Fer (III)sumaleePas encore d'évaluation
- Travaux Pratiques CorrosionDocument8 pagesTravaux Pratiques CorrosionFadwa AsriPas encore d'évaluation
- Phot Cata Chapitre IDocument11 pagesPhot Cata Chapitre IHk EhPas encore d'évaluation
- Controle Qualite MP-PF - 2019-2020 5e Année PharmacieDocument7 pagesControle Qualite MP-PF - 2019-2020 5e Année Pharmaciezineb fellaPas encore d'évaluation
- TPN: 3 Réactivité Chimique: Ph-Metrie Etude Des Courbes de Variation de PHDocument7 pagesTPN: 3 Réactivité Chimique: Ph-Metrie Etude Des Courbes de Variation de PHArradPas encore d'évaluation
- Corrigé Série 1Document5 pagesCorrigé Série 1Mohamed ECHAMAI100% (2)
- Etude de La Contamination en Métaux Lourds, PB & CD, Dans Les Produits de La Pêche Au Maroc - OUARHACH AichaDocument66 pagesEtude de La Contamination en Métaux Lourds, PB & CD, Dans Les Produits de La Pêche Au Maroc - OUARHACH AichasktanePas encore d'évaluation
- QCD-CHIMIE 2022 À 2007 PDFDocument6 pagesQCD-CHIMIE 2022 À 2007 PDFYacouba CamaraPas encore d'évaluation