Académique Documents
Professionnel Documents
Culture Documents
Fiche Mémo Chapitre 1
Transféré par
rouxmatheoTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Fiche Mémo Chapitre 1
Transféré par
rouxmatheoDroits d'auteur :
Formats disponibles
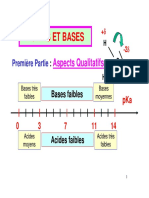
RETENIR L’ESSENTIEL
fiche de Chapitre 1 : transformation acide-base Term Spé
mémorisation
Questions Réponses
Définir un acide Un acide est une espèce chimique capable de céder un ion
hydrogène H+(proton)
Définir une base Une base est une espèce chimique capable de capter un ion
hydrogène H+(proton)
Comment savoir que c’est un Un acide fait apparaître une liaison polarisé entre un atome
acide d’hydrogène H et un autre atome plus électronégatif , la rupture
de cette liaison permettant la libération d’un ion hydrogène H+ .
(une liaison covalente est dite polarisée si la différence
électronégativité est supérieur a 0,4)
Comment savoir que c’est Une base fait apparaître un atome portant un ou plusieurs
une base doublets non liants susceptibles de venir combler la lacune
électronique d’un ion hydrogène H+ , donc capable de capter un
ion H+
Comment est former un Deux espèces chimiques forment un couple acide/base s’il est
couple acide-base possible de passer de l’une a l’autre par un transfert d’un ion H+
Donner les demi équations AH = A- + H+ ou BH+ = B + H+
Donner l’équation bilan acide 1 + base 2 = base 1 +acide 2
Qu’est qu’un espèce Une espèce chimique est dite amphotère si elle constitue à la fois
amphotère l’acide d’un couple acide / base et la base d’un autre couple
acide / base.
Qu’est ce qu’une réaction Une transformation acide – base est une transformation chimique
acide-base impliquant le transfert d’un ion hydrogène H+ entre l’acide d’un
couple acide / base et la base d’un autre couple acide / base.
Donner la relation du pH pH = - log ( [ H3O+] / C0 )
• C : concentration standard : C0 = 1 mol . L-1 ;
0
• [ H3O+ ] : concentration en quantité de matière effective en ions
oxonium ( mol . L-1 )
• log : fonction logarithme décimal
• pH : potentiel Hydrogène de la solution ( sans unité )
Donner la relation de la [ H3O+]=C0x10-pH
concentration en ion • C0 : concentration standard : C0 = 1 mol . L-1
oxonium • [ H3O+ ] : concentration en quantité de matière effective en ions
oxonium ( mol . L-1 )
• pH : potentiel Hydrogène de la solution ( sans unité )
Vous aimerez peut-être aussi
- TP Physique - TS-Chute Parabolique-2Document3 pagesTP Physique - TS-Chute Parabolique-2amine milano0% (1)
- 2-Équilibres IoniquesDocument14 pages2-Équilibres IoniquesNour el houdaPas encore d'évaluation
- c1 Reactions Acides BasesDocument3 pagesc1 Reactions Acides BasesComan SakoPas encore d'évaluation
- La Notion de PHDocument12 pagesLa Notion de PHPerfectly WrongPas encore d'évaluation
- 6-Les Équilibres Acido-BasiquesDocument50 pages6-Les Équilibres Acido-BasiqueslilybarachantPas encore d'évaluation
- Rappels Chimie Des SolutionsDocument24 pagesRappels Chimie Des SolutionsDavid KientegaPas encore d'évaluation
- Chapitre IIDocument28 pagesChapitre IIchaima sagiPas encore d'évaluation
- # 02 Cours Chap 1 Réactions Acide-Base ProfDocument2 pages# 02 Cours Chap 1 Réactions Acide-Base ProfLouisPas encore d'évaluation
- Réaction Acido-Basique - WikipédiaDocument10 pagesRéaction Acido-Basique - WikipédiaAlan HœdâPas encore d'évaluation
- Chimie Solutions Aqueuses MPSI Et ApplicationsDocument20 pagesChimie Solutions Aqueuses MPSI Et ApplicationsmissmaymounaPas encore d'évaluation
- Cours Transformation Acide-BaseDocument5 pagesCours Transformation Acide-BaseRaphaël VILLARETPas encore d'évaluation
- Thermodynamique Des Equilibres Chimiques Dans Les Solution AqueusesDocument85 pagesThermodynamique Des Equilibres Chimiques Dans Les Solution AqueusesFatima BenPas encore d'évaluation
- Capture D'écran . 2022-01-29 À 23.52.15 PDFDocument11 pagesCapture D'écran . 2022-01-29 À 23.52.15 PDFAymen NamanePas encore d'évaluation
- Chapitre 1-2Document14 pagesChapitre 1-2Hassna OuifkiPas encore d'évaluation
- 1.réactions Acido-Basiques Et Couples Acide - Base PDFDocument3 pages1.réactions Acido-Basiques Et Couples Acide - Base PDFkimmikPas encore d'évaluation
- 27Tlf-SMP2 Cours Chimie en Solution Chapitres 2 Et 3 PR OUACHTAKDocument46 pages27Tlf-SMP2 Cours Chimie en Solution Chapitres 2 Et 3 PR OUACHTAKHhhhppp MikPas encore d'évaluation
- Acide BaseDocument35 pagesAcide BaseKhoudia Sy CamaraPas encore d'évaluation
- C3Chim Transformations Limitees PDFDocument4 pagesC3Chim Transformations Limitees PDFAzizElheniPas encore d'évaluation
- Cours2 - Acides Et Bases 1Document40 pagesCours2 - Acides Et Bases 1BONNEHPas encore d'évaluation
- Cours - Réact° Chimiq Par Échange de Proton.Document8 pagesCours - Réact° Chimiq Par Échange de Proton.FILALI AOUAL OumaimaPas encore d'évaluation
- Chapitre 2Document64 pagesChapitre 2ILHAM AMRAOUIPas encore d'évaluation
- Chap 1 P H2019Document101 pagesChap 1 P H2019dyhp2pswsrPas encore d'évaluation
- YfcmowghzigdqasuryufDocument2 pagesYfcmowghzigdqasuryufMichael GuillienPas encore d'évaluation
- Cour de Chimie en SolutionDocument20 pagesCour de Chimie en SolutionIhsan Mokhlisse100% (28)
- Reactions Acide BaseDocument14 pagesReactions Acide BaseDjonba PaguerePas encore d'évaluation
- Chapitre I CorrectionDocument4 pagesChapitre I CorrectionNAVENDRAN AjananPas encore d'évaluation
- C1 - Transformations Acide-BaseDocument2 pagesC1 - Transformations Acide-Basepxy6nghtysPas encore d'évaluation
- SN2-Chapitre 05 H2024Document29 pagesSN2-Chapitre 05 H2024alyssiamorrissette7Pas encore d'évaluation
- Carte Mentale Chap1Document1 pageCarte Mentale Chap1im.victoiresonPas encore d'évaluation
- Equilibres Acido-BasiquesDocument43 pagesEquilibres Acido-Basiquesattentatalabombe100% (5)
- Chapitre 2 - PH Des Solutions AqueusesDocument11 pagesChapitre 2 - PH Des Solutions AqueusesBeatrice Florin100% (1)
- Séance 1.091 Acide Base StagiairesDocument7 pagesSéance 1.091 Acide Base Stagiairesaita.kane6Pas encore d'évaluation
- AcibaseDocument35 pagesAcibaseAbdessamad EttariqiPas encore d'évaluation
- Transformation Acide BaseDocument6 pagesTransformation Acide BaseAlexandre RonetPas encore d'évaluation
- Fascicule 2007-2008-2eme Partie Chi PhysikDocument96 pagesFascicule 2007-2008-2eme Partie Chi PhysikHenri Elias HabibPas encore d'évaluation
- Cours de Chimie Des Solutions Chapitre 2 Acides Et BasesDocument58 pagesCours de Chimie Des Solutions Chapitre 2 Acides Et Basesmeriemg912Pas encore d'évaluation
- Cours Chimie Analytique 2 AnnéeDocument4 pagesCours Chimie Analytique 2 AnnéeMeryem ZouarhiPas encore d'évaluation
- Cours 15 Le Couple Acide Base Selon BronstedDocument2 pagesCours 15 Le Couple Acide Base Selon BronstedArti100% (4)
- Chapitre I Partie 1Document8 pagesChapitre I Partie 1Amna TahriPas encore d'évaluation
- Chapitre IV 1Document37 pagesChapitre IV 1sidiPas encore d'évaluation
- Chimie en SolutionDocument54 pagesChimie en SolutionFRANCK ARMAND JOSIAS BONKOUNGOU WENDBENEDOPas encore d'évaluation
- Analyse Equilibres Reactions Acide Base PrecipitationDocument50 pagesAnalyse Equilibres Reactions Acide Base PrecipitationCyril GaillardPas encore d'évaluation
- Introduction To PHDocument3 pagesIntroduction To PHNouhaila YahdihPas encore d'évaluation
- Chimie 2BaSN Chap 7 - TaggedDocument21 pagesChimie 2BaSN Chap 7 - TaggedErikRPGPas encore d'évaluation
- Chap I-2 CSDocument18 pagesChap I-2 CSSimo MaroPas encore d'évaluation
- Acide Base PDFDocument3 pagesAcide Base PDFAbdelhakim BailalPas encore d'évaluation
- Chap 2 Les Acides Et Les BasesDocument4 pagesChap 2 Les Acides Et Les BasessaliPas encore d'évaluation
- Chap I Equilibres AcidobasiquesDocument28 pagesChap I Equilibres Acidobasiqueselguerchsara68Pas encore d'évaluation
- Chapitre 3: Transformations Chimiques S'effectuant Dans Les Deux SensDocument6 pagesChapitre 3: Transformations Chimiques S'effectuant Dans Les Deux SensDounia Larhouasli MarrakchiPas encore d'évaluation
- Chimie Générale 9 - Equilibres Chimiques Et Réactions Acido-Basiques (Part 1)Document41 pagesChimie Générale 9 - Equilibres Chimiques Et Réactions Acido-Basiques (Part 1)AliEle2013Pas encore d'évaluation
- Acides Bases Fiche CoursDocument2 pagesAcides Bases Fiche CoursNessrine ZahiPas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Couples de Forces - CopieDocument28 pagesCouples de Forces - CopiefontainePas encore d'évaluation
- II.3Méthodes D'extraction:: I I Q. V+R - I N - A - K .T V+Ir R Tapez Uneéquation IciDocument11 pagesII.3Méthodes D'extraction:: I I Q. V+R - I N - A - K .T V+Ir R Tapez Uneéquation IciOum BelkaçemPas encore d'évaluation
- Instruments de Bord 1.originalDocument45 pagesInstruments de Bord 1.originalNinou VivanoPas encore d'évaluation
- La Formation Des Gouttes de Nuage, de Brouillard Et de PluieDocument11 pagesLa Formation Des Gouttes de Nuage, de Brouillard Et de PluieAntoninPas encore d'évaluation
- Hssine Stage 2émeDocument35 pagesHssine Stage 2émeHssine MsekniPas encore d'évaluation
- Catalogue 2020V1.2 FR Partie 01 Normes Regles ConventionsDocument26 pagesCatalogue 2020V1.2 FR Partie 01 Normes Regles ConventionsmohamedPas encore d'évaluation
- Exercices Corrigés Statistique DescriptiveDocument18 pagesExercices Corrigés Statistique DescriptiveJalna Lya CarènePas encore d'évaluation
- De La Classification À La Liaison1Document76 pagesDe La Classification À La Liaison1Nadia BedouhenePas encore d'évaluation
- Chapitre 1vibrations Libres Des S.P.D.D.LDocument13 pagesChapitre 1vibrations Libres Des S.P.D.D.LZaki BouananePas encore d'évaluation
- Série04LEEA3-AII I2021Document2 pagesSérie04LEEA3-AII I2021Salim BouaziziPas encore d'évaluation
- Parcours 4: Le Texte Explicatif Lecture Approfondie: Pourquoi Le Ciel Est-Il Bleu ?Document2 pagesParcours 4: Le Texte Explicatif Lecture Approfondie: Pourquoi Le Ciel Est-Il Bleu ?Nguyễn Tuệ PhươngPas encore d'évaluation
- TD Nombres-Complexes Ia 23-24Document2 pagesTD Nombres-Complexes Ia 23-24adamasow1515Pas encore d'évaluation
- Sujet Bilan MPSI2 MPII 22 23Document19 pagesSujet Bilan MPSI2 MPII 22 23bhffuhPas encore d'évaluation
- Pfe2019 PDFDocument86 pagesPfe2019 PDFannaPas encore d'évaluation
- Semaine20 GCD2 2023-2024Document1 pageSemaine20 GCD2 2023-2024samirmahmoudy017Pas encore d'évaluation
- Chapitre-4-Les-Transformations-A-Etat-Solide-Des-Alliages Fe-CDocument29 pagesChapitre-4-Les-Transformations-A-Etat-Solide-Des-Alliages Fe-CKenla Charly juniorPas encore d'évaluation
- Une initiation au calcul tensoriel: #1. L'opérateur ΣDocument40 pagesUne initiation au calcul tensoriel: #1. L'opérateur ΣFatima Zahra MoghraouiPas encore d'évaluation
- TD1.3. - Exercice 1Document1 pageTD1.3. - Exercice 1Mackenzie Moran100% (2)
- Diapos Cours4Document64 pagesDiapos Cours4harouna souley hegaPas encore d'évaluation
- Guide de Pompage SolaireDocument17 pagesGuide de Pompage SolaireAbdou Elmokhtary67% (3)
- w140 Enthalpie Libre de DissolutionDocument10 pagesw140 Enthalpie Libre de DissolutionSabin SamPas encore d'évaluation
- 2022 Polynesie J1 ExoA Sujet TracteurGravitationnel 5ptsDocument3 pages2022 Polynesie J1 ExoA Sujet TracteurGravitationnel 5ptsgrajzgrPas encore d'évaluation
- Chap 2Document20 pagesChap 2Taha DaoudPas encore d'évaluation
- ConiquesDocument2 pagesConiquesJob ElsonPas encore d'évaluation
- TD Z TransformDocument2 pagesTD Z TransformBelingaPas encore d'évaluation
- Examen Blanc SC Math Num 3Document10 pagesExamen Blanc SC Math Num 3Yasmine Ine100% (1)
- Déversement - Eurocode 3Document3 pagesDéversement - Eurocode 3kouadio eric kouadioPas encore d'évaluation
- Vecteur 2Document2 pagesVecteur 2Placide GohoungoPas encore d'évaluation
- Physics Paper 3 TZ2 HL-2Document41 pagesPhysics Paper 3 TZ2 HL-2jreallsnPas encore d'évaluation