Académique Documents
Professionnel Documents
Culture Documents
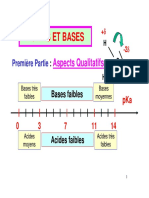
Introduction To PH
Transféré par
Nouhaila YahdihTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Introduction To PH
Transféré par
Nouhaila YahdihDroits d'auteur :
Formats disponibles
Machine Translated by Google
Technique
Référence pH
Introduction au pH
INTRODUCTION LE CONCEPT MOLAIRE ion »sont utilisés de manière interchangeable
dans les applications de mesure du pH.
Le pH est une unité de mesure qui décrit le degré Une mole d'un composé est définie comme le
d'acidité ou d'alcalinité d'une solution. Il est mesuré nombre de molécules d'Avogadro (6,02 x Certains composés forment des acides ou des
sur une échelle de 0 à 14. Le terme pH est dérivé 1023 molécules), qui ont une masse bases faibles ; seul un très faible pourcentage de
de « p », le symbole mathématique du logarithme approximativement égale au poids moléculaire, ces composés se dissocie en ses ions
négatif, et de « H », le symbole chimique de exprimé en grammes. constituants, de sorte que très peu d’ions hydrogène
l'hydrogène. La définition formelle du pH est : le Par exemple, l’hydroxyde de sodium NaOH, qui a un ou hydroxyle sont formés. Un exemple de ceci est
logarithme négatif de l’activité des ions poids moléculaire de 23 + 16 + 1 = 40, l’acide acétique, qui forme moins d’un ion hydrogène
hydrogène. aurait 40 grammes dans une mole. Puisque le poids pour cent molécules :
atomique de l’ion hydrogène (H+) est de un (1), il y a
un gramme d’ions hydrogène dans une mole H2O + CH3COOH → H3O+ +
pH = log[H+]
d’hydrogène. Une solution avec un pH de 10 contient CH3COO
Le pH fournit les informations quantitatives 1 x 10 à 10 moles d'ions hydrogène, soit 10
nécessaires en exprimant le degré d'activité d'un acide à 10 grammes dans une solution d'un litre. L'eau pure se dissocie également faiblement, avec
ou d'une base en termes d'activité de ses ions 107 ions hydrogène et 107 ions hydroxyle
hydrogène. formés pour chaque molécule d'eau à 25°C :
IONISATION
La valeur du pH d’une substance est directement liée 2H2O → H3O+ + OH
au rapport des concentrations d’ions hydrogène [H+] Un ion est une particule chargée, créée par un atome
ou une molécule qui possède soit L'ajout d'acide à l'eau augmente la concentration
et d’ions hydroxyle [OH].
gagné ou perdu un ou plusieurs électrons. d'ions hydrogène et réduit la concentration
Si la concentration en H+ est supérieure à celle en d'ions hydroxyle. Une base ajoutée à l’eau a
OH, le matériau est acide ; c'estàdire que la La présence d’ions dans la solution permet à l’énergie
électrique de traverser la solution en tant que l’effet inverse, augmentant la concentration en
valeur du pH est inférieure à 7. Si la concentration
conducteur. Différent ions hydroxyle et réduisant la concentration en ions
en OH est supérieure à sa concentration en H+, le
les composés forment des ions en solution en hydrogène :
matériau est basique, avec une valeur de pH supérieure
à 7. Si un nombre égal d'ions H+ et OH sont présents, différentes quantités, selon la capacité des
le matériau est neutre. , avec un pH de 7. atomes à gagner ou à perdre des électrons.
Ils se dissocieront (ou s'ioniseront) en solution pour H2O + HCI → H3O+ + CI H2O
former des ions hydrogène (H+) ou hydroxyle + NaOH → Na+ + H2O + OHIl existe une
Les acides et les bases contiennent respectivement (OH) dans la solution.
des ions hydrogène et hydroxyle libres. Étant donné grande variété d'applications pour la mesure du
que la relation entre les ions hydrogène et les ions
Les molécules qui se dissocient facilement pH. Par exemple, la mesure et le contrôle du pH sont
hydroxyle dans une solution donnée est
forment des acides ou des bases fortes lorsqu'elles la clé du succès de la purification de l'eau potable,
constante pour un ensemble de conditions donné, l’un
sont en solution aqueuse (solvant aqueux). Des de la fabrication du sucre, du traitement des eaux
ou l’autre peut être déterminé en connaissant l’autre. Ainsi, exemples en sont l'acide chlorhydrique (HCI) ou usées, de la transformation des aliments,
le pH est une mesure à la fois de l’acidité et de
l'hydroxyde de sodium (NaOH) : de la galvanoplastie, ainsi que de l'efficacité et
l’alcalinité, même si par définition il s’agit d’une HCI + H2O → H3O+ + CINaOH de la sécurité des médicaments, des cosmétiques,
mesure sélective de l’activité des ions hydrogène. Puisque → Na+ + OH etc. Les plantes ont besoin que le sol soit à
le pH est une fonction logarithmique, une modification l'intérieur. une certaine plage de pH pour se
Dans une solution aqueuse, les ions hydrogène se développer correctement, et les animaux
d’une unité de pH représente une variation de dix fois
combinent normalement avec le solvant aqueux pour peuvent tomber malades ou mourir si leur pH sanguin
de la concentration en ions hydrogène. Le
former l’ion hydronium (H3O+). Les mesures n'est pas dans les limites correctes. La figure 1,
tableau 1 montre la concentration des ions hydrogène
de pH de ces solutions sont donc des mesures page suivante, donne les valeurs de pH pour certains
et des ions hydroxyle à différentes valeurs de pH.
de concentration en ions hydronium.
produits industriels et ménagers courants.
Normalement, les termes « ion hydronium » et
« hydrogène »
MESURE DU PH
CONCENTRATION EN IONS HYDROGÈNE Une indication approximative du pH peut être obtenue
Tableau 1
EN MOLES/LITRE À 25°C (77°F) à l’aide de papiers ou d’indicateurs pH, qui
H+ OH changent de couleur à mesure que le niveau de pH
pH
varie. Ces indicateurs ont des limites en
0 (100) 1 0,00000000000001 (1014) termes de précision et peuvent être difficiles à
1 (101) 0,1 0,0000000000001 (1013) interpréter correctement dans des échantillons colorés ou troubles.
2 (102) 0,01 0,000000000001 (1012) Des mesures de pH plus précises sont
3 (103) 0,001 0,00000000001 (1011) obtenues à l'aide d'un pHmètre. Un système
4 (104) 0,0001 0,0000000001 (1010) de mesure du pH se compose de quatre
5 (105) 0,00001 0,000000001 (109) composants : une électrode de mesure du pH,
6 (106) 0,000001 0,00000001 (108) une électrode de référence, un appareil de mesure à
7 haute impédance d'entrée et un échantillon du
(107) 0,0000001 0,0000001 (107) matériau à mesurer. Le
8 (108 ) 0,00000001 0,000001 (106)
L'électrode de pH peut être considérée comme
9 (109) 0,000000001 0,00001 (105) une batterie, avec une tension qui varie en fonction
dix (1010) 0,0000000001 0,0001 (104) du pH de la solution mesurée. L'électrode de
11 (1011) 0,00000000001 0,001 (103) mesure du pH est une ampoule en verre sensible
12 (1012) 0,000000000001 0,01 (102) aux ions hydrogène, avec une sortie en millivolts qui
13 varie en fonction des changements dans la
(1013) 0,0000000000001 0,1 (101)
14 concentration relative des ions hydrogène à
(1014) 0,00000000000001 1100) l'intérieur et à l'extérieur de l'ampoule.
Pour commander, appelez le 18008266342 ou magasinez en ligne sur omega.com 1 SM
Machine Translated by Google
Technique
POINTS MILIEUX DES PLAGES DE pH VALEURS pH DE CERTAINS
POUR LE CONTRÔLE DES PROCÉDÉS SUBSTANCES COMMUNES
EXTRÊMEMENT ALCALIN 14,0
LESsive ménagère d'une électrode et d'une autre, ainsi que les
LAVAGE DES BOUTEILLES changements dans le rendement des électrodes
13,0
CUIVRAGE au fil du temps. Par conséquent, chaque système
EAU DE JAVEL
doit être calibré périodiquement. Les tampons
12,0
sont disponibles avec une large gamme de valeurs
de pH, et ils se présentent sous forme liquide
PLACAGE EN LAITON AMMONIAC prémélangée ou sous forme de capsules de poudre
11.0
sèche pratiques. La plupart des pHmètres
nécessitent un étalonnage à plusieurs valeurs de pH spécifiques.
LAIT DE MAGNÉSIE
Un étalonnage est généralement effectué
près du point isopotentiel (le signal produit par
10,0
une électrode à pH 7 est de 0 mV à 25°C/
CHAUXSODA
BORAX 77°F), et un second est généralement effectué
RAMOLLISSEMENT
9.0
à pH 4 ou pH 10. Il est préférable de sélectionnez
un tampon aussi proche que possible de la
BICARBONATE DE SOUDE valeur réelle du pH de l’échantillon à mesurer.
AQUARIUM D'EAU SALÉE 8.0 EAU DE MER
SANG
EFFETS DE LA TEMPÉRATURE
EAU DE PISCINE
AQUARIUM D'EAU DOUCE
EAU DISTILLÉE
Comme indiqué précédemment, l'électrode de
7.0
LAIT pH dépend de la température et peut être
PROCESSUS DE BRASSAGE
compensée dans les circuits du pHmètre. Le
MAÏS circuit du pHmètre utilise l'équation de Nernst,
6.0
NICKELAGE qui est une description mathématique générale
du comportement des électrodes.
PRÉPARATION DES ALIMENTS 5.0 ACIDE BORIQUE
DU JUS D'ORANGE E = Ex + 2,3 RTK log (ai)
_______
4.0 nF
TRAITEMENT DES CORNICHONS
où:
PHOTOGRAVURE
3.0 Ex = constante (en fonction de
VINAIGRE
électrode de référence)
JUS DE CITRON
R = constante
2.0
TK = température absolue (Kelvin)
n = charge de l'ion (y compris le signe)
1.0
F = constante
L'ACIDE DE LA BATTERIE
EXTRÊMEMENT ACIDE
ai = activité de l'ion
0,0
Figure 1 Pour la mesure du pH, on s'intéresse à l'ion
hydrogène pour H+ :
La sortie de l'électrode de référence ne varie pas sensible à la température. La compensation de
avec l'activité de l'ion hydrogène. température peut être manuelle ou automatique. 2.3RTK
________
L'électrode de pH a une résistance interne très Avec la compensation manuelle, une mesure de = 59,16 mV
élevée, ce qui rend difficile la mesure de la température séparée est requise et le contrôle nF
variation de tension avec le pH. L'impédance de compensation manuelle du pHmètre peut
d'entrée du pHmètre et les résistances de fuite être réglé avec la valeur de température où : n = 1 et T = 25°C. Ce terme est
sont donc des facteurs importants. Le pH approximative. Avec la compensation automatique communément appelé coefficient de
mètre est essentiellement un amplificateur à haute de température (ATC), le signal d'une sonde Nernst. Puisque le pH est défini comme le
impédance qui mesure avec précision les de température séparée est introduit dans logarithme négatif de l’activité des ions
tensions infimes des électrodes et affiche les le pHmètre, afin qu'il puisse déterminer hydrogène, l’équation générale à n’importe
résultats directement en unités pH sur un avec précision la valeur du pH de quelle température peut être exprimée comme suit :
affichage analogique ou numérique. Dans l'échantillon à cette température.
certains cas, les tensions peuvent également E = Ex – 1,98 TKpH
être lues pour des applications spéciales ou Les changements de température d'une solution
pour une utilisation avec des électrodes à SOLUTIONS TAMPONS
modifieront la sortie en millivolts de l'électrode de
sélection d'ions ou à potentiel d'oxydoréduction (ORP). Les tampons sont des solutions qui ont des pH en verre conformément à l'équation de
valeurs de pH constantes et la capacité Nernst. La variation de la sensibilité de l'électrode
COMPENSATION DE TEMPÉRATURE
de résister aux changements de pH. Ils servent en fonction de la température est une fonction
La compensation de température est contenue à calibrer le système de mesure du pH (électrode linéaire et la plupart des pHmètres disposent
dans l'instrument, car les électrodes de pH et appareil de mesure). Il peut y avoir de de circuits conçus pour compenser cet effet.
et les mesures sont petites différences entre la sortie
2 Pour commander, appelez le 18008266342 ou magasinez en ligne sur omega.comSM
Machine Translated by Google
Technique Testeur de poche PHH7011
Transmetteur
de pH
PHETX600 11∕2 NPT. PHETX610
raccord à
compression pH
PHETX620, transmetteur de pH électrode. PHH128
pour robinet chaud avec PHE620
BVA, vanne à boisseau sphérique
en PVC pour robinet chaud.
PHE6510, électrode avec PHEH6510, ensemble
de montage et câble.
Chaque électrode
fournie avec
soit BNC
(illustré) ou norme
américaine
connecteur.
Électrode
économique
PHE1304.
Norme de connecteur
BNC.
Électrode à
Électrode à usage
Électrode
usage général
Tous les PHE1411 pour économique
Électrode ORP général Électrode à
modèles PHE1311. PHE1417 avec
à usage les échantillons pointe de perforation
présentés sont double jonction
général nécessitant robuste PHE2385 pour
plus petits que la taille réelle. une double PTFE.
Électrode ORP à double jonction ORE1411 viandes, fromages et cuir.
ORE1311. pour ions interférents. jonction.
Erreur d'électrode de verre dans
les unités de pH 10°C (50°F)
15°C (59°F)
20°C (68°F)
25°C (77°F) Température
30°C (86°F)
35°C (95°F)
40°C (104°F)
Compteur
de paillasse PHB21.
La compensation automatique
59 mV par décennie à 25°C (77°F) de la température devient Pour plus de détails et les
52 mV par décennie à 0°C (32°F) plus critique à mesure que la prix des produits
température passe de 25 °C (77 présentés ici, visitez
74 mV par décennie à 100°C (212°F)
°F) ou que le pH passe de 7,0. omega.com
H+ (ions hydrogène) OH– (ions hydroxyles)
Acide Neutre 7 Alcalin
pH 0 1 23 4 5 6 8 9 10 11 12 13 14
mV à + + + + + + + – – –– – – –
25°C 414 355 296 237 177 118 59 00 59 118 117 237 296 355 414 (77°F)
Pour commander, appelez le 18008266342 ou magasinez en ligne sur omega.com 3 SM
Vous aimerez peut-être aussi
- Les Univers Paralleles PDFDocument86 pagesLes Univers Paralleles PDFDamien Franck100% (1)
- Potentiel HydrogèneDocument13 pagesPotentiel HydrogèneFoudil LaouiciPas encore d'évaluation
- Acide BaseDocument4 pagesAcide BaseRafika SalmiPas encore d'évaluation
- c1 Reactions Acides BasesDocument3 pagesc1 Reactions Acides BasesComan SakoPas encore d'évaluation
- Cours 14 L'eau Et Les Solutions AqueusesDocument3 pagesCours 14 L'eau Et Les Solutions AqueusesArti100% (1)
- PH AcideDocument2 pagesPH AcideRezgui AbderrahimPas encore d'évaluation
- Acide BaseDocument35 pagesAcide BaseKhoudia Sy CamaraPas encore d'évaluation
- Les Reactions Chimiques-Uua8Document113 pagesLes Reactions Chimiques-Uua8bafoa.ifmPas encore d'évaluation
- YfcmowghzigdqasuryufDocument2 pagesYfcmowghzigdqasuryufMichael GuillienPas encore d'évaluation
- Chimie Des Solutions 2022Document26 pagesChimie Des Solutions 2022Mohsine DriowyaPas encore d'évaluation
- Chimie de Solution en Travaux PublicDocument8 pagesChimie de Solution en Travaux Publicgeorges.kevin.henderson.681068732Pas encore d'évaluation
- Leçon I - Notion de PH-1Document1 pageLeçon I - Notion de PH-1lauryannajl26Pas encore d'évaluation
- Fiche 3 PH Solutions Acides Et BasiquesDocument1 pageFiche 3 PH Solutions Acides Et BasiquesRoxyPas encore d'évaluation
- Chapitre Propriétés Acido-BasiquesDocument11 pagesChapitre Propriétés Acido-BasiquesjeanPas encore d'évaluation
- 6-Les Équilibres Acido-BasiquesDocument50 pages6-Les Équilibres Acido-BasiqueslilybarachantPas encore d'évaluation
- SN2-Chapitre 05 H2024Document29 pagesSN2-Chapitre 05 H2024alyssiamorrissette7Pas encore d'évaluation
- Bioelectronique - Vincent U. Schreier PDFDocument5 pagesBioelectronique - Vincent U. Schreier PDFjoel_tetard100% (1)
- Chimie Générale 9 - Equilibres Chimiques Et Réactions Acido-Basiques (Part 1)Document41 pagesChimie Générale 9 - Equilibres Chimiques Et Réactions Acido-Basiques (Part 1)AliEle2013Pas encore d'évaluation
- Cours Acide Base 2022Document12 pagesCours Acide Base 2022Aurélie PierratPas encore d'évaluation
- Chapitre 3 Le Potentiel Hydrogene Ou PHDocument15 pagesChapitre 3 Le Potentiel Hydrogene Ou PHSimier NoéPas encore d'évaluation
- SEQUENCE06 Acidefortbaseforte 1 STLDocument6 pagesSEQUENCE06 Acidefortbaseforte 1 STLMed BriniPas encore d'évaluation
- Les Acides Et Les BasesDocument59 pagesLes Acides Et Les BasesCarter JeanPas encore d'évaluation
- Les Solutions Aqueuses IoniquesDocument18 pagesLes Solutions Aqueuses IoniquesMétatron GamesPas encore d'évaluation
- MMCh3 Les Réactions Acido-Basiques CoursDocument4 pagesMMCh3 Les Réactions Acido-Basiques CoursegozeelowPas encore d'évaluation
- Fiche Mémo Chapitre 1Document1 pageFiche Mémo Chapitre 1rouxmatheoPas encore d'évaluation
- Chapitre 2 - PH Des Solutions AqueusesDocument11 pagesChapitre 2 - PH Des Solutions AqueusesBeatrice Florin100% (1)
- Le PH SuperprofDocument1 pageLe PH Superprofkalinux78brgPas encore d'évaluation
- 4 5890728413047557017 PDFDocument35 pages4 5890728413047557017 PDFSamuel Loïc100% (1)
- COURS DE 3ème BIENDocument35 pagesCOURS DE 3ème BIENAnge N'driPas encore d'évaluation
- PH MetrieDocument14 pagesPH MetrieMeriem KeddadPas encore d'évaluation
- LC13 - Acides Et Bases (Lycée) : Niveau: TS BibliographieDocument13 pagesLC13 - Acides Et Bases (Lycée) : Niveau: TS BibliographieDiallo SafaiouPas encore d'évaluation
- Equilibre Acido-Basique 2019Document44 pagesEquilibre Acido-Basique 2019Théophile NAMOINEPas encore d'évaluation
- ch13 Reaction Chimique Echange ProtonDocument5 pagesch13 Reaction Chimique Echange ProtonSophie RosiPas encore d'évaluation
- PH Et Équilibre Acido-BasiqueDocument9 pagesPH Et Équilibre Acido-BasiqueAdamPas encore d'évaluation
- C9 ForceDesAcidesEtBasesEleveDocument13 pagesC9 ForceDesAcidesEtBasesEleveYann FourteauPas encore d'évaluation
- Thème: Chimie Générale Titre de La Leçon: Solutions Aqueuses. Notion de PHDocument10 pagesThème: Chimie Générale Titre de La Leçon: Solutions Aqueuses. Notion de PHMabonzotPas encore d'évaluation
- AcibaseDocument35 pagesAcibaseAbdessamad EttariqiPas encore d'évaluation
- 5 PHDocument6 pages5 PHDaboPas encore d'évaluation
- Acide Fort-Base ForteDocument11 pagesAcide Fort-Base Forteyann.carly BoulinguiPas encore d'évaluation
- 2-Équilibres IoniquesDocument14 pages2-Équilibres IoniquesNour el houdaPas encore d'évaluation
- 3eme Seq4 CoursDocument3 pages3eme Seq4 Coursnael.zakariaPas encore d'évaluation
- Activités Acide FlorenceDocument9 pagesActivités Acide FlorenceChristophe GourbeyrePas encore d'évaluation
- Chimir PHDocument16 pagesChimir PHImane KaPas encore d'évaluation
- I. PH D Une Solution AqueuseDocument5 pagesI. PH D Une Solution AqueuseJean-Loïc BauchetPas encore d'évaluation
- Acide and BaseDocument80 pagesAcide and BaseMBOTAKE LawsonPas encore d'évaluation
- Définition Et Mesure Du PHDocument2 pagesDéfinition Et Mesure Du PHla physique selon le programme FrançaisPas encore d'évaluation
- Tle Cours C1Document3 pagesTle Cours C1Thouria ELPas encore d'évaluation
- Le PH Et Sa Mesure BisDocument31 pagesLe PH Et Sa Mesure Bisstanbul20001156Pas encore d'évaluation
- # 02 Cours Chap 1 Réactions Acide-Base ProfDocument2 pages# 02 Cours Chap 1 Réactions Acide-Base ProfLouisPas encore d'évaluation
- Chapitre 2 - Solvants, Électrolytes, Acides Et Bases - CoursDocument7 pagesChapitre 2 - Solvants, Électrolytes, Acides Et Bases - CoursGODANI PhilippePas encore d'évaluation
- Chapitre 2 Acide BaseDocument17 pagesChapitre 2 Acide BaseSouFien MabroukPas encore d'évaluation
- Chap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDocument74 pagesChap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDylanPas encore d'évaluation
- Acides Bases Fiche CoursDocument2 pagesAcides Bases Fiche CoursNessrine ZahiPas encore d'évaluation
- Reactions Acide BaseDocument14 pagesReactions Acide BaseDjonba PaguerePas encore d'évaluation
- Analyse Equilibres Equilibres Evolution Systeme ChimiqueDocument21 pagesAnalyse Equilibres Equilibres Evolution Systeme ChimiqueCyril GaillardPas encore d'évaluation
- Chapitre - 1 Les Acides Et Les BasesDocument14 pagesChapitre - 1 Les Acides Et Les Baseseduardo3000Pas encore d'évaluation
- Chap 02 Re - Action Chimique Par e - Change de Proton2019Document8 pagesChap 02 Re - Action Chimique Par e - Change de Proton2019Younes HoumadiPas encore d'évaluation
- Chapitre Un CDocument13 pagesChapitre Un CDaboPas encore d'évaluation
- Séance 1.091 Acide Base StagiairesDocument7 pagesSéance 1.091 Acide Base Stagiairesaita.kane6Pas encore d'évaluation
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- 2016azur4081 PDFDocument171 pages2016azur4081 PDFsalima dadouPas encore d'évaluation
- Pfe 9 PDFDocument27 pagesPfe 9 PDFNouhaila YahdihPas encore d'évaluation
- Fiche de Données de Sécurité FormaldéhydeDocument17 pagesFiche de Données de Sécurité FormaldéhydeJackson KandaPas encore d'évaluation
- PEC28 Formaldehyde 1 153Document153 pagesPEC28 Formaldehyde 1 153Nouhaila YahdihPas encore d'évaluation
- L'adsorption de Méthylène PDFDocument12 pagesL'adsorption de Méthylène PDFAymene Salah BendrihemPas encore d'évaluation
- Sikafill®: Fiche ProduitDocument3 pagesSikafill®: Fiche Produitabdelali baaddouchPas encore d'évaluation
- Chapitre 03Document23 pagesChapitre 03Kamel BarounPas encore d'évaluation
- FkjumDocument2 pagesFkjumAbdullah MohamedPas encore d'évaluation
- TP DE GENIE CHIMIQUE 2 (Absorption - Distillation) L3 GPDocument13 pagesTP DE GENIE CHIMIQUE 2 (Absorption - Distillation) L3 GPBouchra Benabdallah100% (1)
- BECOM230149Document2 pagesBECOM230149qsegaqgPas encore d'évaluation
- Prorox Ps 970Document1 pageProrox Ps 970Med CHPas encore d'évaluation
- PolarimetrieDocument9 pagesPolarimetrieÑar ĎjesPas encore d'évaluation
- Modéle 5 PR Y.BELGHITDocument2 pagesModéle 5 PR Y.BELGHIThakima032Pas encore d'évaluation
- L'Éther Fluide Et Tourbillonnaire Des Champs de TorsionDocument63 pagesL'Éther Fluide Et Tourbillonnaire Des Champs de TorsionSavouretPas encore d'évaluation
- Garga 3Document15 pagesGarga 3Benjamin GonzalezPas encore d'évaluation
- RDM Flexion 2 STMDocument61 pagesRDM Flexion 2 STMsaihoPas encore d'évaluation
- PHY2001 Guide - 2016 05Document235 pagesPHY2001 Guide - 2016 05Cédric GiraudPas encore d'évaluation
- Em5 PDFDocument9 pagesEm5 PDFDridi AchrefPas encore d'évaluation
- TD Mouvement Dans Un Champ de Forces Centrales-EnonceDocument4 pagesTD Mouvement Dans Un Champ de Forces Centrales-EnonceYoussef MzabiPas encore d'évaluation
- TP PbaDocument2 pagesTP Pbatechno samirPas encore d'évaluation
- Controle 2 Mod8 2AC INT (WWW - Pc1.ma)Document2 pagesControle 2 Mod8 2AC INT (WWW - Pc1.ma)Ab ElhassanPas encore d'évaluation
- Les Contre-Vérités Du Dernier Pamphlet ClimatosceptiqueDocument5 pagesLes Contre-Vérités Du Dernier Pamphlet Climatosceptiquemedane_saad67070% (1)
- Polycopié - Examens Corrigés de Chimie Des Solutions - Filière Svi s3 - 2022-2023Document75 pagesPolycopié - Examens Corrigés de Chimie Des Solutions - Filière Svi s3 - 2022-2023Elhamidi Houda100% (1)
- Conception Et Realisation D - Un - El Atmi Anas - 55 PDFDocument72 pagesConception Et Realisation D - Un - El Atmi Anas - 55 PDFAmine MedPas encore d'évaluation
- Monoacides Faibles Et Monobases Faibles - 0Document3 pagesMonoacides Faibles Et Monobases Faibles - 0Michel La Marée HautePas encore d'évaluation
- 2018 Suj BepcphchDocument3 pages2018 Suj BepcphchAlix LassaPas encore d'évaluation
- Encyclopédie Galactique - Tome 2Document23 pagesEncyclopédie Galactique - Tome 2Cédric DuclouxPas encore d'évaluation
- TP 2 Mathlab v2014Document4 pagesTP 2 Mathlab v2014ayoubPas encore d'évaluation
- Physique 6EMEDocument2 pagesPhysique 6EMETrude Mbou100% (1)
- Exos M2Document4 pagesExos M2Yves-rolandN'guessanPas encore d'évaluation
- TD Thermodynamique 2023 - Série N°4-1Document2 pagesTD Thermodynamique 2023 - Série N°4-1salma ihssanPas encore d'évaluation
- Cahier Module B1 1 2011 2012Document13 pagesCahier Module B1 1 2011 2012EspoirPas encore d'évaluation
- Exercice I: Utilisation Des Opérateurs Vectoriels: Y.ChairDocument4 pagesExercice I: Utilisation Des Opérateurs Vectoriels: Y.ChairMarwan BouhdidiPas encore d'évaluation