Académique Documents
Professionnel Documents
Culture Documents
MMCh3 Les Réactions Acido-Basiques Cours
Transféré par
egozeelowTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
MMCh3 Les Réactions Acido-Basiques Cours
Transféré par
egozeelowDroits d'auteur :
Formats disponibles
Matière et matériau T STI2D Spé
Ch3 Les réactions acido-basiques
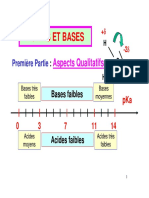
1.Solutions acide, basique et neutre
pH est l’abréviation de
potentiel hydrogène
Une solution est Une solution est Une solution est
acide lorsque son neutre lorsque son basique lorsque
pH < 7 pH = 7 son pH > 7
Le pH est une grandeur sans unité
comprise entre 0 et 14 qui quantifie
l’acidité d’une solution aqueuse.
2. Théorie de Bronsted des acides et des bases
Définitions des acides et des bases
Un acide noté AH, est une espèce chimique susceptible de libérer au moins un proton H+ en
milieu aqueux.
AH(aq) → A-(aq) + H+(aq)
Une base, notée A-, est une espèce chimique susceptible de capter au moins un proton H+ en
milieu aqueux.
A-(aq) + H+(aq) → AH(aq)
Les réactions acido-basiques 1
Couple acido-basique
Ces deux espèces chimiques sont dites conjuguées et forment un couple acide base AH(aq) / A-(aq)
A ce couple est associée une demi-équation acido-basique : AH(aq) A-(aq) + H+(aq)
Exemples : acide éthanoïque / ion éthanoate
AH1(aq) A1-(aq)(aq) / CH3COO-(aq)
CH3/COOH CH3COOH(aq) CH3COO-(aq) + H+(aq)
3. Réaction acido-basique
Lors d’une réaction acido-basique, nous avons un échange de protons H+(aq) entre un acide d’un premier couple
acide/base et une base d’un second couple.
L’acide AH1(aq) réagit avec la base A2-(aq) selon l’équation :
AH1(aq) A1-(aq) + H+(aq)
AH2(aq) / A2-(aq) AH2(aq) A2-(aq) + H+(aq)
AH1(aq) + A2-(aq) → A1-(aq) + AH2(aq)
Pour lutter contre l’acidification
progressive de certains lacs, on y introduit
une base, la chaux Ca(OH)2 qui réagira
après dissolution avec les ions H30+(aq).
Les réactions acido-basiques 2
4. pH d’une solution aqueuse
Relation entre pH et concentration
En solution, le proton n’existe pas à l’état libre. On peut en simplifiant, considérer qu’il est
capté par une molécule d’eau, formant un ion oxonium H3O+.
Le pH d’une solution est directement lié à la concentration molaire en ions oxonium par la relation :
Sans unité Concentration (mol.L-1)
pH = -log [H3O+]
Fonction mathématique logarithme décimal
Connaissant le pH, la concentration en ions oxonium est calculée par la relation : [H3O+] = 10-pH
Influence de la dilution sur le pH
Lorsque le pH d’une solution augmente, la concentration des ions oxonium [H3O+]
diminue.
Inversement, lorsque le pH d’une solution diminue, la concentration des ions
oxonium [H3O+] augmente.
Lorsqu’on dilue un acide le pH augmente et tend vers 7.
Inversement si l’on dilue une base le pH diminue et tend vers 7.
Les réactions acido-basiques 3
Les réactions acido-basiques 4
Vous aimerez peut-être aussi
- Équilibres en solution: Les Grands Articles d'UniversalisD'EverandÉquilibres en solution: Les Grands Articles d'UniversalisPas encore d'évaluation
- Chapitre 2 - PH Des Solutions AqueusesDocument11 pagesChapitre 2 - PH Des Solutions AqueusesBeatrice Florin100% (1)
- Les Reactions Acido Basiques Resume de CoursDocument2 pagesLes Reactions Acido Basiques Resume de CoursMahfoud NatsuPas encore d'évaluation
- C9 ForceDesAcidesEtBasesEleveDocument13 pagesC9 ForceDesAcidesEtBasesEleveYann FourteauPas encore d'évaluation
- Reactions Acide BaseDocument14 pagesReactions Acide BaseDjonba PaguerePas encore d'évaluation
- # 02 Cours Chap 1 Réactions Acide-Base ProfDocument2 pages# 02 Cours Chap 1 Réactions Acide-Base ProfLouisPas encore d'évaluation
- Acide BaseDocument35 pagesAcide BaseKhoudia Sy CamaraPas encore d'évaluation
- Le PH Et Sa Mesure BisDocument31 pagesLe PH Et Sa Mesure Bisstanbul20001156Pas encore d'évaluation
- Chapitre 6 - Reactions Acido - BasiquesDocument3 pagesChapitre 6 - Reactions Acido - BasiquesFongar gamingPas encore d'évaluation
- Tle Cours C1Document3 pagesTle Cours C1Thouria ELPas encore d'évaluation
- Resume Acides Et Bases PDFDocument2 pagesResume Acides Et Bases PDFAnonymous nbHyrU81Pas encore d'évaluation
- Chimie Des Solutions 2022Document26 pagesChimie Des Solutions 2022Mohsine DriowyaPas encore d'évaluation
- Chapitre - 1 Les Acides Et Les BasesDocument14 pagesChapitre - 1 Les Acides Et Les Baseseduardo3000Pas encore d'évaluation
- PH Et SolubilitéDocument34 pagesPH Et SolubilitésafemindPas encore d'évaluation
- Micro MDocument28 pagesMicro Ml3bsectionbPas encore d'évaluation
- Chapitre 2 Acide BaseDocument17 pagesChapitre 2 Acide BaseSouFien MabroukPas encore d'évaluation
- Chap I-3 CSDocument11 pagesChap I-3 CSSimo MaroPas encore d'évaluation
- Chap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDocument74 pagesChap5 - EC2-Eqgilibres Acido-Basiques - 2022 - ON - DEPDylanPas encore d'évaluation
- CHAPITRE I - Chimie en SolutionDocument3 pagesCHAPITRE I - Chimie en SolutionNikabou Napo TCHANDIKOUPas encore d'évaluation
- Séance 1.091 Acide Base StagiairesDocument7 pagesSéance 1.091 Acide Base Stagiairesaita.kane6Pas encore d'évaluation
- Chapitre Un CDocument13 pagesChapitre Un CDaboPas encore d'évaluation
- Acide Base PDFDocument3 pagesAcide Base PDFAbdelhakim BailalPas encore d'évaluation
- Equilibre Acido-Basique 2019Document44 pagesEquilibre Acido-Basique 2019Théophile NAMOINEPas encore d'évaluation
- Force Des Acides Et BasesDocument4 pagesForce Des Acides Et Basestjmhfkdkd5Pas encore d'évaluation
- Tab 3Document11 pagesTab 3deziri mohamedPas encore d'évaluation
- Calcul Du PH Des Solutions AqueusesDocument5 pagesCalcul Du PH Des Solutions AqueusesHassen JinyorPas encore d'évaluation
- 6-Les Équilibres Acido-BasiquesDocument50 pages6-Les Équilibres Acido-BasiqueslilybarachantPas encore d'évaluation
- Reactivité Chimique - Chapitre 2Document69 pagesReactivité Chimique - Chapitre 2abraham LincolnPas encore d'évaluation
- Chapitre 3: Transformations Chimiques S'effectuant Dans Les Deux SensDocument6 pagesChapitre 3: Transformations Chimiques S'effectuant Dans Les Deux SensDounia Larhouasli MarrakchiPas encore d'évaluation
- Chapitre 3: Transformations Chimiques S'effectuant Dans LesDocument6 pagesChapitre 3: Transformations Chimiques S'effectuant Dans LesFATIMA fatiiiPas encore d'évaluation
- Cours Acide BaseDocument14 pagesCours Acide BaseAli AllamPas encore d'évaluation
- Equilibres Acido-BasiquesDocument43 pagesEquilibres Acido-Basiquesattentatalabombe100% (5)
- Chap1 Acide BaseDocument43 pagesChap1 Acide BaseBtn Princii IsraëlPas encore d'évaluation
- Les Acides Et Les BasesDocument3 pagesLes Acides Et Les BasesRemy HebertPas encore d'évaluation
- 27Tlf-SMP2 Cours Chimie en Solution Chapitres 2 Et 3 PR OUACHTAKDocument46 pages27Tlf-SMP2 Cours Chimie en Solution Chapitres 2 Et 3 PR OUACHTAKHhhhppp MikPas encore d'évaluation
- Chap 2 Les Acides Et Les BasesDocument4 pagesChap 2 Les Acides Et Les BasessaliPas encore d'évaluation
- Solutionaqueusechap 2Document6 pagesSolutionaqueusechap 2Kawthar MokhtarPas encore d'évaluation
- Chapitre 2Document64 pagesChapitre 2ILHAM AMRAOUIPas encore d'évaluation
- 5-Transformations Acide-Base Solution AqueuseDocument4 pages5-Transformations Acide-Base Solution AqueusesdoulajPas encore d'évaluation
- Chapitre 3 Reaction ABDocument4 pagesChapitre 3 Reaction ABkimoPas encore d'évaluation
- Chapitre Chimie st2sDocument6 pagesChapitre Chimie st2snabil douadiPas encore d'évaluation
- 2-Équilibres IoniquesDocument14 pages2-Équilibres IoniquesNour el houdaPas encore d'évaluation
- Equilibre Acido-BasiqueDocument44 pagesEquilibre Acido-BasiqueKhaoula OthmaniPas encore d'évaluation
- ch13 Reaction Chimique Echange ProtonDocument5 pagesch13 Reaction Chimique Echange ProtonSophie RosiPas encore d'évaluation
- Analyse Equilibres Reactions Acide Base PrecipitationDocument50 pagesAnalyse Equilibres Reactions Acide Base PrecipitationCyril GaillardPas encore d'évaluation
- Chapitre Propriétés Acido-BasiquesDocument11 pagesChapitre Propriétés Acido-BasiquesjeanPas encore d'évaluation
- Cours III Acides - Bases-A. BENAMARDocument60 pagesCours III Acides - Bases-A. BENAMARMed Seghir YounesPas encore d'évaluation
- LC13 - Acides Et Bases (Lycée) : Niveau: TS BibliographieDocument13 pagesLC13 - Acides Et Bases (Lycée) : Niveau: TS BibliographieDiallo SafaiouPas encore d'évaluation
- Chapitre I Partie 1Document8 pagesChapitre I Partie 1Amna TahriPas encore d'évaluation
- I. PH D Une Solution AqueuseDocument5 pagesI. PH D Une Solution AqueuseJean-Loïc BauchetPas encore d'évaluation
- Cours Chimie IIDocument37 pagesCours Chimie IINesrine Kaddouri100% (1)
- AcibaseDocument35 pagesAcibaseAbdessamad EttariqiPas encore d'évaluation
- C7 Cours T°S Acide Faible Base Faible Couple Acide Base Et Constante D AciditéDocument11 pagesC7 Cours T°S Acide Faible Base Faible Couple Acide Base Et Constante D AciditéBabacar NdiayePas encore d'évaluation
- Acide and BaseDocument80 pagesAcide and BaseMBOTAKE LawsonPas encore d'évaluation
- Transformations Acide - Base Eleve NDocument2 pagesTransformations Acide - Base Eleve Nblack HPas encore d'évaluation
- TS Chim Chap3Document11 pagesTS Chim Chap3HAMADA1972Pas encore d'évaluation
- Étude de La Poussée AxialeDocument5 pagesÉtude de La Poussée Axialechahrazed bngPas encore d'évaluation
- Aide Memoire Tuyauterie - CompletDocument62 pagesAide Memoire Tuyauterie - CompletMars7695% (121)
- Les Modes de Transferts Thermique Dons Les BatimentDocument6 pagesLes Modes de Transferts Thermique Dons Les Batimentfatiha100% (1)
- 3 - Rapport Sukuk Final PDFDocument28 pages3 - Rapport Sukuk Final PDFOussama Derwich100% (2)
- 9 - Cours 9 Applications Industrielles Du Laser AggrandiDocument4 pages9 - Cours 9 Applications Industrielles Du Laser AggrandiLokman HamzaPas encore d'évaluation
- Certificat Informatique & Internet - Guide de L'apprenantDocument6 pagesCertificat Informatique & Internet - Guide de L'apprenantKhadidiatou DialloPas encore d'évaluation
- rapport_cc_MILKADocument21 pagesrapport_cc_MILKAfefeelbouzidiPas encore d'évaluation
- LeadershipDocument6 pagesLeadershipEvodie WestPas encore d'évaluation
- Physique StatistiqueDocument369 pagesPhysique StatistiqueAnas Hasni86% (7)
- (CFT) Memento PDFDocument6 pages(CFT) Memento PDFlacoste123Pas encore d'évaluation
- Système CW de LiebertDocument86 pagesSystème CW de LiebertJavier LunaPas encore d'évaluation
- CV Afiatou ToeDocument1 pageCV Afiatou ToeFranck AbPas encore d'évaluation
- Jeu de L'oie Épisode 3Document5 pagesJeu de L'oie Épisode 3Mery MeryPas encore d'évaluation
- Cours HDD ASSASNETDocument91 pagesCours HDD ASSASNETAlyssa PeixotoPas encore d'évaluation
- STA201 - Equations Structurelles - 1 - JakobowiczDocument65 pagesSTA201 - Equations Structurelles - 1 - JakobowicztchamPas encore d'évaluation
- Devoir de Controle +Liaisons+MécaniquesN2 1AS 2021Document4 pagesDevoir de Controle +Liaisons+MécaniquesN2 1AS 2021Razan KhPas encore d'évaluation
- Mobiscript 3Document77 pagesMobiscript 3wukzPas encore d'évaluation
- Cas - Pratique - Conduite - Du - Changement - Jean-FrançoisDocument3 pagesCas - Pratique - Conduite - Du - Changement - Jean-FrançoisFérielPas encore d'évaluation
- MTTH 4Document1 pageMTTH 4Anas MenoirPas encore d'évaluation
- Programmation Didactique - Concours 10Document55 pagesProgrammation Didactique - Concours 10Miguel92% (13)
- Evangile Apocryphe de ThomasDocument10 pagesEvangile Apocryphe de ThomasYves MinougouPas encore d'évaluation
- Examen de EntrepreneuriatDocument14 pagesExamen de EntrepreneuriatMamadou Gueye100% (1)
- Guide Des Associations 2020 21Document88 pagesGuide Des Associations 2020 21David Avishaï CohenPas encore d'évaluation
- Itinerary Email v2 20160620193500903Document3 pagesItinerary Email v2 20160620193500903Shaimae ChatouiPas encore d'évaluation
- Placard de Recrutement ATS FRDocument7 pagesPlacard de Recrutement ATS FRMarass-Tech AgadezPas encore d'évaluation
- Il Faut Que Je Sois ParfaitDocument111 pagesIl Faut Que Je Sois ParfaitlynxnetPas encore d'évaluation
- SolfegeDocument24 pagesSolfegeDodaPas encore d'évaluation
- PompageDocument14 pagesPompagewithe animalsPas encore d'évaluation
- L'Etat de Nature Chez Thomas HobbesDocument10 pagesL'Etat de Nature Chez Thomas HobbesDenisa Elena FocaruPas encore d'évaluation
- Les Obstacles A La CommunicationDocument3 pagesLes Obstacles A La CommunicationSissou Bello100% (2)