Académique Documents
Professionnel Documents
Culture Documents
98606175
Transféré par
Ahmed Omar AmineCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
98606175
Transféré par
Ahmed Omar AmineDroits d'auteur :
Formats disponibles
Microgreffage du pistachier (Pistacia vera L.) cv.
Mateur
Chatibi A., Ghorbel A., Kchouk M.L., Mliki A. X GREMPA Seminar Zaragoza : CIHEAM Cahiers Options Mditerranennes; n. 33 1998 pages 121-130
Article available on lin e / Article dispon ible en lign e ladresse : -------------------------------------------------------------------------------------------------------------------------------------------------------------------------http://om.ciheam.org/article.php?IDPDF=98606175 -------------------------------------------------------------------------------------------------------------------------------------------------------------------------To cite th is article / Pou r citer cet article -------------------------------------------------------------------------------------------------------------------------------------------------------------------------Chatibi A., Ghorbel A., Kchouk M.L., Mliki A. Microgreffage du pistach ier ( Pistacia vera L.) cv. Mateu r. X GREMPA Seminar . Zaragoza : CIHEAM, 1998. p. 121-130 (Cahiers Options Mditerranennes; n. 33) --------------------------------------------------------------------------------------------------------------------------------------------------------------------------
http://www.ciheam.org/ http://om.ciheam.org/
CIHEAM - Options Mediterraneennes
Microgreffage du pistachier (Pisfacia vera L.) CV. Mateur
A. Chatibi, M.L. de 95, 2050
A. Mliki et A. Ghorbel
- fistacia vera L. prsente des difficults de bouturage, de greffage et mme de transplantation. De plus, l'entre en production de cette culture est assez tardive(huit dix ans). Pourtant, le pistachier possede des facults d'adaptation varitale peu communes car il supporte divers sols (acides, calcaires, gypseux), de faibles pluviomtries et pousse des altitudes allant du niveau de la mer jusqu' plus de 1 O00 m. C'est une culture assez prometteuse pour les rgions arides car elle se substitue aisment l'amandier et mme l'olivier lorsque ceux-ci sont absents. Cependant, l'extension de la culture du pistachier demeure tributaire de la mise en place de techniques fiables de multiplication et de slection de nouvelles varits. La culture in vitrodu pistachier vrai s'est elle-mme heurte diverses difficults, et ce, malgr les rcents travaux entrepris au laboratoire qui ont permis de surmonter un grand nombre d'entre elles, et en particulier, de produire massivement le pistachier partir de cotyldons et de feuilles in vitro. Toutefois, les plants ainsi obtenus sont comparables aux plants de semis. Ainsi, afin de produire massivement des plants identiques au cultivar d'origine, nous nous sommes intresss la technique de microgreffage in vitro et ex vitro du CV. Mateur. Les rsultats montrent que les pourcentages de succs ont t plus levs lorsque les greffons proviennent de vitropousses issues d'apex mristmatiques in vitro et cultives sur le milieu Zygotic(Ra-Z) contenant 1,O mg l-' de 0,2 mg I-' AIB et 0,05 mg l-' ANA. Ces greffons doivent tre greffs en fente sur des porte-greffes de cm de diam&tre, issus de semis cultivs en serre.
: Pistacia vera
L., porte-greffe, greffon, greffage
in vitro, greffage ex vitro.
SUMMARY "Micrograftingof pistachio (Pistacia veraL.) CV. Mateur". Pistacia vera L. is difficult to propagate by cutthgs, to graft andto transplant, besides the fact that it also takes long to produce (eight to ten years). Yet, the
crop has uncommon characteristics for varietal adaptation since it grows on unsuitable soils (acidic, calcareous, 1,000 gypseous), with low rainfall and at various altitudes ranging from sea level up to more than m. It is avery promising crop in drylands since if easily replaces almond and even olive trees when these are absent. However, the extension of pistachio culture still depends on reliable techniques for propagation and breeding ofnew cultivars. In vitro culture of true pistachio faces several difficukies despite the recent work undertaken in the laboratory which allowed to overcome many of them and particularly to massively produce in vitro pistachio starting from cotyledons and leaves. However, such plants are comparable to seedlings, and, in order to produce plantsidentical to theoriginalcultivar, we investigatedthe in vitro and exvitro micrograftingtechniquesofthe CV. Mateur. So far, results showed that the success rate has been higher when scions were taken on vitro-shoots issued from meristematic apices in vitro 1.0 mg r' BAP, 0.2 mg ri IBA and 0.05 mg ri NAA. Scions must be cleft grafted on rootstocks, having a diameter of cm, obtained from greenhouse-cultivated seeds.
Key words; Pistacia vera
rootstocks, scions, in vitrograftingr ex vitrografting.
Le ces
(fistacia vera
pas la La in vitro elle-mme s'est complexe suite de dsinfection, d'oxydation des tissus, de maintien des de et ; Chatibi et al., 1995). Les de CV. decotyldons(Chatibi et al., 1996a) etdefeuilles issues et al., 1996b).Toutefois,endpit du succs de ces technique in vitro, il n'en pas moins que l'obtention massivede dlicate.
de
est se
assez difficile
121
CIHEAM - Options Mediterraneennes
Le microgreffage est une approche qui permet de rsoudre bon nombre de problmes classiques tels que les incompatibilits greffons/porte-greffes, la secretion de substances phnoliques et de rsine (Joley et Opitz, 1971 ; AI-Barazi et Schwabe, 1982 ; Sheibani et Villiers, 1995), les reprises lentes et alatoires des greffons, entrainant une htrognit des arbres greffs surtout lorsqu'il s'agit des porte-greffes issus de semis. Le microgreffage permet galement d'augmenter la production par : (i) la production de plantes indemnes de virus (Mosella- Chancel, 1979 ; Vogel et al., 1988 ; Barba, et al., 1989 ; Ben Abdallah et al., 1996) ou (i) pour la production de ttes de lignes ou de greffons sains utiliss pour la multiplication (Vogel et al., 1988). peut galement tre utilis pour I'indexage (Bouzid, 1983 ; Tanne et al., 1993) et le contrle prcoce des incompatibilits au greffage (Jonard et al., 1988). Chez le pistachier (Pistacia vera L.), le micrograffage a t jusque-l peu pratiqu (Barghchi et Alderson, 1989 ; Abousalimet Mantell, 1992). Ainsi, cette technique reprsente juste titre une alternative supplmentaire l'extension grande chelle d'un cultivar donn. Le prsent travail rapporte les rsultats obtenus lors du microgreffage du pistachier vrai CV. Mateur. Divers facteurs ont t pris en considration notamment l'origine du greffon et du porte-greffe, leur tat physiologique, le milieu de multiplication ainsi que la technique de microgreffage proprement dite.
Matriel et mthodes
Les greffons et porte-greffes proviennent tous du pistachier (Pistacia veraL.) CV. Mateur. Les porte-greffes utiliss sont issus de semis cultivs soit in vitro soit ex vitro en serre contrle, tandis que les greffons sont des bourgeons (apicaux ou axillaires) ou des mristmes obtenus soit sur un pied-mre g de quatre ans soit partir de vitroplants. Les techniques de microgreffage utilises (en surface, en fente longitudinale ou en cusson) varient en fonction de l'origine du greffon et du porte-greffe. Le pH des milieux de culture utiliss est ajust 6,5 avant autoclavage par l'addition de KOH (IN). Les plants in vitro sont maintenus en chambrede culture 25k2"C sous une intensit lumineuse de 3 lux (-15 W m-') et une photopriode de 12 h.
Obtention de porte-greffes de semis
vitro
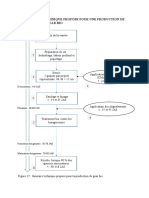
Des graines collectes en 1993 sont dsinfectes selon le protocole dcrit par Chatibi et al. (1996a,b).Les embryons zygotiques sont dbarrasss de cotyldons et cultivs sur le milieu de base de MS (Murashige et Skoog, 1962) dpourvu d'hormones et contenant 15 g 1-1 de saccharose et 7 g l d'agar. Au bout de trois semaines de culture, les plantules atteignent 5 8 cm de longueur. Elles seront dcapites 2 cm des racines, en prenant soin d'liminer tous les bourgeons axillaires, et serviront de porte-greffes : (i) aux apex issus de pied-mres de quatre ans ou (i) aux apex issus de vitropousses. Le microgreffage est effectu in vitro soit en surface soit en cusson (Fig. 1). L'ensemble, greffon et porte-greffe, est cultiv sur un milieu contenant 0,3 mg l-' BAP, 0,l mg l-' AIB, 15 g l-' saccharose et 6 g l-' agar.
Les graines maintenues pralablement un mois 4"C, sont dcortiques puis traites par une solution fongicide 1 g1-l de Rovral pendant uneheure.Aprs 48 h de trempage dans de l'eau distille strile, les graines sont traites une seconde fois au Rovral (0,5 g l-') et semes sous serre contrle dans des gobelets en plastique de 150 ml contenant de la tourbe strile. Aprs 4 semaines de culture, des plantules de 10 cm sont dveloppes dont le diamtre des tiges varie entre 0,l et 0,3 cm. Ces plantules seront decapites 4 cm environ des racines et tous les bourgeons situs en dessous de la section seront limins. Le microgreffage de bourgeons issus de vitropousses,
122
CIHEAM - Options Mediterraneennes
elles-mmes issus de mristmes, se fera en fente longitudinale pour les bourgeons apicaux et en cusson pour les bourgeons axillaires (Fig. 1).
en surface
en ecusson
multiplicationin vitro
Jantule& ga8cm
culture d'embryon zygotique sur sans hormones
bourgeon apical B 1 cm
bourgeon axillaire
grnine trait&
en fente longitudinale bourgeons terminaux bourgeons axillaires
en Bcusson
issus de
$&capitation plantule
de
cm
Fig. 1.
Microgreffage in vitro et ex vitro du pistachier (Pistacia vera L.) CV. Mateur.
Prlkvement et culture d'apex mristmatiques
Prlvement d'apex issus du matriel vgtal adulte
Aprs dsinfection des boutures (Chatibi et al., prleves sur un pied-mre adulte maintenu en verger, des apex mristmatiques de cm prlevs aseptiquement sur des bourgeons axillaires sont greffs directement sur les porte-greffes obtenus in vitro. Les apex peuvent tre dormants ou en activit physiologique (Fig. 1).
123
CIHEAM - Options Mediterraneennes
Prlvement d'apex issus de matriel in vitro
Paralllement, desapex mristmatiques de 0,5-1,0mm sont cultivs in vitro surun milieu d'initiation base de MS additionn de 1 ,O mg l-' thiamine-HCI, 50 mg l-' myoinositol, 40 mg fer chlat, 0,5 mg l-' BA, 0,5 mg l"' 0,2 mg l-' GA3, 20,O g l-' de glucose et 8,O g l-' d'agar. Aprs 9 semaines de culture, les pousses vigoureuses de 4 5 cm sont transfres sur trois milieux de multiplication base de MS, de Zygotic (Ra-Z Rangan et al., 1968) et de DKW (McGranahan et Driver, 1987) additionns chacun de 1 ,O mg BAP, 0,2 mg l-' AIB et 0,05 mg l-' ANA. Des apex mristmatiques de 0,2-0,3 cm sont ensuite prlevs sur les pousses dveloppes. sont greffs soit en surface soit en cusson, les porte-greffes provenant de la germination des embryons zygotiques cultivs in vitro (Fig.
Microgreffage ex vitro
Microgreffage de bourgeons terminaux
Les bourgeons terminaux, prlevs sur des pousses produites in vitro sur les trois milieux de base utiliss, sont introduits dans une fente longitudinale pratique la surface dcapitke du porte-greffe issu de semis en serre. Ensuite, la zone de greffe est ligature par du crin vgtal raphia (Chamaerops humilis), trait au pralable par du Rovral 0,5 g l-', puis recouverte par de la pte modeler (Fig. 1).
Microgreffage des bourgeons axillaires
Ces bourgeons en croissance proviennent des vitropousses dbarrasses de leurs bourgeons terminaux et cultives sur les trois milieux de base riches en BAP (1,5 mg l-'). Aprs une semaine de culture, les bourgeons axillaires sont isols, avec les feuilles qui les abritent et une partie de I'corce, puis introduits soigneusement dans le "T" de I'cusson. La zone de greffe subit ensuite le mme traitement dcrit prcedemment (Fig. 1). Qu'il s'agisse du greffage en fente ou en 6cusson, aprs leur pulvrisation par une solution du fongicide (Rovral) raison de 0,5 mgl-', les plantules greffes sont places en serre sous un tunnel en plastique bien tanche o l'humidit est saturante. La temprature dans la serre est maintenue 25+3"C.
Analyse des rsultats
La mise au point de la technique du microgreffage a ncessit des tests successifs afin de dterminer : (i) l'influence du mode de greffage in vitro, en surface ou en cusson, en partant d'apex mristmatiques de vitroplants (Table 1) ; (i) l'influence de l'originedes greffons sur le microgreffage in vitro en cusson (Table 2) ; (iii) l'influence du milieu de multiplication quant au greffage ex vitro en cusson (Table 3) ; (v) l'influence du mode de greffage ex vitro, enfente longitudinale ou en cusson, en partant de vitropousses cultives sur milieu de multiplication Ra-Z (Table 4) et (v) l'influence du diametre du porte-greffe ex vitro quand la greffe est pratiquke en fente longitudinale (Table 5).
Rsultats et discussion Microgreffage in vitro
Greffage d'apex rnristrnatiques issus de vitropousses
Les meilleurs pourcentages de russite du greffage invitro (67-76%, Tables 1 et 2) ont t obtenus avec la greffe en cusson d'apex juvniles issus de vitropousses. Dans ces conditions, la
124
CIHEAM - Options Mediterraneennes
croissance des greffons est rapide et 7 8 semaines aprs le greffage, les greffons atteignent 8 10 cm de longueur (Fig. 2).
Table 1.
Influence des techniques du greffage in vitro (apex mristmatiques de vitropousses)
Mode greffage de Nombre greffes de dcapite Surface Ecusson 24 34
% Contamination
% Reprise
Table 2.
Influence de l'origine des greffons (microgreffage in vitro, greffe en cusson)
Origine des greffons Nombre de greffes
% Contamination
34 34 24
% Reprise
76,O 16,6
In vitro (dormant) Verger
activit) Verger (en
Greffage d'apex mristmatiques issus du pied-mre
Le greffage in vitro d'apex issus de matriel vgtal adulte ne russit que dans17% des cas. Ceci pourrait tre d une incompatibilit entre greffon et porte-greffe qui se manifeste pareillement par une disjonction des greffons qui prissent progressivement suite une scrtion intense de substances phnoliques au niveau de la zone de greffe (Martinez, 1979 ; Mosella-Chancel, 1979 ; Bouzid, 1983 ; Jonard, 1986). Cet chec est plus marqu lorsque les apex sont prlevs sur un matrielvgtal en pleine activitphysiologique.Parcontre,lorsque les apexsontdormants, la librationdesubstancesphnoliquesestplusrduiteet n'entraine gnralementpas la mort du greffon. En outre, dans certains cas, aprs trois semaines de greffage et au cours de la croissance des cals cicatriciels, les greffons sont rejets faute d'une bonne soudure avec les porte-greffes. Les plantulesobtenuesaprs8semaines ne dpassentpas1,5 2,O cm.Cetteobservationat galement rapporte par Barghchi et Alderson (1989). Ce rsultat rejoint galement celui dcrit par Bouzid (1983) sur le Citrus quant l'importance du stade juvnile du greffon.
Acclimatation des plantules greffes
Qu'il s'agisse des greffons produits in vitro ou ceux issus du matriel vgtal adulte dormant, et malgr la russite dumicrogreffage, les racines desporte-greffess'hypertrophient (Fig. 3) en donnant naissance une callogense intense. Ils finissent gnralement par se ncroser et aucune reprise n'a t observe sur substrat naturel en serre contrle. L'limination prcoce des racines avant greffage, telle que dcrite chez la vigne (Benin et Grenan, 1984 ; Ben Abdallah et al., 1996), rduit sensiblement la croissance des greffons. Mme aprs culture sur le milieu rhizogne (Chatibi et a/., 1995), l'induction ultrieure de nouvelles racines adventives n'est pas possible.
L e
ex vifro
L'aspect morphologique et physiologique des greffons varie en fonction du milieu de multiplication utilis. Ainsi, les pousses multiplies sur milieu de base Ra-Z sont gnralement semi-lignifies et donnent des bourgeons apicaux qui, bien que de taille importante, demeurent en croissance ralentie. De plus, les feuilles sont plutt cassantes. Ceci offre aux greffons une meilleure rsistanceau stress pendant et aprs le greffage ex vitro. Au contraire, les pousses cultives sur les mileux de base MS ou DKW ont une croissance trs active et leurs bourgeons apicaux sont trs poussants, montrant des
125
CIHEAM - Options Mediterraneennes
feuilles plus larges,mais toutefois plus fragiles lors dugreffage. Les greffonsainsiconstitus se dshydratent rapidement ds leur sortie du tube et deviennenttrs sensibles I'vapotranspiration.
Fig. 2.
Microgreffage in vitro en cusson d'un apex mristmatique sur un porte-greffeobtenu in vitro.
Fig. 3.
Hypertrophie de la racine du porte-greffe obtenu in vitro aprs microgreffage.
Par ailleurs, le microgreffage en fente ou en cusson (Figs 4 et 5) donne une reprise importante (60%, Table 4). Toutefois, lorsque la greffe est en cusson,la croissance ultrieure des greffons et la vigueurdesplantsobtenussontmoinsimportanteset la cicatrisation demeure le plussouvent incomplte. En ce qui concerne le diamtre des porte-greffes,nous avons remarqu qu'en dessous de 0,2 cm, la pratique du microgreffage est dlicate car elle ncessite des greffons trs rduits qui, malheureusement, se ncrosent trs rapidement aprs greffage. Au-del d'un diametre de 0,3 cm du porte-greffe, et notamment 1,O cm, nous avons observ une incompatibilit accrue entre greffon et porte-greffe, marqueparunesecretionexcessivedessubstancesphnoliquesquiinhibent la soudure. De plus, nous avons remarqu que mGme le taux de contamination durant le microgreffage augmente lorsque le diamtre des porte-greffes est important. De ce fait, les meilleurs pourcentages de reprise sont obtenus lorsque le microgreffage est effectu sur des sujets de 0,2 0,3 cm de diamtre. Ainsi, la reprise des greffons issus de vitroplants est meilleure lorsqu'ils sont cultivs sur R a 2 et greffs en fente longitudinale sur des porte-greffes de 0,2 0,3 cm de diamtre (Tables 3, 4 et 5).
126
CIHEAM - Options Mediterraneennes
Fig. 4.
Microgreffage ex vitro en fente d'un bourgeon terminal sur un porte-greffe issu de semis.
Fig. 5.
Microgreffage ex vitro en cusson d'un bourgeon axillaire sur un porte-greffe issu de semis.
Table 3.
Influence du milieu de mulitiplication (greffe en cusson en serre)
% Contamination 15 % Reprise
Milieux base deNombre greffes de (1962) MS Ra-Z (1968) 431
44,O 21 ,o
30,O
24 20
62,5 15,6
DKW 987) (1
Table 4. Influence de
la technique du greffage ex vitro (milieu de multiplication Ra-Z) Contamination 12,o 21,o 67,O Reprise
Technique du greffage Nombre de greffes longitudinale Fente Ecusson 58,O 24 24
127
CIHEAM - Options Mediterraneennes
Table 5.
Influence du diamtre du porte-greffe ex vitro (greffe en fente longitudinale)
% Contamination
% Reprise
Diametre Nombre greffes des de porte-greffes(cm)
30
730 12,o 7,O 13,O 10,o 17,O
63,O
25 15 30 10
15
8
Conclusions
Le microgreffage, l'inverse du greffage classique, permet au manipulateur de se dgager des contraintessaisonniresetd'acclrerI'tablissementdegreffessaines. Ceci estd'autant plus intressantque la techniquepermetd'obtenirdesgreffons et des porte-greffesau mme stade physiologique, condition sine qua non la russite de la compatibilit de la greffe chez les espces ligneuses. Parmicrogreffage,nousavons pu obteniruntauxderepriseimportantquiavoisine les 70% lorsque le greffon est issu de vitropousses produites sur Ra-Z et greffs en fente longitudinale sur des porte-greffes de 0,2 cm de diamtre. Nous avons remarqu que la russite du microgreffage in vitro dpend non seulement de I'ge physiologique des greffons et des porte-greffes mais galement de l'poque de prlvement du greffon sur les pieds-mres adultes et de I'paisseur du porte-greffe. Le mme rsultat a t observ dans le genre Prunus (Martinez, 1979), chez le p6cher (Possel et al., 1980) et chez le pommier (Shu Ching-Huang et Millikan, 1982). Cependant, chez le pommier, les meilleurs rsultats ont t obtenus lorsque la plante est en pleine activit physiologique, entre les mois d'avril et de juin, alors que chez le pistachier il est prfrable de prlever les greffons sur un matriel adulte dormant. Par ailleurs, face l'htrognit des rsultats du microgreffage ex vitro, lie au diamtre du porte-greffe issu desemis, l'utilisation de vitroplants acclimats pourrait constituerunemeilleure alternative.Eneffet, aprs environquatresemainesd'acclimatation,nousavonsconstatque les vitroplantsontgnralementundiamtrecomprisentre0,2 et 0,4 cm, ce quireprsenteune condition assez favorable pour la russite dumicrogreffage ex vitrochez le pistachier CV. Mateur. Ainsi, l'analyse des rsultats relatifs au microgreffage du pistachier vrai a rvl6 que : (i) l'origine des greffons ; (i) leur tat physiologique ; (iii) le diamtre des porte-greffeset (iv) les milieux de base utiliss pour la multiplication des pousses in vitro, jouent un rle dterminant dans la russite de la technique du microgreffage du pistachier. A l'instar de plusieurs arbres fruitiers, tels que le pcher, le Citrus et la vigne, la technique du microgreffage peut intervenir activement dans l'amlioration de la production du pistachier CV. Mateur. Les incertitudes du microgreffage ex vitro sur des plantules issues de semis, lies gnralement au diamtre des porte-greffes, peuvent tre escamotes par la production de porte-greffes homognes in vitro. Ceci est d'autant plus-pratique que certaines espces du genre Pistacia utilises couramment comme porte-greffe, tel que le Pistacia integerrima, semblent tre plus facile multiplier in vitro que le Pistacia vera L. L'obtentionde porte-greffes homognespeuttre ralise soit partir d'apex mristmatiques ou .de bourgeons axillaires chez fistacia integerrima (Avanzato ef al., 1993 ; Martinelli,1987); soit encorepar la rgnrationdebourgeonsadventifs partirdescotyldons matures de Pistacia vera L. (Chatibi et al., 1996a,b).
128
CIHEAM - Options Mediterraneennes
Rfrences
Abousalim, A. et Mantell, S.H. (1992). Micrografting Cell Tissue OrganCult., 29 : 231-234. of pistachio (fistacia vera L.
CV.
Mateur). Plant
Al-Barazi, M. et Schwabe, W. (1982). Rooting softwood cuttings of adult Pistacia vera L. J. Horf. Sci., 57(2) : 247-252. Avanzato, D., Cherubini, S. et Chacha, C. (1993). Analisi di alcuni fattori che influenzano l'innesto di fistacia integerrima clonato in vitro. Rivista di Frutticoltura, 12 : 61-65. Barba, M., Cupidi, A. et Amminabile, A. (1989). Uso del microinnesto in vitro per il risanamento del Mandoro. Dans: Atti del Convegno Virosi ed Entomofauna del Mandoro, pp. 155-166. Barghchi, M. et Alderson, P.G. (1989). Pistachio (fistacia vera L.). Biotechnology in Agriculture and Forestry, Vol. 5 , Tree Bajaj, Y.P.S. (ed.). pp. 68-98. BenAbdallah, F., Fnayou, A.,Grenan, S. etGhorbel, A. (1996).Contribution l'amliorationdu microgreffage de la vigne. Bulletin de No. 785-786(69) : 601-616. Benin, M. et Grenan, S. (1.984). Le microgreffage : Nouvelle technique d'limination des virus de la vigne. f r o . Agri. Viti., 2 : 33-36. Bouzid, S. (1 983).Morphogense et possibilits nouvelles de multiplication vgtative in vitro chez le Citrus. Thse de Doctorat Es-Sci. Nat., Fac. Sci. Tunis p. 136. Chatibi, A., Kchouk, M.L., Ben Abdallah, F., Zemni, H. et Ghorbel, A. (1995). Rooting improvement of fistacia vera L. CV. Mateur by in vitro culture of apices and cuttings.Acta Horficulturae, 41 9: 213220. Chatibi, A., Kchouk, M.L., Mliki, A., Zemni, H. et Ghorbel, A. (1996a). Use adventitiousshootsregenerationandplantpropagationfrommaturecotyledons (Pistacia veraL.). Acta Horficulfurae, (soumis). of growth regulators for of pistachio
Chatibi,A.,Kchouk,M.L.,Mliki,A.etGhorbel,A.(1996b).Organogense in vitro du pistachier (fistacia vera L.) CV. Mateur. Dans : X Colloque GREMfA, Mekns, Maroc, 13-17 octobre 1996. Jacquy, P. (1973). La culture du pistachier en Tunisie.Projet AGP FAO/TUN/72/003. Joley, L.E. et Opitz, K.W. (1971). Further experiences with propagation of Pistacia. Combined. Dans : Proceeding of the lnternational Plant Propagators Society, 21 : 62-76. Jonard, R. (1 986). Micrografting and its Applications to Tree Improvement. Biotechnoloy in Agriculture and Forestry. Vol. 1, Trees 1. Bajaj, Y.P. S. (ed.). pp. 31-48.
,
Jonard, Luckman, D., Schall, F. et Villemur, P. (1988). Essai de contrle prcoce des incompatibilits au greffagechezdeuxespces fruitires (abricotieretcitronnier), l'aidede plusieurs techniques de culture in vitro : Microgreffage, association d'entre-noeuds, fusion de cals, suspenssions cellulaires. grne Colloque sur les' Recherches Fruitires, Bordeaux, France, 7-8 dcembre, 1988, pp. 239-254. Martinelli, A. (1987). Cloning and propagation of fistacia integerrima by tissue culture. California Pistachio Comm. Ann. Rep., pp. 92-93. Martinez, J.E. (1979). Techniques de greffage in vitro d'apexappliques I'tude des incompatibilits du- genrePrunus. Thse 3eme Cycle, Agron. au greffage chez diverses espces fruitires Phytotech., USTL., Montpellier, p. 151. McGranahan, G.H. et Driver, J. (1987). Cell and Tissue Culture in Forestry. Bonga, J.B. (ed.). Njhoff, Dordrecht.
129
CIHEAM - Options Mediterraneennes
Mosella-Chancell,' L. (1979). Le microgreffage in vitro du pcher (Prunus persica Batsch) : Influence de certains composs phnoliques.CRAS (Srie D), 289 : 567-570. Murashige, T. et Skoog, F. (1962). A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant, 15 : 473-497. Possel, J., Martinez, J. et Jonard, R. (1980). Variations saisonnires de l'aptitude du greffagein vitro d'apex du pcher (Prunus persica Batsch). Relations avec les teneurs en composs phnoliques endognes et les activits peroxydasiques et polyphnoloxydasiques.Physiol, V4g., 18 : 665-675. Rangan, T.S., Murashige, T. et Bitters, W.P. (1968). In vitro initiation of nucellar embryos monoembryonic Citrus. HortSci.,3 : 226-227. in
Sheibani, A. et Villiers, T.A. (1 995). Effect of explant type and culture medium on micropropagation of three Pistacia species. Acta Horticulturae,41 9: 229-232. Shu-Ching Huanget Millikan, D.F. (1982). ln vitro micrografting of apple shoot tips. J. Hort- Sci., 15 : 741-743. Tanne, E., Shlamovitz, et Spiegel-Roy, P. (1993). Rapidly diagnosing grapevine Corky-Bark vitro micrografting. HortSci., 28(6) : 667-668. by in
Vogel, R., Nicoli, M. et Bove, J.M. (1988). Le microgreffage de mristmes in vitro. Son utilisation en Corse pour la rgnration des agrumes. Fruits, 43(3) : 167-173.
130
Vous aimerez peut-être aussi
- MicroGreffage Du Pistachier PDFDocument11 pagesMicroGreffage Du Pistachier PDFAbu AquiPas encore d'évaluation
- Chapter 3 Les Cultures in Vitro Végétales v2011Document29 pagesChapter 3 Les Cultures in Vitro Végétales v2011Rabah ZerzourPas encore d'évaluation
- Micro Greffage Du ChataignierDocument6 pagesMicro Greffage Du ChataignierJames GutierrezPas encore d'évaluation
- CIVDocument29 pagesCIVKESSAISSIA SARAPas encore d'évaluation
- Les Cultures in Vitro VégétalesDocument3 pagesLes Cultures in Vitro VégétalesAoulmi Amani100% (1)
- In Vitro Culture of The Olive Tree Olea Europaea L. Present Aspects and Prospects 2024Document16 pagesIn Vitro Culture of The Olive Tree Olea Europaea L. Present Aspects and Prospects 2024lamesabosharPas encore d'évaluation
- In Vitro Rearing of Pratylenchidae Nematodes On CaDocument5 pagesIn Vitro Rearing of Pratylenchidae Nematodes On CaAdrian VallejoPas encore d'évaluation
- ChampignonsDocument10 pagesChampignonsDahirouPas encore d'évaluation
- Oasis86 93Document8 pagesOasis86 93HAJAR ZZPas encore d'évaluation
- 7 HarinarivoDocument25 pages7 HarinarivoST-CYR VANESSAPas encore d'évaluation
- Cours 1 Biotechnologies Végétales PDFDocument29 pagesCours 1 Biotechnologies Végétales PDFlazraqab50% (2)
- Canne A SucreDocument27 pagesCanne A SucrePinky Gouy100% (2)
- Multiplication Végétative in Vitro de L'arabustaDocument10 pagesMultiplication Végétative in Vitro de L'arabustaAdan VelázquezPas encore d'évaluation
- Culture in VitroDocument4 pagesCulture in Vitrogouf100% (1)
- Micropropagation of Adult Avocado MoDocument10 pagesMicropropagation of Adult Avocado Moothman berraqPas encore d'évaluation
- Botechnologies Végétales 1Document49 pagesBotechnologies Végétales 1Med Lamine RabhiPas encore d'évaluation
- Compte Rendu TP GreffageDocument11 pagesCompte Rendu TP GreffagebenikoundangePas encore d'évaluation
- Doc6 Fiche PIF DefDocument2 pagesDoc6 Fiche PIF DefStephane Durel MbidaPas encore d'évaluation
- La Multiplication Du PistachierDocument12 pagesLa Multiplication Du PistachierAbu AquiPas encore d'évaluation
- Bisuness Plan Michou PDFDocument6 pagesBisuness Plan Michou PDFJinny Pierre OnanaPas encore d'évaluation
- Culture Invitro Des Ve Get AuxDocument5 pagesCulture Invitro Des Ve Get Auxelhidhab2014Pas encore d'évaluation
- Fourrages Hydroponiques Inran-3Document10 pagesFourrages Hydroponiques Inran-3Samir BELGHOL100% (1)
- Valorisation Des Espèces MicroalguesDocument6 pagesValorisation Des Espèces Microalguesf.ezzahraeadnaniPas encore d'évaluation
- 1 PBDocument15 pages1 PBtbmtbm007Pas encore d'évaluation
- Protocole ExpérimentalDocument101 pagesProtocole Expérimentalisraami3raj100% (2)
- Itineraire Technique de Production de GuarDocument4 pagesItineraire Technique de Production de GuarKevine Kenmoe MochePas encore d'évaluation
- 164753-Article Text-425457-1-10-20180111Document19 pages164753-Article Text-425457-1-10-20180111CHEO BRADAPas encore d'évaluation
- Régénération de Vitroplants Par Embryogenèse Somatique À Partir D'embryons Zygotiques ImmaturesDocument10 pagesRégénération de Vitroplants Par Embryogenèse Somatique À Partir D'embryons Zygotiques ImmaturesYAZBACKPas encore d'évaluation
- Mita TechniquepifDocument3 pagesMita TechniquepifYvan NzouakeuPas encore d'évaluation
- txt38 Brochure Greffage AvocatierDocument14 pagestxt38 Brochure Greffage AvocatierEspoir LibertéPas encore d'évaluation
- INBP - de L'usage Des Graines Dans Le Pain - AnnexeDocument16 pagesINBP - de L'usage Des Graines Dans Le Pain - Annexethierry.trailerPas encore d'évaluation
- GOYAVIERDocument11 pagesGOYAVIERahande fabrice100% (2)
- Biotechnologies VégétalesDocument27 pagesBiotechnologies Végétalescoursenligne.lille190% (30)
- Hal 00928708Document11 pagesHal 00928708MarwaPas encore d'évaluation
- Techniques de Multiplication Des Plantes Chapitres 3, 4 Et 5Document30 pagesTechniques de Multiplication Des Plantes Chapitres 3, 4 Et 5Robert Bibong100% (1)
- 10 - Production Des Semences CertifieesDocument17 pages10 - Production Des Semences CertifieesMadjokfaOscarPas encore d'évaluation
- (Psilocybin FR) La Mycologie Recreative-Gaspard Des MontagnesDocument59 pages(Psilocybin FR) La Mycologie Recreative-Gaspard Des MontagnesMitko KrumovPas encore d'évaluation
- 1 0 Techniques de MultiplicationDocument14 pages1 0 Techniques de MultiplicationSami AbdouPas encore d'évaluation
- Cultiver CocoDocument4 pagesCultiver CocoMoussa FofanaPas encore d'évaluation
- Conservation Des Souches Et Ensemencement IndustrielDocument7 pagesConservation Des Souches Et Ensemencement IndustrielmokranimaminePas encore d'évaluation
- Production de Semences Sélectionnées Au MarocDocument10 pagesProduction de Semences Sélectionnées Au Maroczangui hamissou100% (1)
- Ftec Igname SemenceauxDocument2 pagesFtec Igname SemenceauxKobinan GbokoPas encore d'évaluation
- Graines GerméesDocument20 pagesGraines GerméesPé Nagy100% (6)
- Mushroom Growers GuideDocument43 pagesMushroom Growers GuideCraig Ohlsen100% (1)
- Technologie Semenciere IfdcDocument27 pagesTechnologie Semenciere IfdcAbdrahamane TRAOREPas encore d'évaluation
- Artemisia Annua PaludismeDocument3 pagesArtemisia Annua PaludismeJacques CélèrePas encore d'évaluation
- Cahier de Reference TechniqueDocument44 pagesCahier de Reference TechniqueMD Nassima100% (1)
- Icrisat Niger Genebank Article Reca Fev 2023Document10 pagesIcrisat Niger Genebank Article Reca Fev 2023mahamadougadokarimouPas encore d'évaluation
- Cacaoyer 2019Document7 pagesCacaoyer 2019Arsène DOUSSOHPas encore d'évaluation
- Ftech Cacao Ver2009Document4 pagesFtech Cacao Ver2009Kodana Adam CoulibalyPas encore d'évaluation
- Fiche Technique Synthetique Pour La Production Du Maïs Jaune Zea Mays L.Document5 pagesFiche Technique Synthetique Pour La Production Du Maïs Jaune Zea Mays L.mgoungbePas encore d'évaluation
- Agrodok41 PDFDocument90 pagesAgrodok41 PDFMaurice Lucien NaoussiPas encore d'évaluation
- Cours2bis vitrotechniquesapplicationsPM2008Document81 pagesCours2bis vitrotechniquesapplicationsPM2008othman berraqPas encore d'évaluation
- 2021 ProductiondeplantsDocument9 pages2021 ProductiondeplantsNico. BenoitPas encore d'évaluation
- Multiplication Végétative PDFDocument13 pagesMultiplication Végétative PDFMimoun Kandoussi0% (1)
- Cultiver BananeDocument4 pagesCultiver BananeMoussa FofanaPas encore d'évaluation
- Modifications à apporter à la taille de la vigne des Charentes: L'apoplexie, traitement préventif (méthode Poussard) , traitement curatifD'EverandModifications à apporter à la taille de la vigne des Charentes: L'apoplexie, traitement préventif (méthode Poussard) , traitement curatifPas encore d'évaluation
- Systèmes Aquaponiques, Plantes. Volume 3: Sistemas de acuaponíaD'EverandSystèmes Aquaponiques, Plantes. Volume 3: Sistemas de acuaponíaPas encore d'évaluation
- L'agroécologie - Cours Technique: Une agriculture biologique artisanale et autonomeD'EverandL'agroécologie - Cours Technique: Une agriculture biologique artisanale et autonomeÉvaluation : 5 sur 5 étoiles5/5 (2)
- سرار الحروف و حساب الجملDocument12 pagesسرار الحروف و حساب الجملAhmed Omar AminePas encore d'évaluation
- سرار الحروف و حساب الجملDocument12 pagesسرار الحروف و حساب الجملAhmed Omar AminePas encore d'évaluation
- MORINGA Production Et Transformation 1926 - PDF PDFDocument40 pagesMORINGA Production Et Transformation 1926 - PDF PDFAbu Aqui100% (2)
- Aloe Vera Laura SorianoDocument30 pagesAloe Vera Laura SorianoAhmed Omar AminePas encore d'évaluation
- Code Des ProfDocument27 pagesCode Des ProfAhmed Omar AminePas encore d'évaluation
- Code GeoDocument64 pagesCode GeoAhmed Omar AminePas encore d'évaluation
- Code DiplomesDocument12 pagesCode DiplomesAhmed Omar AminePas encore d'évaluation
- Electricite - Doc - TFB Energies SolairesDocument19 pagesElectricite - Doc - TFB Energies SolairesAhmed Omar AminePas encore d'évaluation
- CR RelaisDocument3 pagesCR RelaisNidhal HamdiPas encore d'évaluation
- 01 - Fonction Gamma Et Fonctions de Bessel PDFDocument34 pages01 - Fonction Gamma Et Fonctions de Bessel PDFAhmed Omar Amine100% (1)
- PolarisationDocument2 pagesPolarisationAhmed Omar AminePas encore d'évaluation
- AnalyseDocument261 pagesAnalysergconxolPas encore d'évaluation
- Théorie Et Pratique Du Calcul SymboliqueDocument84 pagesThéorie Et Pratique Du Calcul SymboliqueAhmed Omar AminePas encore d'évaluation
- R Seaux Lin AiresDocument9 pagesR Seaux Lin Airesfooks1099Pas encore d'évaluation
- Mecanique PointDocument11 pagesMecanique Pointabdelhi7475% (4)
- Mécanique RationnelleDocument414 pagesMécanique Rationnellefaridovitche100% (13)
- AmpliDocument7 pagesAmpliBounegab YoucefPas encore d'évaluation
- 01 - SQL ProceduralDocument19 pages01 - SQL ProceduralAhmed Omar AminePas encore d'évaluation
- 21emd 1 Mecanique Rationnelle 2000 2001Document4 pages21emd 1 Mecanique Rationnelle 2000 2001Ahmed Omar AminePas encore d'évaluation
- PDFDocument71 pagesPDFAhmed Omar AminePas encore d'évaluation
- TheseDocument188 pagesTheseAhmed Omar AminePas encore d'évaluation
- 05 - SQLDocument7 pages05 - SQLAhmed Omar AminePas encore d'évaluation
- Technique de SoudureDocument1 pageTechnique de SoudureAhmed Omar AminePas encore d'évaluation
- Huile de Figue de Barberie-SiliceDocument4 pagesHuile de Figue de Barberie-SiliceAhmed Omar AminePas encore d'évaluation
- Les Principales Techniques Distillation Extraction PDFDocument3 pagesLes Principales Techniques Distillation Extraction PDFAhmed Omar AminePas encore d'évaluation
- ANDI Demande - Constat - Entree - ExploitationDocument1 pageANDI Demande - Constat - Entree - ExploitationAhmed Omar Amine100% (4)
- ANDI Demande - Modification - ListeDocument4 pagesANDI Demande - Modification - ListeAhmed Omar Amine100% (1)
- Fiche Projet N 43 Unité D'exploitation de Plantes MédicinalesDocument3 pagesFiche Projet N 43 Unité D'exploitation de Plantes MédicinalesAhmed Omar AminePas encore d'évaluation
- 1nac Soci FR PDFDocument20 pages1nac Soci FR PDFAhmed Omar AminePas encore d'évaluation
- Zytostatika Checkliste ZL 20071130 F PDFDocument25 pagesZytostatika Checkliste ZL 20071130 F PDFAhmed Omar AminePas encore d'évaluation
- Maladies Des Plantes Cultives Et LutteDocument23 pagesMaladies Des Plantes Cultives Et LutteBasset BoumaddaPas encore d'évaluation
- Ftec Recepage ManiocDocument2 pagesFtec Recepage ManiocDiabagaté Siambou100% (1)
- CIRADjournals,+document 457561Document5 pagesCIRADjournals,+document 457561bipbip5504Pas encore d'évaluation
- Tomate Cerise Duroc 14Document24 pagesTomate Cerise Duroc 14Ismail AlaouiPas encore d'évaluation
- PoaceaeDocument8 pagesPoaceaeahmed12elbassilPas encore d'évaluation
- Forets Nourricieres Climat TempereDocument78 pagesForets Nourricieres Climat TempereBenjamin Lisan100% (1)
- Adventices Au Maroc Livre CouleursDocument448 pagesAdventices Au Maroc Livre CouleursMunatas Usus100% (1)
- Catalogue 2009 EnvoyéDocument13 pagesCatalogue 2009 EnvoyéraharahaPas encore d'évaluation
- Flore Pittoresque Et Medicale Des Antilles v04Document407 pagesFlore Pittoresque Et Medicale Des Antilles v04Dominique RosaliePas encore d'évaluation
- Festival Plantes Fontiers 2021 Programme CompletDocument3 pagesFestival Plantes Fontiers 2021 Programme CompletxcoppiPas encore d'évaluation
- La Culture de La FraiseDocument4 pagesLa Culture de La FraiseCedric NdibaPas encore d'évaluation
- Les Plantes Grasses Ou Succulentes, Idéales en Pot Ou en RocailleDocument9 pagesLes Plantes Grasses Ou Succulentes, Idéales en Pot Ou en RocailleElyasse B.Pas encore d'évaluation
- Mathematiques PrintempsDocument31 pagesMathematiques PrintempsLaurette LimaPas encore d'évaluation
- Agent de L'acariose Bronzée de La TomateDocument6 pagesAgent de L'acariose Bronzée de La TomatehindPas encore d'évaluation
- Siwar - PPTX (Enregistrement Automatique)Document10 pagesSiwar - PPTX (Enregistrement Automatique)Min yasminePas encore d'évaluation
- Memoire Master Soraia Et Chaima - 2 - MemoireDocument52 pagesMemoire Master Soraia Et Chaima - 2 - Memoireziadibrir0Pas encore d'évaluation
- Mémoire de RP YungHingDocument23 pagesMémoire de RP YungHingHoussou IgorPas encore d'évaluation
- 716 La Fixation Symbiotique D Azote Atmospherique-Oct1994Document50 pages716 La Fixation Symbiotique D Azote Atmospherique-Oct1994Anonymous MKSfyYyODPPas encore d'évaluation
- Guide Pratique Du Jardinier Francais Traite D Horticulture PH Desmoulins 1881Document495 pagesGuide Pratique Du Jardinier Francais Traite D Horticulture PH Desmoulins 1881foutriquetPas encore d'évaluation
- ARBORICULTUREDocument3 pagesARBORICULTUREBenmessabih RymaPas encore d'évaluation
- Guide Eco JardinDocument92 pagesGuide Eco Jardinglynis100% (3)
- GO-05 Normes de Stratification ForestièreDocument34 pagesGO-05 Normes de Stratification Forestièrefilms et séries en français JL LIK100% (1)
- Phytopatologie 2EME ANNEEDocument36 pagesPhytopatologie 2EME ANNEEKonan fulgence KouassiPas encore d'évaluation
- Fiche Tech Bio-Pesticides 231016Document2 pagesFiche Tech Bio-Pesticides 231016Rimka BakPas encore d'évaluation
- Plantes. Autogames AllogamesDocument5 pagesPlantes. Autogames AllogamesSamir BenmouffokPas encore d'évaluation
- Chapitrr 6 - Les GymnospermesDocument12 pagesChapitrr 6 - Les Gymnospermesidirlidia01Pas encore d'évaluation
- Document 387627Document10 pagesDocument 387627Izalmouna HamidPas encore d'évaluation
- Cours de BotaniqueDocument97 pagesCours de BotaniquePerrait DjiPas encore d'évaluation
- Cours Arboriculture Fruitiere 2013Document2 pagesCours Arboriculture Fruitiere 2013un_jour_de_printempsPas encore d'évaluation
- Malus SieversiiDocument10 pagesMalus Sieversiivocaw88374Pas encore d'évaluation