Académique Documents
Professionnel Documents
Culture Documents
Polycopié de Biochimie
Transféré par
nasroddine0 évaluation0% ont trouvé ce document utile (0 vote)
76 vues14 pagesCopyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
76 vues14 pagesPolycopié de Biochimie
Transféré par
nasroddineDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 14
a) Structure théorique : n’existe pas en réalité b) Forme zwitterionique : présente
aux valeurs de pH physiologique
Fig. II-01 : Structure générale d’un acide α-aminé (sauf la proline).
Fig. II-02 : Stéréoisomérisme des α-amino acides.
Fig. II-03 : Classification et propriétés des acides aminés protéiques.
Fig. II-04 : Structure chimique des 20 acides aminés protéiques.
Fig. II-05 : Formation réversible d'une liaison disulfure par oxydation
de deux molécules de cystéine.
a) Protéiques
b) Non protéiques
Fig. II-06 : Acides aminés peu fréquents.
Comportement acide
Comportement basique
Fig. II-07 : Propriété acido-basique (amphotérique) des acides aminés.
Fig. II-08 : Ionisation et titration des acides aminés.
Fig. II-09 : Formation de la liaison peptidique.
Fig. II-10 : Séquence d’amino acide chez l’Insuline Bovine.
Fig. II-11 : Présentation schématique de quelques fonctions des protéines
membranaires.
Fig. II-12 : Caractéristique de la liaison peptidique.
Fig. II-13 : Structure primaire des protéines.
Fig. II-14 : Structure secondaire des protéines, les hélices α.
Fig. II-15 : Hélices α de la Ferritine (protéine de stockage).
(A)
(B)
(C)
(D)
Fig. II-16 : Structure secondaire des protéines, les feuillets β.
A) présentation schématique des feuillets β, B) feuillets β antiparallèle, C) feuillets β
parallèle, D) feuillets β mixte.
.
Fig. II-17: feuillets β d’une protéine.
Fig. II-18: Structure tertiaire des protéines.
(A : Ribonucléase, B : Myoglobine)
(A) (B)
Fig. II-19: Structure quaternaire des protéines.
(A: Protein Cro du bactériophage λ, B : Hémoglobine)
Fig. II-20: Les niveaux structuraux des protéines.
Fig. II-21: Principe de la dialyse.
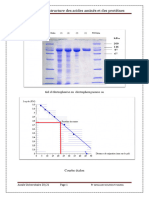
Fig. II-22: Séparation électrophorétique des protéines sur gels de polyacrylamide.
.
Fig. II-23: Chromatographie d’affinité.
Fig. II-24: Chromatographie d’exclusion (filtration sur gel).
Mélange de
protéines
Fig. II-25: Chromatographie d’échange d’ion.
Vous aimerez peut-être aussi
- Rappels Acides Aminã©s Protã©ines Master Agro 21Document23 pagesRappels Acides Aminã©s Protã©ines Master Agro 21sihatasnim9Pas encore d'évaluation
- Bi102-2017-Acides AminesDocument62 pagesBi102-2017-Acides AminesMà YàPas encore d'évaluation
- Les Acides AminesDocument63 pagesLes Acides AminesgdevouePas encore d'évaluation
- La Science Alimentaire de A A Z.Document12 pagesLa Science Alimentaire de A A Z.djaouad bourouaisPas encore d'évaluation
- Les Peptides BenchakrounDocument90 pagesLes Peptides BenchakrounMohamed ECHAMAIPas encore d'évaluation
- Biochimie: 1 Année de Médecine S1Document321 pagesBiochimie: 1 Année de Médecine S1Ezekari ChaimaePas encore d'évaluation
- Cours Protéines 2021Document34 pagesCours Protéines 2021elbeztamoumaymaPas encore d'évaluation
- Partie II - Bio Cellulaire - II.A.Les Procaryotes - 5. Synthèse Des ProtéinesDocument83 pagesPartie II - Bio Cellulaire - II.A.Les Procaryotes - 5. Synthèse Des ProtéinesmanelbeggarPas encore d'évaluation
- 12 bc2 Protides 120207Document103 pages12 bc2 Protides 120207hichem lounisPas encore d'évaluation
- Introduction + AaDocument10 pagesIntroduction + Aasoufireda25Pas encore d'évaluation
- 1 Protéines StudentDocument55 pages1 Protéines StudentNathan DenisPas encore d'évaluation
- Structure Et Fonction Des ProtéinesDocument31 pagesStructure Et Fonction Des Protéinespierrenobang237Pas encore d'évaluation
- Biochimie ProtidesDocument107 pagesBiochimie ProtidesFrançois regis NikièmaPas encore d'évaluation
- Chapitre III Les ProtéinesDocument13 pagesChapitre III Les ProtéinesEssassi AmmarPas encore d'évaluation
- DiaposDocument115 pagesDiaposAicha MrizigPas encore d'évaluation
- Introduction + Aa - ElèveDocument8 pagesIntroduction + Aa - Elèvesoufireda25Pas encore d'évaluation
- AcidesaminesDocument7 pagesAcidesaminesAnas kharraziPas encore d'évaluation
- Cours 1 Signalisation Cellulaire PDFDocument19 pagesCours 1 Signalisation Cellulaire PDFBouyelfane MohamedPas encore d'évaluation
- DM N°2 - SujetDocument7 pagesDM N°2 - Sujet9l100% (1)
- Biochimie Structurale 2Document105 pagesBiochimie Structurale 2PekoJhames08gmail.comPas encore d'évaluation
- Pharmacie Concours 2007Document2 pagesPharmacie Concours 2007FDPas encore d'évaluation
- Les Proteines Structures Fonctions 2021Document25 pagesLes Proteines Structures Fonctions 2021Ionpopmolly IrocktomfordPas encore d'évaluation
- BiochimieDocument12 pagesBiochimieEric Valery TAHOUE NOUMSIPas encore d'évaluation
- Cours Acides Aminés 2020-2021Document49 pagesCours Acides Aminés 2020-2021Abdelhamid ArouiPas encore d'évaluation
- Biochimie Structurale ProteinesDocument65 pagesBiochimie Structurale Proteineskhalilchips2005Pas encore d'évaluation
- Chimie Organique I BRAIADocument75 pagesChimie Organique I BRAIAMoussoulouhou e Eddine Moutuen HabibPas encore d'évaluation
- PACES - Poly - Protides Peptide Et Proteines LEHMANN 2010-2011 - 1 Page CouleurDocument41 pagesPACES - Poly - Protides Peptide Et Proteines LEHMANN 2010-2011 - 1 Page CouleurTRARIPas encore d'évaluation
- PRESENTATION 2023 - Acides Aminés, Peptides Et ProtéinesDocument67 pagesPRESENTATION 2023 - Acides Aminés, Peptides Et Protéinesmintchimechak2Pas encore d'évaluation
- Biochimie PDFDocument34 pagesBiochimie PDF12052000Pas encore d'évaluation
- Récap QCM ProtéinesDocument8 pagesRécap QCM Protéinesmyriam.baazzi26Pas encore d'évaluation
- Biochimej Univ Angers FR Page2 COURS 7RelStructFonction 3StrDocument41 pagesBiochimej Univ Angers FR Page2 COURS 7RelStructFonction 3StrmadmajPas encore d'évaluation
- BIOCHIMIEDocument5 pagesBIOCHIMIEMamoutou BouaréPas encore d'évaluation
- Cahier de QCM ED 2016-17 Complet-1Document13 pagesCahier de QCM ED 2016-17 Complet-1hakududePas encore d'évaluation
- 1 6 Structure Des Acides Amines-1Document13 pages1 6 Structure Des Acides Amines-1Eric OuakaraPas encore d'évaluation
- Acides Aminés Et Peptides Deuxième PartieDocument26 pagesAcides Aminés Et Peptides Deuxième PartieDouâa BmPas encore d'évaluation
- TD 3 PEPTIDES Et PROTEINESDocument4 pagesTD 3 PEPTIDES Et PROTEINESnasroddine100% (4)
- Cahier D'exercice1Document24 pagesCahier D'exercice1GHERMI .M100% (8)
- Les Alcaloïdes Leurs Propriétés Biologiques Et Effets ThérapeutiquesDocument75 pagesLes Alcaloïdes Leurs Propriétés Biologiques Et Effets ThérapeutiqueslazharinoghagPas encore d'évaluation
- KPAF Bio AVB 2223 Chap 4bis Biochimie SuiteDocument76 pagesKPAF Bio AVB 2223 Chap 4bis Biochimie SuiteMargauxPas encore d'évaluation
- TD QCM Oct 2012Document5 pagesTD QCM Oct 2012Sabri CherrakPas encore d'évaluation
- Acides Aminés, Peptides Et ProtéinesDocument42 pagesAcides Aminés, Peptides Et ProtéinesEspoir EDOHPas encore d'évaluation
- Chapitre2-Biochimie structurale-L3-CP-S6-2020-2021-proteines-lakehalDocument34 pagesChapitre2-Biochimie structurale-L3-CP-S6-2020-2021-proteines-lakehalRayane YsfPas encore d'évaluation
- Biochimie - Questions de TD Upc 23Document5 pagesBiochimie - Questions de TD Upc 23abbymij62Pas encore d'évaluation
- Liste Des Figures: Chapitre I: Rappels BibliographiquesDocument2 pagesListe Des Figures: Chapitre I: Rappels BibliographiquescilinePas encore d'évaluation
- Proteines 22-23Document52 pagesProteines 22-23Linda Mansour100% (1)
- 01-Les Acides Aminés, Peptides Et Protéines, Cours 2015-2016 PDFDocument38 pages01-Les Acides Aminés, Peptides Et Protéines, Cours 2015-2016 PDFnassinassi98100% (1)
- Biochimie Struc Cours 2Document36 pagesBiochimie Struc Cours 2Djamosco SibabiPas encore d'évaluation
- Chimie RepresentationSpatialeMoleculesDocument13 pagesChimie RepresentationSpatialeMoleculesmaxime.courtil1811Pas encore d'évaluation
- 2 - Dégradation Des Proteines Et AA - PolyDocument16 pages2 - Dégradation Des Proteines Et AA - PolyRuth BUKAKAPas encore d'évaluation
- Cours 2. Structure Et Fonction Des ProtéinesDocument148 pagesCours 2. Structure Et Fonction Des Protéinesmessage4you.11Pas encore d'évaluation
- Chap5 2020Document56 pagesChap5 2020afennPas encore d'évaluation
- Correction Groupe 1 GHDocument15 pagesCorrection Groupe 1 GHMayssa ChayahPas encore d'évaluation
- Peptides, Caractéristiques Et Structure Des ProtéinesDocument11 pagesPeptides, Caractéristiques Et Structure Des ProtéinesMohamed HATRAFPas encore d'évaluation
- Programme Detaille Des Enseignements de Licence de BiochimieDocument30 pagesProgramme Detaille Des Enseignements de Licence de BiochimiephildkonanPas encore d'évaluation
- Proteines 2020Document20 pagesProteines 2020OwassiPas encore d'évaluation
- FGFGDocument2 pagesFGFGmarnPas encore d'évaluation
- ميلتي كــوشDocument3 pagesميلتي كــوشnasroddinePas encore d'évaluation
- Memoire Boukhors-Bendif-Halitim 2022univ Msila Master - Enc PDFDocument50 pagesMemoire Boukhors-Bendif-Halitim 2022univ Msila Master - Enc PDFnasroddinePas encore d'évaluation
- BEGGUI-ZAIDI CompressedDocument73 pagesBEGGUI-ZAIDI CompressednasroddinePas encore d'évaluation
- Chapitre I Présentation de Lagglomération PDFDocument6 pagesChapitre I Présentation de Lagglomération PDFnasroddinePas encore d'évaluation
- 2260 THVDocument47 pages2260 THVnasroddinePas encore d'évaluation
- Orca Share Media1682435864357 7056647475619766666 PDFDocument4 pagesOrca Share Media1682435864357 7056647475619766666 PDFnasroddinePas encore d'évaluation
- TD 2 Acides AminesDocument2 pagesTD 2 Acides AminesIngenieur Agro100% (4)
- Informatique 2 PDFDocument51 pagesInformatique 2 PDFLOUAI2RPas encore d'évaluation
- Analyse Granulométrique Pas Tamisage À SecDocument3 pagesAnalyse Granulométrique Pas Tamisage À SecSofiane Bensefia40% (5)
- Le Matériel GénétiqueDocument14 pagesLe Matériel GénétiquenasroddinePas encore d'évaluation
- 2 Version TDgénétique 2 AnnéeDocument37 pages2 Version TDgénétique 2 AnnéenasroddinePas encore d'évaluation
- CARTOUCHEDocument2 pagesCARTOUCHEnasroddinePas encore d'évaluation
- TP Mds N02 PDFDocument4 pagesTP Mds N02 PDFLeghrieb RaidPas encore d'évaluation
- TD 3 PEPTIDES Et PROTEINESDocument4 pagesTD 3 PEPTIDES Et PROTEINESnasroddine100% (4)
- Chapitre I Les GlucidesDocument42 pagesChapitre I Les GlucidesbigwebPas encore d'évaluation
- Méthodesderésolutionex GénétdiploidesDocument2 pagesMéthodesderésolutionex GénétdiploidesnasroddinePas encore d'évaluation
- Matériel GénétiqueDocument7 pagesMatériel GénétiquenasroddinePas encore d'évaluation
- Cours de ZoologieDocument56 pagesCours de Zoologienasroddine100% (1)
- LU Les Acides - AminesDocument10 pagesLU Les Acides - AminesnasroddinePas encore d'évaluation
- Lois de MendelDocument40 pagesLois de MendelAbdelkrim BenchemamiPas encore d'évaluation
- GénétiqueDocument42 pagesGénétiquenasroddinePas encore d'évaluation
- Glucides PDFDocument38 pagesGlucides PDFNanfaPas encore d'évaluation
- Chap.3 ProtéineDocument46 pagesChap.3 ProtéinenasroddinePas encore d'évaluation
- LipideDocument28 pagesLipideChanez FekirPas encore d'évaluation
- Cours Écopedologie1Document27 pagesCours Écopedologie1nasroddine100% (1)
- Assainissement: Spécialité: GroupeDocument26 pagesAssainissement: Spécialité: Groupenasroddine100% (1)
- Relation Sol VégétationDocument22 pagesRelation Sol Végétationnasroddine100% (2)
- Faune de SolDocument22 pagesFaune de Solnasroddine100% (1)
- Relation Sol VégétationDocument22 pagesRelation Sol Végétationnasroddine100% (2)
- Les Domaines ProteiquesDocument33 pagesLes Domaines Proteiqueshafssaki643Pas encore d'évaluation
- Peptides Et ProtéinesDocument12 pagesPeptides Et ProtéinesIngenieur AgroPas encore d'évaluation
- TH8726 NakibDocument148 pagesTH8726 NakibInes AquariusPas encore d'évaluation
- Fiche Cours MedisupDocument37 pagesFiche Cours Medisupdudeman67% (3)
- Proteines 22-23Document52 pagesProteines 22-23Linda Mansour100% (1)
- Peptides, Caractéristiques Et Structure Des ProtéinesDocument11 pagesPeptides, Caractéristiques Et Structure Des ProtéinesMohamed HATRAFPas encore d'évaluation
- Cours 1 Partie IDocument160 pagesCours 1 Partie IMaria gacemPas encore d'évaluation
- Seve Michel p14 PDFDocument34 pagesSeve Michel p14 PDFla manga gamingPas encore d'évaluation
- Biochimie 03 - Structures Des ProtéinesDocument22 pagesBiochimie 03 - Structures Des ProtéinesNathan CohenPas encore d'évaluation
- UE1 - Biochimie - ProtéinesDocument23 pagesUE1 - Biochimie - Protéinessun-nee-chan9Pas encore d'évaluation
- Polycopié de BiochimieDocument14 pagesPolycopié de BiochimienasroddinePas encore d'évaluation
- 3les ProteinesDocument55 pages3les ProteinesHaddy MarouanePas encore d'évaluation
- CorrectionDocument42 pagesCorrectionSandraPas encore d'évaluation
- Les Proteines Structures Fonctions 2021Document25 pagesLes Proteines Structures Fonctions 2021Ionpopmolly IrocktomfordPas encore d'évaluation
- Annatuts - Biochimie - 2021-2022Document61 pagesAnnatuts - Biochimie - 2021-2022Modou KebePas encore d'évaluation
- Production Des Metabolites PDFDocument72 pagesProduction Des Metabolites PDFChawki MokademPas encore d'évaluation
- Cours Proteine 1er MasterDocument31 pagesCours Proteine 1er MasterKenz L'AïdPas encore d'évaluation
- Projet Final - La Toile D'araignéeDocument49 pagesProjet Final - La Toile D'araignéeEricjPas encore d'évaluation
- 12 bc2 Protides 120207Document103 pages12 bc2 Protides 120207hichem lounisPas encore d'évaluation
- Cours Biomolecules Biotech 2019Document145 pagesCours Biomolecules Biotech 2019Kouamé Emiliano Emmanuel N'ZOPas encore d'évaluation
- Biochimie Structurale 2Document105 pagesBiochimie Structurale 2PekoJhames08gmail.comPas encore d'évaluation
- PACES - Poly - Protides Peptide Et Proteines LEHMANN 2010-2011 - 1 Page CouleurDocument41 pagesPACES - Poly - Protides Peptide Et Proteines LEHMANN 2010-2011 - 1 Page CouleurTRARIPas encore d'évaluation
- Biochimie Des Animaux Domestiques I Synthèse: Objet Du CoursDocument62 pagesBiochimie Des Animaux Domestiques I Synthèse: Objet Du CoursJustin DrouetPas encore d'évaluation
- 4 Protides CoursDocument7 pages4 Protides CoursBetschbel DorcéPas encore d'évaluation
- Proteines 4Document41 pagesProteines 4Dr.Zakaria MFTPas encore d'évaluation
- Biochimie 1a Medecine Khlil 2020-21Document113 pagesBiochimie 1a Medecine Khlil 2020-21the girlPas encore d'évaluation
- Les ProteinesDocument10 pagesLes ProteinesWissal ElbarPas encore d'évaluation
- TD ProteinesDocument30 pagesTD ProteinesSoufiane MboutayebPas encore d'évaluation
- These Belakhdar Ok Final2Document46 pagesThese Belakhdar Ok Final2Amina HaniPas encore d'évaluation
- Cours 1Document13 pagesCours 1Cristina Cevallos CampañaPas encore d'évaluation