Académique Documents
Professionnel Documents
Culture Documents
Evolution Spontanée
Transféré par
Noury Abk0 évaluation0% ont trouvé ce document utile (0 vote)
5 vues3 pagesTitre original
evolution spontanée
Copyright
© © All Rights Reserved
Formats disponibles
PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
5 vues3 pagesEvolution Spontanée
Transféré par
Noury AbkDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 3
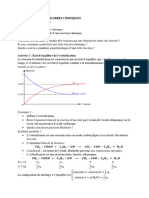
L'évolution spontanée d'un système
L'évolution spontanée d'un système chimique décrit la tendance d'un système
chimique à évoluer vers un état d'équilibre thermodynamique, où l'entropie est à son
maximum et où l'énergie libre est minimale. Cette évolution est déterminée par la loi
de la thermodynamique de la décroissance de l'énergie libre, qui stipule que dans un
système fermé, l'énergie libre tend à décroître au cours du temps. Les réactions
chimiques qui se produisent lors d'une évolution spontanée sont dirigées par
l'augmentation de l'entropie totale du système et la réduction de l'énergie libre.
L'évolution spontanée est souvent associée à l'augmentation du désordre ou de
l'entropie du système, ce qui se traduit par une augmentation du nombre de micro-
états accessibles au système. Cependant, il est important de noter que l'évolution
spontanée ne signifie pas toujours une augmentation de la température ou de la
concentration de la substance.
En résumé, l'évolution spontanée d'un système chimique décrit la tendance d'un
système à évoluer vers un état d'équilibre thermodynamique, déterminé par la loi de
la thermodynamique de la décroissance de l'énergie libre.
Il existe plusieurs facteurs qui peuvent influencer le sens d'évolution d'une réaction
chimique, notamment :
1. Énergie totale du système : Le sens de la réaction chimique dépend du signe de
ΔG, la différence d'énergie libre entre les réactifs et les produits. Une réaction
qui libère de l'énergie sous forme de chaleur ou de lumière est exothermique et
se déroulera spontanément dans le sens des produits. À l'inverse, une réaction
qui absorbe de l'énergie est endothermique et se déroulera spontanément dans
le sens des réactifs.
2. Température : L'augmentation de la température augmente la vitesse des
réactions chimiques, ce qui peut influencer le sens d'évolution.
3. Concentration des réactifs et des produits : La réaction chimique se déroulera
spontanément dans le sens qui augmente la concentration des produits et
diminue la concentration des réactifs.
4. Pression : La pression peut influencer le sens d'une réaction chimique en
modifiant la concentration des réactifs et des produits dans un système fermé.
5. Équilibre chimique : Le sens de la réaction chimique dépend de l'état d'équilibre
chimique entre les réactifs et les produits. Si les produits sont en excès, la
réaction se déroulera spontanément dans le sens des réactifs. Si les réactifs sont
en excès, la réaction se déroulera spontanément dans le sens des produits.
Il est important de prendre en compte ces facteurs pour prédire le sens d'évolution
d'une réaction chimique et pour comprendre comment la thermodynamique peut
influencer les réactions chimiques.
La température peut accélérer les réactions chimiques en augmentant la vitesse des
molécules, ce qui augmente la probabilité de collisions efficaces. Cependant, il est
important de noter que la température peut également endommager les catalyseurs
et les réactifs, ce qui peut limiter l'efficacité de la réaction.
La pression peut également influencer les réactions chimiques en modifiant la stabilité
et la distribution des espèces chimiques dans un système. En ajustant la pression, il est
possible d'augmenter la vitesse des réactions et de contrôler la direction dans laquelle
elles se produisent.
En somme, la température et la pression peuvent être utilisées pour contrôler et
optimiser les réactions chimiques, en combinaison avec d'autres types de catalyseurs.
cours
La constante d'équilibre K est un coefficient mathématique qui décrit la
distribution des espèces chimiques à l'équilibre dans une réaction chimique. Elle est
utilisée pour déterminer les conditions d'équilibre et les taux relatifs de formation des
produits et des réactifs dans une réaction chimique.
La constante d'équilibre K est déterminée à partir de la relation suivante :
où [A], [B], [C], [D] sont les concentrations des espèces chimiques A, B, C, D dans la
réaction chimique, et a, b, c, d sont les coefficients stoechiométriques de ces espèces.
La constante d'équilibre dépend de la température, de la pression et de la nature des
espèces chimiques impliquées dans la réaction. Elle peut être influencée par les
catalyseurs, les modificateurs de pH, les inhibiteurs, les stabilisateurs, etc.
En conclusion, la constante d'équilibre est un concept clé en chimie qui aide à
comprendre les conditions d'équilibre et les taux relatifs de formation des produits et
des réactifs dans une réaction chimique.
Le quotient de réaction, ou Q
Le quotient de réaction, ou Q, est un autre concept important en chimie qui décrit
les concentrations des espèces chimiques à un moment donné au cours de la réaction,
avant ou après l'atteinte de l'équilibre. Il est déterminé à partir de la relation suivante :
où [A], [B], [C], [D] sont les concentrations des espèces chimiques A, B, C, D dans la
réaction chimique, et a, b, c, d sont les coefficients stoechiométriques de ces espèces.
La relation entre Q et la constante d'équilibre K est la suivante :
• Si Q < K, la réaction chimique tend vers la formation de produits et l'équilibre
est atteint en augmentant les concentrations des produits C et D.
• Si Q = K, la réaction chimique est en équilibre.
• Si Q > K, la réaction chimique tend vers la formation de réactifs et l'équilibre est
atteint en augmentant les concentrations des réactifs A et B.
En conclusion, Q et K sont des concepts importants en chimie qui sont utilisés pour
décrire les conditions d'équilibre et les taux relatifs de formation des produits et des
réactifs dans une réaction chimique.
Vous aimerez peut-être aussi
- CV Ingenieur R&D Génie ProcédésDocument1 pageCV Ingenieur R&D Génie ProcédésTourvieillePas encore d'évaluation
- Chap I (Généralités Sur La Catalyse Et Les Catalyseurs)Document7 pagesChap I (Généralités Sur La Catalyse Et Les Catalyseurs)Dope BwoyPas encore d'évaluation
- La Distillation AtmosphériqueDocument62 pagesLa Distillation Atmosphériquerihab tlichPas encore d'évaluation
- Cinétique ChimiqueDocument7 pagesCinétique ChimiquehajPas encore d'évaluation
- Chap 2 Rappel de Cinétique Chimique Stœchiométrie Et Notion D'avancementDocument14 pagesChap 2 Rappel de Cinétique Chimique Stœchiométrie Et Notion D'avancementAPas encore d'évaluation
- Chapitre 2Document4 pagesChapitre 2Moustapha Bassirou NianePas encore d'évaluation
- 2022 Tle Spã© Chapitre 14 Cinétique ChimiqueDocument6 pages2022 Tle Spã© Chapitre 14 Cinétique Chimiquemavrinissue4Pas encore d'évaluation
- Chapitre 9Document17 pagesChapitre 9Belinda DancheuPas encore d'évaluation
- Analyse 3Document19 pagesAnalyse 3ibrahimPas encore d'évaluation
- TP EquilibrechimiqueDocument8 pagesTP Equilibrechimiquecherazer67% (3)
- Chapitre 3 Equilibres Chimiques 3ème Génie Des ProcédésDocument23 pagesChapitre 3 Equilibres Chimiques 3ème Génie Des ProcédésCherif LaifaPas encore d'évaluation
- Les Equilibres ChimiquesDocument7 pagesLes Equilibres Chimiquesdembamamadou274Pas encore d'évaluation
- Presentation 9Document9 pagesPresentation 9douaearikiPas encore d'évaluation
- Cours Chimie II 1ère SNV v2 PDFDocument38 pagesCours Chimie II 1ère SNV v2 PDFSamsouma BkPas encore d'évaluation
- Cinétique ChimiqueDocument10 pagesCinétique Chimiquearfpower100% (2)
- Cinétique ChimiqueDocument15 pagesCinétique ChimiqueYounes JaaidaniPas encore d'évaluation
- 6.equilibre ChimiqueDocument3 pages6.equilibre ChimiqueDan GrigorePas encore d'évaluation
- Transformation Chimiquebilan de MatièreDocument3 pagesTransformation Chimiquebilan de MatièreKamal LaourdaniPas encore d'évaluation
- TPN°2 Résumé PDFDocument4 pagesTPN°2 Résumé PDFNada DjenanePas encore d'évaluation
- Chapitre 1Document57 pagesChapitre 1minaPas encore d'évaluation
- 2 5 A Term-Enthalpie Libre StandardDocument7 pages2 5 A Term-Enthalpie Libre StandardoumaroumarietouPas encore d'évaluation
- Chp. Transformation ChimiqueDocument5 pagesChp. Transformation ChimiqueyvancharlesmendoumeessengPas encore d'évaluation
- L'équilibre Chimique 2Document16 pagesL'équilibre Chimique 2medPas encore d'évaluation
- Cours À Recopier 05Document2 pagesCours À Recopier 05jean valjeanPas encore d'évaluation
- Fiche Sur La Loi de Modération 3Document2 pagesFiche Sur La Loi de Modération 3chadaPas encore d'évaluation
- Chapitre II Influence Des Concentrations Et de La Température Sur La VitesseDocument4 pagesChapitre II Influence Des Concentrations Et de La Température Sur La VitesseroffaaPas encore d'évaluation
- CHAPITRE 1 Partie 2Document14 pagesCHAPITRE 1 Partie 2hamid ibbakhPas encore d'évaluation
- ChC1 - Effets ThermiquesDocument16 pagesChC1 - Effets ThermiquesMamadou Alpha JallowPas encore d'évaluation
- ch2 - Transformation Chimique Dun Systã Me - complétéDocument24 pagesch2 - Transformation Chimique Dun Systã Me - complétéd.xw.wx3Pas encore d'évaluation
- Cours SM4001 PDFDocument105 pagesCours SM4001 PDFbentouamiPas encore d'évaluation
- Transformations Chimiques S Effectuant Dans Les 2 Sens Resume de Cours 1Document2 pagesTransformations Chimiques S Effectuant Dans Les 2 Sens Resume de Cours 1Fatima Zahrae El BouhmidiPas encore d'évaluation
- Rappels Cinetique ChimiqueDocument22 pagesRappels Cinetique ChimiqueSaid Soilihi ZayadPas encore d'évaluation
- Avancement D Une Reaction ChimiqueDocument4 pagesAvancement D Une Reaction ChimiqueFitouri MoncefPas encore d'évaluation
- Cours 5Document19 pagesCours 5Moïse BlackPas encore d'évaluation
- 06 Evolution Spontanee D Un Systeme ChimiqueDocument7 pages06 Evolution Spontanee D Un Systeme ChimiqueElec FoPas encore d'évaluation
- II 04 CinetiqueDocument3 pagesII 04 CinetiqueMohamed ElouakilPas encore d'évaluation
- Chimie AnalytiqueDocument90 pagesChimie Analytiqueismaelsienou7Pas encore d'évaluation
- Preprint Cinetique ACXIXmeDocument14 pagesPreprint Cinetique ACXIXmephytanjaPas encore d'évaluation
- Cinétique ChimiqueDocument30 pagesCinétique ChimiqueYounes MotraniPas encore d'évaluation
- CR Equilibre ChimiqueDocument3 pagesCR Equilibre Chimiquemohamed mohPas encore d'évaluation
- Suivi D'une Transformation ChimiqueDocument4 pagesSuivi D'une Transformation ChimiqueBadr addine AboualalaPas encore d'évaluation
- Equilibre ChimiqueDocument7 pagesEquilibre ChimiquecherazerPas encore d'évaluation
- C12 Transformation ProfDocument1 pageC12 Transformation Profsamra147Pas encore d'évaluation
- Description D'un Système Chimique en Réaction (1029)Document6 pagesDescription D'un Système Chimique en Réaction (1029)AxellePas encore d'évaluation
- Chapitre - 6 Notes de CoursDocument7 pagesChapitre - 6 Notes de Coursfredalinga2Pas encore d'évaluation
- Les Transformations Chimiques de La MatièreDocument12 pagesLes Transformations Chimiques de La Matièreibtissam moumanPas encore d'évaluation
- Résumé Équilibre ChimiqueDocument4 pagesRésumé Équilibre ChimiqueMehdi BnmssdPas encore d'évaluation
- 0.Polycopié Biochimie Mé TaboliqueDocument68 pages0.Polycopié Biochimie Mé Taboliquesaraqassid6Pas encore d'évaluation
- Support de Cours HOMEOSTASIE DU MILIEU INTERIEUR ABED NousseibaDocument42 pagesSupport de Cours HOMEOSTASIE DU MILIEU INTERIEUR ABED Nousseibabalnanaime6Pas encore d'évaluation
- Suivi Temporel D'une Transformation ChimiqueDocument10 pagesSuivi Temporel D'une Transformation ChimiqueMhamed LaihemPas encore d'évaluation
- 1ère S - Chimie - Révision - La Transformation ChimiqueDocument13 pages1ère S - Chimie - Révision - La Transformation ChimiqueFidel ْPas encore d'évaluation
- Les Équilibres ChimiquesDocument3 pagesLes Équilibres ChimiquesabdderahmaneameurPas encore d'évaluation
- TP ChimieDocument10 pagesTP ChimieVictor AhadiPas encore d'évaluation
- CinetiqueDocument50 pagesCinetiquesidi mohamed el amine nekkalPas encore d'évaluation
- Réactivité Chimique: S3 Mip, FST - Fès Année Universitaire 2020/2021Document63 pagesRéactivité Chimique: S3 Mip, FST - Fès Année Universitaire 2020/2021Oumayma IkhlefPas encore d'évaluation
- Cours - Physique Loi de Moderation Et Loi Daction de Masse - Bac Math (2013-2014) MR Afdal AliDocument3 pagesCours - Physique Loi de Moderation Et Loi Daction de Masse - Bac Math (2013-2014) MR Afdal AliceddmefPas encore d'évaluation
- Résolution Examen Blanc 2019-2020 - Question 1Document1 pageRésolution Examen Blanc 2019-2020 - Question 1arthursimon374Pas encore d'évaluation
- Chapitre 1-ThermodynamiqueDocument7 pagesChapitre 1-ThermodynamiqueWiam ElboukriouiPas encore d'évaluation
- Prépa 2 - HamidiDocument8 pagesPrépa 2 - Hamidifatima chtoukiPas encore d'évaluation
- Processus irréversibles non linéaires en thermodynamique: Les Grands Articles d'UniversalisD'EverandProcessus irréversibles non linéaires en thermodynamique: Les Grands Articles d'UniversalisPas encore d'évaluation
- Études et recherches sur l'alimentation et le travail du cheval de troupeD'EverandÉtudes et recherches sur l'alimentation et le travail du cheval de troupePas encore d'évaluation
- Les Êtres Vivants Dépendent De La Mécanique QuantiqueD'EverandLes Êtres Vivants Dépendent De La Mécanique QuantiquePas encore d'évaluation
- Série D'exercices N°1 - Sciences Physiques Avancement D'une Réaction Chimiquue - Bac Mathématiques (2012-2013) MR BARHOUMI EzedineDocument4 pagesSérie D'exercices N°1 - Sciences Physiques Avancement D'une Réaction Chimiquue - Bac Mathématiques (2012-2013) MR BARHOUMI Ezedinejuini rawiaPas encore d'évaluation
- 7-Structure Et Fonction Des EnzymesDocument10 pages7-Structure Et Fonction Des EnzymesMaroua MeroufelPas encore d'évaluation
- Memoire Bensmaine 2022PDF3Document59 pagesMemoire Bensmaine 2022PDF3Mourad LovelPas encore d'évaluation
- TP 2 Pétro ChimieDocument2 pagesTP 2 Pétro Chimiesidi mohamed el amine nekkalPas encore d'évaluation
- Le Raffinage Principaux ProcédésDocument31 pagesLe Raffinage Principaux ProcédésAmine80% (5)
- Obtention de L'ammoniac Procédé HABER-BOSCH: N + 3H 2NHDocument3 pagesObtention de L'ammoniac Procédé HABER-BOSCH: N + 3H 2NHMa LiaPas encore d'évaluation
- Ed116 PDFDocument4 pagesEd116 PDFSofianeLaouPas encore d'évaluation
- Arroussi Maroua Azzi MouniraDocument78 pagesArroussi Maroua Azzi Mouniraamounei1303Pas encore d'évaluation
- Bulletin Des ENRDocument40 pagesBulletin Des ENRAbdelkader AlgérienPas encore d'évaluation
- C Ex05 Cin CaDocument4 pagesC Ex05 Cin CaZedexterPas encore d'évaluation
- Modélisation Et Commande D'un Système de Post-Traitement Pour La Régénération de Filtres À ParticulesDocument9 pagesModélisation Et Commande D'un Système de Post-Traitement Pour La Régénération de Filtres À ParticulesImad Al-RhammourPas encore d'évaluation
- Génie Enzymatique Section 1Document9 pagesGénie Enzymatique Section 1Irnatene ChahinezPas encore d'évaluation
- Procédés IndustrielsDocument67 pagesProcédés IndustrielsOthmane Jalal100% (3)
- B 2 2 Exemples de Substitution Elec 2Document7 pagesB 2 2 Exemples de Substitution Elec 2mohsatPas encore d'évaluation
- Agroressources Pour La Chimie DurableDocument13 pagesAgroressources Pour La Chimie DurableArnold Murphy Elouma NdingaPas encore d'évaluation
- 3 - Catalyse Et Catalyseurs PDFDocument4 pages3 - Catalyse Et Catalyseurs PDFAchwak BelfadelPas encore d'évaluation
- Cours APC Chimie 1ère CDDocument40 pagesCours APC Chimie 1ère CDPaulin100% (1)
- Craquage Catalytique PDFDocument15 pagesCraquage Catalytique PDFRaa Nia100% (1)
- Manya 2Document11 pagesManya 2Jonas lumbuPas encore d'évaluation
- Esterification HydrolyseDocument5 pagesEsterification HydrolyseAnis Dahnen100% (1)
- TP 2 Synthèse de BenzyleDocument14 pagesTP 2 Synthèse de BenzyleDhiab ArtPas encore d'évaluation
- BioinformatiqueDocument12 pagesBioinformatiqueJalelo AbdelPas encore d'évaluation
- Mini ProjetDocument17 pagesMini ProjetshadyPas encore d'évaluation
- SOMMAIREDocument30 pagesSOMMAIRENõ JõdPas encore d'évaluation
- Transformation Des Produits Alimentaires Par Des EnzymesDocument58 pagesTransformation Des Produits Alimentaires Par Des EnzymesEmnaPas encore d'évaluation
- 07 Chap1Document24 pages07 Chap1Houcine BendaoudPas encore d'évaluation
- Filtre Particule Diesel 02Document1 pageFiltre Particule Diesel 02oueslati boujbalPas encore d'évaluation