Académique Documents
Professionnel Documents
Culture Documents
Les Équilibres Chimiques
Transféré par
abdderahmaneameurCopyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Les Équilibres Chimiques
Transféré par
abdderahmaneameurDroits d'auteur :
Formats disponibles
Les équilibres chimiques
1 Réactions complètes et équilibres mobiles
Certaines réactions chimiques sont complètes. Par exemple, la réaction de formation de
chlorure d'hydrogène à haute température...
H2 + Cl2 = 2 HCl
...ne s'arrête que lorsque l'un des deux réactifs H2 ou Cl2 est épuisé. On parle parfois dans ce
cas d'équilibre statique. Par contre, d'autres réactions chimiques ne semblent s'arrêter que
lorsqu'une partie seulement des réactifs a été transformée en produit(s). On parle dans ce cas
d'équilibre chimique mobile.
2 Equilibres chimiques mobiles en phases homogènes
Considérons l'équation d'une réaction chimique réversible à laquelle s'applique la loi d'action
des masses:
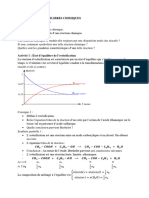
H2 + I2 = 2 HI
Si l'ensemble est porté à une température de 430°C, le système est homogène (car tous les
réactifs et tous les produits sont dans le même état, gazeux dans notre exemple), et, que l'on
parte d'un mélange stœchiométriquement équilibré de H2 et de I2 ou de HI, on mesure toujours
après réaction et en terme de nombre de molécules ou de moles:
Lorsque les vitesses v1 de formation de HI et v2 de décomposition de HI sont égales,
l'équilibre mobile est atteint puisqu'il se forme à chaque instant autant de molécules d'iodure
d'hydrogène qu'il n'en disparaît.
3 Facteurs influençant les équilibres chimiques
3.1 Influence des variations de concentration sur les équilibres
chimiques et équilibres en phases hétérogènes
Afin de maintenir la constante d'équilibre effectivement constante à une certaine température,
toute variation de la concentration d'un réactif ou d'un produit entraîne une réaction
permettant de retrouver l'équilibre originel. Si, par exemple, dans l'exemple précédent...
H2 + I2 = 2 HI
...on augmente la concentration de l'hydrogène, les rencontres des molécules d'hydrogène et
d'iode deviennent plus fréquentes et la réaction de formation d'iodure d'hydrogène voit sa
vitesse s'accroître. Le précédent équilibre est ainsi déplacé dans le sens de la formation de HI
jusqu'à ce que la valeur de...
[HI]2 / [H2] . [I2]
...redevienne égale à la constante d'équilibre.
La consommation d'un réactif ou d'un produit entraîne de déplacement de l'équilibre mobile
dans le sens qui épuise la substance rajoutée ou qui reconstitue la substance consommée.
3.2 Influence des variations de pression sur les équilibres
chimiques
Lors de la formation de gaz ammoniac selon la réaction...
N2 + 3 H2 = 2 NH3
...on constate qu'une mole de gaz diazote réagit exactement avec 3 moles de gaz dihydrogène
pour produire deux moles de gaz ammoniac. Or, on sait que toute mole de gaz occupe un
même volume à une température donnée. Il s'ensuit que lors de la réaction de formation
d'ammoniac, il y a diminution de volume. On comprend pourquoi une augmentation de
pression (ou, ce qui revient au même, une diminution du volume disponible) favorise la
synthèse d'ammoniac, tandis qu'une décompression en favorise la décomposition.
De façon générale, l'équilibre chimique mobile en phase gazeuse est influencé par la pression,
ce qu'exprime la loi de LE CHATELIER:
Dans un système chimique clos en équilibre mobile, une compression favorise la réaction qui
s'effectue avec contraction de volume; par contre, une décompression favorise la réaction qui
s'effectue avec dilatation de volume.
3.3 Influence des variations de température sur les équilibres
chimiques
Dans l'exemple précédent,...
H2 + I2 = 2 HI
...comme l'enthalpie standard de formation de HI vaut +26,3 kJ/mol, la réaction de formation
d'iodure d'hydrogène est une réaction endothermique, tandis que la réaction de décomposition
de HI est exothermique.
Une élévation de la température favorise donc la réaction endothermique et le déplacement de
l'équilibre dans le sens de la formation de HI, tandis qu'un abaissement de la température
déplace l'équilibre dans le sens de la décomposition de HI, favorisant ainsi la réaction
exothermique.
De façon générale, l'équilibre chimique mobile est influencé par la température, ce qu'exprime
la loi de VAN 'T HOFF:
Dans un système chimique clos en équilibre mobile, une élévation de la température favorise
la réaction endothermique; par contre, un abaissement de la température favorise la réaction
exothermique.
Par ailleurs, la valeur de la constante d'équilibre varie en fonction de la température (et
seulement en fonction de la température). Autrement dit, les proportions des produits et
réactifs d'un équilibre mobile ne sont pas les mêmes à différentes températures.
Vous aimerez peut-être aussi
- L'équilibre Chimique 2Document16 pagesL'équilibre Chimique 2medPas encore d'évaluation
- Les Equilibres ChimiquesDocument7 pagesLes Equilibres Chimiquesdembamamadou274Pas encore d'évaluation
- Chapitre 3 Equilibres Chimiques 3ème Génie Des ProcédésDocument23 pagesChapitre 3 Equilibres Chimiques 3ème Génie Des ProcédésCherif LaifaPas encore d'évaluation
- 08 Thermochimie PDFDocument21 pages08 Thermochimie PDFMourad MakhloufPas encore d'évaluation
- Chapitre Ii FmosDocument86 pagesChapitre Ii FmosOumarou KontaPas encore d'évaluation
- Réactivité Chimique: S3 Mip, FST - Fès Année Universitaire 2020/2021Document63 pagesRéactivité Chimique: S3 Mip, FST - Fès Année Universitaire 2020/2021Oumayma IkhlefPas encore d'évaluation
- Résolution Examen Blanc 2019-2020 - Question 1Document1 pageRésolution Examen Blanc 2019-2020 - Question 1arthursimon374Pas encore d'évaluation
- Cours - Chimie Loi de Modération Chap 3 Déplacement Des Équilibres Chimiques - Bac Mathématiques (2010-2011) MR Akermi AbdelkaderDocument3 pagesCours - Chimie Loi de Modération Chap 3 Déplacement Des Équilibres Chimiques - Bac Mathématiques (2010-2011) MR Akermi AbdelkaderAbdelhakim Ebdelli100% (1)
- CHAPITRE IV - Thermochimie PDFDocument8 pagesCHAPITRE IV - Thermochimie PDFRafik DraPas encore d'évaluation
- Equilibres ChimiquesDocument14 pagesEquilibres ChimiquesCRYPTEXPas encore d'évaluation
- CHAPITRE 1 Partie 2Document14 pagesCHAPITRE 1 Partie 2hamid ibbakhPas encore d'évaluation
- Analyse 3Document19 pagesAnalyse 3ibrahimPas encore d'évaluation
- TP EquilibrechimiqueDocument8 pagesTP Equilibrechimiquecherazer67% (3)
- Cours 13 Équilibres ChimiquesDocument4 pagesCours 13 Équilibres ChimiquesArti80% (5)
- CR Equilibre ChimiqueDocument3 pagesCR Equilibre Chimiquemohamed mohPas encore d'évaluation
- Evolution SpontaneeDocument4 pagesEvolution SpontaneeloujeynPas encore d'évaluation
- Les Lois de La Reaction Chimique Resume de Cours 4Document2 pagesLes Lois de La Reaction Chimique Resume de Cours 4Kaw TarPas encore d'évaluation
- ch2 - Transformation Chimique Dun Systã Me - complétéDocument24 pagesch2 - Transformation Chimique Dun Systã Me - complétéd.xw.wx3Pas encore d'évaluation
- Série D'exercices - Chimie Déplacement Des Équilibres Chimiques (Loi de Modération) - Bac Sciences Exp (2010-2011) MR Baccari. AnisDocument3 pagesSérie D'exercices - Chimie Déplacement Des Équilibres Chimiques (Loi de Modération) - Bac Sciences Exp (2010-2011) MR Baccari. AnisKais GuesmiPas encore d'évaluation
- Diagramme Enthalpique, Tracé Et Bilan ÉnergétiqueDocument6 pagesDiagramme Enthalpique, Tracé Et Bilan ÉnergétiquemassiPas encore d'évaluation
- Chapitre VII Thermochimie PDFDocument14 pagesChapitre VII Thermochimie PDFÇiçek KokusuPas encore d'évaluation
- Chimie - Epreuve Type 2022 - CopieDocument32 pagesChimie - Epreuve Type 2022 - CopieFélix NKURUNZIZAPas encore d'évaluation
- EnthalpieDocument3 pagesEnthalpieMathieu Belgacem0% (1)
- Solutions Et Expression de ConcentrationDocument11 pagesSolutions Et Expression de ConcentrationNicoleta ChivuPas encore d'évaluation
- Chapitre II - Equilibres Liquide - VapeurDocument28 pagesChapitre II - Equilibres Liquide - Vapeurben binahPas encore d'évaluation
- La RectificationDocument26 pagesLa Rectificationwissoubenaouda2110Pas encore d'évaluation
- Chapitre 7 Energie Et Enthalpie Libres - Critères D'évolution D'un SystèmeDocument17 pagesChapitre 7 Energie Et Enthalpie Libres - Critères D'évolution D'un SystèmeZehnouni AbderezakPas encore d'évaluation
- Evolution SpontanéeDocument3 pagesEvolution SpontanéeNoury AbkPas encore d'évaluation
- Cours Chim 06Document28 pagesCours Chim 06fsqiypiyiherafzferkPas encore d'évaluation
- ThermodynamiqueDocument8 pagesThermodynamiqueTess Berthier100% (1)
- Cours-Chimie-UAA6-UAA7-Equilibres Et ThermodynamiqueDocument18 pagesCours-Chimie-UAA6-UAA7-Equilibres Et Thermodynamiquebafoa.ifmPas encore d'évaluation
- Révision Thermo Et EquilibreDocument4 pagesRévision Thermo Et Equilibrefbch123Pas encore d'évaluation
- Ch9 Temps Evolution ChimiqueDocument4 pagesCh9 Temps Evolution Chimiqueالغزيزال الحسن EL GHZIZAL HassanePas encore d'évaluation
- Chaleur de Dissolution GC 2010 - CopieDocument7 pagesChaleur de Dissolution GC 2010 - Copiesidi mohamed el amine nekkalPas encore d'évaluation
- Chapitre 2Document7 pagesChapitre 2bouzidi hamzaPas encore d'évaluation
- Partie 3 Chap 2 L'enthalpie ElèveDocument18 pagesPartie 3 Chap 2 L'enthalpie ElèvedPas encore d'évaluation
- Partie ThermodynamiqueDocument22 pagesPartie ThermodynamiqueBelkiss LoudjainePas encore d'évaluation
- Cours Chapitre 4 2Document4 pagesCours Chapitre 4 2isautierpPas encore d'évaluation
- CH 3 (L.A.M. & Modération)Document4 pagesCH 3 (L.A.M. & Modération)Seif Souid88% (8)
- 1 Equilibres ChimiquesDocument6 pages1 Equilibres ChimiquesMira MslPas encore d'évaluation
- Chapitre 2Document4 pagesChapitre 2Moustapha Bassirou NianePas encore d'évaluation
- 6.equilibre ChimiqueDocument3 pages6.equilibre ChimiqueDan GrigorePas encore d'évaluation
- Thermochimie 2016Document18 pagesThermochimie 2016N. AKROURPas encore d'évaluation
- Chp. Transformation ChimiqueDocument5 pagesChp. Transformation ChimiqueyvancharlesmendoumeessengPas encore d'évaluation
- Chapitre 3Document102 pagesChapitre 3abderrahimnPas encore d'évaluation
- 1 Bioenergetique LAS 2020Document38 pages1 Bioenergetique LAS 2020Duvalier EkeguePas encore d'évaluation
- 1 Bioenergetique LAS 2020Document38 pages1 Bioenergetique LAS 2020hissein ousmanPas encore d'évaluation
- Rappels Cinetique ChimiqueDocument22 pagesRappels Cinetique ChimiqueSaid Soilihi ZayadPas encore d'évaluation
- Chap 2 Rappel de Cinétique Chimique Stœchiométrie Et Notion D'avancementDocument14 pagesChap 2 Rappel de Cinétique Chimique Stœchiométrie Et Notion D'avancementAPas encore d'évaluation
- Activités 1-3 Transformations p-98-100 CorrectionDocument2 pagesActivités 1-3 Transformations p-98-100 CorrectionmayaPas encore d'évaluation
- Chapitre2 Thermodynamique 2Document12 pagesChapitre2 Thermodynamique 2Mohamed GuelaiPas encore d'évaluation
- Chapitre 1 Thermodynamique AppliqueDocument15 pagesChapitre 1 Thermodynamique Appliquebouzidi hamzaPas encore d'évaluation
- CH3L.a.M. ModérationDocument6 pagesCH3L.a.M. ModérationAmen RouissiPas encore d'évaluation
- CH01 Cours ThermodynamiqueDocument13 pagesCH01 Cours ThermodynamiqueFaycal BouhaniaPas encore d'évaluation
- Chapitre 1 CS ENSA 2021Document26 pagesChapitre 1 CS ENSA 20213freefire 3gamePas encore d'évaluation
- Cinétique ChimiqueDocument10 pagesCinétique Chimiquearfpower100% (2)
- Doc. 5Document3 pagesDoc. 5einssenku781Pas encore d'évaluation
- FORCES ET EQUILIBRE (Classe de 2nde)Document12 pagesFORCES ET EQUILIBRE (Classe de 2nde)Tsiory IriantsoaPas encore d'évaluation
- Le Sensible, Passion Sémiotique en CommunicationDocument4 pagesLe Sensible, Passion Sémiotique en CommunicationHind Karou'ati OuannesPas encore d'évaluation
- MemoireDocument4 pagesMemoireMohamedsalah chaibrassouPas encore d'évaluation
- La Mort - Avant, Pendant, ApresDocument30 pagesLa Mort - Avant, Pendant, ApresPierre Le Maschere75% (4)
- CDM 10Document20 pagesCDM 10TRAOREPas encore d'évaluation
- La SocialisationDocument3 pagesLa SocialisationYasmine TariPas encore d'évaluation
- LES FICHES DE LECTURE L'acteur Et Le Système de Michel CrozierDocument27 pagesLES FICHES DE LECTURE L'acteur Et Le Système de Michel CrozierjosephPas encore d'évaluation
- Estimation Administrative Réseau GAZDocument1 pageEstimation Administrative Réseau GAZzineddine regadPas encore d'évaluation
- Aduc Distrib RéservoirDocument111 pagesAduc Distrib Réservoirmicheka100% (1)
- Aimé Forest (Intro + Cap 1-4) La Structure Métaphysique Du Concret Selon Saint Thoamsa D'aquinDocument69 pagesAimé Forest (Intro + Cap 1-4) La Structure Métaphysique Du Concret Selon Saint Thoamsa D'aquinMoacir N de Oliveira100% (1)
- 2 - LutilitarismeDocument3 pages2 - LutilitarismeArthur HotchmanPas encore d'évaluation
- TD N°1 Systèmes de TélécommunicationsDocument4 pagesTD N°1 Systèmes de Télécommunicationssamira sowPas encore d'évaluation
- LE LIVRE DES DOUZE PORTES de l'ALCHIMIEDocument7 pagesLE LIVRE DES DOUZE PORTES de l'ALCHIMIEBelhamissiPas encore d'évaluation
- Cha Uffe Eau AtlanticDocument68 pagesCha Uffe Eau Atlanticmathieu.lagier.mlagPas encore d'évaluation
- Demarrage Avec Des ResistancesDocument3 pagesDemarrage Avec Des ResistanceshocinekhanfriPas encore d'évaluation
- Integration DerivationDocument4 pagesIntegration DerivationSafaa BelagounPas encore d'évaluation
- Francisco Candido Xavier FR Série Historique 01 Il y A Deux Mille Ans YjspDocument281 pagesFrancisco Candido Xavier FR Série Historique 01 Il y A Deux Mille Ans Yjspjoseyannicksaurin100% (3)
- Arrete LPP 24 Janvier 2015 PDFDocument12 pagesArrete LPP 24 Janvier 2015 PDFTasmim DjamilPas encore d'évaluation
- Axe 1Document4 pagesAxe 1Maryem Reyane100% (1)
- PFE LAHOUAICHRI AbdessadekDocument55 pagesPFE LAHOUAICHRI Abdessadekabdomarin100% (1)
- MEMOIRE Énergie RenoDocument68 pagesMEMOIRE Énergie RenoFerdaous AbdelmalekPas encore d'évaluation
- XYZ110Document49 pagesXYZ110Bijio FreddPas encore d'évaluation
- Quelques Critères D - Inspection D - Une Classe-1Document3 pagesQuelques Critères D - Inspection D - Une Classe-1mayaPas encore d'évaluation
- 04 La Fonction Derivee BisDocument29 pages04 La Fonction Derivee BisAsyncrite BAKASSAPas encore d'évaluation
- Propulseur Electromagnétique - CoilGun4COCLUSIONDocument1 pagePropulseur Electromagnétique - CoilGun4COCLUSIONMAD-BONDOPas encore d'évaluation
- PHP - Fonctions Sur Les Chaînes de Caractères - ManualDocument5 pagesPHP - Fonctions Sur Les Chaînes de Caractères - ManualFélicien Dialaboré DjibaPas encore d'évaluation
- (PDF) CORRIGÉS Du Cahier D'exercices Le Nouveau Taxi 2 Carol Dias - Academia - Edu 2 PDFDocument1 page(PDF) CORRIGÉS Du Cahier D'exercices Le Nouveau Taxi 2 Carol Dias - Academia - Edu 2 PDFVika HlukhaPas encore d'évaluation
- Algo Chapitre 3Document14 pagesAlgo Chapitre 3abdo rahemene hajjiPas encore d'évaluation
- Ligne 9-10-11 CompletDocument27 pagesLigne 9-10-11 CompletAnge Miniminione Sims SimoPas encore d'évaluation
- Efforts Sur Les DenturesDocument13 pagesEfforts Sur Les DenturesMll RaghebPas encore d'évaluation