Académique Documents
Professionnel Documents
Culture Documents
Polycopié Electrophorèse Master Agro Alimentaire
Transféré par
sihatasnim9Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Polycopié Electrophorèse Master Agro Alimentaire
Transféré par
sihatasnim9Droits d'auteur :
Formats disponibles
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
ELECTROPHORESE
Illustration des différentes étapes de déroulement de l’électrophorèse verticale
sur gel de polyacrylamide
Année Universitaire 20/21 Page 24 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
ELECTROPHORESE
1) Définition
2) Mobilité électrophorétique
2-1) Facteurs influençant la mobilité électrohorétique
2-1-1) Force ionique du tampon
2-1-2) pH du tampon
2-1-3) Température
2-1-4) Intensité
3) Supports utilisés en électrophorèse.
4) Types d’électrophorèse
4-1) Electrophorèse horizontale
4-1-1) Electrophorèse horizontale sur la bande d’acétate de cellulose
4-2) Electrophorèse verticale
4-2-1) Préparation du gel de polyacrylamide PAGE
4-2-1-1) Composition
4-2-2) Formule du gel
4-2-3) Relation entre la taille des macromolécules à séparer et la
concentration du gel
4.3.1) Notion de gel de concentration et gel de séparation
4.3.1.1 ) Définition du gel de concentration
4.3.1.2 ) Définition du gel de concentration
. 4.3.1.3 ) Outils nécessaires pour former le gel
4-3-2) Electrophorèse de protéines sur un gel de polyacrylamide
4-3-2-1) Native PAGE
4-3-2-2) SDS-PAGE ou dénaturante
5) La révélation
5-1) Coloration avec le bleu de coomassie
5.2) La décoloration
5.3) Résultat de la révélation de SDS-PAGE
5.4) Exploitation du gel
6) Application de SDS PAGE: Détermination du poids moléculaire
Année Universitaire 20/21 Page 25 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
1) Définition
C’est une méthode d’analyse et de fractionnement, basée sur la migration différentielle
de particules chargées électriquement sous l’effet d’un champ électrique.
Lélectrophorèse concerne les macromolécules ionisables telles que les protéines et les acides
nucléiques.
2) Mobilité électrophorétique
Champ électrique
E
Force de frottement
Force de Coulomb
f Particules
F
+ q
Sens de déplacement
Figure 1: Les forces exercées sur une particule chargée
Sous l'action d'un champ électrique E, la particule se déplace avec une vitesse
électrophorétique (Ve) qui est proportionnelle au champs électrique, la formule qui relie les
deux grandeurs est la suivante :
Ve = µ Ee (1)
Ve : la vitesse électrophorétique (m.s-1
µ : la mobilité électrophorétique ( m2.s-1.volt-1)
E : le champs électrique (volt.m-1
µ : la mobilité électrophorétique
A partir de la formule précédente (1), nous déduisons que la mobilité
electrophorétique s’écrit comme suit
µ = Ve / Ee (2)
A savoir que le champs électrique (E) crée entre les 2 électrodes exerce une force (F)
force de Coulomb selon la formule suivante,
F = q Ee (3)
q : la charge de la particule
Année Universitaire 20/21 Page 26 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
La force de frottement (f) va s'opposer à la migration de la particule et va la freiner.
f = 6 r Ve (4) : cœfficient de la viscosité du milieu
Ve : vitesse électrophorétique de la
protéine,
r : rayon de la particule
A l’état stationnaire, c'est-à-dire à l’équilibre, les deux forces s’égalisent,
F –f=0 ou F=f
q Ee = 6 r Ve (4)
Comme déjà écrit (2) la mobilité électrophorétique est le rapport entre Ve/ Ee,
Et à partir de la formule (4) le même rapport s’écrit de la manière suivante :
Ve / Ee = q / 6 r (5)
Et selon la formule (3) ce rapport correspond à µ d’où l’expression de la mobilité
électrophorétique en fonction de la charge, le rayon de la particule et la viscosité du milieu.
Ve /Ee = µ d’où µ = q / 6 r
Selon la formule ci-dessus, la mobilité électrophorétique dépend de plusieurs facteurs,
- En premier lieu, la mobilité varie en fonction de la charge de la particule,
d’où la nécessité de garder un pH constant durant l’électrophorèse. Le cas le plus important et
celui des acides aminés et des protéines dont la charge change en fonction du pH ainsi que le
sens de la migration.
- La viscosité du milieu, agit également sur la qualité et la vitesse de la
migration des particules. Il faut signaler que la température modifie la viscosité du milieu, en
effet une élévation de la température lors de l’éléctrophorèse induit l’évaporation du tampon
et par conséquent sa concentration et l’augmentation de sa viscosité. Ceci se traduit par
l’opposition à la migration des particules par l’augmentation de la force de frottement. Il est
donc impératif d’éviter l’élévation de la température lors de la migration des particules. Dans
cet objectif les cuves d’électrophorèse sont munies de couvercles et d’un système de
refroidissement externe qui baisse de la température du tampon de migration.
- La taille de la particule influence également la mobilité électrophorétique,
effectivement les particules volumineuses auront une migration réduite par apport aux
particules de petite taille. En tout cas les particules de petite taille migre loin.
2-1) Facteurs influençant la mobilité électrohorétique
- 2-1-1) Force ionique du tampon
Correspond à la somme du produit des concentrations des ions multipliée par leur valence au
carré, l’unité de la force ionique est le mol par litre comme la concentration.
µ (mol/l) = Ci (Vi)2 / 2
Année Universitaire 20/21 Page 27 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
À savoir qu’a courant et à voltage précis, plus la concentration en électrolytes du
tampon d’électrophorèse ou la force ionique du tampon d’électrophorèse est forte plus la
migration des molécules de l'échantillon sera lente. Ceci signifie que la résistance à la
migration des molécule augmente avec l’augmentation de la force ionique du tampon et
inversement. Il faut donc bien préparer le tampon d’électrophorèse.
2-1-2) pH du tampon
En électrophorèse la charge de la macromolécule est un critère très important, elle
détermine le sens de la migration de la particule c'est-à-dire vers l’anode ou vers la cathode
Les molécules biologiques et plus particulièrement les acides aminés et les protéines
qui contiennent plusieurs groupements ionisables, leur charge est dépendante du pH du
milieu.
Pour une protéine, la charge nette dépend de la différence entre le pH du milieu et le
point isoélectrique, pH– pI, le pI point isoélectrique et le pH qui confère aux protéines une
charge globale neutre.
Si le pH est > au pI la charge nette est négative (anion) et la migration aura lieu vers
l'anode
Si le pH est < au pI la charge nette est positive (cation) et la migration aura lieu vers la
cathode
Si le pH est = au pI à la charge nette est nulle et la particule ne migrera pas , elle sera focalisée
2-1-3)Latempérature
Au cours de l’electrophorèse, le passage du courant s'accompagne d'un échauffement
du support (par effet Joule), ce qui entraîne l'évaporation de l'eau de la phase liquide,
l’évaporation s’accompagne de la concentration du tampon et l’augmentation de sa viscosité
et la résistance à la migration. Pour limiter ce phénomène, la cuve est fermé par un couvercle;
on utilise aussi des cuves réfrigérées.
2-1-4) Intensité
Le courant électrique en mA,plus le courant est intense plus la migration se fera vite.
3) Supports utilisés en électrophorèse.
Il existe différents types d’électrophorèse en fonction de la nature du support de la
séparation.
- Electrophorèse libre en veine liquide
Nous allons donner une simple description de ce type d’électrophorèse. La migration
s'effectue au sein d'un liquide de composition déterminée contenu dans un tube en U de
section carrée qui permet la prise de mesures optiques au travers du tube. Elle est dite
également électrophorèse en veine liquide ou encore électrophorèse de frontières car la
séparation n’est pas complète mais il se forme des frontières mises en évidence par des
méthodes optiques telles que l'absorption ultra-violette pour les protéines.
Année Universitaire 20/21 Page 28 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
- Electrophorèse sur support solide (papier, acétate de cellulose et autres),
- Electrophorèse sur gels, (polyacrylamide, agarose, amidon, ...).
Nous allons étudier largement les deux dernières catégories d’électrophorèse
4) Types d’électrophorèse
On distingue deux types d’électrophorèse : électrophorèse horizontale et
électrophorèse verticale et ceci en fonction de la cuve et surtout de la disposition du support
de la séparation (membrane ou gel).
4-1) Electrophorèse horizontale
Elle est nommée ainsi car le support sera déposé horizontalement, ça peut être un gel
ou une membrane
Figure 2 : Cuve pour la réalisation d’électrophorèse horizontale
4-1-1) Electrophorèse horizontale sur la bande d’acétate de cellulose
Nous allons citer le cas de la séparation des protéines sérique sur la membrane
d’acétate de cellulose, pour cette technique les étapes de la migration et de la révélation se
passent comme suit :
La bande d’acétate de cellulose est préparée en la trempant dans le tampon tris-véronal à pH
8.6 puis les échantillons sont déposés et soumis à la migration.
Trempage da la membrane dans le tampon Dépôt préalable et migration
Figure 3 : Illustration d’électrophorèse horizontale
Une fois la migration est terminée, la membrane sera placée dans un bain de colorant
renfermant par exemple le Rouge ponceau. La coloration est suivie d’une décoloration à
l’aide d’une solution d’acide acétique à 5 %.
Année Universitaire 20/21 Page 29 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
Coloration Décoloration
Figure 4: Les étapes d’électrophorèse sur la bande d’acétate de cellulose
Pour la quantification des protéines sérique la membrane peur être transparisée dans
du méthanol afin de la lire à l’aide d’un densitomètre. Cet appareil obéit au même principe
qu’un spectrophotomètre (loi de Beer- Lamber)t. Avec cet appareil il y a une relation entre
l’intensité de la coloration des bandes d’électrophorèse et la densité optique. Cet appareil est
étalonné au préalable.
a b
Figure 5: Résultat d’électrophorèse des protéines sériques sur la bande d’acétate de
cellulose (a) et lecture densitométrique (b)
Année Universitaire 20/21 Page 30 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
4-2) Electrophorèse verticale
Cette technique est dite verticale car le support d’électrophorèse est disposé vérticalement
4-2-1) Préparation du gel de polyacrylamide PAGE
Le polyacrylamide est un copolymère d’acrylamide et de bis acrylamide. Il est très
utilisé car il est transparent et par conséquent lisible en spectrophotométrie et ultraviolet. Il
permet une bonne résolution car on peut adapter la taille des pores. Il sert à la fois à la
séparation des protéines et des acides nucléiques.
4-2-1-1) Composition
CH2=CH-CO-NH2 acrylamide
(CH2=CH-CONH)2CH méthylène bis acrylamide ou agent de pontage
La polymérisation de l'acrylamide est initiée par l'addition de
– persulfate d'ammonium : initie la polymérisation
– TEMED (NNN'N'-tétraméthyléthylènediamine). Catalyse la polymérisation
–
Figure 6 : Structure d’acrylamide, de bisacrylamide et la structure du gel de
polyacrylamide
4-2-2) Formule du gel
La porosité des gels obtenus dépend de la concentration totale en monomères et de la
proportion d'agent monomère réticulant (le bisacrylamide).
Les gels sont définis selon leur teneur en acrylamide et bisacrylamide. La nature du gel est
déterminé par T (exprimé en %) la concentration totale en acrylamide et bisacrylamide :
T s’écrit sous la forme suivante :
T% = (a+b) x 100 / V
a : masse d'acrylamide en gramme,
b: masse de bisacrylamide en gramme
V : volume total de solution en ml.
Le pourcentage C ou la proportion d'agent réticulant est le rapport du Bis
acrylamide par rapport à l''acrylamide total:
C % = [poids (Bis acrylamide) / poids(de polyacrylamide)]x 100.
Année Universitaire 20/21 Page 31 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
Plus le T est élevé plus le gel est concentrée c‘est à dire plus les mailles sont serrées et
le gel servira à la séparation des protéines de petites taille voir tableau II.
4-2-3) Relation entre la taille des macromolécules à séparer et la concentration du
gel
En électrophorèse, il faut adapter la structure des mailles du gel à la taille des
macromolécules à séparer. Le tableau ci-dessous montre qu’il existe une relation
inversement proportionnelle entre la taille des particules à séparer et la concentration
du gel. Pour séparer des particules de grosses tailles, il faut utiliser un gel peu concentré qui
possède des mailles du réseau lâches.
Tableau I : La relation entre la concentration du gel et le poids moléculaire des
macromolécules (valeurs approximatives)
Polyacrylamide (T%) Poids moléculaire (KDa)
15-20 10-40
10-15 40-100
5-10 100-300
5 300-500
2-5 > 500
Figure 7: Illustration de la relation entre la concentration du gel, les mailles du réseau
et la gamme de poids moléculaire des molécules à séparer
La figure 7 montre que le gel de polyacrylamide est constitués de canalicules sinueux
dans les quels les particules circulent. Les petites particules traversent aisément ces
canalicules et arrivent en un temps court à des distances lointaines, par contre les grosses
Année Universitaire 20/21 Page 32 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
particules seront arrêtées au début du gel. C est le passage sélectif des molécules à travers les
pores du gel qui permettra la séparation de ces macromolécules.
Figure 8 : Schéma d’électrophorèse verticale et la séparation en fonction du poids
moléculaire
4.3) Electrophorèse verticale sur gel de polyacrylamide
Préparation du gel de polyacrylamide
Il faut préparer certaines solutions tampons et autres ingrédients indispensabls dont les
proportions seront définies en fonction de la concentration désirée du gel
- Polyacrylamide ,la solution mère à 30% (29.02 :0.8)
- Tampon ( exemple tris HCl M? pH ?)
- SDS 10% ( µl)
- Eau distillée (ml)
- Persulfate d’ammonium (µl)
- Temed (µl) (dernier réactif à ajouter)
4.3.1) Notion de gel de concentration et gel de séparation
-
Figure 9 : Localisation de gel de concentration et gel de séparation
Année Universitaire 20/21 Page 33 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
4.3.1.1 ) Définition du gel de concentration
Sera coulé en second lieu après la polymérisation du gel de séparation
Donc se trouve au-dessus , il est le plus proche de la cathode
IL est généralement peu concentré en polyacrylamide
Son rôle est de concentrer ou de focaliser l’échantillon
Il occupe une faible proportion du gel
Les puits sont formés au niveau du gel de concentration de concentration
Tableau II : Exemple de composition dugel
Solution Volume
Polyacrylamide à 30
5 ml
% (solution mère)
Tris 0,5 M pH 6,8 5 ml
SDS 10 % 600 µl
Eau distillée 10 ml
Persulfate
200 µl
d’ammonium 10 %
Temed 30 µl
Figure 10 : Position et rôle du gel de concentration
4.3.1.2 ) Définition du gel de séparation ou de migration
Le premier à couler
Se trouve au dessous, il couvre une grande proportion du gel
Il est généralement plus concentré en polyacrylamide
C est le support de la séparation des protéines
Renferme le front de migration des protéines
Tableau III : Exemple de composition de gel de séparation
Solution Volume
Polyacrylamide à 30 %
18 ml
(solution mère)
Tris 1,5 M pH 8,8 11,27 ml
SDS 10 % 600 µl
Eau distillée 15,4 ml
Persulfate
200 µl
d’ammonium 10 %
100
Temed
µl
Figure 11 : Position et rôle du gel de migration
Année Universitaire 20/21 Page 34 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
Tableau IV : Comparaison entre la composition du gel de séparation et gel de concentration
Solution Gel de séparation
Gel de concentration
Polyacrylamide à 30 % (Solution
5 ml 18 ml
mère)
Tris 1,5 M pH 8,8 11,27 ml
Tris 0,5 M pH 6,8 5 ml
SDS 10 % 600 µl 600 µl
Eau distillée 10 ml 15,4 ml
Persulfate d’ammonium 10 % 200 µl 200 µl
Temed 30 µl 100 µl
. 4.3.1.3 ) Outils nécessaires pour former le gel
Pour confectionner un gel de polyacrylamide, il faut préparer au préalable les solutions
déjà citées au dessus.Ces solutions de gels de polyacrylamide seront coulées entre deux lames
de verres qui serviront de moules et donneront la forme planaire au gel après la
polymérisation des solutions grace à la présence de persulfate d’ammonium et le TEMED.
Il y un ordre de confection de gel :
Le gel de séparation sera coulé en premier et après sa polymérisation, le
gel de concentration sera coulé. Il faut immédiatement déposer les peignes au niveau
du gel de concentrations. Après polymérisation du gel de concentration, les peignes seront
enlevés et ainsi les puits du dépôt d échantillon seront formés.
Le moule pour préparer le gel est constitué de deux lames de verre (voir figure11)
séparées du côté gauche et du coté droit par des espaceurs ou intercalaires, l’épaisseur des
espaceurs déterminera l’épaisseur du gel.
Pour renforcer l’adhésion des deux lames séparées par les espaceurs des pinces vont
serrerl’ensemble et ceci du côté gauche et droit
Année Universitaire 20/21 Page 35 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
Figure 12 : Les lames de verres, les peignes et le upport pour couler la solution du gel
4-3-2) Electrophorèse de protéines sur un gel de polyacrylamide
Il existe deux types d’électrophorèse sur le gel de polyacrylamide , électrophorèse
native non dénaturante et l’ électrophorèse dénaéturante SDS- PAGE. 4.3) Electrophorèse
verticale sur gel de polyacrylamide
4-3-2-1) Native PAGE
L’électrophorèse Native est une technique réalisée en condition nos dénaturante de la
structure et la fonction des protéines. Il faut éviter tout type de dénaturation chimique,
physique et même des conditions extrêmes de pH et de force ionique. Avec cette technique
une révélation de l’activité enzymatique sur le gel est possible. Pour ce faire il faut fournir à
l’enzyme en question le substrat et les cofacteurs et la révélation se fera sur le gel. Le
précipité formé selon la réaction enzymatique aura lieu à l’endroit où existe l’enzyme.
Révélation spécifique
Isoenzyme 1
Isoenzyme 2
Zymorramme d’ alpha amylases
Figure 13: Révélation enzymatique après migration des échantillons sur un gel de
polyacrylamide
Principe de la coloration : L’amidon est coloré en général en bleu par le Lugol mais
l’enzyme alpha dégrade l’amidon en glucose, ce dernier n’est pas reconnu par le lugol est
Année Universitaire 20/21 Page 36 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
donne des taches claires. La révélation à l’endroit de l’enzyme est sous forme de taches
incolores sur un fond foncé montrant que l’amidon est resté intact dans tout le gel.
4-3-2-2) SDS-PAGE ou dénaturante
Elle se pratique en présence d’agents dénaturants tel que le SDS dodécyl sulfate de
sodium. Le Sodium dodécylsulfate ou SDS voir figure 13 est un détergent anionique
dénaturant surfactant, il déroule les protéines en cassant toutes les liaisons de faible énergie, il
se fixe sur les protéines et leur confèrent une même densité de charge négative et dans ce
cas les protéines migreront qu en fonction de leur poids moléculaire. On peut également
chauffer l’échantillon .
(SDS : CH3 - (CH2)10 - CH2 - O - SO3-, Na+),
Figure 14: la structure de SDS dodécyl sulfate de sodium
Pour cette électrophorèse dénaturante on peut également utiliser des agents réducteurs
comme le beta mercaptoethanol ou dithiotreitol dtt qui coupent les ponts disulfures et ainsi
on peut déterminer le nombre des sous unités qui composent certaines macromolécules.
5) La révélation
Suite à l’électrophorèse sur le gel, il faut passer à la révélation c'est-à-dire à la
coloration des échantillons afin d’identifier les différents constituants. En réalité la révélation
peut se faire sur le gel ou réaliser un transfert des molécules séparés sur une membrane et
révéler sur la membrane et ceci nous amène à une autre technique ‘immunoblot ou westerblot)
La révélation sur le gel peut se faire de différentes manières mais nous allons citer que celle
qui utilise le bleu de Coomassie.
5-1) Coloration avec le bleu de coomassie
Le principe repose sur le fait que les protéines plongées dans un milieu acide sont
dénaturées et exposent les groupements azotés qui seront colorés avec le bleu de coomassie.
Le bleu de Coomassie permet de détecter un minimum de 100 ng de protéine et la
coloration est proportionnelle à la quantité de protéines. Néanmoins cette coloration est peu
spécifique car détecte toutes les protéines de manière générale, peu sensible peu couteuse ,
facile et donc très utilisée.
Année Universitaire 20/21 Page 37 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
La coloration consiste à préparer la solution de la coloration renfermant les réactifs
suivants
bleu de coomassie à 2,5% (colore les groupement protéiques),
d'isopropanol à 20% ( fixe les protéines)
d'acide acétique à 20% (dénature les protéines les protéines)
d'eau à 57,5%
Le gel sera placé dans la solution de coloration pendant un certain temps et sous agitation de
préférence.
Figure 15 : Gel d électrophorèse coloré avec le bleu de coomassie
5.2) La décoloration
Le gel coloré sera placé dans une solution de décoloration composée des ingrédients
suivants :
Isopropanol ou méthanol 45%
Acide acétique de 10%
E'au 45%
La décoloration est obtenue après plusieurs bains de la solution décolorante
jusqu’apparition des bandes. Le résultat obtenu est représenté par la figure 16.
Année Universitaire 20/21 Page 38 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
Figure 16 : Décoloration du gel d’électrophorèse coloré avec le bleu de Coomassie
5.3) Résultat de la révélation de SDS-PAGE
Sont sous forme de bandes
L intensité de la coloration est proportionnel à la quantité de protéines
La position des bandes ou la distance de migration est inversement proportionnelle à la taille
5.4) Exploitation du gel
Pour exploiter le gel il faut déterminer la mobilité relative de chaque protéine, cette
mobilité relative est désignée par « RF » elle est propre à chaque bande et les protéines qui la
composent
Pour calculer la RF
A partir du gel révélé, il faut relever ou mesurer le front de migration qui correspond
la distance de migration d’un colorant inerte (bleu de bromophénol), c est la distance
maximale de migration: désignée par d1 sur la figure 17
A partir du gel révélé, il faut relever d2 qui correspond à la mesure de la distance
de migration de la protéine X ou la distance parcourue par la protéine dans le gel.
Mobilité relative correspond au rapport des deux valeurs d2/ d1
Année Universitaire 20/21 Page 39 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
Figure 17 : Illustration de la mobilité relative
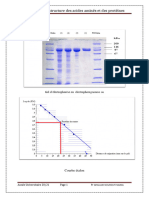
5.5) Application de SDS PAGE: Détermination du poids moléculaire
Pour déterminer le poids moléculaire des protéines inconnues à l’aide de la technique SDS-
PAGE il faut faire migrer dans les mêmes conditions et sur le même gel des protéines de
références ou des standards de poids moléculaire connue. Après la migration est la révélation
du gel (voir techniques de révélation).
Pour l’exploiter le gel, il faut relever à partir du gel la distance de migration de chaque
protéine de référence et dresser la courbe étalon. Cette courbe correspond à la représentation
graphique du poids moléculaire en fonction de la distance de migration (voir la figure 14). La
courbe est une droite décroissante car plus la protéine est de faible poids moléculaire
plus elle migrera loin et inversement.
Année Universitaire 20/21 Page 40 Pr Ghailani Nourouti Naima
Electrophorèse Master agroalimentaire
Module analyse des biomolécules
a b
Figure 18 : Electrophorèse SDS-PAGE et l’exploitation de la courbe étalon
Comme le montre la figure 18 b, le report de la distance de migration de la protéine
inconnue à partir du gel sur la courbe étalon et la projection du point sur l’axe des poids
moléculaire permet la détermination du poids moléculaire de la protéine en question.
Année Universitaire 20/21 Page 41 Pr Ghailani Nourouti Naima
Vous aimerez peut-être aussi
- Les Êtres Vivants Dépendent De La Mécanique QuantiqueD'EverandLes Êtres Vivants Dépendent De La Mécanique QuantiquePas encore d'évaluation
- ElectrophorèseDocument36 pagesElectrophorèseidealchqPas encore d'évaluation
- BC3 BMC3 BHS3Document16 pagesBC3 BMC3 BHS3Staline DonkengPas encore d'évaluation
- Fermions: Les Grands Articles d'UniversalisD'EverandFermions: Les Grands Articles d'UniversalisPas encore d'évaluation
- Chapitre3 - ElectrophoreseDocument11 pagesChapitre3 - ElectrophoreseArsène NtyamPas encore d'évaluation
- Electrophorèse 2014.2015Document29 pagesElectrophorèse 2014.2015Khaoula Kouloughli100% (1)
- Fascicule PCEM1 ElectrophoreseDocument13 pagesFascicule PCEM1 ElectrophoreseCleaver Bright100% (1)
- BIO 304 - ELECTROPHORESE - Cours 2022Document30 pagesBIO 304 - ELECTROPHORESE - Cours 2022mistic JayPas encore d'évaluation
- Electrophorese en Champ PulséDocument23 pagesElectrophorese en Champ Pulséابو ريتاج100% (4)
- Macromolecules Et ColloidesDocument8 pagesMacromolecules Et Colloidesyann couldPas encore d'évaluation
- Cours Licence EC 2022 23 - 230427 - 122800Document37 pagesCours Licence EC 2022 23 - 230427 - 122800Fouad RahiouyPas encore d'évaluation
- Purification Des ProtéinesDocument25 pagesPurification Des Protéinessalma maroufPas encore d'évaluation
- Exposé Biologie Moléculaire Electrophorèse Champ PulséDocument10 pagesExposé Biologie Moléculaire Electrophorèse Champ PulséRebecca Boutchoouang75% (4)
- TD 3 Fractionnement Celleulaire FinalDocument32 pagesTD 3 Fractionnement Celleulaire FinalAinganoun Mahcih100% (1)
- Cours, ÉlectrophorèseDocument15 pagesCours, ÉlectrophorèseJalelo AbdelPas encore d'évaluation
- E L Chap 6 ColloidsDocument11 pagesE L Chap 6 Colloidshanane yhPas encore d'évaluation
- Méthodes ÉlectrophoétiquesDocument48 pagesMéthodes Électrophoétiquesmeriama debPas encore d'évaluation
- L' ÉlectrophorèseDocument14 pagesL' Électrophorèsenipton27100% (2)
- Electrophorese2 - LcABCQ - 071220Document82 pagesElectrophorese2 - LcABCQ - 071220Fatima zahra NaciriPas encore d'évaluation
- Méthode DanalyseDocument22 pagesMéthode Danalyseaymard bozaiPas encore d'évaluation
- 07 ElectrophorÅ Se Cap PDFDocument14 pages07 ElectrophorÅ Se Cap PDFkalaouiPas encore d'évaluation
- Electrophorese 2020 v2Document61 pagesElectrophorese 2020 v2Linda MansourPas encore d'évaluation
- 3-Électrochimie Lois Régissant PDFDocument18 pages3-Électrochimie Lois Régissant PDFSamar CelenaPas encore d'évaluation
- Les Techniques ÉlectrophorétiquesDocument12 pagesLes Techniques ÉlectrophorétiquesNoussiba BougheraraPas encore d'évaluation
- Les Techniques Électrophorétiques (Protéines Et ADN)Document11 pagesLes Techniques Électrophorétiques (Protéines Et ADN)Ayoub LakhdariPas encore d'évaluation
- ElDocument6 pagesElAmin MohammedPas encore d'évaluation
- Méthodes de Séparation, ElèctrophorèseDocument24 pagesMéthodes de Séparation, ElèctrophorèseKenz L'AïdPas encore d'évaluation
- Electrochimie L3 GP 2023-2024Document62 pagesElectrochimie L3 GP 2023-2024Soumia BakhtaPas encore d'évaluation
- Spectroscopie IR UV VisDocument30 pagesSpectroscopie IR UV VismanelPas encore d'évaluation
- Chap I - Principes Generaux S5 - Chap V - Masse Spect S5Document47 pagesChap I - Principes Generaux S5 - Chap V - Masse Spect S5bilalPas encore d'évaluation
- Medjaoui Chapitre 3 Lélectrophorèse Module Techniques Biochimiques Et Moléculaire M2BiochimieDocument26 pagesMedjaoui Chapitre 3 Lélectrophorèse Module Techniques Biochimiques Et Moléculaire M2Biochimiesemmanimusta7Pas encore d'évaluation
- Electrophorèse CapillaireDocument12 pagesElectrophorèse CapillaireZerPas encore d'évaluation
- 5 Éme Cours (Lélectrophorèse)Document30 pages5 Éme Cours (Lélectrophorèse)ngofrancis58Pas encore d'évaluation
- 3 Electrophorese VDocument10 pages3 Electrophorese VsalimPas encore d'évaluation
- Sujet N°2 SP Tle DDocument4 pagesSujet N°2 SP Tle Dguebi daniel akagboPas encore d'évaluation
- Chapitre 04 Propriétés Électriques Des SolutionsDocument5 pagesChapitre 04 Propriétés Électriques Des SolutionsSabin SamPas encore d'évaluation
- 09 - Transports Electriques Et TransmembranairesDocument10 pages09 - Transports Electriques Et Transmembranairessisics2005Pas encore d'évaluation
- Biochimie1an-Strategies Etude ProteinesDocument7 pagesBiochimie1an-Strategies Etude ProteinesAGUEZLANE NOURPas encore d'évaluation
- Cours Electrophysiologie Cardiaque DR Djouhri 1Document18 pagesCours Electrophysiologie Cardiaque DR Djouhri 1Farouk ChellaliPas encore d'évaluation
- Cours BiophysiqueDocument55 pagesCours BiophysiqueLionel DahePas encore d'évaluation
- BiophysiqueDocument7 pagesBiophysiquealmnaouarPas encore d'évaluation
- Cours Géophysique ISTP 2022Document141 pagesCours Géophysique ISTP 2022YINKUANIX FFPas encore d'évaluation
- Cours Spectrophotométrie Uv VisibleDocument34 pagesCours Spectrophotométrie Uv VisibleAbir LatréchePas encore d'évaluation
- Electrophorese PDFDocument12 pagesElectrophorese PDFsalimPas encore d'évaluation
- 1 - CHAPI-IntroductionDocument29 pages1 - CHAPI-IntroductionRachid NasriPas encore d'évaluation
- Bio emDocument10 pagesBio emJean-Loïc BauchetPas encore d'évaluation
- Polymeres Conducteurs Et Leurs ApplicationsDocument10 pagesPolymeres Conducteurs Et Leurs ApplicationsYc YacinePas encore d'évaluation
- Électrochimie - Présentation GénéraleDocument4 pagesÉlectrochimie - Présentation GénéraleABAKIHPas encore d'évaluation
- VoltaempérométrieDocument4 pagesVoltaempérométrieSamar CelenaPas encore d'évaluation
- Voltaempérométrie PDFDocument4 pagesVoltaempérométrie PDFSabin Sam100% (2)
- Fascicule TP ProtéomiqueDocument21 pagesFascicule TP ProtéomiquePixel service Hosni100% (1)
- SynthèseDocument38 pagesSynthèseRoméo CakpoPas encore d'évaluation
- Etude de La Conductivité Électrique Du Poly (Oxyde D'éthylène)Document13 pagesEtude de La Conductivité Électrique Du Poly (Oxyde D'éthylène)samir idrissPas encore d'évaluation
- PA. Modélisation Thermique Et Électrochimique DesDocument8 pagesPA. Modélisation Thermique Et Électrochimique DesMohamed Ould MoussaPas encore d'évaluation
- Electrophorèse CapillaireDocument37 pagesElectrophorèse CapillaireNongwendé Marc OuédraogoPas encore d'évaluation
- LElectrophorèseDocument2 pagesLElectrophorèseKada BouameurPas encore d'évaluation
- Electronique OrganiqueDocument49 pagesElectronique OrganiqueAhlem MalaouiPas encore d'évaluation
- 1 PhysicochimieDocument50 pages1 Physicochimieyouness.khalfaoui100% (2)
- VolailleDocument19 pagesVolaillesihatasnim9Pas encore d'évaluation
- GLOSSAIRE Sécurité SanitaireDocument7 pagesGLOSSAIRE Sécurité Sanitairesihatasnim9Pas encore d'évaluation
- Utilisation Des Réactifs de Carrez Dans Le Dosage Des Sucres Invertis Au Niveau de La Mélasse de Betterave Sucrière Au Sein de LDocument47 pagesUtilisation Des Réactifs de Carrez Dans Le Dosage Des Sucres Invertis Au Niveau de La Mélasse de Betterave Sucrière Au Sein de Lsihatasnim9Pas encore d'évaluation
- STA101-ED 8 Cle42c1d1-1Document5 pagesSTA101-ED 8 Cle42c1d1-1sihatasnim9Pas encore d'évaluation
- Add Partie2 AfcDocument30 pagesAdd Partie2 Afcsihatasnim9Pas encore d'évaluation
- Utilisation Des Réactifs de Carrez Dans Le Dosage Des Sucres Invertis Au Niveau de La Mélasse de Betterave Sucrière Au Sein de LDocument47 pagesUtilisation Des Réactifs de Carrez Dans Le Dosage Des Sucres Invertis Au Niveau de La Mélasse de Betterave Sucrière Au Sein de Lsihatasnim9Pas encore d'évaluation
- Chapitre 1 - Hygiene-Et-Technologie-Du-LaitDocument34 pagesChapitre 1 - Hygiene-Et-Technologie-Du-Laitsihatasnim9Pas encore d'évaluation
- Rappels Acides Aminã©s Protã©ines Master Agro 21Document23 pagesRappels Acides Aminã©s Protã©ines Master Agro 21sihatasnim9Pas encore d'évaluation
- BiscuitsDocument3 pagesBiscuitssihatasnim9Pas encore d'évaluation
- Ddoc T 2020 0114 BourkaibDocument386 pagesDdoc T 2020 0114 BourkaibchafikPas encore d'évaluation
- Techniques D'analyses Des Proteines-1Document37 pagesTechniques D'analyses Des Proteines-1immPas encore d'évaluation
- Cours 4 ElectrophoreseDocument11 pagesCours 4 ElectrophoreseDjawed BoutPas encore d'évaluation
- Travaux Pratiques - Biochimie Generale: Médecine-DentisterieDocument19 pagesTravaux Pratiques - Biochimie Generale: Médecine-DentisterieGerard MichelinPas encore d'évaluation
- Dépistage Des Anticorps Dirigés Contre Les Antigènes Nucléaires SolublesDocument12 pagesDépistage Des Anticorps Dirigés Contre Les Antigènes Nucléaires SolublesCDM achiffaPas encore d'évaluation
- TP CitrusDocument5 pagesTP CitrusMeryem EramiPas encore d'évaluation
- Meh5534 PDFDocument64 pagesMeh5534 PDFRehab MaachouPas encore d'évaluation
- Correction TD Adressage L1SV 2021Document17 pagesCorrection TD Adressage L1SV 2021kirito 83Pas encore d'évaluation
- Coursl2 20fevrier2013 R LebrunDocument79 pagesCoursl2 20fevrier2013 R LebrunBrahim ABAGHOUGHPas encore d'évaluation
- TechniqDocument54 pagesTechniqkhaisse0% (1)
- Polycopié Electrophorèse Master Agro AlimentaireDocument18 pagesPolycopié Electrophorèse Master Agro Alimentairesihatasnim9Pas encore d'évaluation
- Proteomic Travaux DirigesDocument4 pagesProteomic Travaux DirigesAbde AssaidiPas encore d'évaluation
- Electrophorse SDS PAGE Principe Et - A155Document5 pagesElectrophorse SDS PAGE Principe Et - A155SurbroPas encore d'évaluation
- AT - Se Paration de Prote Ines Par SDS PAGEDocument8 pagesAT - Se Paration de Prote Ines Par SDS PAGErahmani100% (1)
- TP Méthodologie de Biologie Moléculaire PDFDocument8 pagesTP Méthodologie de Biologie Moléculaire PDFyounes chouaiPas encore d'évaluation
- Grille TP Électrophorèse SDS PAGEDocument3 pagesGrille TP Électrophorèse SDS PAGEemmaPas encore d'évaluation
- Controle QulitéDocument58 pagesControle Qulitéfairouz_83Pas encore d'évaluation
- Detection A LeclDocument40 pagesDetection A LeclJean-Serein MbendePas encore d'évaluation
- TP: Séparati On de Protéine S Par L'électro Phorèse SDS-: Universite Des Freres Mentouri ConstantineDocument8 pagesTP: Séparati On de Protéine S Par L'électro Phorèse SDS-: Universite Des Freres Mentouri ConstantineAbdou GharbiPas encore d'évaluation
- Chapitre 2 Purification Et Caractérisation Des EnzymesDocument35 pagesChapitre 2 Purification Et Caractérisation Des EnzymesFatïma ZohraPas encore d'évaluation
- Protocole de Ire BIO6031-BIA3020 2010 - 2Document32 pagesProtocole de Ire BIO6031-BIA3020 2010 - 2themarutoPas encore d'évaluation
- Sds-Page TP16Document3 pagesSds-Page TP16H HPas encore d'évaluation
- Fascicule TP ProtéomiqueDocument21 pagesFascicule TP ProtéomiquePixel service Hosni100% (1)
- Examen3 Techniques Danalyses BiologiqueDocument5 pagesExamen3 Techniques Danalyses BiologiqueaxelPas encore d'évaluation
- Méthodes de Séparation, ElèctrophorèseDocument24 pagesMéthodes de Séparation, ElèctrophorèseKenz L'AïdPas encore d'évaluation
- Cours, ÉlectrophorèseDocument15 pagesCours, ÉlectrophorèseJalelo AbdelPas encore d'évaluation
- L - Éléctrophorèse SDS-Page FinalDocument31 pagesL - Éléctrophorèse SDS-Page Finalsahla amri100% (1)
- Technologie automobile: Les Grands Articles d'UniversalisD'EverandTechnologie automobile: Les Grands Articles d'UniversalisPas encore d'évaluation
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)
- L'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)D'EverandL'Art de la guerre: Traité de stratégie en 13 chapitres (texte intégral)Évaluation : 4 sur 5 étoiles4/5 (3032)
- Revue des incompris revue d'histoire des oubliettes: Le Réveil de l'Horloge de Célestin Louis Maxime Dubuisson aliéniste et poèteD'EverandRevue des incompris revue d'histoire des oubliettes: Le Réveil de l'Horloge de Célestin Louis Maxime Dubuisson aliéniste et poèteÉvaluation : 3 sur 5 étoiles3/5 (3)
- Géobiologie de l'habitat et Géobiologie sacrée: Pour un lieu sainD'EverandGéobiologie de l'habitat et Géobiologie sacrée: Pour un lieu sainÉvaluation : 4.5 sur 5 étoiles4.5/5 (2)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- Anatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursD'EverandAnatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursPas encore d'évaluation
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Physique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresD'EverandPhysique quantique pour les débutants: Découvrez les fondements de la mécanique quantique et la façon dont elle affecte le monde dans lequel nous vivons à travers ses théories les plus célèbresÉvaluation : 5 sur 5 étoiles5/5 (2)
- L'Art de La Magie au Bougie Wicca: Le Guide du Débutant à la Pratique de la Magie au Bougie de WiccaD'EverandL'Art de La Magie au Bougie Wicca: Le Guide du Débutant à la Pratique de la Magie au Bougie de WiccaÉvaluation : 3 sur 5 étoiles3/5 (1)
- Manuel pour les débutants Fabriquez des savons naturelsD'EverandManuel pour les débutants Fabriquez des savons naturelsÉvaluation : 3 sur 5 étoiles3/5 (2)
- Anatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsD'EverandAnatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsPas encore d'évaluation
- Affirmations positives : Perte de poids pour les femmesD'EverandAffirmations positives : Perte de poids pour les femmesPas encore d'évaluation
- Le B.A.-Ba de la communication: Comment convaincre, informer, séduire ?D'EverandLe B.A.-Ba de la communication: Comment convaincre, informer, séduire ?Évaluation : 3 sur 5 étoiles3/5 (1)
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- Production et propagation des sons: Les Grands Articles d'UniversalisD'EverandProduction et propagation des sons: Les Grands Articles d'UniversalisPas encore d'évaluation
- Guide De Démarrage De L'Apiculture: Le Guide Complet Pour Élever Des AbeillesD'EverandGuide De Démarrage De L'Apiculture: Le Guide Complet Pour Élever Des AbeillesPas encore d'évaluation
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- Mes inventions (Traduit): Autobiographie de Nikola TeslaD'EverandMes inventions (Traduit): Autobiographie de Nikola TeslaÉvaluation : 4.5 sur 5 étoiles4.5/5 (2)
- Approvisionnement et traitement de l’eau: Les Grands Articles d'UniversalisD'EverandApprovisionnement et traitement de l’eau: Les Grands Articles d'UniversalisPas encore d'évaluation
- Transformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitD'EverandTransformez votre vie: Utilisez le pouvoir créateur qui est en vous pour construire votre vie à l'image de ce que vous voulez qu'elle soitÉvaluation : 4 sur 5 étoiles4/5 (14)