Académique Documents
Professionnel Documents
Culture Documents
Exercices 9 Suivi Temporel
Transféré par
ayoubbouuderqaTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Exercices 9 Suivi Temporel
Transféré par
ayoubbouuderqaDroits d'auteur :
Formats disponibles
CHIMIE / Unité :1
LA TRANSF. D'UN
SYSTEME CHIMIQUE
EST-ELLE TOUJOURS
RAPIDE
EXERCICE 1
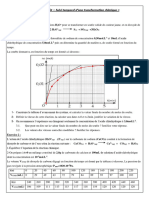
On étudie l’évolution en fonction du temps d’un mélange obtenu à partir de 100mL d’une
solution d’acide éthanedioïque à 6,0010 -2 mol.L-1 et 100mL d’une solution acidifiée de
dichromate de potassium à 1,6610 -2 mol.L-1. On
obtient la courbe suivante :
La réaction d’oxydoréduction qui se produit met en jeu
les couples Cr2O72– / Cr3+ et CO2 / H2C2O4
1) Citer deux facteurs pouvant modifier la vitesse d’une
réaction chimique.
2) Ecrire les deux demi-équations électroniques ainsi que
l’équation bilan de la réaction qui se produit entre l’ion
2–
dichromate Cr2O7 et l’acide éthanedioïque H2C2O4.
3) Etablir la quantité initiale de chacun des réactifs et en
déduire le réactif limitant.
4) Dresser le tableau d’avancement de la réaction faisant
apparaître l’avancement temporel x(t).
5) Définir mathématiquement la vitesse volume v(t) de cette réaction.
6) Exprimer cette vitesse de réaction v(t) en fonction de la vitesse de formation des ions Cr 3+. Détailler le calcul
de cette démonstration.
7) Déterminer la valeur de la vitesse de formation des ions Cr3+ à la date t = 50 s.
8) En déduire la vitesse volumique de la réaction à cette même date.
9) Déterminer le temps de demi-réaction t1/2 de cette réaction.
10) Déterminer graphiquement la quantité d’ions Cr3+ présente lorsque la réaction est considérée comme étant
terminée.
11) En déduire le volume de gaz carbonique dégagé par cette réaction dans les C.N.T.P.
(On donne R = 8,31 S.I.)
EXERCICE 2
Les ions permanganate MnO4– en milieu acide oxydent lentement l’acide oxalique H 2C2O4 en dioxyde de
carbone. Les couples mis en jeux sont :
MnO4–(aq) / Mn2+(aq) et CO2 (aq) / H2C2O4(aq). [MnO4-](mmol∙L-
1)
On place dans une cuve de spectrophotomètre
un volume V1 = 1,00 mL de la solution S 1 0,2
avec un volume V’=1,00 mL d’une solution
d’acide oxalique à C’ =1,0∙10-3 mol∙L-1.
Le mélange est rapidement homogénéisé, et
on mesure à l’aide du spectrophotomètre 0,1
l’évolution de la concentration de l’ion
permanganate en fonction du temps.
On obtient alors la courbe C1 = f(t) ci-contre : t (min)
1) Écrire les demi-équations électroniques 0,0
pour chacun des deux couples qui 0 1 2 3 4 5
interviennent dans cette réaction.. En déduire
l'équation de la réaction entre les ions peroxodisulfate et les ions iodure.
2) Ce graphique permet-il de déterminer le réactif limitant ? Justifier.
3) A l’aide des grandeurs C1, C’, V’, V1 et de l’avancement x, dresser le tableau d’avancement.
4) Exprimer la vitesse de la réaction notée v en fonction de [MnO4-] concentration des ions permanganate.
5) Déterminer la vitesse initiale v (0) de la réaction.
6) Exprimer la concentration des ions Mn2+ en fonction de x, V1 et V’. Calculer cette concentration en fin de
réaction.
7) Déterminer le temps de demi-réaction t1/2
Vous aimerez peut-être aussi
- Série D'exercices N°2 - Sciences Physiques Cinétique Chimique - Bac Sciences Exp (2013-2014) MR Alibi AnouarDocument6 pagesSérie D'exercices N°2 - Sciences Physiques Cinétique Chimique - Bac Sciences Exp (2013-2014) MR Alibi AnouarKais GuesmiPas encore d'évaluation
- Série D'exercices de Révision Corrigées de Chimie Suivi Temporel d'1 Transformation Vitesse de La Réaction p.SBIRO Abdelkrim (WWW - Pc1.ma)Document19 pagesSérie D'exercices de Révision Corrigées de Chimie Suivi Temporel d'1 Transformation Vitesse de La Réaction p.SBIRO Abdelkrim (WWW - Pc1.ma)Yacine Ait El Houss100% (15)
- Risque Chimique-1-1Document37 pagesRisque Chimique-1-1youssefelabbassiPas encore d'évaluation
- SerieDocument7 pagesSeriemehdi benmassoudPas encore d'évaluation
- Série D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument8 pagesSérie D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDMoulayMouly100% (6)
- Série de Révision 2023 PDFDocument58 pagesSérie de Révision 2023 PDFnur alouiPas encore d'évaluation
- 2 Suivi Temporel Dune Transformation Vitesse de Reaction RepareDocument4 pages2 Suivi Temporel Dune Transformation Vitesse de Reaction RepareMouna ElPas encore d'évaluation
- Série 2 2 Bac SMDocument3 pagesSérie 2 2 Bac SMYns Frakchi92% (12)
- Exercices - Cinétique Chimique - Chapitre 6Document3 pagesExercices - Cinétique Chimique - Chapitre 6Marwan Azerty100% (2)
- Vitesse 2Document5 pagesVitesse 2lemiaPas encore d'évaluation
- TD de CinétiqueDocument14 pagesTD de CinétiqueDieu-donné Akin100% (2)
- Série N°1Document1 pageSérie N°1alae el jarmouniPas encore d'évaluation
- Série D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriDocument5 pagesSérie D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriTawfiq Weld EL Arbi0% (1)
- Serir SuiviDocument7 pagesSerir Suivikhaoula elhansaliPas encore d'évaluation
- Série Sur Suivi 2 Bac PC - 2022Document4 pagesSérie Sur Suivi 2 Bac PC - 2022Alaoui AminePas encore d'évaluation
- 2-Cinetique ChimiqueDocument5 pages2-Cinetique ChimiqueAnis Dahnen0% (1)
- Olympiade-Chimie Maroc 2016 Serie 4Document4 pagesOlympiade-Chimie Maroc 2016 Serie 4mrPas encore d'évaluation
- Capture D'écran . 2023-11-16 À 19.24.58Document14 pagesCapture D'écran . 2023-11-16 À 19.24.58azeddineelghazoui637Pas encore d'évaluation
- Chimie TD 3 Cinétique ChimiqueDocument4 pagesChimie TD 3 Cinétique ChimiqueFranck Momo100% (1)
- Serie Suivi 2 Bac Biof SM PC FrancaisDocument5 pagesSerie Suivi 2 Bac Biof SM PC FrancaisMoussa Traoré100% (1)
- Exercice 29 Suivi Temporel D'une Transformation Chimique (Pr. DIAM)Document5 pagesExercice 29 Suivi Temporel D'une Transformation Chimique (Pr. DIAM)mndmtrofixPas encore d'évaluation
- Serie C: Cinétique Chimie: 500 ML 2.10 500 ML 6.10 +2 H /H /I (H)Document4 pagesSerie C: Cinétique Chimie: 500 ML 2.10 500 ML 6.10 +2 H /H /I (H)Babacar NdiayePas encore d'évaluation
- Série D'exercices - Chimie Cinétique Chimique - Bac Sciences Exp (2011-2012) MR Dahmani LotfiDocument0 pageSérie D'exercices - Chimie Cinétique Chimique - Bac Sciences Exp (2011-2012) MR Dahmani LotfiMouf55Pas encore d'évaluation
- SuiviDocument3 pagesSuivihahaPas encore d'évaluation
- Serie de RevisionDocument3 pagesSerie de Revisionacademie archimedePas encore d'évaluation
- CNTRL Cinétique PDFDocument8 pagesCNTRL Cinétique PDFAyoub EtterchPas encore d'évaluation
- Série N°9-9Document3 pagesSérie N°9-9Jihad ELPas encore d'évaluation
- Série+d'exercices - Sciences Physiques Préparation Bac+2011 - Bac+Mathématiques (2010-2011) MR Benaich PDFDocument21 pagesSérie+d'exercices - Sciences Physiques Préparation Bac+2011 - Bac+Mathématiques (2010-2011) MR Benaich PDFBen Salem Noureddine0% (2)
- TD Suivi Temporel D'une Transformation Prof B.mousLIMDocument16 pagesTD Suivi Temporel D'une Transformation Prof B.mousLIMBadr Mouslim100% (2)
- Série de Révision 2021 SciencesDocument38 pagesSérie de Révision 2021 SciencesWiem BenchahbounPas encore d'évaluation
- Cinetique Chimique ExosDocument3 pagesCinetique Chimique ExosAbel MalléPas encore d'évaluation
- Série Cinétique Chimique 2bac: P T P T RDocument9 pagesSérie Cinétique Chimique 2bac: P T P T Rrkibi.khadija2006Pas encore d'évaluation
- Chimie TD 3 Cinétique Chimique PDFDocument4 pagesChimie TD 3 Cinétique Chimique PDFOussama El BouadiPas encore d'évaluation
- Serie 2 Suivi Temporelle D Une Transformation ChimiqueDocument7 pagesSerie 2 Suivi Temporelle D Une Transformation Chimiquee.maskarPas encore d'évaluation
- Exercices 8 Suivi TemporelDocument1 pageExercices 8 Suivi TemporelMeryam MessaoudiPas encore d'évaluation
- Série de Révision 2021 Sciences Corrigé Ma ClasseDocument72 pagesSérie de Révision 2021 Sciences Corrigé Ma ClasseSamir LoqmanePas encore d'évaluation
- 651d3e5278640 Magazine1Document6 pages651d3e5278640 Magazine1yasminmarouani02Pas encore d'évaluation
- C.P 22-23 CinetiqueDocument2 pagesC.P 22-23 CinetiquediarratogsibPas encore d'évaluation
- Série Chimie Cinétique Chimique 2011 2012 (Dahmani Lotfi)Document4 pagesSérie Chimie Cinétique Chimique 2011 2012 (Dahmani Lotfi)Aicha DaouPas encore d'évaluation
- Avancement 2Document2 pagesAvancement 2Foudil LaouiciPas encore d'évaluation
- Sciences-Physique S1-S3-1er-gr 2006Document5 pagesSciences-Physique S1-S3-1er-gr 2006Doro CisséPas encore d'évaluation
- Ex 1Document2 pagesEx 1soulaimaneelaouni220Pas encore d'évaluation
- PC Tle S TD 11Document2 pagesPC Tle S TD 11Dossou Salome Le VétérinairePas encore d'évaluation
- Serie C1 PDFDocument4 pagesSerie C1 PDFMofid PC100% (3)
- Série N°3 Avec Correction Chimie Série Cinétique 2007 2008 (Tlili Touhami)Document14 pagesSérie N°3 Avec Correction Chimie Série Cinétique 2007 2008 (Tlili Touhami)Ltaief Chayma100% (2)
- Applications Suivi20.21Document3 pagesApplications Suivi20.21Phobos ElfaPas encore d'évaluation
- Sciences Physiques - Cinetique Chimique-Gazzah MahmoudDocument3 pagesSciences Physiques - Cinetique Chimique-Gazzah MahmoudMahmoud GazzahPas encore d'évaluation
- Pays: Togo Année: 2016 Session: Sciences Physiques Série: BAC, Série D Durée: 3 H Coefficient: 3Document3 pagesPays: Togo Année: 2016 Session: Sciences Physiques Série: BAC, Série D Durée: 3 H Coefficient: 3MAGNANGOUPas encore d'évaluation
- 31RS11 PDFDocument8 pages31RS11 PDFMoufida ZouaghiPas encore d'évaluation
- Ob s1 Cinetique ChimiqueDocument2 pagesOb s1 Cinetique Chimiquemedabdellahisamba34Pas encore d'évaluation
- Devoir Synthèse-1 - 4 M-2022Document6 pagesDevoir Synthèse-1 - 4 M-2022Riadh BesbesPas encore d'évaluation
- Série D'exercices N°1 Lycée Pilote - Chimie - AVANCEMENT - Bac Sciences Exp (2018-2019) MR Mabrouki SalahDocument6 pagesSérie D'exercices N°1 Lycée Pilote - Chimie - AVANCEMENT - Bac Sciences Exp (2018-2019) MR Mabrouki SalahMôlkà Trabelsi0% (1)
- Série D'exercices - Sciences Physiques Préparation Bac 2011 - Bac Mathématiques (2010-2011) MR BenaichDocument21 pagesSérie D'exercices - Sciences Physiques Préparation Bac 2011 - Bac Mathématiques (2010-2011) MR BenaichTawfiq Weld EL ArbiPas encore d'évaluation
- TP - Avancement I2Document2 pagesTP - Avancement I2lennym398Pas encore d'évaluation
- Cinn Chim1Document4 pagesCinn Chim1Sarra HmPas encore d'évaluation
- Cinétique Chimique Exercices 01.TextMarkDocument4 pagesCinétique Chimique Exercices 01.TextMarkAbedPas encore d'évaluation
- Exercices 4 Suivi TemporelDocument1 pageExercices 4 Suivi TemporelOmar HibaPas encore d'évaluation
- Série D'exercices N°1 - Sciences Physiques Cinétique Chmique, Dosage Acide-Base, Dipôle RL, Oscillations Mécaniques Forcées - Bac Sciences Exp (2010-2011) MR Abdmouleh NabilDocument5 pagesSérie D'exercices N°1 - Sciences Physiques Cinétique Chmique, Dosage Acide-Base, Dipôle RL, Oscillations Mécaniques Forcées - Bac Sciences Exp (2010-2011) MR Abdmouleh NabilhammouazizPas encore d'évaluation
- Controle 4 Atomesions 3eDocument4 pagesControle 4 Atomesions 3ehelene.helene5656Pas encore d'évaluation
- 1 spé chap 3 bilan cours act 1 et 2Document3 pages1 spé chap 3 bilan cours act 1 et 2el bardaiPas encore d'évaluation
- Série N°2 TP-HydrologieDocument4 pagesSérie N°2 TP-Hydrologieparapharmacie oumaymaPas encore d'évaluation
- These BENZEKRI 07 10 2018Document180 pagesThese BENZEKRI 07 10 2018Amel MetzPas encore d'évaluation
- TP Physio VDocument8 pagesTP Physio VfiraPas encore d'évaluation
- TD5 Stereochimie ConfigurationDocument4 pagesTD5 Stereochimie ConfigurationkushanjidPas encore d'évaluation
- Theory of Membrane Gas SeparationDocument201 pagesTheory of Membrane Gas SeparationPhatchayada KhamhaengPas encore d'évaluation
- Pollution Des SolsDocument15 pagesPollution Des SolsHalima ZaghbibPas encore d'évaluation
- absorption coursDocument23 pagesabsorption coursIsmail ZitouniPas encore d'évaluation
- Video DatationDocument33 pagesVideo DatationStephani BouraPas encore d'évaluation
- EXMD - 2022 - Épreuve - 2 - Aout - AM - Bleu - Sans Corrigé - VFDocument25 pagesEXMD - 2022 - Épreuve - 2 - Aout - AM - Bleu - Sans Corrigé - VFboudhar mohamedPas encore d'évaluation
- Memoire PhotodiodeDocument81 pagesMemoire PhotodiodeToukaa Dz0% (1)
- Fndae 38 Chap 01 02 PDFDocument27 pagesFndae 38 Chap 01 02 PDFNacer KorichiPas encore d'évaluation
- CHAPITRE B-Valorisation Des Dechets Dans Le GCDocument12 pagesCHAPITRE B-Valorisation Des Dechets Dans Le GCsabri yahiaouiPas encore d'évaluation
- Activité 1la Radioactivité Dans Notre Environnement - ElèvesDocument5 pagesActivité 1la Radioactivité Dans Notre Environnement - ElèvesGabriel reignePas encore d'évaluation
- Exposé SVT Les Minerais A MadagascarDocument7 pagesExposé SVT Les Minerais A MadagascarJohan RaharisonPas encore d'évaluation
- Débouchage LiègeDocument3 pagesDébouchage LiègeMy depPas encore d'évaluation
- QCM Ordures MénagèresDocument1 pageQCM Ordures Ménagèresbadia.el1Pas encore d'évaluation
- Université Ibn Tofail PDF FINALDocument131 pagesUniversité Ibn Tofail PDF FINALrahma elmaaroufiPas encore d'évaluation
- Cours de Mecanique Des Materiaux Composites Cycle Master Enset 2Document263 pagesCours de Mecanique Des Materiaux Composites Cycle Master Enset 2Odi Enyegue Timothee Thierry100% (5)
- 283 Pulleys TaperlockveeDocument8 pages283 Pulleys TaperlockveepitambervermaPas encore d'évaluation
- COURS 2 Membrane PlasmiqueDocument109 pagesCOURS 2 Membrane Plasmiqueautre.compte.02468Pas encore d'évaluation
- 6570 Materiaux Composites Et Structures Composites EnsDocument32 pages6570 Materiaux Composites Et Structures Composites Ensnacer zidiPas encore d'évaluation
- Indices Salaires & Matieres: TrimestreDocument9 pagesIndices Salaires & Matieres: TrimestreYoucefPas encore d'évaluation
- Conductimetrie Rappels CoursDocument11 pagesConductimetrie Rappels CoursAmanda BellPas encore d'évaluation
- FT Hacierba 1.450.70 BHDocument1 pageFT Hacierba 1.450.70 BHC PPas encore d'évaluation
- Resume Sciences Bilogique Pour L'ingenieurDocument37 pagesResume Sciences Bilogique Pour L'ingenieurSara AdPas encore d'évaluation
- BIO CEL Chap 4 - 3 Système Endomembranaire 20-21-1Document20 pagesBIO CEL Chap 4 - 3 Système Endomembranaire 20-21-1fatimaarrach59Pas encore d'évaluation
- Etude de La Qualité Nutritionnelle Et Sensorielle Du PainDocument65 pagesEtude de La Qualité Nutritionnelle Et Sensorielle Du PainSawsen MhamdiPas encore d'évaluation