Académique Documents
Professionnel Documents
Culture Documents
Electrolytes Et Inogramme Sanguin PDF
Transféré par
YASMEROTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Electrolytes Et Inogramme Sanguin PDF
Transféré par
YASMERODroits d'auteur :
Formats disponibles
1
UNIVERSITE DE RENNES I
FACULTE DE MEDECINE DE RENNES
DEPARTEMENT DE BIOCHIMIE ET BIOLOGIE MOLECULAIRE
P.C.E.M. 2
BIOCHIMIE SEMEIOLOGIQUE : module Nphrologie
ELECTROLYTES
ET IONOGRAMME SANGUIN
PROFESSEUR ANDRE LE TREUT
Anne Universitaire 2007 2008
2
D D finir les finir les lectrolytes lectrolytes
Interpr Interpr ter l ter l expression des unit expression des unit s s
de concentration : unit de concentration : unit s pond s pond rales, unit rales, unit s SI s SI
de charge de charge lectrique lectrique
Comprendre les notions de : Comprendre les notions de :
dissociation dissociation lectrolytique lectrolytique
quilibre ionique quilibre ionique
compartiments hydriques de l compartiments hydriques de l organisme organisme
Liquide extracellulaire (plasma sanguin, liquide interstitiel) Liquide extracellulaire (plasma sanguin, liquide interstitiel)
Liquide intracellulaire Liquide intracellulaire
changes entre les compartiments changes entre les compartiments
Pression osmotique ( Pression osmotique (osmolarit osmolarit , , osmolalit osmolalit ) )
Pression oncotique des prot Pression oncotique des prot ines ines
Conna Conna tre la composition normale en tre la composition normale en lectrolytes des lectrolytes des
principaux compartiments hydriques de l principaux compartiments hydriques de l organisme organisme
Savoir prescrire un ionogramme sanguin Savoir prescrire un ionogramme sanguin
Conna Conna tre pour les principaux tre pour les principaux l l ments du ionogramme : ments du ionogramme :
Les m Les m thodes de dosage thodes de dosage
Les valeurs de r Les valeurs de r f f rence rence
Les principales perturbations Les principales perturbations
Les objectifs Les objectifs
A. A. D D finition : compos finition : compos s chimiques qui, dissous dans s chimiques qui, dissous dans
un solvant tel que l un solvant tel que l eau, ont la propri eau, ont la propri t t de se de se
dissocier en ions de charges dissocier en ions de charges lectriques oppos lectriques oppos es. es.
B. B. Terminologie : Terminologie :
Solut Solut + solvant + solvant solution solution
Tous les solut Tous les solut s physiologiques ne sont pas capables de s physiologiques ne sont pas capables de
dissociation : ex. glucose, ur dissociation : ex. glucose, ur e, e,
On trouve donc en solution, des mol On trouve donc en solution, des mol cules ionis cules ionis es et des es et des
mol mol cules non ionis cules non ionis es. es.
C. C. La dissociation donne naissance La dissociation donne naissance des des
groupements groupements
simples : simples : ClNa ClNa Cl Cl
- -
+ Na + Na
+ +
complexes : complexes : PO PO
4 4
HNa HNa
2 2
PO PO
4 4
H H
- -
+ 2 Na + 2 Na
+ +
I. La dissociation des I. La dissociation des lectrolytes lectrolytes
3
D. D. Il y a 2 types d Il y a 2 types d lectrolytes : lectrolytes :
1. 1. Les Les lectrolytes forts qui se dissocient compl lectrolytes forts qui se dissocient compl tement, tement,
et sont donc toujours ionis et sont donc toujours ionis s. Ce sont les acides forts s. Ce sont les acides forts
( (HCl HCl), les bases fortes ( ), les bases fortes (NaOH NaOH), et leurs sels (le ), et leurs sels (le
chlorure de sodium : chlorure de sodium : NaCl NaCl Na Na
+ +
+ Cl + Cl
- -
) )
2. 2. Les Les lectrolytes faibles qui ne se dissocient que lectrolytes faibles qui ne se dissocient que
partiellement : ex. de la plupart des acides organiques partiellement : ex. de la plupart des acides organiques
(acide ac (acide ac tique, acide aspartique) tique, acide aspartique)
a) a) Dans ce cas, il y a dans la mme solution coexistence Dans ce cas, il y a dans la mme solution coexistence la la
fois de mol fois de mol cules dissoci cules dissoci es (ions) et de mol es (ions) et de mol cules non cules non
dissoci dissoci es es
b) b) le rapport du le rapport du Nb Nb de mol dissoci de mol dissoci es/ es/Nb Nb total de total de
mol est appel mol est appel coefficient de dissociation coefficient de dissociation du solut du solut
(1 (1 - - ) est la fraction de mol ) est la fraction de mol cules non dissoci cules non dissoci es es
E. E. Les ions sont de 2 types : anions et cations Les ions sont de 2 types : anions et cations
1. 1. Ils migrent diff Ils migrent diff remment dans un champ remment dans un champ lectrique : lectrique :
a) a) les cations les cations charg charg s positivement s positivement
migrent vers la cathode : ex. Na migrent vers la cathode : ex. Na
+ +
, K , K
+ +
, ,
Ca Ca
++ ++
ou Mg ou Mg
++ ++
b) b) les anions les anions charg charg s n s n gativement gativement
migrent vers l migrent vers l anode:. anode:.
Ex: Cl Ex: Cl
- -
, CO , CO
3 3
H H
- -
2. 2. Dans tous les liquides physiologiques, la neutralit Dans tous les liquides physiologiques, la neutralit
lectrique doit tre maintenue : lectrique doit tre maintenue :
le nombre total de charges positives le nombre total de charges positives
port port es par les cations doit donc tre es par les cations doit donc tre
quilibr quilibr par un nombre par un nombre gal de gal de
charges n charges n gatives port gatives port es par les anions es par les anions
4
A. A. Les unit Les unit s de concentration : s de concentration :
1. 1. Le syst Le syst me international d me international d unit unit s (SI) est l s (SI) est l gal en France gal en France
depuis 1961. Il est appliqu depuis 1961. Il est appliqu la biologie fran la biologie fran aise depuis aise depuis
1978 1978
a) a) Dans le SI, l Dans le SI, l unit unit de mati de mati re s re s exprime en mol exprime en mol
(sous (sous- -multiples : mmol, multiples : mmol, mol mol, , nmol nmol, , pmol pmol, , ) )
b) b) Les unit Les unit s molaires correspondent au nombre de moles par s molaires correspondent au nombre de moles par
litre (mol/l) litre (mol/l)
c) c) Ce choix se justifie par le fait que dans les processus Ce choix se justifie par le fait que dans les processus
biologiques, les r biologiques, les r actions biochimiques se d actions biochimiques se d roulent entre roulent entre
entit entit s mol s mol culaires culaires
d) d) Ex. du chlorure de sodium Ex. du chlorure de sodium ClNa ClNa
1 mol 1 mol cule cule- -gramme (ou mole) = 58,5 g gramme (ou mole) = 58,5 g
(Na : 23 + Cl : 35,5) (Na : 23 + Cl : 35,5)
Une solution molaire de Une solution molaire de ClNa ClNa (1 mole/l ou 1 M) = 58,5 g/l (1 mole/l ou 1 M) = 58,5 g/l
2. 2. Les unit Les unit s pond s pond rales (g/l) sont donc aujourd rales (g/l) sont donc aujourd hui obsol hui obsol tes tes
Sauf quand la masse mol Sauf quand la masse mol culaire M d culaire M d une substance n une substance n est est
pas connue pr pas connue pr cis cis ment (m ment (m langes de prot langes de prot ines). Dans ce ines). Dans ce
cas, la concentration s cas, la concentration s exprime encore en g/l (mg/l, exprime encore en g/l (mg/l, g g/l) /l)
II. Expression des r II. Expression des r sultats sultats
B. B. Les unit Les unit s de charges s de charges lectriques : lectriques :
1. 1. S S expriment en expriment en quivalents quivalents ( (Eq Eq) )
ou en milli ou en milli quivalents ( quivalents (mEq mEq) )
2. 2. Mesurent l Mesurent l activit activit chimique d chimique d un un lectrolyte donn lectrolyte donn qui, qui,
elle elle- -mme, est fonction de la valence des ions mme, est fonction de la valence des ions
a) a) Lorsqu Lorsqu il s il s agit d agit d un un lectrolyte monovalent lectrolyte monovalent : Na : Na
+ +
L L activit activit en en mEq mEq est est gale au nombre de mmol gale au nombre de mmol
On dira ainsi que dans le plasma la concentration On dira ainsi que dans le plasma la concentration
normale en sodium (natr normale en sodium (natr mie) est de 142 mmol/l ou de mie) est de 142 mmol/l ou de
142 142 mEq mEq/l /l
b) b) Lorsqu Lorsqu il s il s agit d agit d un un lectrolyte bivalent lectrolyte bivalent : Ca : Ca
++ ++
L L activit activit en en mEq mEq est est gale au gale au Nb Nb de mmol x 2 de mmol x 2
On dira ainsi que dans le plasma la concentration On dira ainsi que dans le plasma la concentration
normale en calcium (calc normale en calcium (calc mie) est de 2,50 mmol/l ou mie) est de 2,50 mmol/l ou
de 5 de 5 mEq mEq/l /l
5
A. A. Le m Le m tabolisme des tabolisme des lectrolytes est intimement lectrolytes est intimement
li li celui de l celui de l eau eau
1. 1. L L eau est le solvant eau est le solvant dans lequel les dans lequel les
lectrolytes sont dissous lectrolytes sont dissous
2. 2. L L eau totale eau totale = 60% du poids corporel = 60% du poids corporel
a) a) Variations physiologiques avec : Variations physiologiques avec :
i. i. les tissus : teneur + les tissus : teneur + lev lev e dans les tissus mous, e dans les tissus mous,
+ faible dans tissus durs (os, cartilage) + faible dans tissus durs (os, cartilage)
ii. ii. Le % de masse maigre ou de masse grasse Le % de masse maigre ou de masse grasse
- - 75% d 75% d eau dans le muscle eau dans le muscle
- - 10% d 10% d eau dans le tissu adipeux (impact chez eau dans le tissu adipeux (impact chez
l l ob ob se) se)
iii. iii. le sexe : H 60%, F 50% le sexe : H 60%, F 50%
iv. iv. l l ge : nourrisson 75%, vieillard <50% ge : nourrisson 75%, vieillard <50%
b) b) En pathologie, En pathologie,
toute variation rapide du poids corporel doit faire toute variation rapide du poids corporel doit faire
suspecter une r suspecter une r tention ou une perte d tention ou une perte d eau eau
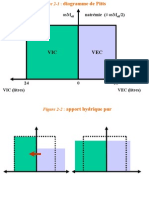
III. Les compartiments hydriques de l III. Les compartiments hydriques de l organisme organisme
B. B. L L organisme comprend deux grands secteurs organisme comprend deux grands secteurs
hydriques hydriques
1. 1. Le secteur Le secteur extra extra- -cellulaire cellulaire (liquide extracellulaire (liquide extracellulaire - - LEC) LEC)
a) a) 20% du poids corporel ( 20% du poids corporel ( milieu int milieu int rieur rieur ) )
b) b) Il est subdivis Il est subdivis en 2 parties : en 2 parties :
i. i. Le plasma sanguin (secteur vasculaire) Le plasma sanguin (secteur vasculaire)
- - l l eau plasmatique repr eau plasmatique repr sente environ 5% du poids corporel sente environ 5% du poids corporel
- - les solut les solut s existent sous forme dissoci s existent sous forme dissoci e ( e ( lectrolytes) et non lectrolytes) et non
dissoci dissoci e (glucose, ur e (glucose, ur e, e, ) )
ii. ii. Les liquides interstitiels et la lymphe Les liquides interstitiels et la lymphe
- - repr repr sentent 15% du poids corporel sentent 15% du poids corporel
- - sa composition est celle d sa composition est celle d un un ultra ultra- -filtrat filtrat de plasma sanguin de plasma sanguin
(pauvre en prot (pauvre en prot ines) ines)
2. 2. Le secteur cellulaire Le secteur cellulaire (liquide intracellulaire (liquide intracellulaire - - LIC) LIC)
a) a) 40 40 50% du poids corporel 50% du poids corporel
b) b) Composition assez variable d Composition assez variable d un tissu un tissu l l autre, mais autre, mais
remarquable par remarquable par
i. i. sa pauvret sa pauvret en Na et Cl, en Na et Cl,
ii. ii. sa richesse en K et Phosphates sa richesse en K et Phosphates
6
C. C. Les Les changes entre LIC et LEC changes entre LIC et LEC
1. 1. Les membranes plasmiques se comportent en partie Les membranes plasmiques se comportent en partie
comme des membranes semi comme des membranes semi- -perm perm ables. ables.
Elles sont plus perm Elles sont plus perm ables ables l l eau qu eau qu aux solut aux solut s. s.
2. 2. Mise en Mise en vidence du pouvoir osmotique P : vidence du pouvoir osmotique P :
avant avant
apr apr s s
P P
3. 3. La direction du flux de l La direction du flux de l eau libre eau libre d d pend du gradient de pend du gradient de
pression osmotique entre le LIC et le LEC : l pression osmotique entre le LIC et le LEC : l eau va du milieu eau va du milieu
le moins concentr le moins concentr (hypotonique) vers le milieu le plus (hypotonique) vers le milieu le plus
concentr concentr (hypertonique) (hypertonique)
4. 4. La pression osmotique (ou La pression osmotique (ou osmolarit osmolarit ) )
est proportionnelle au nombre de particules en solution est proportionnelle au nombre de particules en solution
5. 5. L L osmolarit osmolarit se mesure en se mesure en osmoles osmoles ( (Osm Osm) )
ou ou milliosmoles milliosmoles ( (mOsm mOsm) )
1 1 Osm Osm est la pression osmotique exerc est la pression osmotique exerc e par une e par une
mol mol cule cule- -gramme de solut gramme de solut dissout dans 1 l d dissout dans 1 l d eau eau
a) a) Cas du glucose (mol Cas du glucose (mol cule non dissoci cule non dissoci e, M = 180g) e, M = 180g)
1 solution contenant 180 g de glucose/l d 1 solution contenant 180 g de glucose/l d eau eau
d d veloppe une pression osmotique de 1 veloppe une pression osmotique de 1 Osm Osm
b) b) Cas du Cas du ClNa ClNa (dissoci (dissoci , M = 58,5g) , M = 58,5g)
1 solution contenant 58,5 g de 1 solution contenant 58,5 g de ClNa ClNa/l d /l d eau d eau d veloppe veloppe
une pression osmotique de 2 une pression osmotique de 2 Osm Osm
7
c) c) Pression osmotique : 2 modes d Pression osmotique : 2 modes d expression expression
i. i. L L osmolarit osmolarit , , qui d qui d pend du nombre d pend du nombre d osmoles osmoles
contenues dans 1 litre de solution, est d contenues dans 1 litre de solution, est d environ de environ de
300 300 mOsm mOsm
ii. ii. L L osmolalit osmolalit correspond au nombre d correspond au nombre d osmoles osmoles
contenues dans 1 Kg de solvant contenues dans 1 Kg de solvant
(on se r (on se r f f re au litre d re au litre d eau pure) eau pure)
Cette nuance est importante pour le plasma Cette nuance est importante pour le plasma
sanguin qui ne contient que 93% d sanguin qui ne contient que 93% d eau (le volume eau (le volume
restant : essentiellement les prot restant : essentiellement les prot ines). ines).
iii. iii. Dans le cas du plasma, l Dans le cas du plasma, l osmolalit osmolalit est donc > est donc >
l l osmolarit osmolarit d d un facteur 100/93 un facteur 100/93
6. 6. Mesure du pouvoir osmotique : Mesure du pouvoir osmotique :
a) a) M M thode directe par thode directe par osmom osmom trie trie
Mesure de la force Mesure de la force appliquer appliquer l l aide d aide d un piston pour maintenir un piston pour maintenir
le volume de la solution le volume de la solution
Mesure de l Mesure de l abaissement du point de cong abaissement du point de cong lation de la solution lation de la solution
( ( cryoscopique) cryoscopique)
On sait que ce point s On sait que ce point s abaisse quand l abaisse quand l osmolarit osmolarit cro cro t. t.
Il est de Il est de - -1,86 1,86 C pour une solution contenant 1 C pour une solution contenant 1 Osm Osm/Kg d /Kg d eau eau
Cas du plasma sanguin : son point de cong Cas du plasma sanguin : son point de cong lation est lation est
normalement de normalement de - -0,56 0,56 C. On peut alors calculer son C. On peut alors calculer son osmolarit osmolarit
par le rapport : par le rapport :
0,56/1,86 # 0,300 0,56/1,86 # 0,300 Osm Osm ou 300 ou 300 mOsm mOsm
b) b) M M thode indirecte : calcul approch thode indirecte : calcul approch partir des partir des
concentrations des principaux solut concentrations des principaux solut s du plasma : s du plasma :
2 (Na 2 (Na
+ +
+ K + K
+ +
) + 10 si ur ) + 10 si ur e et glucose plasmatiques sont e et glucose plasmatiques sont
concentrations normales (5 mmol/l) concentrations normales (5 mmol/l)
l l osmolarit osmolarit du plasma normal est d du plasma normal est d environ 300 environ 300 310 310 mOsm mOsm
(variation possible entre 280 et 400 (variation possible entre 280 et 400 mOsm mOsm) )
En pathologie, ajouter 1 En pathologie, ajouter 1 mOsm mOsm par mmol/l suppl par mmol/l suppl mentaire de mentaire de
glucose ou d glucose ou d ur ur e e
8
D. D. Les Les changes entre plasma et liquides interstitiels changes entre plasma et liquides interstitiels
1. 1. R R glent l glent l hydratation du secteur extracellulaire hydratation du secteur extracellulaire
2. 2. La membrane des capillaires est La membrane des capillaires est
librement librement perm perm able able aux substances diffusibles aux substances diffusibles
lectrolytiques lectrolytiques
beaucoup beaucoup moins moins perm perm able able aux prot aux prot ines, plus ines, plus
abondantes dans le plasma que dans le liquide abondantes dans le plasma que dans le liquide
interstitiel. interstitiel.
3. 3. Les prot Les prot ines exercent donc dans les capillaires un ines exercent donc dans les capillaires un
pouvoir osmotique pouvoir osmotique : il est faible, : il est faible, mais il rend compte mais il rend compte
des flux d des flux d eau entre liquides interstitiels et plasma : eau entre liquides interstitiels et plasma :
c c est la est la pression oncotique pression oncotique
4. 4. La contribution des prot La contribution des prot ines plasmatiques ines plasmatiques la la
pression osmotique totale du plasma pression osmotique totale du plasma (qui est de 300 (qui est de 300
mOsm mOsm) est quantitativement n ) est quantitativement n gligeable : elle gligeable : elle
repr repr sente sente peine 1 peine 1 milliosmole milliosmole, le reste , le reste tant tant
d d velopp velopp par les autres constituants du plasma, dont par les autres constituants du plasma, dont
140 sont uniquement d 140 sont uniquement d velopp velopp es par l es par l ion Na ion Na
+ +
5. 5. Les Les changes entre le plasma et le secteur interstitiel changes entre le plasma et le secteur interstitiel
sont r sont r gis par le rapport entre la pression hydrostatique gis par le rapport entre la pression hydrostatique
(PH) (PH) et et la pression oncotique (PO) dans les capillaires la pression oncotique (PO) dans les capillaires
sanguins sanguins
6. 6. La pression oncotique a pour expression : La pression oncotique a pour expression :
Ponc Ponc = C/M , avec C=concentration en prot = C/M , avec C=concentration en prot ines ines
et M= masse mol et M= masse mol culaire culaire
7. 7. Si l Si l on applique cette relation : on applique cette relation :
a) a) la s la s rumalbumine (C=40 g/l, M = 66 000d), la rumalbumine (C=40 g/l, M = 66 000d), la Ponc Ponc
correspondante est de 40/66 000 = 0,60 correspondante est de 40/66 000 = 0,60 mOsm mOsm/l /l
b) b) aux globulines plasmatiques : aux globulines plasmatiques :
(C moyenne de 30 g/l et M moyenne de 200 000d) (C moyenne de 30 g/l et M moyenne de 200 000d)
g g n n rent une rent une Ponc Ponc de 30/200 000=0,15 de 30/200 000=0,15 mOsmol mOsmol/l /l
8. 8. La pression oncotique totale d La pression oncotique totale d velopp velopp e par les e par les
prot prot ines plasmatiques est donc normalement de 0,75 ines plasmatiques est donc normalement de 0,75
mOsmol mOsmol/l (dont 80 % li /l (dont 80 % li e e l l albumine) albumine)
9
Cons Cons quences quences : :
- - Quand PH > PO Quand PH > PO, il y a extravasation d , il y a extravasation d eau. Cette sortie d eau. Cette sortie d eau entra eau entra ne avec elles ne avec elles
des gaz dissous (O des gaz dissous (O
2 2
), des sels min ), des sels min raux et diverses mol raux et diverses mol cules organiques cules organiques
- - Quand PH < PO Quand PH < PO, il y a rappel de l , il y a rappel de l eau dans le capillaire, entra eau dans le capillaire, entra nant nant
par la mme occasion des gaz dissous (CO par la mme occasion des gaz dissous (CO
2 2
) et des d ) et des d chets m chets m taboliques taboliques
En pathologie En pathologie : constitution d : constitution d oed oed mes p mes p riph riph riques ( riques (hyper hyper- -hydratation hydratation du secteur du secteur
interstitiel) interstitiel) en cas de : d en cas de : d pl pl tion prot tion prot ique du plasma (oed ique du plasma (oed mes de carence) mes de carence)
d d insuffisance cardiaque (stase capillaire) insuffisance cardiaque (stase capillaire)
MOUVEMENTS DE LEAU DANS LE CAPILLAIRE SANGUIN
ple artriel ple veineux
SECTEUR CAPILLAIRE
PH > PO PH < PO
H
2
O H
2
O
SECTEUR INTERSTITIEL
PH : pression hydrostatique (lie la force de propulsion
du sang dveloppe par le coeur)
PO : pression oncotique des protines plasmatiques
Sch Sch ma ma
De De
Starling Starling
PH 30 mm Hg PH 30 mm Hg PH 10 mm Hg PH 10 mm Hg
PO 18 mm Hg PO 18 mm Hg
Les r Les r sultats sont exprim sultats sont exprim s en s en mEq mEq/l /l
Pour la conversion en unit Pour la conversion en unit s SI : tenir compte de la valence s SI : tenir compte de la valence
de l de l ion (ex. : Ca ion (ex. : Ca
++ ++
: 5/2 = 2,50 mmol/l) : 5/2 = 2,50 mmol/l)
Na
+
142 Cl
-
103 Na
+
144 Cl
-
116
Na
+
10 Cl
-
5
K
+
5 CO
3
H
-
27
K
+
5 CO
3
H
-
29
K
+
140 CO
3
H
-
12
Ca
++
5 PO
4
H
-
2
Ca
++
3 PO
4
H
-
2
Ca
++
2 PO
4
H
-
100
Mg
++
3 SO
4
--
1
Mg
++
2 SO
4
--
1
Mg
++
35 SO
4
--
20
Prot
-
16 Prot
-
1 Prot
-
30
Ac. Org. 6 Ac. Org. 5 Ac. Org. 20
Total 155 155 154 154 187 187
LIQUIDE INTERSTITIEL LIQUIDE INTRACELLULAIRE
Cations Anions Cations Anions Anions Cations
PLASMA
E. E. Composition en Composition en lectrolytes des principaux lectrolytes des principaux
secteurs hydriques de l secteurs hydriques de l organisme : organisme :
10
Sch Sch ma de ma de Gamble Gamble
On appelle On appelle
IONOGRAMME la IONOGRAMME la
repr repr sentation graphique sentation graphique
de la composition en de la composition en
cations et anions d cations et anions d un un
liquide biologique liquide biologique
Par extension, c Par extension, c est la est la
mesure de la mesure de la
concentration des concentration des
principaux ions dans le principaux ions dans le
liquide concern liquide concern
(ionogramme sanguin, (ionogramme sanguin,
urinaire) urinaire)
A. A. Le dosage des Le dosage des lectrolytes lectrolytes
Est une prescription tr Est une prescription tr s (trop) r s (trop) r pandue pandue
C C est l est l une des analyses les plus prescrites : elle arrive au 9 une des analyses les plus prescrites : elle arrive au 9
rang de la biologie fran rang de la biologie fran aise (2004) aise (2004)
Activit Activit 2006 au CHU de Rennes : 2006 au CHU de Rennes :
plus de 200 000 ionogrammes sanguins plus de 200 000 ionogrammes sanguins
plus de 20 000 ionogrammes urinaires plus de 20 000 ionogrammes urinaires
C C est un examen codifi est un examen codifi par l par l assurance maladie (NABM : assurance maladie (NABM :
nomenclature des actes de biologie m nomenclature des actes de biologie m dicale) dicale)
ionogramme sanguin simple : Na ionogramme sanguin simple : Na
+ +
+ K + K
+ +
+ Cl + Cl
- -
: :
cotation B20 (tarif de la lettre cotation B20 (tarif de la lettre- -cl cl B B : 0,27 : 0,27 ) )
ionogramme sanguin complet : Na ionogramme sanguin complet : Na
+ +
+ K + K
+ +
+ Cl + Cl
- -
+ +
Bicarbonates CO Bicarbonates CO
3 3
H H
- -
(CO (CO
2 2
total ou total ou r r serve alcaline serve alcaline ) + ) +
Prot Prot ines totales. ines totales.
La prescription spare des actes qui constituent les
ionogrammes donne lieu la cotation du ionogramme
correspondant.
Ionogramme tendu : idem + Ca
++
+ Phosphates
Ionogramme urinaire : Na Na
+ +
+ K + K
+ +
(B20) (B20)
IV. La prescription du ionogramme IV. La prescription du ionogramme
11
Recommandations de bonne pratique m Recommandations de bonne pratique m dicale dicale
Eviter la prescription syst Eviter la prescription syst matique et r matique et r p p t t e si e si
l l tat du patient ne l tat du patient ne l exige pas exige pas
(hors r (hors r animation, soins intensifs) animation, soins intensifs)
Etre plus s Etre plus s lectif dans la prescription. lectif dans la prescription.
Si n Si n cessaire, demander par appel t cessaire, demander par appel t l l phonique au phonique au
laboratoire un compl laboratoire un compl ment d ment d analyse analyse
Avant de prescrire de nouvelles analyses, Avant de prescrire de nouvelles analyses,
v v rifier si : rifier si :
Des r Des r sultats valides ant sultats valides ant rieurs ne sont pas d rieurs ne sont pas d j j
disponibles disponibles
Une demande n Une demande n est pas d est pas d j j en cours, avec des en cours, avec des
r r sultats en attente sultats en attente
Le ionogramme urinaire : Na Na
+ +
+ K + K
+ +
(B20) (B20)
Son indication principale : en n Son indication principale : en n phrologie phrologie
B. B. Conditions Conditions pr pr analytiques analytiques des dosages des dosages
1. 1. chantillons : chantillons :
Pr Pr l l vements : sang veineux, art vements : sang veineux, art riel (si associ riel (si associ la la
gazom gazom trie sanguine) ou capillaire. trie sanguine) ou capillaire.
Urines, liquides de ponction, sueur, f Urines, liquides de ponction, sueur, f ces ces
Acheminement rapide au laboratoire Acheminement rapide au laboratoire
S S rum obtenu apr rum obtenu apr s centrifugation d s centrifugation d un tube sans un tube sans
anticoagulant (tube anticoagulant (tube sec sec ) )
Plasma obtenu apr Plasma obtenu apr s centrifugation d s centrifugation d un tube avec un tube avec
anticoagulant : h anticoagulant : h parine de lithium. Proscrire l parine de lithium. Proscrire l h h parine parine
de sodium, ou l de sodium, ou l EDTA EDTA). ).
Parfois sang total Parfois sang total
Urines sans antiseptique, centrifug Urines sans antiseptique, centrifug es ( es ( limine les limine les
cristaux urinaires) cristaux urinaires)
viter les pr viter les pr l l vements h vements h molys molys s (K s (K
+ +
) )
2. 2. Interf Interf rences possibles : lactescence, rences possibles : lactescence,
hyperprotid hyperprotid mie mie (conduisant (conduisant des fausses des fausses
hyponatr hyponatr mies mies) )
12
A. A. Le sodium plasmatique : Natr Le sodium plasmatique : Natr mie (Na mie (Na
+ +
) )
1. 1. Principal cation extracellulaire de l Principal cation extracellulaire de l organisme organisme
(plasma et liquide interstitiel) : (plasma et liquide interstitiel) :
Rle central dans l Rle central dans l quilibre quilibre hydro hydro- - lectrolytique lectrolytique de de
l l organisme organisme
Son abondance dans les liquides extracellulaires et la Son abondance dans les liquides extracellulaires et la
quasi quasi- -imperm imperm abilit abilit des membranes cellulaires des membranes cellulaires cet cet
ion lui conf ion lui conf rent un fort pouvoir osmotique rent un fort pouvoir osmotique
Rle pr Rle pr pond pond rant dans l rant dans l tat d tat d hydratation des hydratation des
secteurs hydriques : il conditionne les mouvements secteurs hydriques : il conditionne les mouvements
d d eau intracellulaire et extracellulaire eau intracellulaire et extracellulaire
2. 2. M M thodes de dosage thodes de dosage
Photom Photom trie de flamme trie de flamme
Spectrophotom Spectrophotom trie d trie d absorption atomique absorption atomique
Potentiom Potentiom trie trie utilisant une utilisant une lectrode s lectrode s lective aux lective aux
ions (ISE) : sp ions (ISE) : sp cifique du sodium (mesure de la cifique du sodium (mesure de la ddp ddp
cr cr e par la solution contenant des ions sodium) e par la solution contenant des ions sodium)
V. Les principaux V. Les principaux l l ments du ionogramme ments du ionogramme
Mesure Mesure potentiom potentiom trique trique par par lectrode s lectrode s lective lective
- La mesure se fait comparativement une solution talon
- Dans des conditions exprimentales prcises :
- La ddp mesure aux bornes du systme est une fonction logarithmique
de lactivit de lion mesurer : E = K logA + Constante
- Lactivit de lion en solution est lie sa concentration par la relation :
A = g C (g = coefficient dactivit)
Le systme de mesure se
comporte comme une pile :
- L'lectrode de rfrence
est au calomel (HgCl
2
/KCl)
ou au Ag/AgCl/KCl : elle
donne un potentiel stable
- Llectrode de mesure
est une lectrode
membrane slective dont
le potentiel va changer en
fonction de lactivit de
lion doser
13
3. 3. Valeurs de r Valeurs de r f f rence : rence : 138 138 143 mmol/l 143 mmol/l
4. 4. Principales perturbations Principales perturbations
a. a. Hyponatr Hyponatr mies mies : Na < 135 mmol/l : Na < 135 mmol/l
S S accompagnent d accompagnent d une hyperhydratation cellulaire une hyperhydratation cellulaire
avec avec tat confusionnel, puis coma; hypotonie des tat confusionnel, puis coma; hypotonie des
globes oculaires, un signe du pli cutan globes oculaires, un signe du pli cutan
i. i. Pseudo Pseudo- -hyponatr hyponatr mies mies
Hyperprot Hyperprot in in mie mie
Hyperlipid Hyperlipid mie mie
4. 4. Principales perturbations Principales perturbations
a. a. Hyponatr Hyponatr mies mies : Na < 135 mmol/l : Na < 135 mmol/l
ii. ii. Hyponatr Hyponatr mies mies vraies avec vraies avec hypo hypo- -osmolarit osmolarit
avec volume extracellulaire diminu avec volume extracellulaire diminu
- - pertes r pertes r nales : diur nales : diur tiques tiques
- - pertes digestives : vomissements, diarrh pertes digestives : vomissements, diarrh es es
- - sueurs sueurs
avec volume extracellulaire normal avec volume extracellulaire normal
- - s s cr cr tion inappropri tion inappropri e d e d ADH ADH
- - surcharge aqueuse (potomanie : polydipsie surcharge aqueuse (potomanie : polydipsie
psychog psychog ne) ne)
avec volume extracellulaire augment avec volume extracellulaire augment
- - insuffisance h insuffisance h patique, syndrome patique, syndrome
n n phrotique phrotique
- - insuffisance cardiaque insuffisance cardiaque
14
b. b. Hypernatr Hypernatr mies mies : Na > 145 mmol/l : Na > 145 mmol/l
S S accompagnent de signes de d accompagnent de signes de d shydratation shydratation
cellulaire : soif, s cellulaire : soif, s cheresse des muqueuses cheresse des muqueuses
M M canisme : canisme :
Par insuffisance d Par insuffisance d apport d apport d eau (ns, coma) eau (ns, coma)
Par perte excessive d Par perte excessive d eau eau
- - hypersudation hypersudation
- - coma du diab coma du diab te sucr te sucr (sujet incapable de (sujet incapable de
boire pour compenser ses pertes urinaires boire pour compenser ses pertes urinaires
- - diab diab te insipide : insuffisance de te insipide : insuffisance de secr secr tion tion
de l de l ADH ADH
Par surcharge en sel Par surcharge en sel
- - intoxication par le sel intoxication par le sel
- - erreur de r erreur de r animation, trop riche en sel animation, trop riche en sel
B. B. Le potassium plasmatique : Kali Le potassium plasmatique : Kali mie (K mie (K
+ +
) )
1. 1. Principal cation cellulaire mais cation peu repr Principal cation cellulaire mais cation peu repr sent sent
dans les milieux extracellulaires dans les milieux extracellulaires
2. 2. M M thodes de dosage thodes de dosage
Cf Cf dosage du sodium dosage du sodium
3. 3. Valeurs de r Valeurs de r f f rence : 3,5 rence : 3,5 5 mmol/l 5 mmol/l
4. 4. Principales perturbations Principales perturbations
a. a. Hypokali Hypokali mies : K < 3 mmol/l mies : K < 3 mmol/l
S S accompagnent de troubles de la accompagnent de troubles de la repolarisation repolarisation
cardiaque, de paralysie du grle ( cardiaque, de paralysie du grle (ileus ileus) )
M M canisme canisme
Fuites digestives (vomissements, diarrh Fuites digestives (vomissements, diarrh es, fistules es, fistules
digestives) digestives)
Fuites r Fuites r nales nales
15
4. 4. Principales perturbations Principales perturbations
b. b. Hyperkali Hyperkali mies : K mies : K
+ +
> 5,5 mmol/l > 5,5 mmol/l
S S accompagnent : accompagnent :
de troubles cardiaques de troubles cardiaques l l ECG ECG (onde T ample, (onde T ample,
espace PR allong espace PR allong , disparition de l , disparition de l onde P) onde P)
de troubles neurologiques de troubles neurologiques
M M canisme canisme
Surcharge intraveineuse en K (nutrition Surcharge intraveineuse en K (nutrition
parent parent rale) rale)
Insuffisance r Insuffisance r nale nale
Insuffisance surr Insuffisance surr nale nale
Augmentation du catabolisme prot Augmentation du catabolisme prot ique ique
(br (br lures, h lures, h morragies digestives) morragies digestives)
C. C. Le chlore plasmatique : Le chlore plasmatique : chlor chlor mie mie (Cl (Cl
- -
) )
1. 1. Principal anion des liquides extracellulaires Principal anion des liquides extracellulaires
(plasma, liquide interstitiel) (plasma, liquide interstitiel)
Son m Son m tabolisme est souvent li tabolisme est souvent li celui du celui du
sodium sodium
2. 2. M M thodes de dosage thodes de dosage
Colorim Colorim trie trie
Coulom Coulom trie trie
Potentiom Potentiom trie trie (ISE) (ISE)
3. 3. Valeurs de r Valeurs de r f f rence : 95 rence : 95 105 mmol/l 105 mmol/l
16
4. 4. Principales perturbations Principales perturbations
a. a. Hypochlor Hypochlor mies mies : Cl < 90 mmol/l : Cl < 90 mmol/l
Ne s Ne s accompagnent d accompagnent d aucun signe clinique aucun signe clinique
particulier particulier
M M canisme canisme
Peut accompagner une Peut accompagner une hyponatr hyponatr mie mie
Vomissements abondants (riches en Vomissements abondants (riches en HCl HCl) )
Insuffisance r Insuffisance r nale avec acidose m nale avec acidose m tabolique tabolique
b. b. Hyperchlor Hyperchlor mies mies : Cl > 110 mmol/l : Cl > 110 mmol/l
Ne s Ne s accompagnent d accompagnent d aucun signe clinique aucun signe clinique
particulier particulier
M M canisme canisme
Peut accompagner une Peut accompagner une hypernatr hypernatr mie mie
Hyperchlor Hyperchlor mie mie avec acidose m avec acidose m tabolique tabolique
- - pertes digestives de bicarbonates (diarrh pertes digestives de bicarbonates (diarrh es) es)
- - n n phropathies tubulaires phropathies tubulaires
Hyperchlor Hyperchlor mie mie avec alcalose respiratoire avec alcalose respiratoire
Vous aimerez peut-être aussi
- Guide Pratique Creation Logo EntrepriseDocument32 pagesGuide Pratique Creation Logo EntrepriseYASMERO100% (5)
- Abramovici Nello-Bernard, Pierre-Yves Gagneret, Pierre Jauffret-Les Neuf Defis Du Manager - Un Roman D'entreprise, 2eme Edition (2000) PDFDocument233 pagesAbramovici Nello-Bernard, Pierre-Yves Gagneret, Pierre Jauffret-Les Neuf Defis Du Manager - Un Roman D'entreprise, 2eme Edition (2000) PDFYASMEROPas encore d'évaluation
- Manuel de PrélèvementDocument88 pagesManuel de PrélèvementYASMERO100% (3)
- Manuel de PrélèvementDocument88 pagesManuel de PrélèvementYASMERO100% (3)
- 06 - La Résistance Bactérienne Aux AntibiotiquesDocument30 pages06 - La Résistance Bactérienne Aux Antibiotiquesbouchakour meryemPas encore d'évaluation
- Tout Sur Les Viandes, Les Poissons Et Les Fruits de Mer (PDFDrive)Document224 pagesTout Sur Les Viandes, Les Poissons Et Les Fruits de Mer (PDFDrive)Rivo RoberalimananaPas encore d'évaluation
- 2.multiplication ViraleDocument45 pages2.multiplication ViraleRomi AtouiPas encore d'évaluation
- Yummy Magazine N°7Document48 pagesYummy Magazine N°7Yummy Magazine100% (4)
- Cours 6Document27 pagesCours 6BouabidiPas encore d'évaluation
- La Plan Marketing PharmaceutiqueDocument211 pagesLa Plan Marketing PharmaceutiqueYASMERO88% (17)
- Transports MembranairesDocument39 pagesTransports Membranairesgalou123100% (1)
- Anatomie Pathologique111Document74 pagesAnatomie Pathologique111Vita HbPas encore d'évaluation
- Altération Du Béton en Site MaritimeDocument70 pagesAltération Du Béton en Site Maritimexmane111100% (1)
- Microbiologie médicale II: stérilisation, diagnostic de laboratoire et réponse immunitaireD'EverandMicrobiologie médicale II: stérilisation, diagnostic de laboratoire et réponse immunitairePas encore d'évaluation
- Cytogenetique pptx-1Document88 pagesCytogenetique pptx-1franck brice badoPas encore d'évaluation
- Les Cellules Lymphoides 08Document36 pagesLes Cellules Lymphoides 08YASMEROPas encore d'évaluation
- Les StreptocoquesDocument48 pagesLes StreptocoquesBel Kis100% (1)
- Exploration Du Metabolisme GlucidiqueDocument40 pagesExploration Du Metabolisme GlucidiqueAbdoulaye sebyPas encore d'évaluation
- UE2 - Entrainement QCM Concours PACES Première Année de MédecineDocument5 pagesUE2 - Entrainement QCM Concours PACES Première Année de Médecinekiki02Pas encore d'évaluation
- Acides NucleiquesDocument31 pagesAcides NucleiquesLaila Home0% (1)
- Le Ionogramme SanguinDocument4 pagesLe Ionogramme Sanguinmerymorenaa100% (2)
- Cours 2 Equilibre Hydrosode-1Document24 pagesCours 2 Equilibre Hydrosode-1Abdoul karim SamakePas encore d'évaluation
- 16-Evaluation de La Duree de Vie D Un Ouvrage en ServiceDocument32 pages16-Evaluation de La Duree de Vie D Un Ouvrage en ServiceJeudi VeritéPas encore d'évaluation
- QCM MonophaseDocument4 pagesQCM MonophaseKryss KéréPas encore d'évaluation
- Manuel START MAX PDFDocument72 pagesManuel START MAX PDFأنور مازوز أبو يوسف50% (2)
- Deuxième Chapitre:: Ionogramme SanguinDocument17 pagesDeuxième Chapitre:: Ionogramme SanguinMohamed BelghaliPas encore d'évaluation
- Anomalies GRDocument27 pagesAnomalies GRsami aidaPas encore d'évaluation
- Anal 2Document13 pagesAnal 2Mrd ArlPas encore d'évaluation
- Métabolisme GlucidiqueDocument2 pagesMétabolisme GlucidiqueAro MandaPas encore d'évaluation
- Equilibre Hydro ElectrolytiqueDocument15 pagesEquilibre Hydro Electrolytiquenipton27Pas encore d'évaluation
- Chapitre8-Homeostasie CompartimentsDocument15 pagesChapitre8-Homeostasie CompartimentsMahamadou Diawara100% (1)
- HBA1 CDocument3 pagesHBA1 CYounesse Al100% (1)
- TD Compartiments Liquidiens S4 2021Document4 pagesTD Compartiments Liquidiens S4 2021yaya camaraPas encore d'évaluation
- Poly 2012-2013Document172 pagesPoly 2012-2013anfelPas encore d'évaluation
- Biochimie EMD 1 - 2018-2019 PDFDocument4 pagesBiochimie EMD 1 - 2018-2019 PDFAisSa KeRrøùùmPas encore d'évaluation
- Immunologie - Approfondie DR MESSAOUDIDocument75 pagesImmunologie - Approfondie DR MESSAOUDIdalila messaoudi100% (1)
- M1 Im 19-20 Sobhi W M1 Imm Cours de Bet DDocument47 pagesM1 Im 19-20 Sobhi W M1 Imm Cours de Bet DBio Bioch100% (1)
- TD Biophysique 2013Document18 pagesTD Biophysique 2013sarraPas encore d'évaluation
- Exploration de La Fonction Hépatique.Document84 pagesExploration de La Fonction Hépatique.Hicham BenaoumPas encore d'évaluation
- Polycope Fluorescence Cours de Chimie Analytique 3eme Année Pharmacie DR KAARARDocument6 pagesPolycope Fluorescence Cours de Chimie Analytique 3eme Année Pharmacie DR KAARARWarda JoryPas encore d'évaluation
- Biochimie Clinique 2 - Rouen - 4e Annee PDFDocument24 pagesBiochimie Clinique 2 - Rouen - 4e Annee PDFdeziri mohamedPas encore d'évaluation
- TD #2 QCM Biochime StructuraleDocument4 pagesTD #2 QCM Biochime StructuraleMERi BPas encore d'évaluation
- Structure Lineaire Et Cyclique Des OsesDocument23 pagesStructure Lineaire Et Cyclique Des Osesjack rousouPas encore d'évaluation
- Synthese de L'hemoglobineDocument12 pagesSynthese de L'hemoglobineMarie-Rose DADJO LOKOSSOUPas encore d'évaluation
- Le Prélèvement NoriaDocument72 pagesLe Prélèvement NoriaNadaPas encore d'évaluation
- Transfusion SanguineDocument46 pagesTransfusion SanguineAziza AskriPas encore d'évaluation
- CytosqueletteDocument24 pagesCytosquelettefellah aminaPas encore d'évaluation
- Cours Chapitre 1 - BiomoléculesDocument13 pagesCours Chapitre 1 - BiomoléculesGrace MM.Pas encore d'évaluation
- Pharmacodynamie Et Interactions MédicamenteusesDocument19 pagesPharmacodynamie Et Interactions MédicamenteusesChaima FatnassiPas encore d'évaluation
- 14 - Heterosides-CardiotoniquesDocument7 pages14 - Heterosides-CardiotoniquesSk CissePas encore d'évaluation
- Diagnostic Biologique Des Leucémies AiguësDocument42 pagesDiagnostic Biologique Des Leucémies Aiguëstmarid100% (1)
- Mémoire Francesca - CopieDocument50 pagesMémoire Francesca - CopieFrancesca WekamPas encore d'évaluation
- BIO 304 - ELECTROPHORESE - Cours 2022Document30 pagesBIO 304 - ELECTROPHORESE - Cours 2022mistic JayPas encore d'évaluation
- QCM MelangeDocument1 pageQCM MelangeAbdo BdaPas encore d'évaluation
- Equilibre Acido BasiqueDocument22 pagesEquilibre Acido Basiquewarda oudghiriPas encore d'évaluation
- Staphylococcus PPT NATECHE 2020Document21 pagesStaphylococcus PPT NATECHE 2020Anya ZakourPas encore d'évaluation
- Chap 1 Les Glucides Structure Et MétabolismeDocument75 pagesChap 1 Les Glucides Structure Et Métabolismeafaf gou100% (1)
- 1ere S1 Physiologie - LE MILIEU INTERIEUR DR Rouatbi SoniaDocument125 pages1ere S1 Physiologie - LE MILIEU INTERIEUR DR Rouatbi Sonianourhene rakroukiPas encore d'évaluation
- 1 - Explorations Biochimiques Des Fonctions HépatiquesDocument6 pages1 - Explorations Biochimiques Des Fonctions HépatiquesFarah B. BtoushPas encore d'évaluation
- 2eme Bio Soufane Séries de TD Immunolgie CorrigéeDocument22 pages2eme Bio Soufane Séries de TD Immunolgie CorrigéeOumia HarbitPas encore d'évaluation
- Le Milieu Intrieur (Équilibre Hydro-Sodé) 1'Document7 pagesLe Milieu Intrieur (Équilibre Hydro-Sodé) 1'MedMan6100% (1)
- Diagnostic Biologique de La Drépanocytose TSS2Document8 pagesDiagnostic Biologique de La Drépanocytose TSS2Cheick SANOUPas encore d'évaluation
- Chapitre IV - GlucidesDocument12 pagesChapitre IV - GlucidesAPas encore d'évaluation
- 5 Substitution Electrophile 2Document11 pages5 Substitution Electrophile 2Bibi BibaPas encore d'évaluation
- Gale DjohanDocument36 pagesGale DjohanSahouin Claude Medard100% (1)
- Biophysique II GroujDocument42 pagesBiophysique II GroujAdonis Serghini100% (1)
- Série de TD 3 de GénétiqueDocument5 pagesSérie de TD 3 de Génétiquedjassa djassaPas encore d'évaluation
- Cours - 1: Définitions, Morphologie Et Structure Des ChampignonsDocument449 pagesCours - 1: Définitions, Morphologie Et Structure Des ChampignonsKellia MvoghePas encore d'évaluation
- 02 Structure Cyclique Des OsesDocument10 pages02 Structure Cyclique Des OsesBook Hunter100% (1)
- Copie de Résumé GC PDFDocument11 pagesCopie de Résumé GC PDFsylvie jacklinePas encore d'évaluation
- 8 Choses À Savoir Sur Le LasikDocument9 pages8 Choses À Savoir Sur Le LasikYASMEROPas encore d'évaluation
- Identite MarqueDocument8 pagesIdentite MarqueYASMEROPas encore d'évaluation
- Ascite (Orientation Diagnostique)Document6 pagesAscite (Orientation Diagnostique)YASMEROPas encore d'évaluation
- Démarche Diagnostic Bactériologique ClassiqueDocument1 pageDémarche Diagnostic Bactériologique ClassiqueYASMEROPas encore d'évaluation
- Manueldeprelevement PDFDocument82 pagesManueldeprelevement PDFYASMEROPas encore d'évaluation
- Biochimie HématologieDocument827 pagesBiochimie HématologieYASMEROPas encore d'évaluation
- Sérologie Streptococcique ASLODocument13 pagesSérologie Streptococcique ASLOYASMERO75% (4)
- Sérodiagnostic de VDRL Et TPHADocument10 pagesSérodiagnostic de VDRL Et TPHAYASMERO100% (2)
- CréativitéDocument313 pagesCréativitéYASMEROPas encore d'évaluation
- Biochimie HématologieDocument827 pagesBiochimie HématologieYASMEROPas encore d'évaluation
- Examens HematologieDocument7 pagesExamens HematologieYASMEROPas encore d'évaluation
- 109 Hair Salon Slogans Et SlogansDocument2 pages109 Hair Salon Slogans Et Slogansequableenthusia3Pas encore d'évaluation
- 2-ECG Normal ÉliteDocument75 pages2-ECG Normal ÉliteNa WelPas encore d'évaluation
- Plan D'activites Enock KatongoDocument20 pagesPlan D'activites Enock Katongofrancis mukendiPas encore d'évaluation
- Gaz de Schist Final Version 2Document142 pagesGaz de Schist Final Version 2amrt100% (1)
- Fiche 1Document5 pagesFiche 1othman okPas encore d'évaluation
- Questionnaires Audit 2Document8 pagesQuestionnaires Audit 2Mahaliana RatolojanaharyPas encore d'évaluation
- UMIH - Loi Anti-Gaspillage Et Pour Une Économie CirculaireDocument10 pagesUMIH - Loi Anti-Gaspillage Et Pour Une Économie CirculaireAnalyPas encore d'évaluation
- ACFrOgAA86SYiZjAK4rZ1OtrddBWXhmAgnE ItJCPswJ5690wN0B9fuqErrESfXl-1TDzU2x96LI24G4kfLfEnqE0RD Nu VrKhTNtu3WpQl3ptDHdnncmqzxzAHF5SldTSlc3IZHywxHZKgd9mNDocument1 pageACFrOgAA86SYiZjAK4rZ1OtrddBWXhmAgnE ItJCPswJ5690wN0B9fuqErrESfXl-1TDzU2x96LI24G4kfLfEnqE0RD Nu VrKhTNtu3WpQl3ptDHdnncmqzxzAHF5SldTSlc3IZHywxHZKgd9mNwahid El baz100% (1)
- Questionnaire Sur Le Bus Doté D'un Diffuseur de ParfumDocument3 pagesQuestionnaire Sur Le Bus Doté D'un Diffuseur de ParfumVincent BallesterPas encore d'évaluation
- Réserve Naturelle Des Gorges de La LoireDocument185 pagesRéserve Naturelle Des Gorges de La LoireAlexandra GalerPas encore d'évaluation
- Armines-Secheresse SyntheseDocument54 pagesArmines-Secheresse SyntheseFredj Ben SalemPas encore d'évaluation
- Katalogs-19-Les Disjoncteurs CompactsDocument54 pagesKatalogs-19-Les Disjoncteurs CompactsNabil Oumalik100% (2)
- NIKON Super Coolscan 4000 ED Notice Manuel Guide Mode EmploiDocument112 pagesNIKON Super Coolscan 4000 ED Notice Manuel Guide Mode EmploiPhilippe GillionPas encore d'évaluation
- Examen Régional PC Tanger 2022 FRDocument4 pagesExamen Régional PC Tanger 2022 FRfan de Disney ChannelPas encore d'évaluation
- PC23 Cycle3-6e - ProgrammeDocument12 pagesPC23 Cycle3-6e - Programmeestelle.buchyPas encore d'évaluation
- MDS2 - 05 - 2022 - Chpre I - Hydraulique Des SolsDocument50 pagesMDS2 - 05 - 2022 - Chpre I - Hydraulique Des SolsMi RaPas encore d'évaluation
- Fiches MO EpurationDocument15 pagesFiches MO EpurationkaoutarPas encore d'évaluation
- ANNEXE 1 Bordereaux de Prix RénovationDocument4 pagesANNEXE 1 Bordereaux de Prix RénovationAO2 TRAVPas encore d'évaluation
- É Preuve Écrite #1 de SVT: Conseils Pour L'épreuveDocument2 pagesÉ Preuve Écrite #1 de SVT: Conseils Pour L'épreuveFirass Biad100% (1)
- 20 1552ea FDISDocument14 pages20 1552ea FDISchili15Pas encore d'évaluation
- Exercices HalogenoalcanesDocument10 pagesExercices HalogenoalcanesJean-François Abena100% (1)
- PrecipitationsDocument12 pagesPrecipitationsBenslimane mahmoudPas encore d'évaluation
- Livret Bonnes Pratiques Prelevement Flacons Bactalert 2019Document6 pagesLivret Bonnes Pratiques Prelevement Flacons Bactalert 2019KadijaaPas encore d'évaluation
- Le Béton EXPOSÉ ANGLAISDocument2 pagesLe Béton EXPOSÉ ANGLAISAMEYREPas encore d'évaluation