Académique Documents
Professionnel Documents
Culture Documents
En Premier Lieu Bis
Transféré par
Rabie Maanani0 évaluation0% ont trouvé ce document utile (0 vote)
92 vues4 pagesTitre original
En premier lieu bis.docx
Copyright
© © All Rights Reserved
Formats disponibles
DOCX, PDF, TXT ou lisez en ligne sur Scribd
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
0 évaluation0% ont trouvé ce document utile (0 vote)
92 vues4 pagesEn Premier Lieu Bis
Transféré par
Rabie MaananiDroits d'auteur :
© All Rights Reserved
Formats disponibles
Téléchargez comme DOCX, PDF, TXT ou lisez en ligne sur Scribd
Vous êtes sur la page 1sur 4
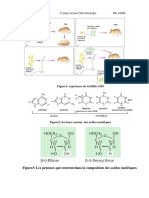
la membrane cellulaire dans tout les organismes vivants a le rôle de maintenir la barrière de
perméabilité de la membrane et la fluidité. La composition de la bicouche phospholipidique de la
membrane est distincte chez les archées par rapport aux bactéries. Dans l'archée, les chaînes latérales
d'hydrocarbures isoprénoïdes sont reliées par un éther à la colonne vertébrale du sn-glycérol-1-
phosphate. Cependant dans les bactéries les chaînes latérales des acides gras sont reliées par un ester à
la colonne vertébrale du sn-glycérol-3-phosphate. Les groupes de têtes polaires sont globalement
partagées dans les archées et les bactéries. De même Les lipides membranaires des archées sont
impliqués dans la survie et l'adaptation des organismes aux environnements extrêmes et aussi pour
constituer la base de la composition membranaire du dernier ancêtre commun LUCA.
Sachant que Les bactéries et les Archées ont une stéréochimie des lipides membranaires opposée
impliquant l’existence d’une membrane hétérochirale instable, une étude récente en l’objet menée par
Caforio et al . conteste l'instabilité prévue d'une membrane hétérochirale .
La présente étude utilise l'ingénierie de E. coli en introduisant une membrane hybride composée des
isoprénoïdes liés à l'éther et d'acides gras qui sont liés à l'ester ,et hétérochiral car ses lipides sont
constitués d'un squelette G1P ou G3P. Grâce à la production régulée à la hausse des éléments
constitutifs des isoprénoïdes et à la coexpression des gènes codant pour la voie de biosynthèse des
lipides archaea de configuration G1P ont été produits à une quantité sans précédente allant à 30% des
phospholipides totaux. Les cellules étaient parfaitement viables avec des taux de croissance normale.
Fait remarquable, les cellules modifiées ont montré une augmentation de leur robustesse à haute
température, au solvant et à la congélation.
La reproduction d’une membrane hétérochirale hybride dans E. coli a été fondée sur la construction
d’une voie composite qui comprend des enzymes bactériennes et archaea (Fig. S1) afin d’avoir de
l'archétidylglycérol (AG) et de l'archétidyléthanolamine (AE) insaturés respectivement homologues du
phosphatidylglycérol (PG) et du phosphatidyléthanolamine (PE) bactériens. Pour obtenir des quantités
élevées de lipides d'éther(EL), la voie MEP-DOXP endogène qui synthèse le pyrophosphate
d'isopentényle (IPP) et le pyrophosphate de diméthylallyle (DMAPP) chez E. coli, a été régulée à la
hausse. Cela avec l’intégration des gènes natifs au macrodomaine "ori" du chromosome (Fig. S2A).
L'effet sur la production d'isoprénoïdes a été testé en combinaison avec les gènes introduits des lipides
d'éther (EL). En utilisant un système de deux vecteurs compatibles ( Fig. S2A), il a été introduit jusqu'à six
gènes de lipides d'éther de diverses espèces (GGPP synthase, G1P déshydrogénase, GGGP synthase,
DGGGP synthase, CDP et PS phosphatidylsérine synthase) ( tableau S2) en E. coli, donnant les souches
IDI+EL+ et MEP/DOXP+EL+. Pour la fixation du groupe de tête polaire, les enzymes endogènes Psd, PgsA
et PgpA d'E. coli, plus la PssA de B. subtilis, ont été utilisées pour reconnaître les dérivés d'archaea ( Fig.
S1). L'augmentation de la production d'IPP et de DMAPP a stimulé de façon spectaculaire la synthèse
d'AG (Fig. S2B). Cependant de faibles quantités d'AE ont été constatées. Les tentatives d'amélioration de
la synthèse d'AE par l'utilisation de différents sites de fixation des ribosomes pour la pssA ou l'ajout de L-
sérine au milieu de croissance ont échoué probablement par la surproduction des niveaux élevés de PE
due à l’enzyme PssA de B. subtilis qui synthétisait le PE et l'AE. Donc les niveaux élevés de PE qui est un
lipide non bicouche toxique a entravé la croissance cellulaire.
La souche MEP/DOXP+EL+ d'E. coli a été optimisée pour la croissance et l'induction afin d'obtenir les
plus grandes quantités possibles d'AG.Une production accrue d'AG a été observée lors de la plantation
des cellules dans un milieu statistiquement optimisé (figure S3A) parallèlement à leur induction tôt au
parcours de la croissance (figure S3B). Le réglage de la concentration d'isopropyl-β-d-1-
thiogalactopyranoside (IPTG), qui contrôle l'expression des gènes hétérologues a montré que les
quantités plus faibles d'IPTG entraînent une fraction lipidique AG plus élevée. La teneur en PG native a
diminué de 30 % dans le type sauvage et à 3 % lorsque la souche a été induite avec 10 μM IPTG (Fig. 1B),
tandis que les niveaux de cardiolipine (CL) ont augmenté (Fig. 1A). Parallèlement, la teneur en PG a
augmenté jusqu'à 23 % de la fraction totale des phospholipides. Des quantités plus élevées d'IPTG (50-
100 μM) n'ont pas entraîné une nouvelle augmentation de la fraction lipidique AG, mais ont provoqué
une augmentation de la synthèse globale des lipides (Fig. S3C). La diminution remarquable de la teneur
en PG en faveur de l'AG démontre l'intégration fonctionnelle de la voie de biosynthèse des lipides
d'éther dans E. coli. Il est important de noter que la souche hybride de membrane hétérochirale est
restée stable après un transfert en série, puisque la souche produisait encore des lipides d'éther en
présence de 10 µM d'IPTG. Il est à signaler que la quantité d'AG produite a augmenté jusqu'à 30% du
lipidome bactérien total par rapport à la souche non induite où le niveau d'AG est resté
approximativement constant (Fig. S4).
Les enzymes G3PDH et G1PDH, utilisées respectivement dans la synthèse de G3P et G1P, ne partagent
aucune homologie structurelle ou fonctionnelle car elles font partie de familles de protéines sans lien
avec l'évolution. Pour s'assurer que la stéréochimie lipidique archaea correcte une souche a été
construite sans la G1PDH (E. coli MEP/DOXP+EL+AraM-), le résultat a été étonnante, car des niveaux
encore substantiels d'AG ont été détectés (18 %), légèrement moins que la souche contenant G1PDH
(l'araM) (23 %). Cela implique que E. coli produit du G1P soit par elle-même, soit par la voie composite
des lipides d'éther contenant des enzymes comme L'acyltransférase (PlsB) caractérisée par une stricte
stéréosélectivité capable d'utiliser la G3P.
L'analyse biochimique utilisant le GGGPS purifié de M. maripaludis ne révèle qu'une modeste préférence
(huit fois) pour le G1P par rapport au G3P. Cependant, malgré cette faible stéréosélectivité, les lipides
archaea synthétisés in vivo à partir des souches d'E. coli modifiées se sont avérés avoir une configuration
G1P, ce qui indique que l'ensemble des enzymes de biosynthèse des lipides d'éther utilisées
sélectionnent G1P comme épine dorsale. Comme cela se produit également en l'absence de la G1PDH
(AraM), cela implique que E. coli possède de manière inattendue un mécanisme natif de formation de
G1P, une caractéristique qui n'a jamais été signalée auparavant.
La membrane conçue avec un pourcentage élevé de G3P sans précédent nous a permis d'étudier l'effet
d'une telle membrane hybride sur le taux de croissance, la viabilité des cellules et la robustesse. Les
souches bactériennes modifiées présentent une longue phase de latence de ∼16h avant le début de la
croissance, mais leur taux de croissance est finalement comparable à celui de la souche de type sauvage.
Le séquençage du génome de la souche induite et adaptée n'a révélé aucune mutation impliquée dans
le métabolisme central ou la synthèse des phospholipides. La phase de latence pourrait donc être le
résultat d'une adaptation métabolique de la souche bactérienne et/ou d'un ajustement de l'expression
d'enzymes hétérologues pour la production viable de lipides d'éthers archaea. D'autre part, la forte
induction de la voie de biosynthèse des lipides archéens a provoqué la ralentie de la croissance
cellulaire et le changement de sa morphologie de façon spectaculaire. Alors que la majorité des cellules
modifiées présentent des cellules allongées et plus fines que celles de la souche sauvage, une forte
induction a entraîné la formation d'appendices lobulaires qui sont finalement libérés des cellules.
L'analyse des extrusions isolées a révélé la présence d'un mélange de lipides archaea et bactériens très
proche de la cellule mère, et a écarté l’implication de l'immiscibilité avec les lipides bactériens
endogènes et la ségrégation des lipides archaea comme cause de ce phénomène. Les extrusions
contiennent également du matériel génétique et proviennent probablement d'une division cellulaire
non symétrique causée par le niveau élevé de biosynthèse des lipides, ce qui est cohérent avec le rôle
important des lipides dans la division cellulaire . Comme la voie de biosynthèse des lipides de l'éther
introduite n'est pas totalement intégrée dans l'homéostasie cellulaire et phospholipidique, il a été
supposé que le broyage abondant observé dans des conditions de forte induction est le résultat du
niveau élevé de surproduction de lipides qui ne suit pas le rythme des autres processus de croissance
cellulaire, ce qui entraîne, par exemple, la formation de sites de division irréguliers.
Bref, il a été exprimé que l'abondant broyage qui se produit lors d'une forte induction est le résultat
d'une surproduction de lipides qui ne suit pas le rythme des autres processus de croissance cellulaire, ce
qui entraîne des perturbations physiologiques, notamment des sites de division irréguliers. Par
conséquent, dans la suite de l'étude, les cellules ont été induites avec 10 μM IPTG pour examiner les
conséquences physiologiques indépendamment de la morphologie cellulaire aberrante.
L'impact du choc thermique et du froid sur la survie des souches à membranes hétérochirales hybrides a
été testé. Des souches d'E. coli de type sauvage et deux souches modifiées [JM109 (DE3), MEP/DOXP+,
MEP/DOXP+EL+] ont été exposées à des températures élevées pendant 2 minutes et ont pu se rétablir
pendant 1 heure à 37 °C. La souche MEP/DOXP+EL+ d'E. coli non induite et induite (10 μM IPTG) a
montré une survie globale élevée lors d'une exposition à 55 °C et 58 °C par rapport aux deux souches
témoins JM109(DE3) et E. coli MEP/DOXP+ qui ne survivent pas lorsqu'elles sont exposées à des
températures supérieures à 50 °C (Fig. 5A). Les cellules ont également été exposées à la congélation et à
la décongélation (-80 °C). Les cellules induites avec 10 μM IPTG ont été remarquablement plus
tolérantes. Enfin, la tolérance au solvant organique l-butanol a été testée en exposant les souches
pendant 1 h à différentes concentrations. Une résistance plus élevée a été observée dans la souche
MEP/DOXP+EL+ d'E. coli non induite et induite (10 μM IPTG), qui abrite la totalité de la voie de
biosynthèse des lipides de l'archaebactérie, par rapport aux témoins (figure 5C). Ce résultat a été
particulièrement remarquable lorsque les cellules ont été traitées avec 2 % de l-butanol. Il est important
de noter que lors de faibles niveaux d'induction, la production de lipides AG n'est pas toxique pour la
cellule bactérienne, mais rend les cellules plus résistantes à différents types de stress
chimiques/physique.
Cette etude rapporte un niveau élevé de lipides membranaires archée dans une souche génétiquement
modifiée de E. coli obtenue par la régulation à la hausse la voie synthétique isoprénoïde endogène
MEP-DOXP, associée à l’introduction et l’ expression de plusieurs gènes clés de la voie de biosynthèse
des lipides archées( E. coli MEP/DOXP + EL). Parmi les dits gènes, la géranylgéranyl disphosphate
synthase(GGPPS) qui catalyse la synthèse de GGPP à partir du diphosphate d'isopentényle et du
diphosphate de diméthylallyle (éléments constitutifs obtenus par la voie isoprénoïde) ; G1PDH pour
synthétiser le G1P ; homologues archée du géranylgéranylglycéryle (GGGP) et du phosphate de
digéranylgéranylglycéryle (DGGGP) synthétisant les deux liaisons éther entre les chaînes latérales des
isoprénoïdes,et une CDP-archéol synthase remplaçant le groupe phosphate du DGGGP insaturé par une
CDP générant du CDP-DGGGP insaturé. Aussi, l’étude aborde une augmentation allant jusqu'à 30% des
lipides de la membrane archée (c'est-à-dire l'archétidylglycérol, AG) qui détriment du
phosphatidylglycérol (PG), le lipide de la membrane bactérie. En outre, la membrane hétérochirale
hybride est restée stable après des transferts en série, ce qui indique que la présence significative d'AG
n'était pas toxique pour la cellule bactérie. D'autre part, les cellules exprimant la voie de biosynthèse
des lipides archaea avaient une morphologie cellulaire différente, légèrement plus allongée que la
normale. Une forte induction de la voie de biosynthèse des lipides de l'archée a conduit à des
changements majeurs de la morphologie cellulaire avec la formation d'appendices bourgeonnants qui
ont finalement été libéré de la cellule. Aussi, il a été confirmé que ces renflements isolés ont été formés
par des archées et des les lipides des membranes bactéries en écartant la possibilité d'une ségrégation
des lipides des membanes archées. En sus, il a été constaté que les cellules membranaires
hétérochirales avaient une plus grande tolérance à la chaleur, et contre les solvants organiques et la
congélation ce qui démontre que ces cellules sont capables de s’adapter avec l’environnement
extérieur. De même à signaler que lors des contrôles de l’expérience en l’absence de G 1PDH, mais en
présence du reste des gènes de biosynthèse des lipides d’archée, les lipides AG avaient encore la
stéréochimie du lipide G1P. Cela suggère que la bactérie E. coli recèle un mécanisme encore inconnu et
sans précédent pour synthétiser la G1P. Cela remet fondamentalement en question la ségrégation de la
stéréochimie du squelette du glycérol dans les lipides membranaires entre les bactéries et les archées.
Malheureusement, la stéréochimie de ses lipides n'a jamais été analysée, mais au vu des résultats de la
présente étude, il est possible que les archées disposent également d'une voie alternative pour
synthétiser les lipides membranaires (G1P). Récemment, il a été démontré que deux groupes d'archéens
non cultivés, à savoir le groupe des euryarchaeota marins et des Lokiarchaeota, descendants de
l'ancêtre des archéens menant aux eucaryotes, contiennent les gènes de synthèse des lipides des
archées ainsi que ceux nécessaires à la formation d'acides gras de type bactéries et de liaisons esters .
Cependant, ils ne possèdent pas non plus la G1PDH pour synthétiser le squelette G1P, mais produisent
plutôt du G3P, ce qui suggère qu'ils ont le potentiel de synthétiser des membranes hétérochirales
hybrides. Ces découvertes, ainsi que la présente étude proposent que les membranes lipidiques
hétérochirales pourraient ne pas être une exception, ni une courte étape transitoire instable dans
l'évolution des membranes cellulaires, mais plutôt une étape plus mécanisme commun qui pensait
exister auparavant. Finalement, l’étude fournit un modèle d'E. coli synthétisant un lipide hybride
hétérochiral qui peut maintenant être testée de manière plus approfondie pour les processus
biotechnologiques. Les études futures devraient consacrer des efforts pour mieux prendre en compte
les avantages physiologiques d'un hybride hétérochiral des membranes à la lumière des implications
dans l'évolution de l'acquisition des lipides membranaires au début de la vie voir même dans la
transformation d’une bactérie pathogène à une bactérie-archée stérile .
Vous aimerez peut-être aussi
- Proteine GDocument11 pagesProteine Gmouhamed el mehdi mouatez latrechePas encore d'évaluation
- BVS MG 034 LakhalDocument3 pagesBVS MG 034 LakhalNoussiba BougheraraPas encore d'évaluation
- S SVT Obligatoire 2019 Polynesie CorrigeDocument8 pagesS SVT Obligatoire 2019 Polynesie CorrigeKahina MallilPas encore d'évaluation
- Epigenetique C1-1Document3 pagesEpigenetique C1-1raabePas encore d'évaluation
- Les Protéomes Du FoieDocument41 pagesLes Protéomes Du FoieLamis HamouyPas encore d'évaluation
- Cours MRE SORODocument21 pagesCours MRE SOROAlexandre OuffouePas encore d'évaluation
- Cours Système Endomembranaire 2021 2022Document9 pagesCours Système Endomembranaire 2021 2022samysaib79Pas encore d'évaluation
- ErythropoeeseDocument3 pagesErythropoeeseyou.saqriPas encore d'évaluation
- Cours Visvikis 08:02Document9 pagesCours Visvikis 08:02Manon righiniPas encore d'évaluation
- 373Document10 pages373ghania DeKPas encore d'évaluation
- Cours 3è TL BC Appliquée VF 2023Document63 pagesCours 3è TL BC Appliquée VF 2023Ousmane SyllaPas encore d'évaluation
- 12 Bactéries Lactiques Et Métabolismes Fermentaires PDFDocument5 pages12 Bactéries Lactiques Et Métabolismes Fermentaires PDFFahroudinePas encore d'évaluation
- Chapitre III. Catabolismes Des GlucidesDocument10 pagesChapitre III. Catabolismes Des GlucidesBenzaid BatoulPas encore d'évaluation
- Biosynthèse Des Lipides MembranairesDocument7 pagesBiosynthèse Des Lipides Membranaireslabidiridha8Pas encore d'évaluation
- L e CholestérolDocument6 pagesL e CholestérolLe IlaPas encore d'évaluation
- Le Réseau EndomembranaireDocument5 pagesLe Réseau EndomembranaireEva BrovedaniPas encore d'évaluation
- Chapitre I Membrane PlasmiqueDocument17 pagesChapitre I Membrane Plasmiquesbbmxb4csdPas encore d'évaluation
- L3 - 2019 - 2020 - Chapitre. 2 Erythropoièse Et ErythrocytesDocument15 pagesL3 - 2019 - 2020 - Chapitre. 2 Erythropoièse Et ErythrocytesSerigne Saliou NdourPas encore d'évaluation
- Expose RDocument1 pageExpose REm MaPas encore d'évaluation
- Phospholipid eDocument2 pagesPhospholipid esalmabahjaoui32Pas encore d'évaluation
- Hypothèse ThéoriqueDocument3 pagesHypothèse ThéoriqueFifi SolaPas encore d'évaluation
- La Fermentation Du LaitDocument6 pagesLa Fermentation Du LaitValéry Epee EbonguePas encore d'évaluation
- Regulation de La Fixation Symbiotique D'azoteDocument8 pagesRegulation de La Fixation Symbiotique D'azoteImène Ben Salah SoltaniPas encore d'évaluation
- WWW Cours Pharmacie Com Biochimie Metabolisme Des Glucides HDocument17 pagesWWW Cours Pharmacie Com Biochimie Metabolisme Des Glucides HMerahi AbdelDjalilPas encore d'évaluation
- Projet CarlDocument3 pagesProjet CarlNadinePas encore d'évaluation
- MetabolismeDocument19 pagesMetabolismeKa Tia100% (1)
- 2021COAZ6025Document159 pages2021COAZ6025Lenz Daniel Jean PaulPas encore d'évaluation
- cour régulation des gènes université mentouriDocument16 pagescour régulation des gènes université mentourimonecole2018Pas encore d'évaluation
- Généralités Sur Le MétabolismeDocument4 pagesGénéralités Sur Le Métabolismeaicha58012Pas encore d'évaluation
- Cours Finale Régulation EnzymatiqueDocument46 pagesCours Finale Régulation EnzymatiqueAGUEZLANE NOURPas encore d'évaluation
- Va Lefevre Carine 18032013Document266 pagesVa Lefevre Carine 18032013oumkairouPas encore d'évaluation
- AgroalimentaireDocument13 pagesAgroalimentaireWafaa ZagharyPas encore d'évaluation
- UE2 - Biologie Cellulaire - Le CytosolDocument11 pagesUE2 - Biologie Cellulaire - Le Cytosolsun-nee-chan9Pas encore d'évaluation
- Biogénèse Des Monoterpènes II - La Chaîne IsopréniqueDocument21 pagesBiogénèse Des Monoterpènes II - La Chaîne IsopréniqueZouhair GharboubPas encore d'évaluation
- Phosphatases Et Gamma - Glutamyl TransféraseDocument35 pagesPhosphatases Et Gamma - Glutamyl TransféraseJlizi MalekPas encore d'évaluation
- 6 - ProstaglandinesDocument10 pages6 - Prostaglandinesdjamila benaissaPas encore d'évaluation
- Organisation Et Diversité Des Génomes ProcaryotesDocument23 pagesOrganisation Et Diversité Des Génomes Procaryotessamir ouabdelkaderPas encore d'évaluation
- 2015 EdwigeArnold PDFDocument144 pages2015 EdwigeArnold PDFMūšť ÃphæPas encore d'évaluation
- YousraDocument10 pagesYousraSarah SisiPas encore d'évaluation
- EnzymeDocument8 pagesEnzymefifi fifiPas encore d'évaluation
- Métabolisme Des Céramides Hypothalamiques Induit Une Résistance À L'insulineDocument356 pagesMétabolisme Des Céramides Hypothalamiques Induit Une Résistance À L'insulinemayassi kellyPas encore d'évaluation
- Cours BMGG 2018Document43 pagesCours BMGG 2018Fares ManelPas encore d'évaluation
- EpigenetiqueDocument4 pagesEpigenetiqueLyes BazaPas encore d'évaluation
- Chapitre 2 Cultures Cellulaires - 231020 - 164605Document4 pagesChapitre 2 Cultures Cellulaires - 231020 - 164605maria.toumi2109Pas encore d'évaluation
- U4-B01. Exploration Des Proteines Plasmatiques (Poly) - 1Document14 pagesU4-B01. Exploration Des Proteines Plasmatiques (Poly) - 1alimkettouchePas encore d'évaluation
- Le Systeme Endomembranaire Réticulum Endoplasmique, Appareil de Golgi, LysosomesDocument22 pagesLe Systeme Endomembranaire Réticulum Endoplasmique, Appareil de Golgi, LysosomesAy ManPas encore d'évaluation
- BiochimieDocument11 pagesBiochimieThéophile NAMOINEPas encore d'évaluation
- 5'nucléotidaseDocument5 pages5'nucléotidaseMezouar AbdennacerPas encore d'évaluation
- La Gluconéogenèse: Une Vo1e Métabolique Essentielle Au Maintien de L 'Homéostasie Glucidique Du Nouveau-NéDocument10 pagesLa Gluconéogenèse: Une Vo1e Métabolique Essentielle Au Maintien de L 'Homéostasie Glucidique Du Nouveau-Néhenocktona269Pas encore d'évaluation
- Série 1 CorrectionDocument21 pagesSérie 1 CorrectionRidouan EL KalmouniPas encore d'évaluation
- Selection Microbienne Pour Les Bacteries Accumulant Le PolyphosphateDocument10 pagesSelection Microbienne Pour Les Bacteries Accumulant Le PolyphosphateAbuawniPas encore d'évaluation
- Bioch Pharm2an-Metabolisme GlucidesDocument28 pagesBioch Pharm2an-Metabolisme GlucidesmaryPas encore d'évaluation
- TD #5: Synthèse Des Protéines de Sécrétion Au Niveau Du REGDocument7 pagesTD #5: Synthèse Des Protéines de Sécrétion Au Niveau Du REGAy ManPas encore d'évaluation
- Métabolisme de BaseDocument6 pagesMétabolisme de BaseaxelPas encore d'évaluation
- 2 - Généralités Lipides 2Document6 pages2 - Généralités Lipides 2nour achkarPas encore d'évaluation
- Génétique Et ÉpigénétiqueDocument41 pagesGénétique Et ÉpigénétiqueAdli OthmanePas encore d'évaluation
- Internet Scientifique ExposéDocument25 pagesInternet Scientifique ExposérelebohiledavePas encore d'évaluation
- Valorisation Du Lactoserum Par La Production de LeDocument8 pagesValorisation Du Lactoserum Par La Production de LeFahroudinePas encore d'évaluation
- Acide AcétiqueDocument2 pagesAcide AcétiqueRabie MaananiPas encore d'évaluation
- Acide AcétiqueDocument2 pagesAcide AcétiqueRabie MaananiPas encore d'évaluation
- TLCDocument7 pagesTLCRabie MaananiPas encore d'évaluation
- TLCDocument7 pagesTLCRabie MaananiPas encore d'évaluation
- Fiche Extraction DentaireDocument2 pagesFiche Extraction DentaireFzPas encore d'évaluation
- Analyses Physico-Chimiques de L'eau D'irrigation - Contribution À La Mise en Place de La Norme ISO 17025:2017Document71 pagesAnalyses Physico-Chimiques de L'eau D'irrigation - Contribution À La Mise en Place de La Norme ISO 17025:2017Abbassi100% (1)
- Répondre À Une de Réclamation - Récapitulatif-1Document3 pagesRépondre À Une de Réclamation - Récapitulatif-1yousra.debdoubiPas encore d'évaluation
- Bapteme Du Seigneur-2Document2 pagesBapteme Du Seigneur-2Anna toukamPas encore d'évaluation
- PFE PPT Marketing Digital V01Document36 pagesPFE PPT Marketing Digital V01tben innovationPas encore d'évaluation
- P251 Activités DétailléesDocument10 pagesP251 Activités DétailléesAsma LakhalPas encore d'évaluation
- F32 - Construction de TrottoirsDocument18 pagesF32 - Construction de TrottoirsreefreefPas encore d'évaluation
- Examen de Contrôle 2015 - M1-Evaluation & Fusions (Enoncé Et Corrigé)Document5 pagesExamen de Contrôle 2015 - M1-Evaluation & Fusions (Enoncé Et Corrigé)kais kaPas encore d'évaluation
- Corrigé Cahier de Fin Dannée (Démos + Conjectures)Document9 pagesCorrigé Cahier de Fin Dannée (Démos + Conjectures)wiliamli888Pas encore d'évaluation
- Passage D Un Moteur 4D56 100cv en 115cvDocument20 pagesPassage D Un Moteur 4D56 100cv en 115cvKhelefi OussamaPas encore d'évaluation
- Optimisez Votre Plate-Forme LogistiqueDocument674 pagesOptimisez Votre Plate-Forme LogistiqueK B-g B-g100% (4)
- Harnais de SécuritéDocument1 pageHarnais de SécuritéLiban AimoulPas encore d'évaluation
- Cours Optique Chap 2Document14 pagesCours Optique Chap 2Sellé GueyePas encore d'évaluation
- TD 03 CorrigéDocument5 pagesTD 03 CorrigéIbtissam Ait ighoudPas encore d'évaluation
- PaddAn2 PaddAn2 - Vocabulaire Mathématiques - Calcul de BaseDocument24 pagesPaddAn2 PaddAn2 - Vocabulaire Mathématiques - Calcul de BasePaddAn2 PaddAn2Pas encore d'évaluation
- Chemin de Croix Du Temps de Carême 2024Document88 pagesChemin de Croix Du Temps de Carême 2024osvaldoPas encore d'évaluation
- Corrige E2 Juin 2009Document26 pagesCorrige E2 Juin 2009Houcine RtimiPas encore d'évaluation
- Lettre de Motivation PONTICELLI Vithushan PRAHASPATHYDocument1 pageLettre de Motivation PONTICELLI Vithushan PRAHASPATHYFdd FddfdPas encore d'évaluation
- Blindage FB4+Document51 pagesBlindage FB4+Walid DridiPas encore d'évaluation
- 04 Exos Derivabilite ConvexiteDocument3 pages04 Exos Derivabilite ConvexiteRamirez BlascoPas encore d'évaluation
- Correcteur PIDDocument8 pagesCorrecteur PIDSalem FaresPas encore d'évaluation
- 3300 StasDocument11 pages3300 Stasimmobilière providencePas encore d'évaluation
- Bilan Social PDFDocument46 pagesBilan Social PDFidrissa dioum100% (3)
- HomogDocument21 pagesHomogaeroartonlinePas encore d'évaluation
- Rapport de StageDocument57 pagesRapport de StageTãdj ĘddïnėPas encore d'évaluation
- L'Orient Des Femmes Dossier de PresseDocument25 pagesL'Orient Des Femmes Dossier de PresseJason WhittakerPas encore d'évaluation
- Le Solaire Photovoltaïque Raccordé Au RéseauDocument31 pagesLe Solaire Photovoltaïque Raccordé Au Réseausalem BEN MOUSSA100% (1)
- Groupe Électrogène Diesel Industriel - 50 HZ: Caractéristiques Générales KOHLER, Haute QualitéDocument9 pagesGroupe Électrogène Diesel Industriel - 50 HZ: Caractéristiques Générales KOHLER, Haute QualitéMohamed Bachir EL GHRIBPas encore d'évaluation
- Hypertension Artérielle Aux Urgences Poussée d'HTA Et Crise Hypertensive ThoracotomieDocument20 pagesHypertension Artérielle Aux Urgences Poussée d'HTA Et Crise Hypertensive ThoracotomiegeraldegnonPas encore d'évaluation
- Conduites Forgées: M. /uguste Bouchayer, Surles Conduites Métalliques, L'auDocument6 pagesConduites Forgées: M. /uguste Bouchayer, Surles Conduites Métalliques, L'aulhabsPas encore d'évaluation
- Secrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieD'EverandSecrets ancestraux d'un maître guérisseur: Un sceptique occidental, un maître oriental et les plus grands secrets de la vieÉvaluation : 5 sur 5 étoiles5/5 (2)
- Anatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsD'EverandAnatomie & 100 étirements essentiels pour le running: Principes de base, Techniques, Tableaux de séries, Précautions à prendre, Conseils, Programmes d'étirementsPas encore d'évaluation
- La vie des abeilles: Prix Nobel de littératureD'EverandLa vie des abeilles: Prix Nobel de littératureÉvaluation : 4 sur 5 étoiles4/5 (41)
- Enseigner une Langue Etrangère Par l’Apprentissage HybrideD'EverandEnseigner une Langue Etrangère Par l’Apprentissage HybridePas encore d'évaluation
- Électrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsD'EverandÉlectrotechnique | Pas à Pas: Bases, composants & circuits expliqués pour les débutantsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Améliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesD'EverandAméliorer votre mémoire: Un Guide pour l'augmentation de la puissance du cerveau, utilisant des techniques et méthodesÉvaluation : 5 sur 5 étoiles5/5 (2)
- La Pensée Positive en 30 Jours: Manuel Pratique pour Penser Positivement, Former votre Critique Intérieur, Arrêter la Réflexion Excessive et Changer votre État d'Esprit: Devenir une Personne Consciente et PositiveD'EverandLa Pensée Positive en 30 Jours: Manuel Pratique pour Penser Positivement, Former votre Critique Intérieur, Arrêter la Réflexion Excessive et Changer votre État d'Esprit: Devenir une Personne Consciente et PositiveÉvaluation : 4.5 sur 5 étoiles4.5/5 (12)
- Harmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020D'EverandHarmonisation Energétique des Lieux: Habitat et haut-lieux sacrés 2020Évaluation : 2.5 sur 5 étoiles2.5/5 (3)
- Le livre de la mémoire libérée : Apprenez plus vite, retenez tout avec des techniques de mémorisation simples et puissantesD'EverandLe livre de la mémoire libérée : Apprenez plus vite, retenez tout avec des techniques de mémorisation simples et puissantesÉvaluation : 4 sur 5 étoiles4/5 (6)
- Force Mentale et Maîtrise de la Discipline: Renforcez votre Confiance en vous pour Débloquer votre Courage et votre Résilience ! (Comprend un Manuel Pratique en 10 Étapes et 15 Puissants Exercices)D'EverandForce Mentale et Maîtrise de la Discipline: Renforcez votre Confiance en vous pour Débloquer votre Courage et votre Résilience ! (Comprend un Manuel Pratique en 10 Étapes et 15 Puissants Exercices)Évaluation : 4.5 sur 5 étoiles4.5/5 (28)
- L'Interprétation des rêves de Sigmund Freud: Les Fiches de lecture d'UniversalisD'EverandL'Interprétation des rêves de Sigmund Freud: Les Fiches de lecture d'UniversalisPas encore d'évaluation
- Hypnotisme et Magnétisme, Somnambulisme, Suggestion et Télépathie, Influence personnelle: Cours Pratique completD'EverandHypnotisme et Magnétisme, Somnambulisme, Suggestion et Télépathie, Influence personnelle: Cours Pratique completÉvaluation : 4.5 sur 5 étoiles4.5/5 (8)
- Anatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursD'EverandAnatomie & 100 étirements essentiels: Techniques, Bénéfices attendus, Précautions à prendre, Conseils, Tableaux de séries, DouleursPas encore d'évaluation
- Essai sur le libre arbitre: Premium EbookD'EverandEssai sur le libre arbitre: Premium EbookÉvaluation : 4 sur 5 étoiles4/5 (1)
- Puissance naturelles - Que faire si votre "meilleure partie" est en grève?: Puissance naturelles-améliorer les recours pour augmenter la virilité de la capacité à obtenir une érection de fermetéD'EverandPuissance naturelles - Que faire si votre "meilleure partie" est en grève?: Puissance naturelles-améliorer les recours pour augmenter la virilité de la capacité à obtenir une érection de fermetéÉvaluation : 3.5 sur 5 étoiles3.5/5 (3)
- Semer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumeD'EverandSemer avec succès pour rassembler avec abundance. Jardin organique et synergique: Calcul des meilleurs jours pour l'ensemencement de chaque légumePas encore d'évaluation
- Introduction à la psychologie des émotions: De Darwin aux neurosciences: découvrir les émotions et leur mode de fonctionnementD'EverandIntroduction à la psychologie des émotions: De Darwin aux neurosciences: découvrir les émotions et leur mode de fonctionnementPas encore d'évaluation
- 20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsD'Everand20 Véritables remèdes de nos grands-mères pour maigrir vite et enfin perdre du poidsÉvaluation : 5 sur 5 étoiles5/5 (1)
- Cahier de jeux de stimulation cognitive: Sujets Alzheimer, désorientés, démences, amnésiesD'EverandCahier de jeux de stimulation cognitive: Sujets Alzheimer, désorientés, démences, amnésiesPas encore d'évaluation
- La Magie Blanche et Noire: La Science de la Vie Terrestre et de la Vie Infinie - Contenant des conseils pratiques pour les étudiants de l'occultismeD'EverandLa Magie Blanche et Noire: La Science de la Vie Terrestre et de la Vie Infinie - Contenant des conseils pratiques pour les étudiants de l'occultismeÉvaluation : 5 sur 5 étoiles5/5 (1)
- Cancer - Leucémie: Et autres maladies apparemment incurables, mais guérissables avec des moyens naturelsD'EverandCancer - Leucémie: Et autres maladies apparemment incurables, mais guérissables avec des moyens naturelsPas encore d'évaluation
- L'analyse des données de sondage avec SPSS: Un guide d'introductionD'EverandL'analyse des données de sondage avec SPSS: Un guide d'introductionPas encore d'évaluation
- Aimez-Vous en 12 Étapes Pratiques: Un Manuel pour Améliorer l'Estime de Soi, Prendre Conscience de sa Valeur, se Débarrasser du Doute et Trouver un Bonheur VéritableD'EverandAimez-Vous en 12 Étapes Pratiques: Un Manuel pour Améliorer l'Estime de Soi, Prendre Conscience de sa Valeur, se Débarrasser du Doute et Trouver un Bonheur VéritableÉvaluation : 5 sur 5 étoiles5/5 (4)