Académique Documents
Professionnel Documents
Culture Documents
TD N°14 Carbonyle
Transféré par
RobertoTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
TD N°14 Carbonyle
Transféré par
RobertoDroits d'auteur :
Formats disponibles
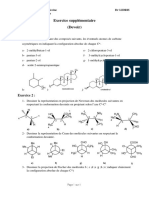
Activation électrophile des groupes carbonyles Feuille d’exercices
n°14
Contenus Capacités exigibles
Activation électrophile du groupe Expliquer qualitativement
carbonyle l’augmentation de l’électrophilie du
groupe carbonyle par protonation.
Acétalisation des aldéhydes et des A
cétones : conditions expérimentales Discuter la régiosélectivité de la
(APTS, appareil de Dean-Stark), réaction d’hémiacétalisation du Exercice 3 : Transacétalisation ()
mécanisme limite de l’acétalisation en glucose.
milieu acide. Interpréter l’isomérisation du Proposer un mécanisme pour la transformation :
glucopyranose par le caractère
Hémiacétalisation acido-catalysée du
glucose, mécanisme limite. renversable de l’hémiacétalisation. O
O O O
HO H OH
Exercice 1 : Formation d’acétal ()
Donner les formules semi-développées ou topologiques des molécules A, B et C.
Exercice 4 ()
1. Donner le nom systématique du rhamose naturel,
représenté ci-contre, en précisant les stéréodescripteurs de
chaque carbone asymétrique.
2. Le rhamose n’est pas stable en chaine ouverte et se referme pour former un
hémiacétal cyclique à 6 maillons. Représenter cet hémiacétal sans indiquer la
stéréochimie et indiquer le mécanisme de la réaction.
3. Indiquer combien de stéréoisomères peuvent se former et les représenter.
Quelle relation d’isomérie les unit ?
Exercice 5 ()
Le fructose est un sucre que l'on trouve en
abondance dans les fruits et le miel. Sa formule
semi-développée, donnée ci-contre, fait apparaître
une fonction cétone. Le fructose n’est pas stable en
chaine ouverte et se referme pour former un
Exercice 2 : Analyse rétrosynthétique () hémiacétal cyclique à 5 (forme furanose) ou 6
(forme pyranose) chainons. Représenter les
On s’intéresse à la molécule A ci-dessous. Proposez une synthèse de A. Préciser le différentes formes cycliques obtenues, en
mécanisme et les conditions expérimentales. indiquant pour chacune le nombre de
stéréoisomères qui peuvent se former.
PCSI Page 1 sur 2
Activation électrophile des groupes carbonyles Feuille d’exercices
n°14
Exercice 6 : Analyse rétrosynthétique de la synthèse de la frontaline 2. On part de la forme G1S pure à Cm0 = 1,0 g.mL-1. A l’aide d’un polarimètre
() munie d’une cuve de L = 1,0 dm, on mesure à l’équilibre un pouvoir rotatoire =
+ 52,7°. En déduire les pourcentages des deux formes à l’équilibre. Justifier ces
La (-)-frontaline ci-dessous, est une molécule de communication chez certains importances relatives.
insectes comme le scarabée Dendroctonus frontalis Zimmermann, parasite des
pins nord-américains. On donne les pouvoirs rotatoires spécifiques :
[(1S)] = + 112 °.dm-1.g-1.mL [(1R)] = + 18,7 °.dm-1.g-1.mL.
Exercice 8 : Transacétalisation (bonus) ()
Dans les conditions réactionnelles suivantes, la réaction conduit à un acétal.
1. Quel est le groupe fonctionnel présent dans la molécule de frontaline ? Comment a-t-il été formé ? (Vous ne disposez que des réactifs présents ci-
2. L’ultime étape d’une synthèse de la frontaline a nécessité l’utilisation d’une dessous)
molécule précurseur notée P. Donner la formule de P, la représenter en indiquant
la configuration absolue du ou des atomes de carbone asymétriques. Quels sont
les groupes fonctionnels présents dans la molécule P ?
Exercice 7 ()
Les deux anomères et du glucose, notés respectivement G1S et G1R, sont
isolables purs à l’état solide, mais ils s’interconvertissent en solution aqueuse
selon la réaction de mutarotation du glucose :
G1S G1R
1. Proposer un mécanisme pour leur interconversion.
PCSI Page 2 sur 2
Vous aimerez peut-être aussi
- Exercices d'intégrales et d'équations intégro-différentiellesD'EverandExercices d'intégrales et d'équations intégro-différentiellesPas encore d'évaluation
- Correction TD Enzymologie 5 PDFDocument29 pagesCorrection TD Enzymologie 5 PDFSalah Eddine Msiky90% (10)
- ENZYMOLOGIEDocument26 pagesENZYMOLOGIEBMA-medecine75% (4)
- Resumé ENZYMOLOGIEDocument13 pagesResumé ENZYMOLOGIEislamouahabiPas encore d'évaluation
- Chimie Organique QCM NomenclatureDocument2 pagesChimie Organique QCM NomenclatureLalanirina Andriamparany100% (1)
- ChapI ENZYMOLOGIE COENZYMES ET VITAMINESDocument49 pagesChapI ENZYMOLOGIE COENZYMES ET VITAMINESbessama84100% (2)
- TD Enzymo Biochimie Met 1Document31 pagesTD Enzymo Biochimie Met 1Saminat RidjaliPas encore d'évaluation
- Fascicule - Travaux Diriges de Chimie. Première C & D CamerounDocument10 pagesFascicule - Travaux Diriges de Chimie. Première C & D CamerounDavid Tagong100% (3)
- Examen 2017 Ratt CorrigeDocument10 pagesExamen 2017 Ratt Corrigefawzi badiPas encore d'évaluation
- 1 Proteines 2007-08Document23 pages1 Proteines 2007-08anon_846940093Pas encore d'évaluation
- Chapitre V Cours SMC4 HYDROCARBURES ET FONCTIONS MONOVALENTESDocument5 pagesChapitre V Cours SMC4 HYDROCARBURES ET FONCTIONS MONOVALENTESanwar jakriPas encore d'évaluation
- Cours Chimie Organique Complet Pcem LicenceDocument63 pagesCours Chimie Organique Complet Pcem LicenceYami le Chimiste100% (1)
- TD D'ingénierie Des PolymèresDocument2 pagesTD D'ingénierie Des PolymèresASMAE BOULAALAM100% (2)
- TD5 Stereochimie ConfigurationDocument4 pagesTD5 Stereochimie ConfigurationkushanjidPas encore d'évaluation
- TD N°14 Carbonyle CorrigéDocument2 pagesTD N°14 Carbonyle CorrigéRobertoPas encore d'évaluation
- 22 PC Sujet ChibDocument24 pages22 PC Sujet ChibbessisnathanePas encore d'évaluation
- 2 - Introduction A L - Enzymologie PDFDocument9 pages2 - Introduction A L - Enzymologie PDFGabrielle NnomoPas encore d'évaluation
- Questionnaires de Revision ChimieDocument3 pagesQuestionnaires de Revision ChimieMohamed Konate100% (1)
- DS ChiOrga 22 23 EnonDocument8 pagesDS ChiOrga 22 23 Enonjotaroda12Pas encore d'évaluation
- Extraits Cinetique Enzymatique - 1503673552391 PDFDocument14 pagesExtraits Cinetique Enzymatique - 1503673552391 PDFOhomonPas encore d'évaluation
- Stéréochimie DynamiqueDocument10 pagesStéréochimie DynamiqueChaimae asmaePas encore d'évaluation
- Exercices de Biochimie Métabolique: TweeterDocument7 pagesExercices de Biochimie Métabolique: TweeterLAMINE DEGUISTARPas encore d'évaluation
- Chimie OrganiqueDocument3 pagesChimie Organiquetcheva jokhanan TiambiPas encore d'évaluation
- Support de Cours Chimie 2 2023-2024-FinalDocument79 pagesSupport de Cours Chimie 2 2023-2024-Finalbalcon3233Pas encore d'évaluation
- TD, Aa, Prot, AnDocument6 pagesTD, Aa, Prot, Ansarahmboumba803Pas encore d'évaluation
- Stéréochimie Des Molécules Organiques (Partie 1)Document2 pagesStéréochimie Des Molécules Organiques (Partie 1)ranaater008Pas encore d'évaluation
- ChimieDocument5 pagesChimieHhimedanePas encore d'évaluation
- TD Chimie Première C D Octobre N°1Document2 pagesTD Chimie Première C D Octobre N°1Belmond NONOPas encore d'évaluation
- Chimie RepresentationSpatialeMoleculesDocument13 pagesChimie RepresentationSpatialeMoleculesmaxime.courtil1811Pas encore d'évaluation
- Chapitre 1-EnzymologieDocument16 pagesChapitre 1-Enzymologie88bkcf9fhqPas encore d'évaluation
- Devoir - IsomérieDocument4 pagesDevoir - IsomérieidrisPas encore d'évaluation
- Chapitre 1 Définition, Classification Et StructureDocument10 pagesChapitre 1 Définition, Classification Et Structureryadh2203Pas encore d'évaluation
- Je Partage 4 - 5969563937924977041 Avec VousDocument6 pagesJe Partage 4 - 5969563937924977041 Avec VouskerdartsPas encore d'évaluation
- Chapitre 01Document7 pagesChapitre 01BENYAHIA NESRINEPas encore d'évaluation
- Chap I Structures Des Molecules Organiques Med Iformed 2023Document23 pagesChap I Structures Des Molecules Organiques Med Iformed 2023Mame diarra bousso NdiayePas encore d'évaluation
- 4 OrgaDocument76 pages4 OrgaTizth MithPas encore d'évaluation
- Examen 2017 Normal CorrigeDocument7 pagesExamen 2017 Normal Corrigefawzi badiPas encore d'évaluation
- Sujet Chimie FMSP 2008Document2 pagesSujet Chimie FMSP 2008Karen DominiquePas encore d'évaluation
- Examen L2 2018 + Corrigã©Document5 pagesExamen L2 2018 + Corrigã©ssicuriniPas encore d'évaluation
- Introduction EnzymatologieDocument9 pagesIntroduction Enzymatologiefiras7Pas encore d'évaluation
- Lycee Moderne de Sassandra Baccalaureat Blanc - Session Fevrier 2022 Année Scolaire: 2021-2022 Durée: 4h Classe: TD SVTDocument4 pagesLycee Moderne de Sassandra Baccalaureat Blanc - Session Fevrier 2022 Année Scolaire: 2021-2022 Durée: 4h Classe: TD SVTOusmane BorePas encore d'évaluation
- #UE6 CT N°1 - Anti-PsychotiquesDocument10 pages#UE6 CT N°1 - Anti-PsychotiquesgrrhgfihPas encore d'évaluation
- TD Tle D Svteehb Échanges CellulairesDocument8 pagesTD Tle D Svteehb Échanges Cellulairesdrabodiane3Pas encore d'évaluation
- 10-48982 Métabolisme Énergétique EMC 2008Document16 pages10-48982 Métabolisme Énergétique EMC 2008koloPas encore d'évaluation
- CHIMIE Tle C&DDocument3 pagesCHIMIE Tle C&DAPPOLON Le NackyPas encore d'évaluation
- Biochimie Des Protéines ObjectifsDocument14 pagesBiochimie Des Protéines ObjectifsYwenn SAMYNPas encore d'évaluation
- 1ere s1 2Document16 pages1ere s1 2Bienvenu Raphaël SamaPas encore d'évaluation
- Exercices CHM144 FSS TD5Document9 pagesExercices CHM144 FSS TD5Omega SigmaPas encore d'évaluation
- Exam L2 Biochimie Session 1 2019 + Corrigã©Document5 pagesExam L2 Biochimie Session 1 2019 + Corrigã©ssicuriniPas encore d'évaluation
- TD4 2021Document3 pagesTD4 2021mohamedmedcheikh619Pas encore d'évaluation
- Serie Acide Aminés - Peptides - ETUDIANTS Protéines - 16 17Document3 pagesSerie Acide Aminés - Peptides - ETUDIANTS Protéines - 16 17Nabil holmes50% (2)
- Réacteurs 3Document4 pagesRéacteurs 3Asma LalamaPas encore d'évaluation
- Planches Chap 1Document8 pagesPlanches Chap 1kokam641Pas encore d'évaluation
- Bac 2014Document3 pagesBac 2014DaniokoPas encore d'évaluation
- Analyse de La VéganineDocument15 pagesAnalyse de La VéganineFatima BenPas encore d'évaluation
- CHIMIE Orga n3 Pharma Etudes 2022Document2 pagesCHIMIE Orga n3 Pharma Etudes 2022mariamtolo48Pas encore d'évaluation
- Mécanismes de SN2019Document14 pagesMécanismes de SN2019benjamin.arfi06Pas encore d'évaluation
- Travaux Dirigés de Chimie OrganiqueDocument86 pagesTravaux Dirigés de Chimie OrganiqueELGORMA HananePas encore d'évaluation
- LAC1S1Document4 pagesLAC1S1abir.belhajamorPas encore d'évaluation
- Poly D'Exercices (RMN Sv2)Document13 pagesPoly D'Exercices (RMN Sv2)Hiba ZEROUALPas encore d'évaluation
- Burkina 2016 SVT Series C 1er Tour S1Document3 pagesBurkina 2016 SVT Series C 1er Tour S1narutoPas encore d'évaluation
- Chapitre 1 SuiteDocument11 pagesChapitre 1 Suitemaryam.dellalPas encore d'évaluation
- Bts Bioch Biobio1994Document6 pagesBts Bioch Biobio1994Adel KridPas encore d'évaluation
- Relativité restreinte, mécanique quantique et relativité générale: Base physique et mathématique de la relativité restreinte et générale et de la mécanique quantiqueD'EverandRelativité restreinte, mécanique quantique et relativité générale: Base physique et mathématique de la relativité restreinte et générale et de la mécanique quantiquePas encore d'évaluation
- Sebti Nomenclature S3 SMPC 2010Document53 pagesSebti Nomenclature S3 SMPC 2010ilyasarmyPas encore d'évaluation
- C10Chim - Esterification - Hydrolyse - Synthese - Exos - Berthelot PDFDocument14 pagesC10Chim - Esterification - Hydrolyse - Synthese - Exos - Berthelot PDFAzizElheniPas encore d'évaluation
- Corrigé S2 G1 2022Document5 pagesCorrigé S2 G1 2022yann.carly BoulinguiPas encore d'évaluation
- Chimie Organique FlashcardsDocument6 pagesChimie Organique Flashcardsmariem OuriPas encore d'évaluation
- TD Acide Carboxylique Et Dérivés Lalmb 2012Document4 pagesTD Acide Carboxylique Et Dérivés Lalmb 2012virginiejustinesambouPas encore d'évaluation
- Corrige PC s2 2013 2Document6 pagesCorrige PC s2 2013 2Essohanam AwatePas encore d'évaluation
- Produits Chimiques Organiques - Synthèses Et UtilisationsDocument47 pagesProduits Chimiques Organiques - Synthèses Et UtilisationsAnis BouhousPas encore d'évaluation
- Chapitre 2Document9 pagesChapitre 2Saïda CHERIFPas encore d'évaluation
- Chapitre II Polymérisation RadicalaireDocument10 pagesChapitre II Polymérisation RadicalaireKherfi CherifaPas encore d'évaluation
- Hydrocarbures Exercices 03Document10 pagesHydrocarbures Exercices 03اباه محمدPas encore d'évaluation
- Cours Organique Chapitre2 Prtie2 14 03 2022Document34 pagesCours Organique Chapitre2 Prtie2 14 03 2022Soundous TayssirPas encore d'évaluation
- A E R M O S MédecineDocument4 pagesA E R M O S MédecineIssouf BerthePas encore d'évaluation
- Cours QlcoolsDocument3 pagesCours Qlcoolsotcs766611Pas encore d'évaluation
- TP Chlmie (1) - 1 2Document18 pagesTP Chlmie (1) - 1 2amineoifikPas encore d'évaluation
- Hydro BenzeniquesDocument14 pagesHydro BenzeniquesDado DjiguibaPas encore d'évaluation
- Cours Chimie-Organique Habilitation 231019 115402Document78 pagesCours Chimie-Organique Habilitation 231019 115402Zitouni IsmailPas encore d'évaluation
- Bioressources: Lipo-Oléo-Protéo-Chimie Chimie Verte Ou Chimie DurableDocument12 pagesBioressources: Lipo-Oléo-Protéo-Chimie Chimie Verte Ou Chimie DurableOrnevalde JulphinPas encore d'évaluation
- BtsmacroDocument12 pagesBtsmacrofafoulolPas encore d'évaluation
- Ratt Org COR 21Document3 pagesRatt Org COR 21lamis b-zPas encore d'évaluation
- TP 1 Analyse Des OsesDocument7 pagesTP 1 Analyse Des OsesSelma ArkabPas encore d'évaluation
- Glucides 3lbiol 2021Document71 pagesGlucides 3lbiol 2021KEBIR ZAHRAPas encore d'évaluation
- Cours HydrocarburesDocument6 pagesCours HydrocarburesPrince Abdoo100% (2)
- 1cours PROF Chap13 Les Molécules OrganiquesDocument15 pages1cours PROF Chap13 Les Molécules Organiquessan gokuPas encore d'évaluation
- Chimie Orga 1Document61 pagesChimie Orga 1Badr ZemmouriPas encore d'évaluation