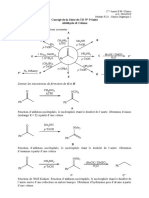
Académique Documents
Professionnel Documents
Culture Documents
CHM 231 Acides Carboxyliques S10
Transféré par
ismaelsalissou3Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
CHM 231 Acides Carboxyliques S10
Transféré par
ismaelsalissou3Droits d'auteur :
Formats disponibles
LES ACIDES CARBOXYLIQUES
Introduction
Les acides carboxyliques sont caractérisés par un groupe carboxylique
O
R C OH CO2H Fonction acide carboxylique
Nomenclature et propriétés physiques
On forme le nom d’un acide en remplaçant par oïque le nom de l’alcane correspondant à la chaîne
la plus longue et en imposant l’indice 1 au carbone du groupe carboxylique.
O
CH3CH2 CH CH2 CH2 C OH acide 4-méthyl hexanoïque
CH3 O
CH3 CH CH CH2 CH2 C OH acide hex-4-énoïque
De nombreux acides carboxyliques ont un nom courant dérivant d’un mot latin ou grec qui indique
une source naturelle.
146 | P a g e Chimie Organique des Fonctions
HCO2H acide méthanoïque acide formique pKa = 3,75
CH3CO2H acide éthanoïque acide acétique pKa = 4,75
CH3CH2CO2H acide propanoïque acide propionique pKa = 4,81
CH3(CH2)2CO2H acide butanoïque acide butyrique pKa = 4,81
CH3 (CH2)3CO2H acide pentanoïque acide valérique pKa = 4,82
CH3(CH2)4CO2H acide hexanoïque acide caproïque pKa = 4,84
CH3(CH2)10CO2H acide dodécanoïque acide laurique pKa = 5,30 acides
CH3(CH2)14CO2H acide hexadécanoïque acide palmitique pKa = 6,46 gras
CH3(CH2)16CO2H acide octadécanoïque acide stéarique
Les acides carboxyliques à chaînes longues saturés ou insaturés à partir de 10 carbones sont des
acides gras.
Les acides carboxyliques sont des substances polaires. Leurs molécules peuvent former de fortes
liaisons hydrogène avec l’eau.
Les acides carboxyliques ont des points d’ébullition élevés.
Les acides carboxyliques à C ≤ 4 sont parfaitement miscibles à l’eau.
Au fur et à mesure que la chaîne carbonée augmente la solubilité diminue.
Acidité
La plupart des acides non substitués ont des constantes d’acidité comprises entre 10-5 et 10-4 et le
pKa entre 4 et 5.
O O
C OH + NaOH C O Na + H2O
Les acides carboxyliques ayant un substituant Halogène en α sont plus acides et plus le nombre de
substituants halogènes est important plus l’acidité est grande.
Préparation des acides carboxyliques
147 | P a g e Chimie Organique des Fonctions
- Oxydation des alcènes
Les alcènes peuvent être oxydés à chaud par le KMnO4.
O O
1/ KMnO4 / OH /
R CH CH R' R C OH + R' C OH
2/ H3O
par ozonolyse
1/ O3 O O
R CH CH R' R C OH + R' C OH
2/ H2O2
Par oxydation des aldéhydes et alcools primaires
O
1/ Ag2O ou Ag(NH3)2 + OH
R CHO R C OH
2/ H3O
O
1/ KMnO4 / OH /
R CH2OH R C OH
2/ H3O
Par oxydation des alkylbenzènes
O
1/ KMnO4 / OH /
CH3 C OH
2/ H3O
Par oxydation des méthylcétones
148 | P a g e Chimie Organique des Fonctions
O O
1/ X2 / OH /
R C CH3 R C OH + HCX3
2/ H3O
Par Hydrolyse des Cyanhydrines et autres nitriles
R OH OH O
1/ CN HB
C O R C C N R C C OH
R' 2/ H3O
R' R'
Hydrolyse des nitriles
1/ HA /
RCH2CO2H
2/ H3O
R CH2 X + CN R CH2 CN O
O HA
OH / H2O / R CH2 C
R CH2 C O OH
O
NaCN OH / H2O /
CH2 CH2 Br CH2 CH2 C N CH2 CH2 C OH
OH OH OH
carbonylation des Grigrard
O
Mg CO2 H3O
R X RMgX R C O MgX R C OH
Ether/
Réactif de Grigrard O
O
Mg 1) CO2
Br MgBr C OH
Ether 2) H3O
CH3 CH3 CH3
Mg / Ether 1/ CO2
CH3 C Cl CH3 C MgCl CH3 C CO2H
2/ H3O
CH3 CH3 CH3
acide carboxylique
encombré
149 | P a g e Chimie Organique des Fonctions
Réaction d'addition - élimination sur le carbonacyle
R R R
Nu Nu H
C O + C O C OH
R' R' R' Nu
Nu
Addition 1,2
Addition - Elimination
R Nu R
R P
C O + Nu H C O C O
P P Nu
addition élimination
Les chlorures d’alcanoyle
O
R C Cl pour les nommer, on remplace acide par chlorure de
et ïque par oyle ou par yle
O
CH3 C Cl Chlorure d'éthanoyle ou d'acéthyle
O
C Cl Chlorure de benzoyle
150 | P a g e Chimie Organique des Fonctions
Préparation des chlorures d’alcanoyle
On utilise des chlorures d’acide inorganique pour préparer les chlorures d’alcanoyle : [PCl3, PCl5,
SOCl2 (chlorure de thionyle)].
Tous ces réactifs réagissent avec les acides pour donner les chlorures d’alcanoyle avec de bon
rendement.
O O
PCl5
R C OH R C Cl + POCl3 + HCl
Pentachlorure
de phosphore
O O
3R C OH + PCl3 3 R C Cl + H3PO3
trichlorure
de phosphore
O O
SOCl2
R C OH R C Cl + SO 2 + HCl
Les chlorures d’acide sont très réactifs.
Mécanisme
O O O Cl
R C O H + Cl S Cl R C O S O
H Cl
O Cl O Cl
R C O S O R C O S O + Cl
Cl H H
O O
R C + O S O + Cl R C Cl + SO 2 + HCl
Cl H
151 | P a g e Chimie Organique des Fonctions
Réaction des chlorures d’alcanoyle
O
O O
R'C O Na
R C O C R' anhydride d'acide
O
R'OH /Base
R C OR' ester
O O O
SOCl2 NH3 amide
R C OH R C Cl R C NH2
PCl3
PCl5
O
R'NH2
R C NHR' amide secondaire
O R'
R'R"NH
R C N
R"
Les chlorures d’alcanoyles sont hydrolysés en milieu aqueux.
Anhydrides d’acides carboxyliques
O
CH3 C
O anhydride acétique
CH3 C
O
152 | P a g e Chimie Organique des Fonctions
O
CH2 C
O anhydride succinique
CH2 C
O
O
O anhydride phtalique
O
CH C
O anhydride maléïque
CH C
O
Synthèse des anhydrides
Les acides carboxyliques réagissent avec les chlorures d’alcanoyle en présence de pyridine et
donnent des anhydrides d’acide.
O O O O
R C OH R' C Cl N
+ R C
(pyridine) O C R'
Certains anhydrides cycliques peuvent être préparés par simple chauffage d’un acide
dicarboxylique approprié.
153 | P a g e Chimie Organique des Fonctions
O O
CH2 C OH CH2 C
O 230°C
O anhydride succinique
CH2 C CH2 C
OH O
acide
succinique
O O
C OH C
230 °C
O anhydride phtalique
OH
C C
O
O
Réaction des anhydrides d’acide carboxylique
Les anhydrides d’acide carboxylique sont très réactifs. On s’en sert pour préparer des esters et des
amides
O O O O
R' OH
R C O C R R C OR' + R C OH
O O O O
NH3
R C O C R R C NH2 + R C O NH 4
O O O O
R'NH3
R C O C R R C NHR' + R C O NH 3R
Les anhydrides d’acide sont hydrolysés en milieu aqueux et en présence de soude.
Les Esters
154 | P a g e Chimie Organique des Fonctions
O
R C OR'
O
CH3 C O CH2 CH3 acétate d'éthyle (éthanoate d'éthyle)
Les esters ont des odeurs agréables
O CH3
CH3 CH2 C O C CH3 Propanoate de terbutyle
CH3
O O
CH3 CH2 O C CH2 C O CH2 CH3 Malonate d'éthyle
O
CH3 C O CH CH2 acétate de vinyle
CH3 O
CH CH2 CH2 O C CH3 acétate d'isoamyle
CH3
(Banana-oil)
Synthèse des esters
Les acides carboxyliques réagissent avec les alcools pour former par condensation des esters. Cette
réaction de condensation est appelée estérification.
Estérification de Fisher
O O
AH
R C OH + R'OH R C O R' + H2O
O O
H2SO4
CH3 C OH + CH3CH2OH CH3 C OCH2CH3 + H2O
155 | P a g e Chimie Organique des Fonctions
Les réactions d’estérification catalysées par des acides sont des réactions réversibles. On peut
déplacer l’équilibre en utilisant un réactif en excès.
On peut accroître le rendement d’une estérification en éliminant l’eau au fur et à mesure qu’elle se
forme.
Mécanisme
Estérification de Fisher : Formation d’un ester à partir d’un acide carboxylique et un alcool. La
réaction est catalysée par un acide fort. La réaction est réversible
O O H
R C OH + H O H R C OH
H
O H OH OH H
R C OH R' O H R C OH R C O
H O R' O H
R'
O O H
R C OR' + H3O R C OR' H2O
Les esters sont hydrolysables en milieu acide en présence d’excès d’eau.
O O
HA
R C OR' + H2O R C OH + R' OH
Estérification de Fischer
O O
H2SO4
R C OH + R' OH R C OR' + H2O
Préparation des esters à partir des chlorures d’alcanoyle
156 | P a g e Chimie Organique des Fonctions
O O
R C Cl + R' OH R C OR' + HCl
O O
Pyridine
C Cl + CH3CH2 OH C OCH2CH3 +
NCl
benzoate d'éthyle H
A partir des anhydrides de l’acide
O
R O O
C Base
O + R' OH R C OR' + R C OH
C
R
O
La réaction d’un alcool avec un anhydride ou un chlorure d’alcanoyle est souvent la meilleure
méthode de préparation d’un ester. On utilise la pyridine comme base.
On peut aussi obtenir les esters par une réaction de trans estérification
CH2 CH3
CH CH2 O
H
C OCH3 + HC CH2 OH CH2 CH C O CH2 + CH3OH
O CH3 CH3 CH
CH2
Acrylate de
méthyle CH3
L’hydrolyse des Esters facilitée par une base est une saponification.
157 | P a g e Chimie Organique des Fonctions
O O O
OH
R C OR' R C OR' R C OH + R'O
OH
O
R C O + R' OH
O O
NaOH / H2O
R' C OR" R' C O Na + R' OH
Préparation des savons.
Les lactones
Les acides carboxyliques dont les molécules comportent un groupe
hydroxyle ou subissent une estérification intra molécule qui donne un
ester cyclique appelé ou lactone.
OH
HO OH
H
O CO2H
O
Vitamine C
(acide ascorbique)
158 | P a g e Chimie Organique des Fonctions
O
O C
HA
R CH CH2 CH2 C OH O + H2O
OH
R
Lactone
On peut aussi préparer des lactones par l'oxydation de Baeyer Villiger
O
mCPBA
O O
Lorsqu’on chauffe les α-hydroxy acides il se forme des diesters cycliques appelé lactides.
O
OH H O
R CH COOH R C C R
Dimérisation C O H
O
Un Lactide
Les Amides
O
H
R C N
H
Les amides se préparent à partir des chlorures d’alcanoyle, des anhydrides, des esters d’acide
carboxylique etc. Les chlorures d’alcanoyle sont plus réactifs.
159 | P a g e Chimie Organique des Fonctions
O O O
R C Cl + NH3 R C Cl R C NH2
NH3 H
Addition-Elimination NH3
O
R C NH2 + NH4
O O
R C Cl + NH2R' R C NHR' + HCl
L’amine ou l’ammoniac sont en excès pour neutraliser l’HCl qui se forme.
O O R'
R C Cl + NHR'R" R C N
R"
un amide tertiaire
On peut aussi utiliser une base comme la pyridine pour catalyser la réaction.
A partir des anhydrides d’acides carboxyliques
Les anhydrides d’acides carboxyliques réagissent avec l’ammoniac et avec les amines primaires
et secondaires pour former des amides.
160 | P a g e Chimie Organique des Fonctions
O O O
R C O + HN R C N + R C O + NH2
2
O O
O
C NH2
C H3O NH2
O + 2NH3
C OH
C O NH4
O O O
acide phtalimique
NH
O
Phtalamide
A partir des esters
O R' O R'
R C OR"' + NH R C N + R'" OH
O R" R" O
Cl CH2 C OCH2CH3 + NH3 Cl CH2 C NH2
O O O
R C OH + HN R C O NH2 R C N + H2O
R CH CO2H Protéine
NH2 Polymérisation
Acide aminé
161 | P a g e Chimie Organique des Fonctions
O
O O R
C NH
C C NH CH CH
R C NH
NH CH R
R O
Liaison peptidique
Formation des liaisons peptidiques avec le DCC Dicyclohexylcarbodiimide
N C N
O 1/ DCC O
R C OH R C NHR'
2/ R'NH2
162 | P a g e Chimie Organique des Fonctions
C6H11 R R
O N N N
R C OH + C R C O C R C O C NH R
N O N O
C6H11 H R
R' H R
N H N C6H11 N
R'NH2
R C O C H R C O C NH R
O NH O
C6H11
O
R C N R' + NH C NH
O H
O O O
1/ DCC
R C OH R C NHR' + NH C NH
2/ R'NH2
Les amides peuvent être hydrolysés :
O O
H3O
R C N R C OH + NH2 Hydrolyse acide
O O
HO/H2O/
R C N R C O + NH3
Synthèse des Nitriles par déshydratation des amides
O
P4O10 AC2O
R C NH2 R C N + H3PO4
Nitrile
P4O10 (pentoxyde de phosphore).
Les nitriles peuvent être hydrolysés en milieu acide ou basique.
163 | P a g e Chimie Organique des Fonctions
Vous aimerez peut-être aussi
- Mobile 1 Niv.a1 - Livre + CD Audio + DVD-2278076558Document4 pagesMobile 1 Niv.a1 - Livre + CD Audio + DVD-2278076558ali0% (1)
- Paul Arnaud 19a PDFDocument3 pagesPaul Arnaud 19a PDFBoubs SelkaPas encore d'évaluation
- Dissertation Léopold Sedar SenghorDocument4 pagesDissertation Léopold Sedar SenghorLina Peña100% (4)
- Doc1 CarboxylesDocument4 pagesDoc1 CarboxylesDominique LoeuilletPas encore d'évaluation
- Cours Acides Carboxyliques Et DerivesDocument46 pagesCours Acides Carboxyliques Et Deriveswissal1111 blmPas encore d'évaluation
- Les AlcoolsDocument4 pagesLes AlcoolsADJEPas encore d'évaluation
- Aldehydes Ce TonesDocument31 pagesAldehydes Ce Tonesmariem outahmiditPas encore d'évaluation
- Chimie Oraganique 2 SMC4Document126 pagesChimie Oraganique 2 SMC4Yc YacinePas encore d'évaluation
- TleD - CH - L4 - Acides Carboxyliques Et DérivésDocument11 pagesTleD - CH - L4 - Acides Carboxyliques Et DérivésHamadi DialloPas encore d'évaluation
- TleD CH L4 Acides Carboxyliques Et DérivésDocument11 pagesTleD CH L4 Acides Carboxyliques Et DérivésHakeem TraorePas encore d'évaluation
- Wa0006Document135 pagesWa0006Yc Yacine100% (1)
- Reaction D'oxydationDocument53 pagesReaction D'oxydationFa TehPas encore d'évaluation
- S6 Hoc TD4 2020Document2 pagesS6 Hoc TD4 2020donaldPas encore d'évaluation
- Chimie Organique Fonctionnelle Examen 11Document6 pagesChimie Organique Fonctionnelle Examen 11abdeljelilabdeljelil464Pas encore d'évaluation
- Chimie Organique 2014 DR DabiréDocument87 pagesChimie Organique 2014 DR DabiréGaétan YaméogoPas encore d'évaluation
- PC 2 OrgaDocument26 pagesPC 2 OrgaandoPas encore d'évaluation
- 4-Procédés D'oxydationDocument13 pages4-Procédés D'oxydationsaa naaPas encore d'évaluation
- Du Monosaccharide Au Polysaccharide: DonnéesDocument15 pagesDu Monosaccharide Au Polysaccharide: DonnéesImanePas encore d'évaluation
- Complement de Cours Chapitre 1. Nomenclature PDFDocument17 pagesComplement de Cours Chapitre 1. Nomenclature PDFMorel TegangPas encore d'évaluation
- TleD CH L1 Les AlcoolsDocument10 pagesTleD CH L1 Les AlcoolsOusmane DoumbiaPas encore d'évaluation
- AntiHTA 02Document49 pagesAntiHTA 02loqmanbenmakhlouf500Pas encore d'évaluation
- Aldéhydes CétonesDocument56 pagesAldéhydes CétonesRoi AroufPas encore d'évaluation
- Doc1 Carbonyles IDocument4 pagesDoc1 Carbonyles IDominique LoeuilletPas encore d'évaluation
- 5 - Inhibiteurs Calciques PDFDocument62 pages5 - Inhibiteurs Calciques PDFAmine BoualiPas encore d'évaluation
- Aldehydes Et CetonesDocument14 pagesAldehydes Et CetonesSamba BarhamPas encore d'évaluation
- Résumé de Réaction D'oxydation en Chimie OrganiqueDocument2 pagesRésumé de Réaction D'oxydation en Chimie Organiquewarda MaPas encore d'évaluation
- Série 2 Isomérie 2020-2021Document3 pagesSérie 2 Isomérie 2020-2021Ayoub HmPas encore d'évaluation
- Chap9coursaldéhyde PDFDocument14 pagesChap9coursaldéhyde PDFChedly TrimechPas encore d'évaluation
- Aldehydfes Et Cetones1Document6 pagesAldehydfes Et Cetones1Abdoul karim SamakePas encore d'évaluation
- AlcyneDocument5 pagesAlcyneloloPas encore d'évaluation
- 1 Chap I AlcanesDocument13 pages1 Chap I AlcanesBenoitPas encore d'évaluation
- Cour Sur Les Acides CarboxiliquesDocument4 pagesCour Sur Les Acides CarboxiliquesngariPas encore d'évaluation
- Thème: Chimie Organique: Niveau: T CDE DisciplineDocument9 pagesThème: Chimie Organique: Niveau: T CDE DisciplineXrap HitPas encore d'évaluation
- Les Acides CarboxyliquesDocument6 pagesLes Acides CarboxyliquesLAHCEN OUTALBPas encore d'évaluation
- Quelques Composés OxygénésDocument6 pagesQuelques Composés OxygénésXray34Pas encore d'évaluation
- Classification Des Fluides Frigorigenes: Fiche de Synthese de I'LlfDocument5 pagesClassification Des Fluides Frigorigenes: Fiche de Synthese de I'LlfTøň Ďąvÿ TripõpůlãiręšPas encore d'évaluation
- S6 HOC Chapitre V PyridineDocument10 pagesS6 HOC Chapitre V PyridinedonaldPas encore d'évaluation
- Examen CatalyseDocument3 pagesExamen CatalyseMariaPas encore d'évaluation
- S6 HOC CH Chapitre 3Document15 pagesS6 HOC CH Chapitre 3Eddouks FatimazahraePas encore d'évaluation
- Chapitre 2 Les AlcanesDocument32 pagesChapitre 2 Les Alcaneselhafyanifatima20Pas encore d'évaluation
- Acide CarboxderivesDocument40 pagesAcide CarboxderivesLevier PoidsPas encore d'évaluation
- Chapitre IIIDocument6 pagesChapitre IIIDas UnbekanntePas encore d'évaluation
- Acide Alpha AminésDocument8 pagesAcide Alpha AminésMohamed BambaPas encore d'évaluation
- Cours Chimie 07Document3 pagesCours Chimie 07Fabrice MAMADOU CAMARAPas encore d'évaluation
- 1S TPC14 CorrectionDocument2 pages1S TPC14 CorrectionNicoleta ChivuPas encore d'évaluation
- Al Cools Phenol SDocument25 pagesAl Cools Phenol SDado DjiguibaPas encore d'évaluation
- Table RMN PDFDocument1 pageTable RMN PDFĤä MžãPas encore d'évaluation
- Table RMNDocument1 pageTable RMNAissa TlbPas encore d'évaluation
- Table RMN PDFDocument1 pageTable RMN PDFMohamed BenafghoulPas encore d'évaluation
- Corrigés Leçon 8 - Estérification Et Hydrolyse D'un EsterDocument5 pagesCorrigés Leçon 8 - Estérification Et Hydrolyse D'un Esterholyeric50Pas encore d'évaluation
- Série 2 C233 - (BCG-S3) Chimie Organique FinalDocument44 pagesSérie 2 C233 - (BCG-S3) Chimie Organique FinalMohammed Alaoui MraniPas encore d'évaluation
- Corrige de Lexercice V Serie III - CompressedDocument7 pagesCorrige de Lexercice V Serie III - CompressedMounir BassiPas encore d'évaluation
- Chap6organomagnésiens PDFDocument5 pagesChap6organomagnésiens PDFChedly TrimechPas encore d'évaluation
- 2023 - TP 6 Les Oxacides Des Halogenes Et Leurs Sels Synthese de Schonite de Zinc Et AmmoniumDocument7 pages2023 - TP 6 Les Oxacides Des Halogenes Et Leurs Sels Synthese de Schonite de Zinc Et Ammoniumaurel.orlayPas encore d'évaluation
- Corrigé TD3Document7 pagesCorrigé TD3Mariam Ben AbdelouahabPas encore d'évaluation
- Chap 5 LES GLUDocument12 pagesChap 5 LES GLUKhadim BEYEPas encore d'évaluation
- RearrangementDocument33 pagesRearrangementibrahim.taghreedPas encore d'évaluation
- Bakasso GLUCIDES-1 PDFDocument95 pagesBakasso GLUCIDES-1 PDFAïchatou Ousmane OumarouPas encore d'évaluation
- TD #9 Suite Corrigé 2018-2019Document4 pagesTD #9 Suite Corrigé 2018-2019Ikram GrPas encore d'évaluation
- Chapitre 4 Les Réactions Doxydo ReductionDocument57 pagesChapitre 4 Les Réactions Doxydo ReductionabdelouahedPas encore d'évaluation
- Resume Theorique m107 2203 6246f60d6b994Document251 pagesResume Theorique m107 2203 6246f60d6b994Ruok Apelapato100% (1)
- td2 Mes Inté 2023-2Document1 pagetd2 Mes Inté 2023-2Thinkpad LenovoPas encore d'évaluation
- Séquence 0Document34 pagesSéquence 0rihab Bouabid100% (1)
- Exercices Corriges Integrales GeneraliseesDocument13 pagesExercices Corriges Integrales Generaliseesjossef belkhierPas encore d'évaluation
- Cours DeterminantsDocument11 pagesCours DeterminantsClory KanyamunezaPas encore d'évaluation
- Bilan Sur L'histoire LittéraireDocument11 pagesBilan Sur L'histoire LittéraireCherif ChokeirPas encore d'évaluation
- Stage D'observation - 1Document13 pagesStage D'observation - 1Jr Mbuyi100% (1)
- Precis de Grammaire Et de Conjugaison FrancaiseDocument25 pagesPrecis de Grammaire Et de Conjugaison Francaiseaokiwe002100% (1)
- CRPE Frs Sujet Zéro1Document5 pagesCRPE Frs Sujet Zéro1gaspar 70Pas encore d'évaluation
- Lecture Suivie ADocument1 pageLecture Suivie AnadiahettarPas encore d'évaluation
- Concours D'entrée en 1ère Année de Licence Construction Et Ouvrages - Mé PDFDocument1 pageConcours D'entrée en 1ère Année de Licence Construction Et Ouvrages - Mé PDFSy Savant NéPas encore d'évaluation
- Prières de LibérationDocument11 pagesPrières de Libérationjmlb0123Pas encore d'évaluation
- Expression Ecrite StrategiesDocument15 pagesExpression Ecrite StrategiesPapa NguiranePas encore d'évaluation
- 1 Eso - Le Présent Du Verbe ÊtreDocument4 pages1 Eso - Le Présent Du Verbe ÊtrevaleriePas encore d'évaluation
- Chapitre 1 OO - Classe-TransitionDocument41 pagesChapitre 1 OO - Classe-TransitionCho ChiPas encore d'évaluation
- La Puissance de La Louange Et de L'adorationDocument9 pagesLa Puissance de La Louange Et de L'adorationReginald CelestinPas encore d'évaluation
- Kleczkloweski Cours 1Document100 pagesKleczkloweski Cours 1Cornion MastanabalPas encore d'évaluation
- Corrigé S1Document3 pagesCorrigé S1MohamedPas encore d'évaluation
- BRM Rectification - Recherche GoogleDocument1 pageBRM Rectification - Recherche GoogleENI33Pas encore d'évaluation
- Les Recettes Chocolat de L'école Valrhona - Tarte PACANE - Valrhona, Imaginons Le Meilleur Du ChocolatDocument4 pagesLes Recettes Chocolat de L'école Valrhona - Tarte PACANE - Valrhona, Imaginons Le Meilleur Du ChocolatlatarteriedenicoPas encore d'évaluation
- République Algérienne Démocratique Et PopulaireDocument100 pagesRépublique Algérienne Démocratique Et PopulaireFadhilaCelinePas encore d'évaluation
- EN ISO 14688-1 (2002) (F) CodifiedDocument6 pagesEN ISO 14688-1 (2002) (F) CodifiedchaimaaPas encore d'évaluation
- Jocatop 6015 Guide ECRITURE GSDocument24 pagesJocatop 6015 Guide ECRITURE GSManue CaldeiraPas encore d'évaluation
- Script CPFDocument2 pagesScript CPFYao Kouakou HilairePas encore d'évaluation
- BABU Jean-Philippe L'influence de La Tradition Grammaticale Gréco-Latine Sur La Grammaire Du Thaï (Communication Au Colloque de l'ATPF, Bangkok, 2007)Document17 pagesBABU Jean-Philippe L'influence de La Tradition Grammaticale Gréco-Latine Sur La Grammaire Du Thaï (Communication Au Colloque de l'ATPF, Bangkok, 2007)Jean-Philippe BABUPas encore d'évaluation
- L'homme en Face de Dieu Selon 'Abd Al-Razzāq Al-QāšānīDocument34 pagesL'homme en Face de Dieu Selon 'Abd Al-Razzāq Al-QāšānīccshamiPas encore d'évaluation
- Zawiya Réelle, Zawiya Virtuelle. Soufisme, Francophonie Et Nouvelles Technologies Au QuébecDocument13 pagesZawiya Réelle, Zawiya Virtuelle. Soufisme, Francophonie Et Nouvelles Technologies Au QuébecMUCAHIT BINICI100% (1)