Académique Documents
Professionnel Documents
Culture Documents
Ecole Nationale Superieure de Chimie: Exercice 1
Transféré par
ImaneTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Ecole Nationale Superieure de Chimie: Exercice 1
Transféré par
ImaneDroits d'auteur :
Formats disponibles
ECOLE NATIONALE SUPERIEURE DE CHIMIE
Cycle Préparatoire Intégré
TRAVAUX DIRIGES DE RMN-1H
Exercice 1
Le spectre RMN-1H d’un composé organique de formule brute C5H8O3 présente les
signaux caractéristiques suivants :
Singulet (2.40 ppm, i =3) ; singulet (3.51 ppm, i = 2) ; singulet (3.92 ppm, i = 3)
En se basant sur la valeur du déplacement chimique et la multiplicité de chaque signal,
déterminer la structure du composé étudié.
Exercice 2
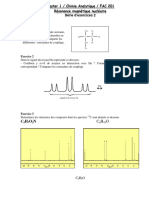
Le spectre RMN du 1H enregistré à 60 MHz par rapport au TMS, d’un composé organique de
formule brute C6H12O2, est donné ci- dessous :
Interpréter soigneusement ce spectre. Identifier le composé A en donnant sa structure semi-
développée.
Exercice 3
Le dépouillement du spectre RMN-1H d’un composé organique de formule moléculaire
C9H8O4 a donné les résultats suivants :
un singulet (11.2 ppm , i = 1) ; un doublet (8.20 ppm, i = 1) ; un triplet (7.63 ppm , i = 1) ; un
triplet (7.35 ppm , i = 1) ; un doublet (7.20 ppm , i = 1) ; un singulet (2.41 ppm , i =3).
On suppose que toutes les constantes de couplage J sont égales.
Proposer une structure qui soit en accord avec ces paramètres spectraux.
N.B : Ce composé est disubstitué en positions 1 et 2 et le signal à 11.2 ppm s'échange avec D20
Exercice 4
Le spectre RMN-1H enregistré dans CDCl3 d’un composé organique de formule brute C5H13N
présente les signaux caractéristiques suivants :
Un triplet (0.90 ppm, i = 6) ; un quintuplet (1.55 ppm, i = 4) ; un quintuplet (2.61 ppm, i = 1) ;
un singulet (5.11ppm, i = 2)
En se basant sur la valeur du déplacement chimique et la multiplicité de chaque signal,
déterminer la structure du composé étudié.
Exercice 5
Le spectre de RMN-1H d’un composé organique de formule brute C8H12O4, présente les
signaux suivants :
un triplet à 1,1 ppm d’intégration 6, un quadruplet à 4,1 ppm d’intégration 4 et un singulet à
6,8 ppm d’intégration 2. Identifier ce composé.
Exercice 6
Le dépouillement du spectre RMN-1H d’un composé organique de formule moléculaire
C13H18O2 a donné les résultats suivants :
Un doublet (0.90 ppm, i = 6); un doublet (1.51 ppm, i = 3) ; un multiplet centré (1.70 ppm, i =
1); un doublet ( 2.41 ppm , i = 2 ) ; un quadruplet ( 3.56 ppm , i = 1) ; un doublet ( 7.11
ppm , i = 2) ; un doublet ( 7.29 ppm , i = 2) ; Un singulet (12.20 ppm, i = 1)
Attribuer avec justification les différents signaux observés et donner la structure de ce composé
Exercice 7
Ci- dessous sont présentés les résultats du dépouillement du spectre RMN - 1H d’un composé
organique de formule brute C6H12O2.
Un singulet (3.65 ppm, i = 3) ; un singulet (3.9 ppm, i = 3 ); un doublet (4.2 ppm, i = 2) ; un
singulet (5.35 ppm, i = 1) ; multiplet (6.2 ppm, i = 1) ; un doublet ( 6.5 ppm , i = 1 ) ; un
multiplet ( 6.82 ppm , i = 3).
Exercice 8
Soit le composé organique de formule brute C3H7NO2. Déterminer sa structure en interprétant
son spectre RMN-1H. Expliquer l’allure des multiplets et mesurer les constantes de couplage.
Exercice 9
a- Identifier un composé C4H8O sachant que son spectre RMN1H comporte :
un doublet (9.5ppm, J=2Hz, i=1) ;
un multiplet (2 - 2.7ppm, J = 2 et 6Hz i=1) ;
un doublet (1.1ppm J = 6Hz, i = 6)
b- En déduire la composition du multiplet
c- Quelles seraient les modifications subies par le spectre si l’on remplaçait, dans le
composé initial, le proton donnant le multiplet par un atome de deutérium
Vous aimerez peut-être aussi
- TD CHM 4047 No1 2023-2024Document4 pagesTD CHM 4047 No1 2023-2024Ervane Obam BikouePas encore d'évaluation
- TD O4 Spectroscopie IR Et RMNDocument8 pagesTD O4 Spectroscopie IR Et RMNMEed E-tanPas encore d'évaluation
- Série D'exercices 2RMNDocument3 pagesSérie D'exercices 2RMNMaroua ChaPas encore d'évaluation
- CPM701 Exo RMNDocument13 pagesCPM701 Exo RMNDomingos Morais ManuelPas encore d'évaluation
- TD RMN - 050302Document5 pagesTD RMN - 050302christmik286Pas encore d'évaluation
- TD 3 RMNDocument3 pagesTD 3 RMNMariam Ben AbdelouahabPas encore d'évaluation
- Correction Série D'exercices 1 RMNDocument4 pagesCorrection Série D'exercices 1 RMNToulmoutine ManelPas encore d'évaluation
- Poly D'Exercices (RMN Sv2)Document13 pagesPoly D'Exercices (RMN Sv2)Hiba ZEROUALPas encore d'évaluation
- Fiche de TD M1 Macromoléculaire, Propriétés Physico-Chimiques Des PolymèresDocument8 pagesFiche de TD M1 Macromoléculaire, Propriétés Physico-Chimiques Des PolymèresHanane DjaffarPas encore d'évaluation
- polyExosRMNMCP 3Document33 pagespolyExosRMNMCP 3Prince Abdoo50% (2)
- TD5 Stereochimie ConfigurationDocument4 pagesTD5 Stereochimie ConfigurationkushanjidPas encore d'évaluation
- DS ChiOrga 22 23 EnonDocument8 pagesDS ChiOrga 22 23 Enonjotaroda12Pas encore d'évaluation
- Epreuve Traitement Du Signal 1Document3 pagesEpreuve Traitement Du Signal 1Wiltress WouapiPas encore d'évaluation
- CC 14dec2015 Sujet Correction BaremeDocument12 pagesCC 14dec2015 Sujet Correction BaremeSimplicePas encore d'évaluation
- Série Dexercices 2 - Spectrométrie Infra RougeDocument3 pagesSérie Dexercices 2 - Spectrométrie Infra RougeSamar ZedamPas encore d'évaluation
- CC ChOr42 Avril2018Document10 pagesCC ChOr42 Avril2018Ayyoub DahbiPas encore d'évaluation
- TD PharmacométrieDocument8 pagesTD PharmacométrieSoumaya HizaouiPas encore d'évaluation
- Exercices Attribution RMN - 1D 2DDocument11 pagesExercices Attribution RMN - 1D 2DSabin Sam100% (1)
- Ap TS RMNDocument7 pagesAp TS RMNelhidhab2014Pas encore d'évaluation
- LPro Spectro DenatDocument33 pagesLPro Spectro DenatSARAHPas encore d'évaluation
- TD RMN 2020 PDFDocument9 pagesTD RMN 2020 PDFSekou Kone100% (2)
- 1 EXAMEN BLANC 2019 PC Tle DDocument2 pages1 EXAMEN BLANC 2019 PC Tle DabdoulhakimouabkarimousanouPas encore d'évaluation
- Devoir de Synthèse N°1 Lycée Pilote - Sciences Physiques - 3ème Mathématiques (2016-2017) MR Abdellahi Ahmed TalebDocument1 pageDevoir de Synthèse N°1 Lycée Pilote - Sciences Physiques - 3ème Mathématiques (2016-2017) MR Abdellahi Ahmed TalebaliPas encore d'évaluation
- Problème 1Document3 pagesProblème 1FàtiiTà EmitàfPas encore d'évaluation
- TD 2019Document32 pagesTD 2019Yc Yacine100% (1)
- C5 - Structure Et Caractérisation Des Molécules OrganiquesDocument4 pagesC5 - Structure Et Caractérisation Des Molécules OrganiquesloukaPas encore d'évaluation
- 22 PC Sujet ChibDocument24 pages22 PC Sujet ChibbessisnathanePas encore d'évaluation
- 1 Terminale D ChimieDocument3 pages1 Terminale D ChimieJoel AsuraPas encore d'évaluation
- 2ème PC Intéro 2s1 2021-2022Document3 pages2ème PC Intéro 2s1 2021-2022sine abdellahPas encore d'évaluation
- BAC Blanc M.cisseDocument3 pagesBAC Blanc M.cisseMoussa CISSEPas encore d'évaluation
- Travaux Dirides de RMN 1dDocument17 pagesTravaux Dirides de RMN 1dangegracek3Pas encore d'évaluation
- Sciences Phy STL BGBDocument7 pagesSciences Phy STL BGBLetudiant.frPas encore d'évaluation
- Science Exp Devoir ExpDocument2 pagesScience Exp Devoir ExpOumar TraoréPas encore d'évaluation
- Examen Corrigé de Techniques D'analyse Physico-Chimique, Univ Mascara 2018Document5 pagesExamen Corrigé de Techniques D'analyse Physico-Chimique, Univ Mascara 2018camelaPas encore d'évaluation
- T Science Devoir ExpDocument2 pagesT Science Devoir ExpOumar TraoréPas encore d'évaluation
- TD Ao Poly 2021 22 TD Analyse Organique CompletDocument17 pagesTD Ao Poly 2021 22 TD Analyse Organique Completmorslithinhinane98Pas encore d'évaluation
- TD 2Document4 pagesTD 2souadkaichach111Pas encore d'évaluation
- EVALUATION PHYSIQUE 3 CHIMIE TS CorrigeDocument5 pagesEVALUATION PHYSIQUE 3 CHIMIE TS Corrigethefalseboy23Pas encore d'évaluation
- Sujet N°2 SP Tle DDocument4 pagesSujet N°2 SP Tle Dguebi daniel akagboPas encore d'évaluation
- Controle 2 - 2 S1 2bac FRDocument3 pagesControle 2 - 2 S1 2bac FRsmail hallaouiPas encore d'évaluation
- (PDF) Etude Experimentale de La Phosphataase Alcaline - Enzymologie 2Document17 pages(PDF) Etude Experimentale de La Phosphataase Alcaline - Enzymologie 2RastatePas encore d'évaluation
- (PDF) Etude Experimentale de La Phosphataase Alcaline - Enzymologie 2 PDFDocument17 pages(PDF) Etude Experimentale de La Phosphataase Alcaline - Enzymologie 2 PDFRastatePas encore d'évaluation
- Preparation Des Candidats A L'Examen Du Bac 2023: Cle de CorrectionDocument7 pagesPreparation Des Candidats A L'Examen Du Bac 2023: Cle de CorrectionAgasroPas encore d'évaluation
- Bac Blanc 2 SM (21-22)Document9 pagesBac Blanc 2 SM (21-22)Salma BendaoudPas encore d'évaluation
- Center - Tech 7points: Chimie: Suivantes Répondre Par Vrai Ou Faux Aux Propositions PTS) 3.5 (: 1ére PartieDocument2 pagesCenter - Tech 7points: Chimie: Suivantes Répondre Par Vrai Ou Faux Aux Propositions PTS) 3.5 (: 1ére PartieNourii Nour-dinePas encore d'évaluation
- Sujet de Rattrapabe TSEDocument2 pagesSujet de Rattrapabe TSETjimonon CoulibalyPas encore d'évaluation
- DS06 ChimieDocument14 pagesDS06 ChimiebenyairjeremiePas encore d'évaluation
- TD Enzymologie 02Document4 pagesTD Enzymologie 02kayleadzbPas encore d'évaluation
- Togo BAC D 2020 Sciences PhysiquesDocument2 pagesTogo BAC D 2020 Sciences PhysiqueszedicusboonPas encore d'évaluation
- 1D2S - PCT - Tle C - 2023Document5 pages1D2S - PCT - Tle C - 2023Ezéchiel HandjemedjiPas encore d'évaluation
- Travaux Dirigés de Chimie OrganiqueDocument86 pagesTravaux Dirigés de Chimie OrganiqueELGORMA HananePas encore d'évaluation
- Blanc Taiba FBDocument8 pagesBlanc Taiba FBsine abdellah0% (1)
- Prob Ses Blanc Regional Ce 2023 Sces PhysiquesDocument1 pageProb Ses Blanc Regional Ce 2023 Sces PhysiquesKeke Yodo0% (1)
- TD SpectroDocument6 pagesTD SpectroHk Eh50% (2)
- SP02DV0 Devoirs PDFDocument52 pagesSP02DV0 Devoirs PDFsalambox0% (2)
- Devoir 2 Modele 3 Physique Chimie 2 Bac SPC Semestre 1Document3 pagesDevoir 2 Modele 3 Physique Chimie 2 Bac SPC Semestre 1AYMAN FFPas encore d'évaluation
- TD Peptitides Et Protéines 2000-2001Document3 pagesTD Peptitides Et Protéines 2000-2001Ikram FerPas encore d'évaluation
- TD Electrocinetique PDFDocument32 pagesTD Electrocinetique PDFOumarPas encore d'évaluation
- Proba p3 240423 092212Document27 pagesProba p3 240423 092212ImanePas encore d'évaluation
- Série 5 S3 - 20-1-23Document2 pagesSérie 5 S3 - 20-1-23ImanePas encore d'évaluation
- Oncf-Voyages-Ibtissam AhmarDocument1 pageOncf-Voyages-Ibtissam AhmarAnas ElaymachPas encore d'évaluation
- Avis Concours 2023 FRDocument1 pageAvis Concours 2023 FRSecretPas encore d'évaluation
- Big Data Et Machine LearningDocument20 pagesBig Data Et Machine Learningpapa babacar DiagnePas encore d'évaluation
- Du Pouvoir Histoire Naturelle de Sa Croissance by Bertrand de JouvenelDocument305 pagesDu Pouvoir Histoire Naturelle de Sa Croissance by Bertrand de JouvenelbooksPas encore d'évaluation
- PFFACE Definition Et NotionDocument72 pagesPFFACE Definition Et Notionouedraogorahimcom373Pas encore d'évaluation
- Application de APR Sur Notre EntrepotDocument3 pagesApplication de APR Sur Notre EntrepotSIHAM BELLAGNECHPas encore d'évaluation
- Espions DocenseignantsDocument64 pagesEspions DocenseignantsJose FernandezPas encore d'évaluation
- La CelluleDocument24 pagesLa CelluleMohammed CHENNAOUIPas encore d'évaluation
- Praxematique 2771Document22 pagesPraxematique 2771Jaime Abad MontesinosPas encore d'évaluation
- Biomedical EngDocument185 pagesBiomedical EngVan Jordan OthaPas encore d'évaluation
- Délégations 2020Document2 pagesDélégations 2020Vincent LacourPas encore d'évaluation
- Almaden Morocco FRDocument20 pagesAlmaden Morocco FRMakrani BrahimPas encore d'évaluation
- Cryoscopie AlmemaDocument9 pagesCryoscopie AlmemaCheikh Ismaïla BA0% (1)
- Examen Final Maths2 2016-2017Document1 pageExamen Final Maths2 2016-2017Ahmed AliPas encore d'évaluation
- 111 PDFDocument7 pages111 PDFAbderrahmane BouzidPas encore d'évaluation
- 2.intérêts ComposésDocument14 pages2.intérêts Composésmabisleona5Pas encore d'évaluation
- Correction Du DS 2013-2014Document5 pagesCorrection Du DS 2013-2014jihenkPas encore d'évaluation
- TD Fascicule RI 2020-2021Document118 pagesTD Fascicule RI 2020-2021Cookies TPas encore d'évaluation
- Les Aires Urbaines, Une Nouvelle Géogra... Sée - 3e - Cours Géographie - KartableDocument8 pagesLes Aires Urbaines, Une Nouvelle Géogra... Sée - 3e - Cours Géographie - KartableInfinityPas encore d'évaluation
- TD1 P&CDocument4 pagesTD1 P&CalmerPas encore d'évaluation
- Le Chef D'oeuvre 2023 2024Document8 pagesLe Chef D'oeuvre 2023 2024Adrien MiloudiPas encore d'évaluation
- Preparation Entretien OifDocument6 pagesPreparation Entretien OifMarc Justin NgassamPas encore d'évaluation
- Cours de RIDocument229 pagesCours de RIAmin BhluliPas encore d'évaluation
- Concept Six SigmaDocument13 pagesConcept Six SigmaMed Ali MassoudiPas encore d'évaluation
- 2012 Belrose Nathalie Les Colonies Françaises de CubaDocument289 pages2012 Belrose Nathalie Les Colonies Françaises de CubaAime MontresorPas encore d'évaluation
- 01 Régimes TransitoiresDocument64 pages01 Régimes Transitoiresoussama zairPas encore d'évaluation
- ST2 Geologie ZguabaDocument46 pagesST2 Geologie ZguabaDjoulene HsnPas encore d'évaluation
- Lettre de Motivation Demande de Bourse Talents: Pour Nous Encourager, Partagez Notre Site Sur Vos Réseaux SociauxDocument2 pagesLettre de Motivation Demande de Bourse Talents: Pour Nous Encourager, Partagez Notre Site Sur Vos Réseaux SociauxLilya OuarabPas encore d'évaluation
- Courant AlternatifDocument12 pagesCourant AlternatifBen Saber Rahiim100% (1)
- 2023 11 13 JERB10 PROGRAMME 16 17 Noiembrie 2023Document16 pages2023 11 13 JERB10 PROGRAMME 16 17 Noiembrie 2023Cristina Alice TomaPas encore d'évaluation
- Automatique 111Document17 pagesAutomatique 111laila AZZOUZIPas encore d'évaluation
- DémarcheDocument2 pagesDémarcheHillary ValidePas encore d'évaluation