Académique Documents
Professionnel Documents
Culture Documents
Ad SUIVI CINETIQUE
Transféré par
Finaritra RAZANAMAHERYTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Ad SUIVI CINETIQUE
Transféré par
Finaritra RAZANAMAHERYDroits d'auteur :
Formats disponibles
SUIVI CINETIQUE D’UNE TRANSFORMATION CHIMIQUE
Objectif :
Réaliser le suivi cinétique d’une transformation lente
Doc. 1 : Principe d’un suivi cinétique d’un système chimique
Le suivi cinétique d’une réaction consiste à déterminer expérimentalement la relation existant entre la
concentration (ou la quantité) d’un réactif ou d’un produit et le temps t ; il est alors possible de déterminer la
vitesse volumique de disparition d’un réactif ou la vitesse volumique d’apparition d’un produit. Ce suivi peut se
faire :
- à partir de la mesure d’une grandeur physique (absorbance, conductivité, pression, pH, etc.) grâce à un
capteur ;
- par titrages successifs de l’une des espèces, à intervalles de temps réguliers.
Ce suivi cinétique peut permettre d’établir une loi de vitesse : celle-ci relie la vitesse volumique de disparition
d’un réactif et les concentrations des réactifs, modélisant à l’échelle macroscopique l’évolution temporelle du
système.
Doc.2 : Spectre d’absorption et cercle chromatique
Doc.3 : complément scientifique
On se propose d’étudier la cinétique de la transformation lente de décomposition de l’eau
oxygénée par les ions iodure en présence d’acide sulfurique, transformation considérée
comme totale. Dans cette transformation, les ions iodure I- réduisent l’eau oxygénée H2O2
On donne les couples Ox/red :
H2O2/H2O
I2/I-
1. Étude théorique de la réaction
1.1. Ecrire les deux demi-équations correspondant aux deux couples et en déduire que l’équation de la réaction
qui modélise la transformation d’oxydoréduction s’écrit :
H2O2(aq) + 2 I–(aq) + 2 H+(aq) = I2(aq) + 4 H2O(l)
La solution de diiode formée étant colorée, la transformation est suivie par
spectrophotométrie, méthode qui consiste à mesurer l'absorbance A de la solution,
grandeur proportionnelle à la concentration en diiode.
1.2. Déterminer la couleur du diiode. Déterminer la longueur d’onde pour régler le spectrophotomètre.
2. Suivi de la réaction
À la date t = 0 s, on mélange 20,0 mL d'une solution d'iodure de potassium (K+(aq) ; I-(aq)) de
concentration 0,10 mol.L-1 acidifiée avec de l'acide sulfurique en excès, 8,0 mL d'eau
et 2,0 mL d'eau oxygénée à 0,10 mol.L-1.
On remplit une cuve spectrophotométrique, et on relève les valeurs de l'absorbance au
cours du temps. On détermine alors, grâce à la loi de Beer-Lambert, la concentration [I2]
du diiode formé :
t (s) 0 126 434 682 930 1178 1420
[I2] (mmol.L–1) 0,00 1,74 4,06 5,16 5,84 6,26 6,53
2.1. Déterminer si le mélange initial est dans des proportions stœchiométriques.
2.2. Établir le tableau d'avancement de la transformation.
2.3. Établir la relation entre [I2](t) et l'avancement x de la transformation.
2.4. Déterminer l'avancement maximal. En déduire la valeur théorique de la
concentration en diiode formé lorsque la transformation est terminée.
3. Exploitation des résultats
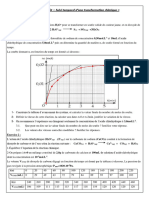
La courbe en annexe représente les variations de l'avancement x de la transformation en fonction du temps.
3.1. Donner la composition du mélange réactionnel pour t = 500 s.
3.2. Exprimer littéralement la vitesse volumique vapp(I2)t d’apparition du diiode puis la vitesse
volumique de disparition vdis(H2O2)t de l’eau oxygénée. Préciser leurs unités. Etablir la relation liant ces
deux vitesses.
3.3. Donner la définition du temps de demi-réaction, puis le déterminer.
3.4. Calculer les valeurs de la vitesse volumique d’apparition vapp(I2)t du diiode (notée v). Tracer son
évolution temporelle aux instants t =0 ; 500s et 1000s.
3.5. Décrire l’évolution de la vitesse volumique d’apparition. identifier quel facteur cinétique permet
d’interpréter cette évolution.
ANNEXE
Vous aimerez peut-être aussi
- 2003 Polynesie Sujet Exo2 Cinetique 2 5ptsDocument2 pages2003 Polynesie Sujet Exo2 Cinetique 2 5ptsAslan AntriPas encore d'évaluation
- 2-Cinetique ChimiqueDocument5 pages2-Cinetique ChimiqueAnis Dahnen0% (1)
- Série N°3 Avec Correction Chimie Série Cinétique 2007 2008 (Tlili Touhami)Document14 pagesSérie N°3 Avec Correction Chimie Série Cinétique 2007 2008 (Tlili Touhami)Ltaief Chayma100% (2)
- Serir SuiviDocument7 pagesSerir Suivikhaoula elhansaliPas encore d'évaluation
- Série D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDDocument8 pagesSérie D'exercices 2, Suivi Temporel D'une Transformation Chimique - Vitesse de Réaction, 2BAC BIOF, SM, PC Et SVT, PR JENKAL RACHIDMoulayMouly100% (6)
- Exercices - Cinétique Chimique - Chapitre 6Document3 pagesExercices - Cinétique Chimique - Chapitre 6Marwan Azerty100% (2)
- Chapitre 2, Suivi Temporel D'une Transformation Chimique, Cours, Activités, Exercices D'application, 2BAC BIOF PR JENKAL RACHIDDocument11 pagesChapitre 2, Suivi Temporel D'une Transformation Chimique, Cours, Activités, Exercices D'application, 2BAC BIOF PR JENKAL RACHIDKarim EL HAJJIPas encore d'évaluation
- SerieDocument7 pagesSeriemehdi benmassoudPas encore d'évaluation
- Serie 2 Suivi Temporelle D Une Transformation ChimiqueDocument7 pagesSerie 2 Suivi Temporelle D Une Transformation Chimiquee.maskarPas encore d'évaluation
- Série D'exercices de Révision Corrigées de Chimie Suivi Temporel d'1 Transformation Vitesse de La Réaction p.SBIRO Abdelkrim (WWW - Pc1.ma)Document19 pagesSérie D'exercices de Révision Corrigées de Chimie Suivi Temporel d'1 Transformation Vitesse de La Réaction p.SBIRO Abdelkrim (WWW - Pc1.ma)Yacine Ait El Houss100% (15)
- Série Sur Suivi 2 Bac PC - 2022Document4 pagesSérie Sur Suivi 2 Bac PC - 2022Alaoui AminePas encore d'évaluation
- 2 Suivi Temporel Dune Transformation Vitesse de Reaction RepareDocument4 pages2 Suivi Temporel Dune Transformation Vitesse de Reaction RepareMouna ElPas encore d'évaluation
- 484983526Document11 pages484983526AliMchirguiPas encore d'évaluation
- Cinétique Chimique App PDFDocument6 pagesCinétique Chimique App PDFAzizElheni100% (1)
- Série Cinétique Chimique 2bac: P T P T RDocument9 pagesSérie Cinétique Chimique 2bac: P T P T Rrkibi.khadija2006Pas encore d'évaluation
- Capture D'écran . 2023-11-16 À 19.24.58Document14 pagesCapture D'écran . 2023-11-16 À 19.24.58azeddineelghazoui637Pas encore d'évaluation
- Série N°9-9Document3 pagesSérie N°9-9Jihad ELPas encore d'évaluation
- Polyc SMC s5 2021-22Document17 pagesPolyc SMC s5 2021-22Lamsaaf MohamedPas encore d'évaluation
- Chimie TD 3 Cinétique Chimique PDFDocument4 pagesChimie TD 3 Cinétique Chimique PDFOussama El BouadiPas encore d'évaluation
- Applications Suivi20.21Document3 pagesApplications Suivi20.21Phobos ElfaPas encore d'évaluation
- Série D'exercices N°2 - Sciences Physiques Cinétique Chimique - Bac Sciences Exp (2013-2014) MR Alibi AnouarDocument6 pagesSérie D'exercices N°2 - Sciences Physiques Cinétique Chimique - Bac Sciences Exp (2013-2014) MR Alibi AnouarKais GuesmiPas encore d'évaluation
- Exercice 29 Suivi Temporel D'une Transformation Chimique (Pr. DIAM)Document5 pagesExercice 29 Suivi Temporel D'une Transformation Chimique (Pr. DIAM)mndmtrofixPas encore d'évaluation
- SuiviDocument3 pagesSuivihahaPas encore d'évaluation
- TD de CinétiqueDocument14 pagesTD de CinétiqueDieu-donné Akin100% (2)
- Cinetique Chimique ExosDocument3 pagesCinetique Chimique ExosAbel MalléPas encore d'évaluation
- Série D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriDocument5 pagesSérie D'exercices N°2 - Sciences Physiques Spectre Atomique - Bac Sciences Exp (2010-2011) MR Hannachi ChokriTawfiq Weld EL Arbi0% (1)
- ch9 ds2 Octobre 2013Document2 pagesch9 ds2 Octobre 2013mohamedPas encore d'évaluation
- TP - Avancement I2Document2 pagesTP - Avancement I2lennym398Pas encore d'évaluation
- Serie Suivi 2 Bac Biof SM PC FrancaisDocument5 pagesSerie Suivi 2 Bac Biof SM PC FrancaisMoussa Traoré100% (1)
- Cours - Suivi TemporelDocument7 pagesCours - Suivi TemporelRedouane Reda100% (2)
- DS2 Oct08Document6 pagesDS2 Oct08la physique selon le programme FrançaisPas encore d'évaluation
- Exercices 1 Suivi TemporelDocument2 pagesExercices 1 Suivi TemporelayoubbouuderqaPas encore d'évaluation
- Exercices 9 Suivi TemporelDocument1 pageExercices 9 Suivi TemporelayoubbouuderqaPas encore d'évaluation
- Chap 5 COURS Loi Cinétique Et Modélisation MicroscopiqueDocument6 pagesChap 5 COURS Loi Cinétique Et Modélisation MicroscopiquefranbillesPas encore d'évaluation
- Suivi CinetiqueDocument7 pagesSuivi CinetiqueMed BriniPas encore d'évaluation
- Cours de Cinétique ChimiqueDocument6 pagesCours de Cinétique Chimiqueilyes fellagPas encore d'évaluation
- Avancement 2Document2 pagesAvancement 2Foudil LaouiciPas encore d'évaluation
- Exercices 4 Suivi TemporelDocument1 pageExercices 4 Suivi TemporelOmar HibaPas encore d'évaluation
- Suivi Temporel D Une Transformation Chimique Vitesse de Reaction Exercices Corriges 3Document2 pagesSuivi Temporel D Une Transformation Chimique Vitesse de Reaction Exercices Corriges 3Jou mohammedPas encore d'évaluation
- Cinetique ConductimetrieDocument10 pagesCinetique ConductimetrieMouad Arrad100% (1)
- 2 - Suivi Temporel D'une Transformation - Vitesse de RéactionDocument31 pages2 - Suivi Temporel D'une Transformation - Vitesse de Réactionlahcen essPas encore d'évaluation
- Série+d'exercices - Sciences Physiques Préparation Bac+2011 - Bac+Mathématiques (2010-2011) MR Benaich PDFDocument21 pagesSérie+d'exercices - Sciences Physiques Préparation Bac+2011 - Bac+Mathématiques (2010-2011) MR Benaich PDFBen Salem Noureddine0% (2)
- TD Suivi Temporel D'une Transformation Prof B.mousLIMDocument16 pagesTD Suivi Temporel D'une Transformation Prof B.mousLIMBadr Mouslim100% (2)
- Olympiade-Chimie Maroc 2016 Serie 4Document4 pagesOlympiade-Chimie Maroc 2016 Serie 4mrPas encore d'évaluation
- 2023 Asie Sujet PH-CHDocument4 pages2023 Asie Sujet PH-CHlea.cueff.07Pas encore d'évaluation
- TD de Cinetique ChimiqueDocument6 pagesTD de Cinetique ChimiquefernandPas encore d'évaluation
- Travaux Dirigés de Chimie N° C2: Exercice 1: Méthode Des Vitesses InitialesDocument3 pagesTravaux Dirigés de Chimie N° C2: Exercice 1: Méthode Des Vitesses InitialesAbderrahman IGHNIHPas encore d'évaluation
- Chapitre-2 - Suivi Temporel D'une Transformation Chimique - Vitesse de RéactionDocument5 pagesChapitre-2 - Suivi Temporel D'une Transformation Chimique - Vitesse de Réactiona houssPas encore d'évaluation
- 02-Vitesse SerieDocument5 pages02-Vitesse SerieboustakatbPas encore d'évaluation
- 12 Chimie TSe 1Document5 pages12 Chimie TSe 1foud18Pas encore d'évaluation
- Ex 1Document2 pagesEx 1soulaimaneelaouni220Pas encore d'évaluation
- Chimie TD 3 Cinétique ChimiqueDocument4 pagesChimie TD 3 Cinétique ChimiqueFranck Momo100% (1)
- Examen National 2021 Session normal-SPDocument8 pagesExamen National 2021 Session normal-SPAmmar LokihiPas encore d'évaluation
- Correction Du TP - Suivi Temporel D'une Transformation Chimique Par ...Document3 pagesCorrection Du TP - Suivi Temporel D'une Transformation Chimique Par ...WaliD MerabeT0% (1)
- Exercices PC 2bac SP International FR 13 3Document16 pagesExercices PC 2bac SP International FR 13 3Jou Physique100% (2)
- Série 2 - Suivi TemporelDocument3 pagesSérie 2 - Suivi TemporelYASSIN SILAMBAPas encore d'évaluation
- ArgumentationDocument54 pagesArgumentationMes FarPas encore d'évaluation
- P5 - Materiaux Et Hopkison BobineDocument28 pagesP5 - Materiaux Et Hopkison BobinehassenPas encore d'évaluation
- Exercice DynamiqueDocument5 pagesExercice DynamiqueLeng Long DyPas encore d'évaluation
- Chapitre - 02 - Théorie de Létat de Contraintes - 2022 - M2 - StructureDocument24 pagesChapitre - 02 - Théorie de Létat de Contraintes - 2022 - M2 - StructureYounes DahPas encore d'évaluation
- EvaporationDocument26 pagesEvaporationRim AbouttiPas encore d'évaluation
- Les Barrages Du Projet À La Mise en ServiceDocument370 pagesLes Barrages Du Projet À La Mise en ServiceBOUKHELIFAPas encore d'évaluation
- SES Mobilite SocialeDocument14 pagesSES Mobilite Socialesar.layani02Pas encore d'évaluation
- TP FontesDocument32 pagesTP FontesBlobimPas encore d'évaluation
- Cours de FrancaisDocument53 pagesCours de FrancaisIratabara LouangePas encore d'évaluation
- Off GrideDocument7 pagesOff GrideChaymae RezzoukPas encore d'évaluation
- L'entrepreneuriatDocument20 pagesL'entrepreneuriatMoussa younessPas encore d'évaluation
- Cours de Physique Du Solide Chapitre 4 Vibrations Et Capacité CalorifiqueDocument17 pagesCours de Physique Du Solide Chapitre 4 Vibrations Et Capacité CalorifiqueETUSUP100% (1)
- CM1 - PolyDocument64 pagesCM1 - PolyWissem AbderrahmenPas encore d'évaluation
- Solide en Rotation CoursDocument4 pagesSolide en Rotation CoursMehdi BnmssdPas encore d'évaluation
- Hygiène Et Sécurité Dans Les ChantiersDocument18 pagesHygiène Et Sécurité Dans Les Chantiersleila salah- dinePas encore d'évaluation
- Sujet D' Histoire Géographie-Enseignement Moral Et Civique - Bac Pro 2022Document12 pagesSujet D' Histoire Géographie-Enseignement Moral Et Civique - Bac Pro 2022LETUDIANT100% (5)
- FicheDocument5 pagesFichenabil87onsPas encore d'évaluation
- Nouveau Microsoft Word DocumentDocument22 pagesNouveau Microsoft Word DocumentHajjaji NouraPas encore d'évaluation
- Réparation Des Ouvrages en Béton Armé ORANDocument67 pagesRéparation Des Ouvrages en Béton Armé ORANwalid dey100% (1)
- Écologie Et Écosystèmes M1S1Document7 pagesÉcologie Et Écosystèmes M1S1BOUBCHIRPas encore d'évaluation
- Cours Ensembles ENSTPDocument7 pagesCours Ensembles ENSTPSaïd AliPas encore d'évaluation
- Evaluation de L'apraxie GestuelleDocument15 pagesEvaluation de L'apraxie GestuelleZaimPas encore d'évaluation
- Electrisation Par FrottementDocument6 pagesElectrisation Par FrottementRio DelphinoPas encore d'évaluation
- L'Oscillateur À Longueur D'onde Multiple O L O M Page 2 - Fabricant Français de Collier Bracelet Ceinture Énergétique Selon Les Théories de G LakhovskyDocument5 pagesL'Oscillateur À Longueur D'onde Multiple O L O M Page 2 - Fabricant Français de Collier Bracelet Ceinture Énergétique Selon Les Théories de G Lakhovskyiuli55Pas encore d'évaluation
- 3 Redouane AZAHRI (La Division Du Travail Source de Richesse Ou D'aliénation)Document58 pages3 Redouane AZAHRI (La Division Du Travail Source de Richesse Ou D'aliénation)Meryam TajabritePas encore d'évaluation
- AdelDocument11 pagesAdelYasmine KaraPas encore d'évaluation
- HA0812 CorrigeDocument7 pagesHA0812 CorrigeBrandon NgniaouoPas encore d'évaluation
- Exercice Corrigé Sur La Gestion Des ApprovisionnementsDocument7 pagesExercice Corrigé Sur La Gestion Des Approvisionnementskistidi33Pas encore d'évaluation
- Fiche Connaissance Besoin Fonctions Contraintes 3eme 2021-2022Document2 pagesFiche Connaissance Besoin Fonctions Contraintes 3eme 2021-2022ᙀ҉η҉Ꮶ҉η҉σ҉ω҉η҉Pas encore d'évaluation
- Serie N6 Equation Non Lin S2015Document2 pagesSerie N6 Equation Non Lin S2015azzamPas encore d'évaluation