Académique Documents
Professionnel Documents
Culture Documents
98 337
Transféré par
hizballah27Titre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
98 337
Transféré par
hizballah27Droits d'auteur :
Formats disponibles
Immunologie
B 318
Immunité humorale
Lymphocytes B ; immunoglobulines (structure, diversité, fonction) ; complément ;
lymphocytes NK ; exploration en pratique clinique ; concept de déficit inné
de l’immunité humorale
Pr Jean-Louis PASQUALI, Dr Anne-Sophie KORGANOW
Immunologie clinique, hôpitaux universitaires, Hôpital civil, 1, place de l’Hôpital, BP 426, 67091 Strasbourg
Points Forts à comprendre noglobulines et permet, en 4 étapes distinguables, de géné-
rer des lymphocytes B immatures porteurs d’une immu-
noglobuline de membrane, ou récepteur B pour l’antigène.
• La première phase de différenciation Les différentes étapes, initiales et plus tardives, du déve-
des lymphocytes B est indépendante de tout loppement des cellules souches impliquent l’environne-
contact avec un antigène. Elle a lieu dans la moelle ment cellulaire de la moelle osseuse.
osseuse. Cette phase se caractérise essentiellement
par les processus génétiques de réarrangement 1. Interactions cellulaires
des gènes qui codent les immunoglobulines. Les interactions cellulaires des cellules précurseurs des
• À l’issue de cette phase médullaire, lymphocytes B avec des cellules stromales non lymphoïdes
les lymphocytes B matures peuvent circuler font intervenir des contacts cellulaires par le biais de molé-
et subir une seconde phase de maturation cules d’adhésion telle VLA-4 qui interagit avec son ligand
au niveau périphérique après la rencontre avec VCAM-1 exprimé constitutivement par les cellules stro-
l’antigène et sous l’influence de lymphocytes T. males médullaires.
C’est au cours de cette phase que peuvent survenir
la commutation de chaîne lourde et le changement 2. Cellules stromales
d’affinité des anticorps.
La synthèse par des cellules stromales de faibles quantités
• Les complexes antigène-anticorps formés
d’interleukine 7 est absolument indispensable à la prolifé-
constituent le stimulant essentiel de l’activation
ration et à la différenciation B lymphocytaire.
de la voie classique du complément sérique
permettant ainsi aux différents composants
3. Maturation des lymphocytes B
d’interagir et de promouvoir la phagocytose,
la lyse bactérienne et l’inflammation locale. Il est possible de distinguer 4 étapes dans la maturation
intramédullaire des lymphocytes B à l’aide de marqueurs
génétiques ou de surface cellulaire :
• les cellules B progénitrices deviennent des cellules pro-
B précoces quand elles activent les enzymes (recombi-
Lymphocytes B nases) indispensables aux processus génétiques qui per-
mettront la synthèse des immunoglobulines (Ig). À ce stade,
Les lymphocytes B sont les cellules du système immuni- ces cellules expriment déjà des marqueurs de membrane
taire qui produisent les immunoglobulines. Ils dérivent de caractéristiques de la lignée B, tels CD19 et CD40 ;
cellules souches communes à l’ensemble de la lignée lym- • les cellules pro B tardives dérivent des pro B précoces
phocytaire et ont pour origine la moelle osseuse. C’est dans quand apparaît, au niveau des gènes qui codent la région
l’environnement cellulaire de la moelle osseuse que les pre- variable de chaîne lourde µ d’IgM, le premier réarrange-
mières étapes de la différenciation lymphocytaire B pren- ment ;
nent place, avant que ces cellules ne migrent par voie san- • les cellules pré B se caractérisent par l’apparition à la
guine vers les organes lymphoïdes périphériques où ils membrane d’une chaîne lourde µ associée à une pseudo-
peuvent rencontrer les antigènes. chaîne légère invariante ;
• les lymphocytes B immatures expriment à présent une
Différenciation lymphocytaire B IgM de membrane complète après avoir réarrangé les gènes
La différenciation lymphocytaire B débute dans la moelle de la chaîne légère κ tout d’abord, puis, en cas d’ineffica-
osseuse indépendamment de tout contact avec un antigène. cité, la chaîne légère λ (voir : pour approfondir / 1). Ces
Elle se caractérise par une série d’événements irréversibles lymphocytes B immatures peuvent devenir matures quand
concernant essentiellement les gènes qui codent les immu- ils coexpriment l’IgD de membrane. C’est essentiellement
LA REVUE DU PRATICIEN (Paris) 1998, 48 337
IMMUNITÉ HUMORALE
avant l’expression de l’IgD de membrane que s’opère la κ ou λ. Chaque molécule d’IgG est composée de 2 chaînes
sélection des lymphocytes B permettant d’éliminer physi- lourdes γ associées à 2 chaînes légères (soit κ ou λ). De
quement (délétion clonale) ou fonctionnellement (anergie) même, chaque molécule d’IgD, ou d’IgE ou d’IgA mono-
les cellules qui auront produit des récepteurs de membrane mérique associe 2 chaînes lourdes respectivement δ, ε ou
capables de réagir avec des auto-antigènes (phénomène de α, à 2 chaînes légères (soit κ, soit λ). Certaines immuno-
tolérance). En l’absence d’autoréactivité, les lymphocytes globulines sont polymériques grâce à une chaîne J qui lie
B deviennent matures et peuvent migrer de la moelle entre elles les extrémités C terminales des chaînes lourdes :
osseuse vers la périphérie par voie sanguine. il s’agit des IgM composées de 10 chaînes lourdes µ, cha-
cune associée à une chaîne légère κ ou λ, et des IgA com-
Rencontre avec l’antigène posées de 4, 6 ou 8 chaînes lourdes α.
La deuxième phase périphérique de la différenciation lym- Chaque chaîne lourde ou légère d’immunoglobuline est
phocytaire B est dépendante de la rencontre avec l’anti- constituée de 2 régions : une région constante (C) COOH
gène. Cette phase prend place dans les organes lymphoïdes terminale, et une région variable (V) NH2 terminale. La
secondaires que sont la rate, les ganglions, ainsi que les structure d’une IgG a été définie par crystallographie : la
espaces lymphoïdes des muqueuses comme les plaques de molécule en forme de Y classique comprend 3 portions
Peyer intestinales. Dans ces organes lymphoïdes, les lym- globulaires de dimension voisine liées par une zone poly-
phocytes B matures se regroupent sous forme de follicules peptidique flexible appelée région charnière. L’apparie-
où ils sont en contact étroit avec des cellules profession- ment des chaînes lourdes et légères se fait de telle sorte que
nelles de la présentation antigénique, les cellules follicu- les régions variables VH et VL soient associées, de même
laires dendritiques. Dans cet environnement, les lympho- que les régions constantes.
cytes B porteurs de récepteur B spécifiques de l’antigène Des digestions protéiques de l’IgG ont permis de définir
vont proliférer sous l’effet de signaux d’origine T lym- les fonctions portées par les différentes parties de la molé-
phocytaire et se différencier en plasmocytes. Parmi les cule : ainsi, la papaïne peut cliver l’IgG en 3 fragments alors
signaux T lymphocytaires importants figurent d’une part, que la pepsine libère essentiellement 2 fragments selon que
l’expression par les lymphocytes T du ligand de CD40 et la coupure siège d’un côté ou de l’autre du pont disulfure
d’autre part, la synthèse de cytokines (interleukine 4, inter- de la région charnière qui lie les 2 chaînes lourdes γ. Les
leukine 5 et interleukine 6). Les lymphocytes B ainsi acti- fragments d’immunoglobulines libérés par ces digestions
vés au contact de l’antigène, des cellules dendritiques et ont pu être purifiés montrant ainsi que les régions
des lymphocytes T, migrent dans le centre germinatif où constantes des chaînes lourdes constituant en partie le frag-
ils peuvent commuter leur chaîne lourde devenant des plas- ment Fc (pour fragment crystallisable) sont responsables
mocytes sécrétant soit une IgA, soit une IgG, soit une IgE de certaines fonctions effectrices, alors que les régions dites
(voir : pour approfondir / 2). C’est également au niveau de Fab (fragment antigen binding) et Fab 2 qui comportent
ces centres germinatifs que des mutations somatiques vien- les régions variables des chaînes lourdes et légères portent
nent affecter les régions variables des anticorps produits la fonction de reconnaissance de l’antigène.
permettant à certains d’augmenter leur affinité pour l’an-
tigène. Diversité des immunoglobulines
Il existe différents niveaux d’hétérogénéité parmi les immu-
noglobulines. Certains concernent les régions constantes,
Immunoglobulines : d’autres les régions variables.
structure, diversité, fonctions En ce qui concerne les régions constantes, les classes des
immunoglobulines et les sous-classes constituent un pre-
L’ensemble des anticorps produits par les lymphocytes B mier niveau d’hétérogénéité. Les régions constantes des
constitue les immunoglobulines. Chaque anticorps a chaînes lourdes des immunoglobulines sont codées par des
2 fonctions distinctes médiées par 2 régions différentes : la gènes situés sur le chromosome 14. Bien entendu, les dif-
fonction de reconnaissance des antigènes est médiée par férences de séquence nucléotidique des gènes codant µ,
les régions variables, alors que la fonction effectrice est α1, α2, δ, ε, γ1, γ2, γ3 et γ4 sont responsables des diffé-
médiée par les régions constantes. rences protéiques entre les classes et sous-classes qui exis-
tent chez tout individu. Les allotypes des immunoglobu-
Structure des immunoglobulines lines correspondent à des variations ponctuelles de ces
Les immunoglobulines sont formées par 2 séries de chaînes gènes de région constante qui permettent de définir des
protéiques : les chaînes lourdes (H) dont la nomenclature groupes d’individus porteurs ou non de ces variantes allo-
définit la classe et la sous-classe de l’immunoglobuline. À typiques.
l’utilisation de la chaîne lourde µ correspond la classe des Les structures des régions variables sont plus complexes :
IgM, à δ correspond l’IgD, à α correspond l’IgA, à ε cor- elles doivent pouvoir générer suffisamment de diversité
respond l’IgE et à γ1, γ2, γ3 ou γ4 correspond la classe des pour pouvoir se lier à la multitude d’antigènes potentiels.
IgG qui comprend les sous-classes 1, 2, 3 ou 4. À chaque Les mécanismes génétiques qui permettent de créer cette
classe ou sous-classe d’immunoglobulines, ou isotype, cor- diversité des anticorps sont à présent bien compris. La
respond une fonction particulière dans la réponse immu- région variable de la chaîne lourde, quel que soit le gène
nitaire ; les chaînes légères (L) qui peuvent être de 2 types : de région constante utilisé, est constitué à partir de 3 gènes
338 LA REVUE DU PRATICIEN (Paris) 1998, 48
Immunologie
distincts : un gène VH, un gène D (pour diversité) et un
gène JH (pour jonction). Lorsqu’un lymphocyte B pro- Fab.
gresse dans sa maturation médullaire, il va subir un réar- chaîne
légère NH2
rangement dit somatique de ces gènes de région variable
de telle sorte qu’au hasard, il va assembler tout d’abord un
régions
des gènes D du chromosome 14 (il en existe une trentaine ne Fc
variables
paï
disponible) et un des gènes JH (il en existe 6 disponibles). pa
Dans un second temps, cet assemblage DJH sera lui-même région ponts
charnière dissulfurés
assemblé à un des gènes VH disponibles (il en existe 51), ( )
créant ainsi un ensemble de gènes réarrangés VHDJH régions chaîne
courtantes lourde
pe
codant environ 110 acides aminés qui vont constituer la
ps
région variable de la chaîne lourde. Au niveau de la chaîne
in
COOH Fab'2
e
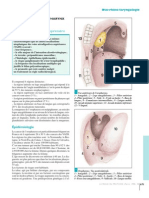
légère κ dont les gènes sont situés sur le chromosome 2, Structure typique d'une IgG
(voisine de la structure d'une IgD et d'une IgE)
ainsi que pour la chaîne légère λ dont les gènes sont situés
chaîne chaîne légère
sur le chromosome 22, 2 gènes distincts contribuent à géné- lourde
rer la région variable : un gène Vκ parmi les 40 gènes dis-
ponibles est assemblé à un gène Jκ parmi les 5 disponibles.
Pour λ, un gène Vλ parmi la trentaine disponible est assem-
blé à un gène Jλ parmi les 4 disponibles dans le génome chaîne légère
humain. Ce réarrangement des gènes de régions variables chaîne lourde
d’immunoglobulines s’opérant au hasard, il est susceptible chaîne J
de créer, par lui-même, un nombre très important de régions
variables différentes. Une fois terminé sur la chaîne lourde
et sur la chaîne légère, ce réarrangement est définitif et
caractéristique du clone lymphocytaire B qui l’a produit. chaîne J
Ce phénomène survenant à la fois sur les chaînes lourdes
et légères, cela ajoute à la diversité possible : un même réar-
Structure typique d'une IgM Structure typique d'une IgA
rangement sur une chaîne lourde pourrait s’associer à un pentamérique dimérique
réarrangement différent sur la chaîne légère et constituer
un anticorps reconnaissant un autre antigène. Par ailleurs,
2 autres mécanismes ajoutent à la diversité des anticorps 1
Structure des immunoglobulines.
produits par les lymphocytes B : d’une part l’imprécision
des mécanismes de jonction des gènes de régions variables
pouvant ainsi modifier la séquence protéique de la région Fonction des immunoglobulines
variable concernée, d’autre part la survenue possible, lors
de la stimulation antigénique de mutations somatiques qui Les régions variables des anticorps ont pour fonction de se
affectent les gènes réarrangés des régions variables (voir : lier aux antigènes de manière à faciliter leur élimination.
pour approfondir / 2). Dans la majorité des cas, les antigènes sont des protéines.
Les anticorps reconnaissent la conformation naturelle de
Deux précisions méritent d’être apportées : l’ensemble des la protéine étrangère et, en particulier, des déterminants (ou
régions variables n’entre pas en contact avec l’antigène ; épitopes) situés à la surface de l’antigène. Dans la mesure
3 régions sur la région variable de la chaîne lourde et où les protéines sont repliées dans leur forme naturelle, les
3 régions de la région variable de la chaîne légère établis- anticorps reconnaissent le plus souvent des groupes
sent ces contacts, ce sont les régions déterminant la com- d’acides aminés distants les uns des autres sur la séquence
plémentarité (CDR) ; les régions variables des anticorps linéaire de l’antigène : les épitopes sont dits conforma-
portent des déterminants antigéniques appelés déterminants tionnels. La liaison des anticorps, avant tout par les régions
idiotypiques. déterminant la complémentarité (CDR) des chaînes lourdes
et légères, avec l’épitope fait intervenir 4 types de forces :
Au cours d’une réponse immunitaire contre un antigène
des forces électrostatiques ; des ponts hydrogènes ; des
(Ag) exogène, les lymphocytes B dont l’IgM de membrane
forces de Van der Waals ; des forces hydrophobiques.
reconnaît l’antigène, vont proliférer et différencier sous
l’effet de différents signaux mentionnés plus haut, ils vont La fonction des régions constantes est dépendante de l’iso-
subir la commutation de classe qui transforme un lym- type de l’immunoglobuline, de même que la diffusion dans
phocyte B sécréteur d’une IgM en lymphocyte B sécréteur l’organisme. Ainsi, le premier anticorps produit au cours
d’une IgG, les régions variables restant identiques, carac- d’une réponse immunitaire est l’IgM dont la forme penta-
téristiques du clone B lymphocytaire producteur. C’est mérique autorise peu de diffusion extravasculaire et permet
aussi pendant cette phase de commutation de chaîne lourde la fixation des protéines du complément et son activation.
que des mutations somatiques des régions variables peu- Les anticorps des autres isotypes ont un poids moléculaire
vent venir augmenter l’affinité de l’anticorps contre l’an- plus faible et peuvent diffuser dans l’espace extravasculaire.
tigène. Les IgA, dont la localisation est essentiellement muqueuse
LA REVUE DU PRATICIEN (Paris) 1998, 48 339
IMMUNITÉ HUMORALE
après transport transépithélial, ont une fonction essentielle une C3 convertase et clivent de nombreuses molécules C3
de neutralisation des pathogènes extérieurs, mais activent en fragments C3a et C3b.
très faiblement le complément. Les IgG1, 2, 3 et 4 peuvent La fonction la plus importante des fractions du complé-
être transportées à travers le placenta pour gagner la circu- ment est de faciliter la capture et la destruction des élé-
lation fœtale, mais seules les IgG1 et 3 ont la capacité de se ments pathogènes (par exemple une bactérie) par les cel-
lier aux récepteurs FcγRIII des cellules tueuses naturelles et lules phagocytaires. Cela se fait de façon spécifique par la
de permettre à ces cellules de lyser les cellules-cibles. La liaison des fragments du complément à des récepteurs
région Fc des IgE peut se lier à un récepteur spécifique des situés à la surface des cellules phagocytaires. Le mieux
IgE à la surface des cellules mastocytaires. Enfin, les IgD ne caractérisé de ces récepteurs est CR1 qui se lie à C3b à la
sont pas ou peu sécrétées, ayant un rôle essentiel de récep- surface des macrophages et des polynucléaires. Il existe
teur B membranaire pour l’antigène. d’autres récepteurs pour les fractions du complément dont
la localisation cellulaire est variée : le CR2 qui fixe le C3d
est présent sur les cellules B (c’est aussi le récepteur du
Système du complément virus d’Epstein-Barr, expliquant le tropisme B cellulaire
Le système du complément est constitué d’un grand de ce virus), le CR3 et le CR4 qui fixent l’inhibiteur du
nombre de protéines plasmatiques dont une partie est C3b à la surface des monocytes macrophages et des poly-
capable de se fixer aux régions constantes des anticorps, nucléaires neutrophiles.
en particulier IgM, et d’activer les autres fractions. Cer- À côté de ce mécanisme important d’activation des cellules
taines protéines du complément sont également capables phagocytaires, les fractions du complément ou leurs récep-
de se lier directement aux parois bactériennes, enfin teurs interviennent dans 3 autres mécanismes de défense :
d’autres fractions jouent un rôle de chémoattractants pour la clairance des complexes immuns ; les fragments C4b et
les cellules phagocytaires. Les protéines du complément C3b se fixent de façon covalente aux complexes immuns
sont synthétisées dans le foie et par les monocytes macro- qui viennent se fixer aux récepteurs CR1 des érythrocytes.
phages, pour l’essentiel. Ceux-ci transportent ces complexes au niveau du foie et de
Il existe 3 voies différentes d’activation du complément : la rate où ils peuvent être phagocytés ; les petits fragments
la voie classique est activée par la fixation d’un anticorps de clivage C3a, C4a et C5a sont appelés anaphylatoxines
sur un antigène, la voie des lectines qui passe par une pro- et sont de puissants médiateurs de l’inflammation locale
téine sérique de liaison au mannose des bactéries et virus, pouvant induire une augmentation de la perméabilité vas-
la voie alterne qui peut être activée dès qu’une fraction du culaire ; l’activation du complément aboutissant au clivage
complément se fixe sur un agent exogène. Les événements du C5 entraîne l’assemblage du complexe d’attaque mem-
précoces de ces 3 voies d’activation impliquent une série branaire : ce complexe formé d’une molécule C5b, du C6
de clivages protéolytiques qui résultent dans l’apparition et du C7 est susceptible de s’insérer dans la bicouche lipi-
d’une activité enzymatique, la C3 convertase, qui va cliver dique d’une cellule. Interviennent alors les molécules C8
la fraction C3 du complément. et C9 capables de créer un pore dans la membrane cellu-
Le premier composant de la voie classique est le C1 qui est laire à la manière dont les perforines des lymphocytes T
un complexe de 3 protéines C1q, C1r et C1s. Deux molé- cytotoxiques peuvent agir.
cules de C1r et C1s sont liées à une molécule de C1q. Le système d’activation du complément pourrait être délé-
Quand une IgM se fixe sur des antigènes, de même, mais tère pour les cellules de l’hôte. Un certain nombre de pro-
à un moindre degré, quand des IgG1 ou IgG3 se fixent en téines de contrôle a été décrit à la surface des cellules : ainsi
s’agrégeant sur un antigène répétitif, les régions constantes l’activation du C1 est contrôlée par une protéine plasma-
exposent le site de liaison du C1q. Cette fixation du C1q tique, le C1 inhibiteur dont le déficit génétique est res-
active le C1r qui, à son tour, active le C1s en générant une ponsable de l’œdème angioneurotique héréditaire. De
sérine protéase active. Cette dernière clive le C4 et le C2, même, l’activité des composés terminaux d’attaque mem-
formant ainsi 2 fragments de taille conséquente C4b et C2b branaire est contrôlée par 2 molécules CD59 et le DAF
qui, ensemble, constituent la C3 convertase de la voie clas- (decay accelerating factor) dont le déficit peut être res-
sique. L’activité principale de ce composé enzymatique ponsable de l’hémoglobinurie paroxystique nocturne.
essentiel est de cliver à son tour un grand nombre de molé-
cules C3, formant, d’une part des molécules C3b qui se
lient à la surface de l’agent pathogène initiateur, et d’autre
Cellules natural killer
part des fragments C3a induisant une réaction inflamma- Les cellules natural killer (NK) sont de grands lympho-
toire locale. cytes granuleux qui ont une origine vraisemblablement
Le dépôt de fragments C3b à la surface d’agents patho- commune à la lignée des lymphocytes T. Ces cellules peu-
gènes est l’élément déterminant de l’activation de la voie vent être considérées comme des effectrices précoces en
alterne d’activation du complément qui doit être considé- réponse à des infections virales et jouent vraisemblable-
rée comme une voie d’amplification des effets de la voie ment un rôle antitumoral. Ces cellules ont en commun d’ex-
classique. En effet, les fragments C3b déposés fixent le fac- primer le récepteur FcγRIII ou CD16. La présence de ces
teur B de la voie alterne qui peut alors être clivé par le fac- récepteurs permet de guider les cellules NK vers la cible
teur D plasmatique en 2 fragments Ba et Bb. Ainsi se for- reconnue par les IgG fixées, dirigeant ainsi la cytotoxicité.
ment de nombreux complexes C3b, Bb qui agissent comme L’activation des cellules NK par liaison des fragments Fc
340 LA REVUE DU PRATICIEN (Paris) 1998, 48
Immunologie
des IgG à CD16 peut induire la production d’IL8, d’inter- Les cellules NK portent les marqueurs CD16, CD56 et
féron γ et de TNFα. Il existe un deuxième mécanisme de CD57. Elles sont très faiblement représentées dans le sang
lyse médié par les cellules NK qui ne fait pas intervenir le périphérique, sauf en cas de leucémie à cellules NK.
récepteur CD16. On ne connaît pas aujourd’hui de façon
détaillée ce mécanisme de reconnaissance directe des cel-
lules-cibles par les cellules NK. En revanche, ne peuvent
Concept de déficit inné
être lysées que les cellules-cibles qui expriment peu ou pas de l’immunité humorale
de molécules du complexe majeur d’histocompatibilité, ou Il existe des déficits primitifs intrinsèques aux lymphocytes
de cellules-cibles peu différenciées. Quel que soit le méca- B et des déficits qui paraissent secondaires à une anoma-
nisme de reconnaissance de la cellule-cible, la cellule NK lie lymphocytaire T dont on a vu l’importance dans l’acti-
relargue ses granules cytoplasmiques libérant perforine et vation B. La meilleure connaissance de la physiologie lym-
granzyme qui vont lyser la cellule-cible. phocytaire B a permis de mieux comprendre les anomalies
moléculaires à l’origine des déficits B intrinsèques.
Exploration en pratique clinique 1. Agammaglobulinémie liée à l’X de Bruton
En l’absence de synthèse d’immunoglobuline, la différen-
L’exploration en pratique clinique des immunoglobulines, ciation B est bloquée au stade pré-B lymphocytaire. Les
du complément et des cellules NK relève de la recherche anomalies moléculaires portent sur une protéine-tyrosine
des déficits immunitaires ou de pathologies néoplasiques. kinase spécifique des B et nécessaire au cours de la diffé-
renciation médullaire.
Immunoglobulines
Le dosage pondéral des immunoglobulines permet de 2. Déficits en IgA
détecter un déficit d’une classe ou sous-classe, de suivre Il s’agit des déficits les plus fréquents dans la population
de façon précise le taux d’une production monoclonale par générale (1 cas sur 700), le plus souvent asymptomatiques.
une prolifération d’un clone lymphocytaire B. Ils peuvent s’associer à des infections muqueuses répétées.
La nature de la sécrétion d’une prolifération monoclonale
3. Déficits en sous-classe d’IgG
est le mieux appréciée par l’immunoélectrophorèse, l’im-
munofixation et l’immunotransfert qui précisent le type de Ceux-ci peuvent être isolés ou s’associer à un déficit en
chaîne légère κ ou γ et l’isotype de la chaîne lourde. IgA ou à une ataxie-télangiectasie.
4. Déficits en IgG et IgA avec hyper IgM
Complément et ses fractions
Ils provoquent des infections répétées à germes pyogènes.
L’étude du complément en pratique relève soit de tests fonc- L’anomalie moléculaire consiste en une anomalie ponc-
tionnels, soit de dosages pondéraux des protéines. tuelle du ligand de CD40 (intrinsèquement, les B seraient
Les tests fonctionnels mesurent l’activité hémolytique de donc normaux).
la voie classique ou CH50. Les dosages évaluent le plus
souvent le taux du C3, du C4, du C1q et du facteur B. 5. Hypogammaglobulinémies
L’intérêt essentiel de ces tests est de rechercher un déficit Les hypogammaglobulinémies d’expression variable, ainsi
qui peut être en rapport soit avec un défaut génétique, soit que les déficits immunitaires combinés portent en général
avec une consommation excessive (catabolisme) liée le plus sur les lymphocytes B et T. ■
souvent à une pathologie à complexes immuns.
Cellules
Les lymphocytes B ne représentent qu’un faible contingent
des lymphocytes comptabilisés dans une numération for- Points Forts à retenir
mule sanguine (10 à 15 % des lymphocytes totaux). Ils peu-
vent être comptés par un certain nombre de marqueurs
membranaires, en général par cytométrie de flux en utili- • L’immunité humorale se caractérise par la
sant des anticorps monoclonaux marqués à un fluoro- production d’anticorps appartenant au groupe
chrome. Les marqueurs B les plus souvent utilisés sont : protéique des immunoglobulines. Celles-ci sont
l’immunoglobuline de membrane, CD19, CD20. hétérogènes puisqu’elles sont composées de
Enfin il existe une certaine hétérogénéité des lymphocytes 5 classes (IgM, IgG, IgA, IgE et IgD) dont le poids
B de l’adulte ainsi qu’en témoigne une faible proportion moléculaire, la structure, la diffusion dans
de lymphocytes B qui expriment à la membrane un mar- l’organisme ainsi que la fonction effectrice
queur (CD5) essentiellement lymphocytaire T. L’intérêt diffèrent.
majeur de la numération des lymphocytes B réside dans la • Constitués de chaînes lourdes et légères, les
compréhension des déficits de l’immunité humorale, mais anticorps sont produits par les lymphocytes B
aussi dans le diagnostic et le suivi de leucémies lymphoïdes après un processus de maturation à présent mieux
comme la leucémie lymphoïde chronique (constituée de connu.
lymphocytes BCD5).
LA REVUE DU PRATICIEN (Paris) 1998, 48 341
IMMUNITÉ HUMORALE
signaux d’origine lymphocytaire T. Cette prolifération s’accompagne
POUR APPROFONDIR d’une différenciation qui permet la sécrétion d’IgM pentamériques : ce
sont ces IgM qui sont les premières détectées lors d’une réponse immu-
nitaire primaire contre les agents infectieux. La persistance du contact
1 / Exclusion allélique antigénique au niveau ganglionnaire induit 2 phénomènes :
– la commutation de chaîne lourde qui consiste à transformer le lym-
Le réarrangement des gènes d’immunoglobulines est finement régulé de phocyte B sécréteur d’IgM en un lymphocyte B sécréteur d’une IgG, d’une
sorte que chaque lymphocyte B ne puisse produire un anticorps que d’une IgA ou d’une IgE selon les signaux lymphocytaires reçus (cytokines) qui
seule spécificité. Ainsi, bien qu’il existe dans chaque lymphocyte B 2 chro- orientent la commutation vers telle ou telle chaîne lourde. Par exemple,
mosomes codant les chaînes lourdes, 2 chromosomes pour les chaînes l’interleukine 4 provoque préférentiellement la commutation vers la syn-
légères κ et 2 pour les chaînes λ, les gènes d’un seul des 2 chromosomes thèse d’IgG1 et d’IgE. Mais l’ensemble de la région variable de chaque
codant la chaîne lourde seront exprimés, de même que ceux d’un seul chaîne lourde µ est « transféré » sur la région constante de la nouvelle
chromosome codant la chaîne légère. Ce phénomène, dénommé exclu- chaîne lourde (γ, α, ou ε) ;
sion allélique, assure la monospécificité de l’anticorps produit, et le carac- – pendant cette phase, les gènes des régions variables de chaîne lourde et
tère unique de la cellule B originale qui a fait les réarrangements géné- de chaîne légère vont subir des mutations somatiques par un mécanisme
tiques successifs. Les lymphocytes B très immatures médullaires moléculaire encore non compris. Certaines de ces mutations vont modi-
réarrangent tout d’abord sur un premier chromosome 14 les gènes de fier la séquence protéique des régions variables de telle sorte que l’anti-
région variable de chaîne lourde pour créer une chaîne µ entière : si cette corps produit (par exemple, à présent une IgG) a une meilleure affinité
protéine est fonctionnelle, capable de replier normalement et de se lier à pour l’antigène. Ce gain d’affinité lié au processus de mutation somatique
une pseudo-chaîne légère invariante, la chaîne µ est transportée à la mem- de l’anticorps va entraîner un avantage pour le lymphocyte en question
brane et le 2e chromosome 14 ne réarrangera pas ses gènes de régions qui proliférera plus vite et produira davantage d’anticorps après diffé-
variables (exclusion allélique). Si tel n’est pas le cas (chaîne lourde µ non renciation plasmocytaire.
fonctionnelle), alors le réarrangement s’opère sur le 2e chromosome 14.
De même pour les chaînes légères où les gènes de κ sont les premiers à
se réarranger, les gènes de λ n’étant utilisés que si les essais κ se sont avé-
rés les 2 fois inefficaces.
2 / Commutation et mutations
somatiques
Un lymphocyte B qui sort de la moelle osseuse est mature et exprime des POUR EN SAVOIR PLUS
récepteurs pour l’antigène de classe IgM et IgD dont les régions variables Revillard J.-P. Immunologie. De Boeck Université ed. 1994 : 47-
sont identiques. En effet, la structure de ces régions variables est le résul- 54 ; 77-83
tat du réarrangement des différents gènes des chaînes lourdes et légères,
réarrangement aléatoire caractéristique de chaque lymphocyte B. Lors de Bach J.-F. Traité d’immunologie. Paris Médecine-Sciences Flam-
la rencontre avec l’antigène, par exemple lors de la traversée d’un gan- marion. 1993 : 77-121 ; 471-80.
glion périphérique, ce lymphocyte B va proliférer sous le contrôle de
342 LA REVUE DU PRATICIEN (Paris) 1998, 48
Vous aimerez peut-être aussi
- 98 909Document3 pages98 909hizballah27Pas encore d'évaluation
- 98 1003Document7 pages98 1003hizballah27Pas encore d'évaluation
- 98 999Document4 pages98 999hizballah27Pas encore d'évaluation
- 98 1011Document7 pages98 1011hizballah27100% (1)
- 98 991Document7 pages98 991hizballah27Pas encore d'évaluation
- 98 905Document4 pages98 905hizballah27Pas encore d'évaluation
- 98 913Document6 pages98 913hizballah27Pas encore d'évaluation
- 98 987Document3 pages98 987hizballah27Pas encore d'évaluation
- 98 919Document5 pages98 919hizballah27Pas encore d'évaluation
- 98 797Document5 pages98 797hizballah27Pas encore d'évaluation
- 98 899Document6 pages98 899hizballah27Pas encore d'évaluation
- Antagonistes Des Récepteurs H Et Inhibiteurs de La Pompe À ProtonsDocument6 pagesAntagonistes Des Récepteurs H Et Inhibiteurs de La Pompe À Protonshizballah27Pas encore d'évaluation
- 98 887Document5 pages98 887hizballah27100% (1)
- 98 881Document5 pages98 881hizballah27Pas encore d'évaluation
- 98 805Document5 pages98 805hizballah27Pas encore d'évaluation
- 98 875Document5 pages98 875hizballah27Pas encore d'évaluation
- 98 802Document3 pages98 802hizballah27Pas encore d'évaluation
- 98 671Document4 pages98 671hizballah27Pas encore d'évaluation
- 98 787Document10 pages98 787hizballah27Pas encore d'évaluation
- 98 765Document5 pages98 765hizballah27Pas encore d'évaluation
- 98 771Document6 pages98 771hizballah27100% (1)
- 98 781Document5 pages98 781hizballah27Pas encore d'évaluation
- 98 679Document6 pages98 679hizballah27Pas encore d'évaluation
- 98 689Document5 pages98 689hizballah27Pas encore d'évaluation
- Lipothymie, Syncope Et Perte de Connaissance Brève: Orientation DiagnostiqueDocument4 pagesLipothymie, Syncope Et Perte de Connaissance Brève: Orientation Diagnostiquehizballah27100% (1)
- 98 667Document4 pages98 667hizballah27Pas encore d'évaluation
- 98 685Document3 pages98 685hizballah27Pas encore d'évaluation
- 98 661Document6 pages98 661hizballah27Pas encore d'évaluation
- 98 653Document4 pages98 653hizballah27Pas encore d'évaluation
- 98 657Document3 pages98 657hizballah27Pas encore d'évaluation
- Cours 1 Composition Et Fonctions Du SangDocument8 pagesCours 1 Composition Et Fonctions Du SangLiz OthicPas encore d'évaluation
- Still de L'adulte-2019Document11 pagesStill de L'adulte-2019Laurence CielPas encore d'évaluation
- Evaluations PDFDocument5 pagesEvaluations PDFAZOUMBETI-Kéla Florent OctavePas encore d'évaluation
- Diagnoctic 13Document30 pagesDiagnoctic 13Benvole AtanganaPas encore d'évaluation
- 8-Hémolyse Physiologique Et PathologiqueDocument5 pages8-Hémolyse Physiologique Et PathologiquealmnaouarPas encore d'évaluation
- La Replication de AdnDocument21 pagesLa Replication de Adnfadel yasminePas encore d'évaluation
- Staphylococcus 3326769Document14 pagesStaphylococcus 3326769Michael MouffoPas encore d'évaluation
- Article14 5 6Document21 pagesArticle14 5 6yaya camaraPas encore d'évaluation
- Immunophénotypage Des Hémopathies Malignes Par Cytométrie de FluxDocument12 pagesImmunophénotypage Des Hémopathies Malignes Par Cytométrie de FluxBenmammarPas encore d'évaluation
- Immuno LogieDocument88 pagesImmuno LogieAya RakaaPas encore d'évaluation
- Pro Ti Do GrammeDocument21 pagesPro Ti Do Grammebengayed_kamelPas encore d'évaluation
- Crispr Et Thérapie GénétiqueDocument3 pagesCrispr Et Thérapie GénétiquenathanverhoeyenPas encore d'évaluation
- CHAPITRE I Généralités Sur La Biologie CéllulaireDocument5 pagesCHAPITRE I Généralités Sur La Biologie CéllulairehanaPas encore d'évaluation
- Metabolisme DR AssousDocument19 pagesMetabolisme DR AssousImane0% (1)
- Fiche CytoG Cours Du 07 02 13 1ere PartieDocument6 pagesFiche CytoG Cours Du 07 02 13 1ere PartieEssoulaymani FirdawsPas encore d'évaluation
- La Multiplication ViraleDocument7 pagesLa Multiplication ViraleSomeone IdkPas encore d'évaluation
- Le Paludisme Dans Le MondeDocument27 pagesLe Paludisme Dans Le Mondevague2000Pas encore d'évaluation
- Travaux Diriges Laboratoire Semestre 1Document16 pagesTravaux Diriges Laboratoire Semestre 1Labo s2Pas encore d'évaluation
- Section C Génétique BactérienneDocument74 pagesSection C Génétique BactérienneBoubacar DioffoPas encore d'évaluation
- Filiere D'Enseignement General Examens de Fin D'Études Secondaires SVT Serie: (SVT) Texte ModèleDocument1 pageFiliere D'Enseignement General Examens de Fin D'Études Secondaires SVT Serie: (SVT) Texte ModèleLaryna SiméonPas encore d'évaluation
- Medecine Interne - Immunopathologie - Inter-MemoDocument82 pagesMedecine Interne - Immunopathologie - Inter-MemoEtienne15100% (1)
- La Pyélonéphrite Aigue Chez L'enfant-Blida-2014 PDFDocument17 pagesLa Pyélonéphrite Aigue Chez L'enfant-Blida-2014 PDFHanane KouidriPas encore d'évaluation
- Fiche de TDDocument3 pagesFiche de TDBodering Alain100% (1)
- CH1 - Noyau CellulaireDocument14 pagesCH1 - Noyau CellulaireAsmaa BharPas encore d'évaluation
- RNAm Shedding FRDocument24 pagesRNAm Shedding FRFredPas encore d'évaluation
- Cours de Physiopathologie 2021 VERSION FINALEDocument266 pagesCours de Physiopathologie 2021 VERSION FINALEespoir luizi100% (2)
- Ségrégation D'un Couple D'allèlesDocument55 pagesSégrégation D'un Couple D'allèlesYves-Nathan Tian BiPas encore d'évaluation
- Collagene PDFDocument10 pagesCollagene PDFmoane8Pas encore d'évaluation
- Les StreptocoquesDocument3 pagesLes StreptocoquesAbdou AmourPas encore d'évaluation
- CYTOPENIESDocument8 pagesCYTOPENIESSahraoui imenePas encore d'évaluation