Académique Documents
Professionnel Documents
Culture Documents
Protocole Groupe 2
Transféré par
Nadera KessarTitre original
Copyright
Formats disponibles
Partager ce document
Partager ou intégrer le document
Avez-vous trouvé ce document utile ?
Ce contenu est-il inapproprié ?
Signaler ce documentDroits d'auteur :
Formats disponibles
Protocole Groupe 2
Transféré par
Nadera KessarDroits d'auteur :
Formats disponibles
MANNAI Sana, ABDOU MOHAMED Amel, BENMEHIRISSE Heddi, DOUAIR Iskander &
BIO Mathieu.
Groupe 2 : Immunologie
Introduction :
Nous avons observé une vidéo qui nous montrait un
phénomène qui faisait réagir des cellules B et T (Lymphocytes :
cellules immunitaires). Le LT était coloré en bleu, ce qui nous a
permis de le reconnaître. Une fois l'entrée en contact avec la
cellule B, il y a eu changement de couleur (Bleu → Vert/Jaune)
donc forcement il y a eu un autre phénomène qui s'est produit à
ce moment là. Dans notre cas, on sait que c'est l'entrée de
Calcium dans la cellule T qui change sa couleur. On veut donc
étudier les conséquences sur la vie de la cellule T.
Problématique :
Comment mettre en évidence les conséquences du contact
du LB sur les LT : Prolifération, différenciation, sécrétion d'une
protéine ?
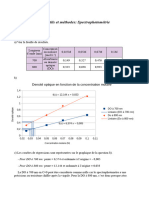
Test proposé pour quantifier des cellules :
Turbidimétrie : Lorsque des cellules sont en suspension
dans un milieu liquide traversé par un faisceau lumineux
monochromatique, la quantité de lumière absorbée et
dispersée par la suspension dépend de la concentration des
cellules et de leur taille. La relation entre absorbance et
concentration en cellules est linéaire dans une gamme de
concentrations couvrant environ un ordre de grandeur.
Si on connaît la droite représentant l'absorbance de la
suspension en fonction de la concentration en cellules, il suffit
de mesurer l'absorbance d'une suspension de concentration
inconnue pour déterminer graphiquement le nombre de cellules
MANNAI Sana, ABDOU MOHAMED Amel, BENMEHIRISSE Heddi, DOUAIR Iskander &
BIO Mathieu.
qu'elle contient.
En partant d'une suspension contenant un nombre de
cellules connu, on peut aisément construire cette droite,
appelée droite étalon. Pour cela, on réalise une gamme de
dilutions déterminée de la suspension connue et l'absorbance
de chaque dilution est mesurée avec un spectrophotomètre. La
droite Absorbance = f (concentration en cellules) est alors
construite.
Pour déterminer la concentration en cellules d'une suspension
de concentration inconnue, on mesure l'absorbance d'un
échantillon, après dilution si nécessaire, et on reporte la valeur
obtenue sur la droite d'étalonnage pour en déduire sa
concentration.
Pour connaître la concentration en cellules de la suspension
servant à construire la droite d'étalonnage on la détermine au
préalable avec une lame à numération (cellule de Malassez ou
lame à numération jetable).
La numération sur lame peut aussi être utilisée directement sur
des échantillons prélevés aux moments voulus.
Principe d'immunofluorescence : C'est un principe
d'immunomarquage qui consiste à révéler une protéine
spécifique sur une coupe de tissu. Le principe est d’utiliser un
anticorps spécifique à la protéine recherchée, afin qu’il puisse
s’y fixer. D’un autre côté, on couple ce même anticorps à un
fluorochrome, pour nous permettre de le détecter au
microscope à épifluorescence. La méthode peut également
inclure un deuxième anticorps, qui sera spécifique du premier,
et qui portera dans ce cas le fluorochrome. Ce dernier est excité
grâce à un faisceau lumineux ne laissant passer que les
longueurs d'ondes capables d'exciter. Une fois le fluorochrome
excité, il émet de la fluorescence plus grande que la longueur
d'onde d'excitation.
Protocole : Gamme étalon; à l'aide de concentrations
connues, établir une courbe. Sur 8 puits, introduire une
MANNAI Sana, ABDOU MOHAMED Amel, BENMEHIRISSE Heddi, DOUAIR Iskander &
BIO Mathieu.
concentration différente en cascade de L T spécifique connue en
les activant à l'aide d'une stimulation L B/LT en plus du Calcium.
Les LT possèdent un épitope auquel on va fixer un anticorps
muni d'un fluorochrome qui est capable, après excitation,
d'émettre de la fluorescence. Pour l'exciter on utilise une
longueur d'onde spécifique. A l'aide des résultats trouvés, on
effectue une courbe. Même protocole pour le milieu à tester. En
fonction de la fluorescence trouvée en déduire la quantité de
cellules.
Cytométrie : Elle consiste à évaluer le nombre de cellules
dans un milieu, on fait passer dans un tuyau transparent notre
milieu à tester. Une lumière monochromatique va être coupée
par le milieu. Un spectrophotomètre va récupérer la lumière a
chaque longueur d'onde précisant une cellule fluorescente,
incrémente (de même pour la turbidimétrie).
Autre protocole : Principe de lame Kova ; sur une plaque,
introduire et étaler notre milieu de cellules, faire une moyenne
des cellules dans chaque case, multiplier par X et Y (longueur
et largeur).
On pourrait se servir du principe d'immunofluorescence pour
rendre nos cellules fluorescentes pour la cytométrie.
Suite à ces différents protocoles, et à la sortie à Luminy nous en
avons sélectionné un, qui consiste tout d'abord à déclencher la
sécrétion d'interleukines et la division des LT 8 ; puis une autre
partie qui consiste à quantifier le nombre de cellule avant et
après division : Quantification par principe de fluorescence
(colorimétrie – comme Élisa).
Dans un premier temps, on place dans une boîte de pétrie des
LT4 avec des antigènes. Après un certain temps, nous
récupèrerons le surnageant qui contiendra des interleukines.
Dans un second temps, on prendra trois types de cellules ; des
MANNAI Sana, ABDOU MOHAMED Amel, BENMEHIRISSE Heddi, DOUAIR Iskander &
BIO Mathieu.
LB, des LT8 et des cellules X, on injectera a chacune d'elles un
produit coloré. Suite à la coloration, on mesurera le nombre de
cellule à l'aide d'un spectrophotomètre. Pour finir, on
récupèrera les manipulations faites précédemment et on place
dans le même milieu les interleukines, enfin nous effectuerons
une dernière mesure au spectrophotomètre qui nous
déterminera le nombre de cellule final.
MANNAI Sana, ABDOU MOHAMED Amel, BENMEHIRISSE Heddi, DOUAIR Iskander &
BIO Mathieu.
Vous aimerez peut-être aussi
- Croissance BactérienneDocument15 pagesCroissance BactérienneHeraclePas encore d'évaluation
- Chapitre 2 SuiteDocument11 pagesChapitre 2 Suitemathilde.thevenin1Pas encore d'évaluation
- Poly L2S4 TD 2009Document26 pagesPoly L2S4 TD 2009Massouh AssouiPas encore d'évaluation
- La Croissance BactérienneDocument30 pagesLa Croissance Bactérienneamira BENTOURA50% (2)
- PPPT THIII CH2 RMHDocument14 pagesPPPT THIII CH2 RMHfinn lockPas encore d'évaluation
- Sfa+ Chimie Seche 2017Document2 pagesSfa+ Chimie Seche 2017kimoPas encore d'évaluation
- Bio Cell Compte Rend UDocument3 pagesBio Cell Compte Rend UAmel MebarkiaPas encore d'évaluation
- Cours Cytometrie Partie IDocument31 pagesCours Cytometrie Partie IswiatktPas encore d'évaluation
- Bactériologie FondamentaleDocument47 pagesBactériologie Fondamentalecoursenligne.lille1100% (6)
- Éosinophilie Avec Systèmes D Hématologie À Différeciation en Trois PopulationDocument2 pagesÉosinophilie Avec Systèmes D Hématologie À Différeciation en Trois PopulationNabyl BektachePas encore d'évaluation
- TD 6 Les Méthodes de Mesure de La Croissance BactérienneDocument26 pagesTD 6 Les Méthodes de Mesure de La Croissance BactérienneBenyoucef AmelPas encore d'évaluation
- Lvrea 266 P 517Document6 pagesLvrea 266 P 517Samira LarouciPas encore d'évaluation
- S SVT Obligatoire 2016 Asie CorrigeDocument8 pagesS SVT Obligatoire 2016 Asie CorrigeWilfriedPas encore d'évaluation
- Cours 1 L1 BioCell 2023-24Document37 pagesCours 1 L1 BioCell 2023-24CreamPas encore d'évaluation
- Cour - 1Document10 pagesCour - 1youcef benaissaPas encore d'évaluation
- TP N°2 (2nde) + AnnexeDocument2 pagesTP N°2 (2nde) + Annexesandra.le.du100% (2)
- CM/TD1 Ue2 - Sujet (Version Finale)Document8 pagesCM/TD1 Ue2 - Sujet (Version Finale)nourabakayokoo10Pas encore d'évaluation
- S SVT Obligatoire 2017 Centres Etrangers CorrigeDocument9 pagesS SVT Obligatoire 2017 Centres Etrangers CorrigeWilfriedPas encore d'évaluation
- TDcycle LSV1 - 2021Document3 pagesTDcycle LSV1 - 2021kirito 83Pas encore d'évaluation
- CMF Harkat 2020 2021Document32 pagesCMF Harkat 2020 2021Imane AbPas encore d'évaluation
- Hémogramme AutomatiséDocument14 pagesHémogramme AutomatisébouabidPas encore d'évaluation
- La Cytométrie en Flux: Maty Diallo Marie Diaw Fatma Saalihatou NiangDocument15 pagesLa Cytométrie en Flux: Maty Diallo Marie Diaw Fatma Saalihatou Niangfatma niangPas encore d'évaluation
- 01-Somesthésie 12Document17 pages01-Somesthésie 12nourhoudaPas encore d'évaluation
- 2 Devoir - TN Devoir de Synthèse n3 2009 2010pilote de SfaxDocument6 pages2 Devoir - TN Devoir de Synthèse n3 2009 2010pilote de SfaxbelhajPas encore d'évaluation
- ExocytoseDocument18 pagesExocytosecoursenligne.lille1100% (1)
- SN16-TE-01-19 - Chapitre 3Document8 pagesSN16-TE-01-19 - Chapitre 3Sadek KkkPas encore d'évaluation
- 1-Généralités Sur Les CellulesDocument15 pages1-Généralités Sur Les Cellulesjacobs100% (1)
- TPE Modelisation Du Comportement Défensif de La Seiche - David MongeDocument29 pagesTPE Modelisation Du Comportement Défensif de La Seiche - David MongeDavid MongePas encore d'évaluation
- Chapitre 4Document9 pagesChapitre 4khaldi aminaPas encore d'évaluation
- Chapitre 2 - Les CD Et Les Anticorps Monoclonaux - ElumensDocument3 pagesChapitre 2 - Les CD Et Les Anticorps Monoclonaux - ElumenstructresdouteuxPas encore d'évaluation
- 3 SpectrophotometrieDocument5 pages3 SpectrophotometrierahmaniPas encore d'évaluation
- Tuyaux Généraux Bio (Questions Ouvertes Tailles Organites Vitamines Photosynthèse Vocabulaire)Document5 pagesTuyaux Généraux Bio (Questions Ouvertes Tailles Organites Vitamines Photosynthèse Vocabulaire)agirmanmazlum3468Pas encore d'évaluation
- Fiches Techniques 3.05 2023-2024LDocument25 pagesFiches Techniques 3.05 2023-2024LAmel Aissat hamlaouiPas encore d'évaluation
- Lab 2 BioDocument9 pagesLab 2 BioSpeedyPotatoPas encore d'évaluation
- Cours Médiation HumoraleDocument12 pagesCours Médiation Humoraleel adab yesminePas encore d'évaluation
- 4ème Séq SVTEEHB TD (Mongo Beti) - 2024Document10 pages4ème Séq SVTEEHB TD (Mongo Beti) - 2024mvomoclaver16Pas encore d'évaluation
- Immuno3an03-Reactions Precipitation AgglutinationDocument18 pagesImmuno3an03-Reactions Precipitation Agglutinationsalima sousou100% (2)
- Cytologie LBM 1Document50 pagesCytologie LBM 1Maria SalissouPas encore d'évaluation
- Analyse ChimiqueDocument27 pagesAnalyse Chimiqueshengolutandulamichel1514Pas encore d'évaluation
- 7 Cours Croissance BactérienneDocument48 pages7 Cours Croissance BactérienneAnaïs Bl100% (2)
- Corrige: Sciences de La Vie Et de La Terre GroupeDocument4 pagesCorrige: Sciences de La Vie Et de La Terre GroupekathyPas encore d'évaluation
- RapportDocument27 pagesRapportAmeni Ben AmorPas encore d'évaluation
- Physiologie Animale S6Document177 pagesPhysiologie Animale S6Ives SonPas encore d'évaluation
- TP 3 ImmunoDocument6 pagesTP 3 ImmunoMahmoud ChiboubPas encore d'évaluation
- MaintDocument14 pagesMaintDib ZahiraPas encore d'évaluation
- Analayse Instrumentale IDocument8 pagesAnalayse Instrumentale IAisaoua BuobouPas encore d'évaluation
- FA La CelluleDocument7 pagesFA La Cellulenourabakayokoo10Pas encore d'évaluation
- CM 8 Remodelage MVDocument5 pagesCM 8 Remodelage MVouariah.aboubakrPas encore d'évaluation
- 1 Devoir - TN Devoir de Synthèse n3 2008 2009pilote de SfaxDocument6 pages1 Devoir - TN Devoir de Synthèse n3 2008 2009pilote de SfaxbelhajPas encore d'évaluation
- Cours Apc TC Defense de Organisme Fiche ÉlèveDocument23 pagesCours Apc TC Defense de Organisme Fiche ÉlèveDAOUDA Nable CoulibalyPas encore d'évaluation
- RegulationDocument30 pagesRegulationYannick DsprbsPas encore d'évaluation
- II - CHAPITRE I La SpectrophotometieDocument5 pagesII - CHAPITRE I La SpectrophotometieRêz NãdäPas encore d'évaluation
- Devoir-Svt 2 1er TrimestreDocument3 pagesDevoir-Svt 2 1er Trimestrekeitakissikaba29Pas encore d'évaluation
- Résumé Abdelmoumene HacenDocument12 pagesRésumé Abdelmoumene HacenMohamed hicham AllamPas encore d'évaluation
- Pry Cisions 1c04929237Document3 pagesPry Cisions 1c04929237andriePas encore d'évaluation
- TD Immunologie CPCK ToubaDocument2 pagesTD Immunologie CPCK ToubaDame Lô0% (1)
- Partie2, S2 - L'Immunologie PlydDocument6 pagesPartie2, S2 - L'Immunologie PlydshibougriPas encore d'évaluation
- S SVT Specialite 2019 Amerique Sud CorrigeDocument10 pagesS SVT Specialite 2019 Amerique Sud CorrigeMyn SdhmdPas encore d'évaluation
- Système immunitaire: Les Grands Articles d'UniversalisD'EverandSystème immunitaire: Les Grands Articles d'UniversalisPas encore d'évaluation
- Rétinex: Dévoiler les secrets de la vision informatique avec RetinexD'EverandRétinex: Dévoiler les secrets de la vision informatique avec RetinexPas encore d'évaluation
- Résumé Bio MolDocument6 pagesRésumé Bio MolNadera KessarPas encore d'évaluation
- He Ma ToDocument23 pagesHe Ma Toseddik100% (1)
- Lymphopoïèse Lymphocytes DR BOUHSANEDocument6 pagesLymphopoïèse Lymphocytes DR BOUHSANENadera KessarPas encore d'évaluation
- Cas Clinique Immuno Hémato Et NfsDocument22 pagesCas Clinique Immuno Hémato Et NfsNadera KessarPas encore d'évaluation
- Lentilles Convergentes PDFDocument15 pagesLentilles Convergentes PDFAbdou Luffy-stPas encore d'évaluation
- Og 2017 2018Document222 pagesOg 2017 2018nkolaaxelPas encore d'évaluation
- Adobe Scan 04 Mai 2021Document10 pagesAdobe Scan 04 Mai 2021Adje EKLOUPas encore d'évaluation
- Kern Refractometre Analogique Kern Ora 59687Document7 pagesKern Refractometre Analogique Kern Ora 59687Marvin PathPas encore d'évaluation
- Le Bon Choix Pour Votre Application. Les Capteurs de Température D'ifm.Document17 pagesLe Bon Choix Pour Votre Application. Les Capteurs de Température D'ifm.ifm electronicPas encore d'évaluation
- TP Traitement-DimageDocument7 pagesTP Traitement-DimagesouhirPas encore d'évaluation
- A New Characterization Factor For Hydrocarbons and Petroleum Fluids FractionsDocument7 pagesA New Characterization Factor For Hydrocarbons and Petroleum Fluids FractionsDiogo AlvesPas encore d'évaluation
- Sécurité Alimentaire Dangers PhysiquesDocument4 pagesSécurité Alimentaire Dangers PhysiquesOuiam OuiamPas encore d'évaluation
- 02DF CacVerivide DDocument2 pages02DF CacVerivide DZOUARIPas encore d'évaluation
- 1 Burkina FasoDocument14 pages1 Burkina Fasobelly prince irambonaPas encore d'évaluation
- Eclairagisme LamdaluxDocument16 pagesEclairagisme LamdaluxBelaliaPas encore d'évaluation
- Linea 2 Led 3360mm 11100lm ls2 5p 840 60d 72wDocument3 pagesLinea 2 Led 3360mm 11100lm ls2 5p 840 60d 72wdriouch MaryemPas encore d'évaluation
- Résumé Du Cours d'OPTIQUE PDFDocument3 pagesRésumé Du Cours d'OPTIQUE PDFNabil holmesPas encore d'évaluation
- Introduction A La Teledetection 3eme TopographieDocument16 pagesIntroduction A La Teledetection 3eme TopographieAhmed HamdaouiPas encore d'évaluation
- Cours 4 Polarisation de La LumièreDocument59 pagesCours 4 Polarisation de La LumièreadamPas encore d'évaluation
- Compte Rendu - TP SpectroDocument6 pagesCompte Rendu - TP Spectrocolinebarre3Pas encore d'évaluation
- TP3 Optique GéométriqueDocument3 pagesTP3 Optique GéométriqueHafsa SlamiPas encore d'évaluation
- NF en 410 Avril 2011Document69 pagesNF en 410 Avril 2011gq49cph79gPas encore d'évaluation
- Généralités Et Techniques HistologiquesDocument7 pagesGénéralités Et Techniques HistologiquesMawi MimiPas encore d'évaluation
- Lasers de Puissance Et Traitements Super CielsDocument2 pagesLasers de Puissance Et Traitements Super CielsOualidPas encore d'évaluation
- Histoire de L'obtique - CopieDocument9 pagesHistoire de L'obtique - CopiethouriaPas encore d'évaluation
- TD Fibre Optique (2021)Document4 pagesTD Fibre Optique (2021)Jordan Mbe SangoPas encore d'évaluation
- Realisation D Un Spectrometre A Fluorescence X PortableDocument183 pagesRealisation D Un Spectrometre A Fluorescence X PortableremikhaledPas encore d'évaluation
- ParticulesoumiseaunchampDocument8 pagesParticulesoumiseaunchamplilia Bennaceur FarahPas encore d'évaluation
- Mesures OtdrDocument76 pagesMesures OtdrGhali FatimaPas encore d'évaluation
- Cours Chap2 Les Couleurs (1) .OdtDocument6 pagesCours Chap2 Les Couleurs (1) .OdtJean-Luc LefriecPas encore d'évaluation
- TD N°3 MIPPC S2 23 24 CorrigéDocument8 pagesTD N°3 MIPPC S2 23 24 Corrigéyasser zaarourPas encore d'évaluation
- SAA Et SEA - 2016-2017Document13 pagesSAA Et SEA - 2016-2017Amine DidoPas encore d'évaluation
- Ondes LumineusesDocument4 pagesOndes LumineusesFatima BarikPas encore d'évaluation
- Rapport D'activitéDocument38 pagesRapport D'activitéESSADIA AIT-OUNAJARPas encore d'évaluation